重庆大学有机8 卤代烃
大学有机化学第九章卤代烃
❖ 3、反应的进攻试剂(HO-)从离去基团的反面 进攻反应底物,产物的构型翻转(瓦尔登转化)
❖ 4、反应过程中是通过一个过渡态而转化为产 物,没有碳正离子中间体生成,不发生重排, 无重排产物。
2. 单分子亲核取代反应(SN1):
C2H5
4-乙基-6-氯-2-己烯
二. 卤代烃的物理性质
❖ 常温常压下:CH3Cl,C2H5Cl及CH3Br Gas ❖ 其它常见RX Liquid
❖ >C15
Solid
❖ RX:分子极性小,不溶于水,易溶于许多有机化
合物(做溶剂)。如:氯仿(CHCl3)
❖ 卤代烷:X数增加,可燃性降低。CCl4为灭火剂
CH3
CH3 C Cl + NaOH
CH3
CH3 C CH2 +NaCl + H2O
CH3
CH2 CH2 Cl ,
Cl
x 几乎不反应
❖ C、由于多数RX由相应的醇制备,因此用此
法制备醇在合成上意义不大。但少数醇可以 用此法。例如:
CH3 Cl2 hv
CH3CH=CH2
Cl2 hv
CH2Cl H2O/NaOH 加加
加热才沉淀
7、与炔钠的反应 (亲核试剂:RC≡C-)
RC≡CH NaNH2 RC≡CNa
液NH3
10 R’X
RC≡CR’
注意:NaNH2是强碱,不能使用叔(30)卤烷,否则 将主要得到烯烃。乙烯型卤代物,卤苯型化合物在
该条件下反应几乎不发生。
二、亲核取代反应历程及立体化学
δR δX + Nu 反应物 亲核试剂
按②:
大学有机化学第七章 卤代烃

△
仲或叔卤代烷在发生消除反应时有两种不同的消除方式。 ' CH3-CH-CH-CH2 KOH CH3CH=CHCH3 + CH3CH2CH=CH2 乙醇 81% 19% H Br H 实验表明,卤代烷脱卤化氢时,主要脱去含氢较少的 β -碳上的氢原子,从而生成含烷基较多的烯烃。
+ AgNO3
H2C
CHCH2ONO2
+ AgCl
可以利用这一反应鉴别烯丙型卤代烃。
H2C CHCH2Cl
+
H2O
NaOH
H2C
CHCH2OH
3)孤立型卤代烷
化学性质与卤代烷相似。 不同类型的卤代烃与硝酸银反应活性为: 烯丙型>孤立型>乙烯型
第四节 卤代烷的制法和重要的卤代烃
一、卤代烷的制备 (1) 烃的卤代
苄基氯
二、不同结构的卤代烯烃和卤代芳烃反应活性的差异
1)乙烯型卤代烃 化学性质很不活泼。如氯乙烯在加热时也不和硝 酸银的醇溶液反应。可以利用这一性质区别卤代烷 与乙烯型卤代烃。 2)烯丙型卤代烃 化学性质非常活泼。如氯乙烯在常温下,可 以迅速和硝酸银的醇溶液反应,析出氯化银。
H2C CHCH2Cl
伯卤代烷的取代物产率最高,仲卤代烷的取代物 次之叔卤代烷的则主要发生消除反应生成烯烃 CH3 CH3—C—Br + NaOCH3 CH3 △ CH3 CH2=C CH3 + CH3OH + HBr
卤代烷发生消除反应的活性顺序: 叔卤烷 > 仲卤烷 > 伯卤烷
烷基结构相同而卤原子不同时,反应活性是:
卤代烯烃:
最新大学有机化学重点知识总结第七章 卤代烃

前言
卤代烃: 烃分子中的H原子被卤原子取代后的 化合物。
RH
RX
X
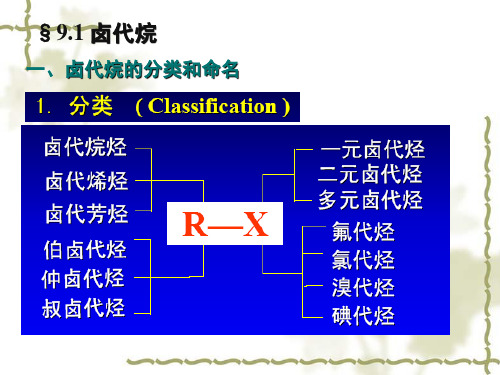
§7.1 卤代烃的分类
烃基结构
饱和卤代烃 卤代烃 不饱和卤代烃
卤代芳烃
卤原子的数目
一元卤代烃
卤代烃 二元卤代烃 三元卤代烃 ……
卤代烃举例
饱和卤代烃:
Br
CH2 CH2 Br Br
CHCl3
三氯甲烷
溴(代)环己烷 1,2–二溴乙烷 (氯仿)
2. 脱卤素
邻二卤代物在锌粉作用下加热,脱掉卤原子而 生成烯烃。
CC XX
Zn乙 ,醇 或 NaI
,
C 丙C 酮
+ X 2
保护 C=C, 或分离提纯烯烃。
三、与活泼金属反应
卤代烃能与某些活泼金属发生反应,生成有机 金属化合物(金属原子直接与碳原子相连接的化 合物)。
R X L i , N a , K , C u , M g , Z n , C d , H g , A l 和 P b
R M C M键
δ
C
Mδ
有机金属化合物中,烃基具有很强的亲核性 和碱性
1. 与镁反应
RX +M g无 水 乙 醚R M g X
烃基卤化镁—Grignard (格氏)试剂
Victor Grignard 和 Paul Sabatier 共享 1912年诺贝尔化学奖。
反应活性:
R X:
RI > RBr > RCl > RF
C H 3C H 2C H 2C H 2B r
N aO H Δ H 2O
C H 3C H 2C H 2C H 2O H+N aB r
N aO H Δ 醇
7、有机化学:卤代烃(8H)解析

2-氯丁烷
2-甲基-2-氯丙烷
第二节 卤代烃的制法
一、由烃制备
1、烷烃的卤代:选择性差,无合成价值。
2、-卤代(Cl、Br)
CH2=CHCH2R ( PhCH2R ) X2 hv or 高温 X CH2=CHCHR ( PhCHR ) X X= Cl,Br
3、不饱和烃与卤素或卤化氢的加成
HBr RCH=CH2 HBr H2O2 RCH2CH2Br RCHBrCH3
C-Br:600-500cm-1、C-F:~500cm-1(在一般
红外光谱中不能检出) 2、核磁共振谱 HC-F(δ4~4.5)、 HC-Cl(δ 3~4 )、 HC-Br(δ 2.5~4 )、
亲核取代反应
R
消除反 应
C H
C
X
活性顺序:碘代烷>溴代烷>氯代烷
CH3CHCH3 X
CH3CCH3 X
伯卤代烃/ 一级卤代烃
仲卤代烃/ 二级卤代烃
叔卤代烃/ 三级卤代烃
(1°RX)
(2°RX)
(3°RX)
二、命名 1、习惯命名法和俗名
CH3CH2CH2I
(CH3)2CHCl
(CH3)3CBr
正丙基碘
CHCl3
异丙基氯
CH2=CHCH2Br
叔丁基溴
PhCH2Cl
混溶,也易溶于醇、醚、烃等有机溶剂中。
在同系物中:Cn↑,则b.p℃↑ 在同族物中:沸点有 RI﹥RBr﹥RCl﹥RF 在同分异构体中:支链越多,沸点越低 比重:(RCl、RF)﹤1, (RBr、RI、多卤代烃)﹥1
二、光谱性质
1、红外光谱
C-I:1400-1000cm-1
C-Cl:800-600cm-1
有机化学-第八章卤代烃ppt课件

三、卤代烷的互换
§ 8—3 卤 代 烷的性质
一、物理性质 (略) 二、化学性质
卤代烃的化学性质活泼,且主要发生在C—X 键上。 ① 分子中C—X 键为极性共价键,碳带部分正电荷,易受带负电荷
或孤电子对的试剂的进攻。
CH C CH CH -I CH CH -Cl CH CH -Br 3 3 3 2 卤 代 烷 : 3 2 3 2 1 . 9 1 0 2 . 0 5 2 . 0 3 D 偶 极 矩 μ ( )
R-CH2-X
R-CH=CH-X 乙烯式 R-CH=CH-CH2-X 烯丙式 R-CH=CH(CH2)n-X n≥2 孤立式
X CH 2 X
卤代芳烃
乙烯式 烯丙式
按卤素所连的碳原子的类型
R-CH -X 2
伯 卤 代 烃
R CH-X 2
R C-X 3
仲 卤 代 烃 2 ° 级 卤 代 烃 ( ) 1 一 级 卤 代 烃 ° ( ) 二
CH -CH-CH -CH-CH -CH 3 2 2 3 Cl CH 3
CH -CH -CH-CH-CH -CH 3 2 2 3 Br Cl
3 -氯 4 -溴 己 烷 3 -溴 4 -氯 己 烷 ×
3、卤代烯烃命名时,以烯烃为母体,以双键位次最小编号。
1 -甲 CH = CH-CH-CH -Cl 3 4 -氯 基 丁 烯 2 2 1 -氯 2 -甲 3 CH 基 丁 烯× 3 Cl CH 3
2、与氰化钠反应
醇 R C H C N + N a X R C H X + N a C N 2 2 腈
R COOH CH2 R COOH 1°反应后分子中增加了一个碳原子,是有机合成中增长碳链的方法之一。
2°CN可进一步转化为–COOH,-CH2NH2等基团。
有机化学第八章卤代烃ppt课件

II. 卤代烃的命名
“某基卤〞或
1). 简单卤代烃——普通命名法 “卤(化/代)某烃”
CH3I
碘甲烷
(CH3)2CHCl
异丙基氯
CH2 Br 苄基溴 (溴化苄)
俗名: CHCl3
氯仿
CHI3
碘仿
CF2Cl2 氟立昂(Freon)
CF2ClBr 剂
-[CF2-CF2]n-
1211 灭火
聚四氟乙烯
氟利昂 ——几种 氟 氯代甲烷和 氟氯 代 乙烷的总称 : CCl3F〔F-11)、CCl2F2 〔F-12)、 CClF3〔F - 13)、 CHCl2F (F - 21)、CHClF2〔F - 22)、 CFCl2CClF2〔F –113)、 CF2ClCClF2( F - 114 ) 。
Ag2O, H2O
Walden转换
O
O
HOCCH2CHCOH
OH (+ )-苹 果 酸
由于中心碳上所连基团的立体效应是影响反应速度 的重要因素,故按SN2历程的相对速度顺序为:
CH3Br > CH3 CH2Br>(CH3)2CHBr
>
伯
仲
>(CH3)3CBr 叔
单分子历程SN1:反应速率只决定 于卤代烃, 部分仲卤代烷〔RR′CHX〕 和叔卤代烃
卤代烷的鉴别:
AgNO3 /乙醇
R3C-X
R3C-ONO2 + AgX
(3°RX)
立即沉淀
R2CH-X AgNO3 /乙醇 R2CH-ONO2 + AgX
(2°RX)
几分钟后沉淀
RCH2-X AgNO3 /乙醇 RCH2-ONO2 + AgX
(1°RX)
大学有机化学第五章卤代烃PPT课件

思考题
思考题3:卤代烃的应用 举例说明卤代烃在日常生活和工业生产中的应用。
THANKS
感谢观看
02
卤代烃的结构与性质
结构
卤素取代烃基
卤代烃是烃分子中的氢原子被卤素取 代后的化合物,一般用R-X表示,其 中R是烃基,X是卤素原子。
碳卤键
碳卤键是卤代烃分子中碳原子和卤素 原子之间的共价键,键能较高,稳定 性好。
物理性质
状态
随着分子中碳原子数的增加,卤代烃由气态逐渐变为液态,最后变为固态。
溶解性
氧化还原反应
卤代烃可被氧化成酮、醇或醛,也可被还原成烃或醚。
04
卤代烃的应用与实例பைடு நூலகம்
应用领域
药物合成
卤代烃在药物合成中常作为重要的中间 体,用于合成多种药物,如抗生素、抗
癌药物等。
工业溶剂
卤代烃如四氯化碳、氯仿等常作为工 业溶剂,用于清洗、稀释和萃取等。
农业化学品
卤代烃在农业中用作杀虫剂、除草剂 和植物生长调节剂等,如2,4-D等。
分为饱和卤代烃、不饱和卤代烃和芳 香族卤代烃。
卤代烃的命名
选择主链
选择最长的碳链作为主链,并标明其碳原子 数。
编号
从靠近卤素原子的碳原子开始编号,并标明 其他取代基的位置。
取代基
按照次序规则,列出其他取代基的名称和位 置。
系统命名法
采用国际通用的IUPAC系统命名法,遵循“ 取代基在前,数字在后”的原则。
大学有机化学第五章卤代 烃ppt课件
• 卤代烃的分类与命名 • 卤代烃的结构与性质 • 卤代烃的合成与反应机理 • 卤代烃的应用与实例 • 习题与思考题
01
卤代烃的分类与命名
卤代烃的分类
卤代烃总结知识点

卤代烃总结知识点一、卤代烃的分类与命名卤代烃可分为一卤代烷、二卤代烷、卤代烯烃、卤代炔烃等几种类别。
根据卤素的种类可以分为氟代烃、氯代烃、溴代烃和碘代烃。
卤代烃的命名根据IUPAC命名法,以及常用命名法来进行。
例如氯代乙烷可用IUPAC命名法为氯乙烷,也可以用常用命名法称为氯乙烷。
卤代烃的命名方法非常多样,需要通过具体的化学式和结构式来进行正确的命名。
二、卤代烃的物理性质卤代烃的物理性质受到卤素种类和数量的影响。
一般来说,卤代烃具有较高的沸点和熔点,密度较大,易溶于有机溶剂,不溶于水。
卤代烃的物理性质与其分子结构密切相关,例如分子中卤素的位置、数量和附加基团等都会影响卤代烃的物理性质。
三、卤代烃的化学性质卤代烃的化学性质主要包括亲核取代反应、消去反应、活化能、引发剂等。
其中最常见的化学性质是亲核取代反应,是卤代烃最主要的化学反应。
亲核取代反应是卤代烃分子中卤素原子被亲核试剂取代的反应,常见的亲核试剂有氢氧根离子、氨基根离子等。
消去反应是卤代烃中一个氢原子和一个卤原子被去除生成烯烃的反应。
此外,卤代烃的化学性质还包括了活化能、引发剂等。
四、卤代烃的合成方法卤代烃的合成方法主要包括直接氢-卤素置换法、卤代烷的化学反应法和烷基卤化法。
直接氢-卤素置换法是将氢原子替换为卤素原子,常用的溴代亚烷合成法就是通过该方法合成。
卤代烷的化学反应法是其他化合物经过化学反应或实验室合成直接得到卤代烷。
而烷基卤化法是烷烃经过卤化制成卤代烷。
卤代烃的合成方法多种多样,可以根据具体的需求和化学实验选择合适的方法。
五、卤代烃的应用卤代烃是一类非常重要的有机化合物,在医药、农药、化工等领域都有广泛的应用。
在医药领域,卤代烃可以用于生产药物和医疗用品,如消毒剂和麻醉剂等。
在农药领域,卤代烃可以用于生产农药,如杀虫剂和杀菌剂等。
在化工领域,卤代烃可以用于生产有机化工产品,如溶剂和增塑剂等。
卤代烃在各个领域都有非常重要的应用价值。
六、卤代烃的环境影响尽管卤代烃在各个领域有重要的应用,但其对环境的影响也不能忽视。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Grignard试剂的反应 Grignard试剂的结构
H OH
δ δ
R
δ
δ
MgX
与含活泼氢的化合物反应:
X Mg OH X Mg X RH X Mg OR X Mg NH2 X Mg C CR
H X RO H H NH2 RC C H
RMgX
避免:合成反应中不能存在含活泼氢的化合物。 应用:定量测定活泼氢。
伯、仲卤代烃 孤立型(伯、仲) CH2=CH-X(乙烯型) C6H5-CH2-CH2-Cl,
加热才起反应
C6H5-Cl
加热也不反应
Problem 1:鉴别 C6H5-CH2-Cl, C6H5-CH2-CH2-Cl, C6H5-Cl
Problem 2: 1. CH3CH2-Br —
Na HS
CH3CH2-SH
μ/×10-30C。m
CH3 Cl
6.47
CH3 Br
5.97
CH3 I
5.47
二、卤代烷的化学性质 结构与性质 卤代烃的官能团是 卤原子。
H
R
亲核试剂NuH
β
H
α
δ
Xδ
R
C-X键具有极性,卤原子带部分负电荷,与之相 连的碳原子带部分正电荷,易受带负电荷或未共 用电子对试剂的进攻,卤原子带一对电子离开, 发生取代反应. 受卤原子吸电子的影响,β-H活泼,在强碱 的作用下离开,发生消除反应.
伯卤代烃 CH3CH2Cl CH2=CHCH2Br CH3CHCH3 仲卤代烃 Cl 叔卤代烃 (CH3)3C-Cl
氟代烃(制法和性质特殊)
3.按X的种类
氯代烃、溴代烃、碘代烃
一卤代烃
CH3CH2Cl
用作局部麻醉剂
4.按X的数目
多卤代烃
HCCI3 杀菌及和缓的防腐剂 CF3CHClBr 新型强效低毒麻醉剂 CF2Cl2 (F12)制冷剂
代反应)
3.亲核试剂的亲核能力: HS- > RS- > CN- > I- > NH3 > OH- > Br- > OR- > Cl- > F- > H2O
2. 消除反应(b-Elimination)
由分子中脱去一个小分子 (如HX、H2O等)形成不饱 和结构的反应称为消除反应。以 E 表示。 乙醇 R—CH—CH2 + KOH ——> R—CH=CH2 + HX D H X 卤代烷除了a 碳上脱去 X 外,还从 b 碳上脱去H, 故又称为 b-消除反应。由于叔卤代烷有3个 b-C,其 上的H均有可能消除,故发生消除反应的活性:
CH3 CH3CH2C=CH2
2-甲基-1-丁烯 29%
仲或叔卤代烃脱 HX 时,主要产物是双键上烃基最多 的烯烃 (最稳定的烯烃,为什么? ),即:主要是从含 H 较 少的b-C上脱氢。此称为Saytzeff规则。
注意: 1.卤代烃的消除反应和取代反应往往同时发生, 有竞争性,例如:
CH3CHCH3 + C2H5ONa Br
△
R-OH + HX R—OH + NaX
此反应常用于将 -OH引入一些较复杂的分子中, 因为有时直接引入-OH比直接引入-X更为困难. 不同类型的一卤代烃的反应活性顺序为: 烯丙型 >2° >1° > 乙烯型 3°
(2) 被氰基取代:
卤代烷与 NaCN 或 KCN 的醇溶液共热, X 被-CN取代,生成腈。
(硫醇)
Na I/丙酮 CH3CH2-I (卤素互换反应) ONa CH CH -O (芳醚)
3 2
CH3CO2Na CH3CO2CH2CH3
2. H2N-CH2CH2CH2CH2Cl —> 影响亲核取代反应的因素主要有: 1. R—X中R的结构(在反应历程部分讨论)
(酯)
NH
2.离去基的性质: -I > -Br > -Cl > -F (氟代烃难发生取
苄基氯
氯化苄
F Cl C Cl Cl
三氯氟甲烷
氟利昂-11
2.系统命名:
①选母体 :烃作母体,将 X 和烃中的
支链一样作为取代基来命名。
②编号:根据最低序列原则将主链编号。
当连有两个取代基且其一为卤原子时,应 给卤原子较大的编号。
③配基: 优先基团后列出。
3
2 1
CH3CHCH2B r
CH3
4 1 3 2 2 3 1 4
R—X + NH3(过量) ——> R—NH2 + HX
生成的胺是碱,又与HX成盐:R-NH3 X-或写成 RNH2· HX
(4) 被烃氧基取代:卤代烷与醇钠(或酚钠)作 用,X被 -OR取代,生成醚。这是制备混合醚的 方法,叫Williamson醚合成法。
R—X + NaOR’——> R—O—R’+ NaX
1.卤代烷亲核取代反应
卤代烷能与许多试剂作用,在反应中,卤代烷 被称为底物。与卤原子相连的 C 叫α 碳原子,它带 部分正电荷,是反应的中心。 C——X 底物
d+ d-
+ Nu(-) ——> Nu — C — + X-
亲核试剂
离去基
进攻试剂都有较大的电子密度,具有亲核性 — 亲核试剂(Nucleophilic reagent,Nu:or Nu:-). 底物受Nu:进攻,C—X键异裂,X原子离开底物分 子,故称为离去基(Leaving group, L).
第八章
第一节 第二节 分类和命名
卤代烃
卤代烃的性质
一、物理性质
二、化学性质 ( 取代、消除、与金属反应)
三、亲核取代反应历程
四、消除反应历程
五、亲核取代与消除反应的关系
六、卤代烯烃卤代芳烃
七、多卤代烃
第八章 卤代烃 (Halides)
烃分子中的氢原子被卤素取代而生成的化合物称 卤代烃。卤原子 (F 、 Cl 、 Br 、 I) 是卤代烃的官能团。 卤代烃的结构通式: R—X。
2-甲基-1-溴丙烷
H3C
CH CH CH3 CH3 B r 3-甲基-2-溴丁烷(错)
2-乙基-1-氯戊烷
2-甲基-3-溴丁烷
CH3CH2CH-CH2CH2CH3 CH2Cl
或:3-氯甲基己烷
1 7
2 6
3 5
4 4
5 3
6 2
7 1
H3C
CH CH CH2
CH CH CH3
CH3 I
Cl
CH3
由于格氏试剂在有机合成中有广泛的应用, 故有“有机合成中的万能试剂”的美称。 Victor Grignard 因此获得 1912 Nobel 化学 奖。
活泼卤代烃和RMgX 偶联产率较高,可以作为制 备烃的方法: R—MgX + ClCH2CH=CH2 ——> R—CH2CH=CH2 注意:与RMgX 偶联的必须是活泼卤代烃(烯丙型 或苄型),一般卤代烃因产率较低,不适于制备。 例:(CH3)3CH ——> (CH3)3C-CH2CH2CH3 (CH3)3CH
R MgX
RCOOH
CH3CHCH2-Br CH3
合成
O CH3CHCH2C-OH CH3
dd+
Mg CH3CHCH2-Br 无水乙醚
d+ dCH3CHCH2-MgBr O = C = O
CH3
CH3
低温
O O +/H O OH H 2 CH CH CH C -OH + Mg CH3CHCH2-C-O-MgBr 3 2 Br CH3 CH3 2-甲基丁酸
(5) 被硝酸根取代 —— 推测卤代烃的类型
R—X + AgONO2
乙醇/ D
卤烃与AgNO3的醇溶液共热,生成硝酸酯和AgX 沉淀: R-O-NO2 + AgX ↓
不同结构的卤代烃卤原子活性不同,产生AgX的速度不同。
叔卤代烃 RCH=CHCH2-X C6H5-CH2-Cl,
室温迅速生成AgX↓
与金属镁反应
卤代烃与金属镁在无水乙醚中反应,生成 烃基卤化镁
R—X + Mg ————> R-Mg-X (烃基卤化镁) 这种产物叫格氏试剂(Grignard reagent).
dd+ 无水乙醚
格氏试剂结构中的 C — M 键极性很强,常 可起碳负离子的作用,具有很强的亲核性。它可 与其它有机物中带部分正电荷的碳原子连接形成 新的C—C键(加长碳链)。
乙醚 > R CuLi 2RLi + CuI ——— 2
RLi
+ LiX
二烷基铜锂 二烷基铜锂是一个十分好的烷基化试剂 R2CuLi + R'X ———> R—R' + RCu + LiX RX + 2Na ———> RNa + NaX
与金属钠
RX + RNa ———> R—R + NaX
Wurtz反应
乙醇,55℃
(CH3)2CHOC2H5 + CH3CH=CH2
23 % 79 %
2.用体积大的强碱作试剂有利于末端烯烃的生成。 此时, Saytzeff规则不适用。例如:
(CH3)2CCH2CH3 + (CH3)3COBr CH2=CCH2CH3 CH3 72 %
3. 与金属反应
卤代烃能与多种金属如 Mg 、 Li 、 Na 、 K 、 Al 等 反 应 生 成 C —M 键 的 金 属 有 机 化 合 物 (Organometalic compounds). 与碱金属反应 与金属锂 RX + 2Li ———>
