3酸碱a
3酸碱平衡紊乱160题

第三章酸碱平衡紊乱一、单选题(A1/A2型题)(B )1.直接反映血浆[HCO3-]的指标是A.PHB.ABC.PaCO2D.BBE.BE(A )2.BE负值增大可见于A.代谢性酸中毒 B.代谢性碱中毒 C.急性呼吸性酸中毒D.急性呼吸性碱中毒E.慢性呼吸性酸中毒ﻫ(B)3.血浆[HCO3-]原发性增高可见于A.代谢性酸中毒B.代谢性碱中毒C.呼吸性酸中毒D.呼吸性碱中毒E.呼吸性酸中毒合并代谢性酸中毒(C)4.血浆[H2CO3]原发性升高可见于ﻫA.代谢性酸中毒 B.代谢性碱中毒 C.呼吸性酸中毒D.呼吸性碱中毒 E.呼吸性碱中毒合并代谢性碱中毒(B)5.血浆[H2CO3]继发性增高可见于A.代谢性酸中毒B.代谢性碱中毒 C.慢性呼吸性酸中毒D.慢性呼吸性碱中毒 E.呼吸性碱中毒合并代谢性碱中毒(D)6.下述哪项原因不易引起代谢性酸中毒ﻫ A.糖尿病 B.休克 C.呼吸心跳骤停 D.呕吐E.腹泻(E)7.单纯型代谢性酸中毒时不可能出现哪种变化A.PH降低B.PaCO2降低C.SB降低D.BB降低E.BE负值减小ﻫ(E)8.可以区分高血氯性或正常血氯代谢性酸中毒的指标是A.PHB.PaCO2C.SBD.BBE.AG( C )9.下述哪项原因可引起AG正常型代谢性酸中毒A.糖尿病B.休克C.轻度肾功能衰竭D.严重饥饿 E.水杨酸类药物中毒ﻫ( B)10.可以引起AG增高型代谢性酸中毒的原因是A.服用含氯性药物过多B.酮症酸中毒C.应用碳酸酐酶抑制剂D.腹泻E.远端肾小管性酸中毒ﻫ(A )11.治疗代谢性酸中毒的首选药物是A.碳酸氢钠B.乳酸钠 C.三羟甲基氨基甲烷(THAM) D.柠檬酸钠E.葡萄糖酸钠ﻫ(D)12.下述哪项原因不易引起呼吸性酸中毒A.呼吸性中枢抑制B.气道阻塞C.肺泡通气量减少D.肺泡气体弥散障碍E.吸入气中CO2浓度过高ﻫ(B)13.急性呼吸性酸中毒时,机体的主要代偿机制是A.增加肺泡通气量B.细胞内、外离子交换和细胞内缓冲ﻫC.肾小管泌H+、泌NH3增加D.血浆碳酸氢盐缓冲系统进行缓冲ﻫE.肾重吸收HCO3-减少(D)14.急性呼吸性酸中毒时,可以出现ﻫA.SB增大 B.AB减少C.SB>AB D.SB<AB E.SB=ABﻫ(D)15.急性呼吸性酸中毒时,下述哪项不能发挥代偿作用A.磷酸盐缓冲系统B.血红蛋白缓冲系统C.细胞内、外离子交换D.肾 E.血浆蛋白缓冲系统(D )15.慢性呼吸性酸中毒时,下述哪项不能发挥代偿作用ﻫ A.血红蛋白缓冲系统B.肾C.细胞内、外离子交换D.肺E.血浆蛋白缓冲系统(E)17.慢性呼吸性酸中毒时,机体的主要代偿方式是A.血浆HCO3-缓冲系统B.增加肺泡通气量C.细胞内、外离子交换D.血红蛋白缓冲系统E.肾小管泌H+增加,重吸收HCO3-增加(B)18.纠正呼吸性酸中毒的最根本措施是A.吸氧B.改善肺泡通气量C.给予NaHCO3D.抗感染E.给予乳酸钠ﻫ(B)19.使用利尿剂的过程中较易出现的酸碱平衡紊乱类型是A.代谢性酸中毒 B.代谢性碱中毒 C.呼吸性酸中毒D.呼吸性碱中毒E.以上都不是(D)20.碱中毒时出现手足搐搦的主要原因是A.血钠降低B.血钾降低C.血镁降低D.血钙降低E.血磷降低( E)22.引起呼吸性碱中毒的原因是A.吸人CO2过少B.输入NaHCO3过多 C.肺泡通气量减少D.输入库存血E.呼吸中枢兴奋,肺通气量增大(D)23.急性呼吸性碱中毒时,酸碱平衡指标的变化是A.PaCO2升高,AB升高 B.PaCO2降低,AB>SB C.PaCO2升高,SB无明显变化ﻫ D.PaCO2降低,AB<SB E.PaCO2降低,SB降低(B)24.反映呼吸性酸碱紊乱的最佳指标是:A、ABB、PaCO2C、SBD、AGE、BE( B)25.呼吸性酸中毒的治疗关键是:A、及时用碱性药物纠酸B、改善肺泡通气C、吸氧D、输入葡萄糖E、降低高血钾(E )26.碱中毒患者尿液呈酸性,往往提示有严重的:A、缺钠B、缺钙C、缺镁D、缺氯E、缺钾(D)27.代谢性酸中毒患者的尿液呈碱性,常提示有:A、严重低钠血症B、严重高钠血症C、严重低钾血症D、严重高钾血症E、严重高钙血症(A)28.酸中毒时血钾变化的规律是:A、升高B、不变C、降低D、先升后降E、先降后升(B )29.所谓“阴离子间隙”是指:A、血清中阳离子减去阴离子B、血清中残余的未测定的阴离子C、血清中阴离子减去阳离子D、血清中残余的未测定的阳离子E、血清中\[Cl-]和\[HCO3-]之和( A)30.腹泻引起的低钾血症对酸碱平衡的影响是:A、代谢性碱中毒B、呼吸性碱中毒C、代谢性酸中毒D、呼吸性酸中毒E、代酸合并呼酸( B)31.急性代谢性酸中毒时,机体最主要的代偿方式是:A、组织外液缓冲B、呼吸代偿C、组织内缓冲D、肾脏代偿E、骨骼代偿(D)32.代偿性呼吸性酸中毒时,最有效的代偿调节作用是:A、血液缓冲B、肺的代偿C、细胞内缓冲D、肾脏代偿E、骨骼缓冲( A)33.酸中毒或碱中毒是指:A、酸或碱积聚或丧失B、血pH值改变超过正常值C、血中钠或钾的增加或减少D、血糖过高或过低E、碱贮备过多(C )34.反常性酸性尿的出现见于:A、代谢性酸中毒B、代谢性碱中毒C、低钾血症D、高钾血症E、高钠血症(B)35.[HCO3-]继发性升高见于:A、急性呼吸性酸中毒B、慢性呼吸性碱中毒C、代谢性酸中毒D、代谢性碱中毒E、呼吸性碱中毒(A)36.血pH明显下降,BB降低,BE负值增大,PaCO2高于正常时说明有:A、混合性酸中毒B、混合性碱中毒C、呼吸性碱中毒合并代谢性酸中毒D、呼吸性酸中毒合并代谢性碱中毒E、代谢性酸中毒(C )37.酸中毒时心功能的变化,下述哪项是错误的?A、静脉回流减少B、心收缩力降低C、外周阻力升高D、易出现心律失常E、可加重微循环障碍(B )38.低氯血症可引起:A、代谢性酸中毒B、代谢性碱中毒C、呼吸性酸中毒D、呼吸性碱中毒E、以上都不对( E)39.严重的急性碱中毒时:A、血Ca2+浓度升高B、血K+升高C、神经肌肉的应激性升高D、易发生抽搐E、C+D( B )40.乳酸性酸中毒时:A、HCO3-继发性增多B、HCO3-继发减少C、H2CO3-原发性增多D、H2CO3原发性减少E、HCO3-H2CO3原发性升高( D)41.下列哪一项不是代谢性酸中毒的原因?A、高热B、休克C、长期不进食D、持续大量呕吐E、急性肾功能衰竭( D )42.AG正常型代谢性酸中毒发生于:A、乳酸性酸中毒B、严重的急性肾功能衰竭C、酮症酸中毒D、轻度或中度慢性肾功能衰竭E、水杨酸中毒( C)43.能反映代谢性酸中毒的指标是:A、AB=SBB、AB↑,SB↑C、AB↓,SB↓D、AB>SBE、AB<SB( D )44.尿液呈酸性的酸碱平衡紊乱是:A、近端肾小管性酸中毒B、远端肾小管性酸中毒C、高钾性代谢性酸中毒D、缺氧引起的乳酸性酸中毒E、乙酸唑胺导致的酸中毒( B)45.代谢性碱中毒时机体的代偿调节方式是:A、呼吸加深加快,CO2呼出过多B、肾脏H+-Na+交换减少,NaHCO3重吸收减少C、肾脏排酸保碱功能增强D、血浆中[H+]增高,被血浆中HCO3-缓冲E、血浆中[H+]进入细胞被细胞内缓冲物质缓冲(C)46.慢性呼吸性酸中毒时机体的主要代偿方式是:A、血液缓冲B、骨骼缓冲C、肾脏代偿D、呼吸代偿E、细胞内外离子交换(A)47.血氯正常性代谢性酸中毒可见于下列何种情况?A、休克B、严重腹泻C、严重呕吐D、远端肾小管性酸中毒E、低钾血症(A )48.代谢性酸中毒时机体发生缓冲和代偿调节作用最快的方式是:A、细胞外液缓冲B、呼吸代偿C、细胞内缓冲D、肾脏代偿E、骨骼缓冲( A)49.对代谢性H+的缓冲主要依靠:A、HCO3-缓冲体系B、血浆蛋白缓冲体系C、Hb缓冲体系D、磷酸盐缓冲体系E、HbO2缓冲体系(C )50.酸中毒引起心肌收缩力:A、先增强后减弱B、先减弱后增强C、减弱D、增强E、不变(B)51.严重呼吸性酸中毒时应慎用:A、人工呼吸机B、碳酸氢钠治疗C、乳酸钠治疗D、THAM治疗E、气管切开改善通气( C)52.某患者血气指标为HCO+-34mmol/L,pH为7.27应诊断为:A、代谢性酸中毒B、代谢性碱中毒C、呼吸性酸中毒D、呼吸性碱中毒E、代酸伴呼碱(C )53.某糖尿病患者,血气分析结果为pH7.30、HCO3-19mmol/L、PaCO24.5kPa(34mmHg),血Na+140mmol/L、血C1+104mmol/L,诊断为:A、AG正常性代谢性酸中毒B、AG增高性代谢性酸中毒C、AG增高性代谢性酸中毒合并代谢性碱中毒D、AG正常性代谢性酸中毒合并呼吸性碱中毒E、混合性酸中毒(C)54.某溺水窒息的患儿,其血气分析结果为pH7.15,PaCO210.64kPa(80mmHg),HC O3-27mmol/L,应该诊断为:A、代谢性酸中毒B、代谢性碱中毒C、急性呼吸性酸中毒D、慢性呼吸性酸中毒E、代酸合并代碱(A)55.某53岁患者,因严重糖尿病而入院,查:pH7.18,BE为-12mmol/L,AG 20mmol/L,分析此患者发生何种类型酸碱平衡紊乱?A、代谢性酸中毒B、代谢性碱中毒C、急性呼吸性酸中毒D、慢性呼吸性酸中毒E、代酸合并代碱(C)56.某慢性阻塞性肺疾患病人,测得其pH7.32,PaCO28.91kPa(67mmHg),HCO3-35mmol/L,该病人应诊断为:A、呼吸性碱中毒伴代谢性酸中毒B、代谢性碱中毒C、呼吸性酸中毒D、代谢性酸中毒E、呼吸性碱中毒(B)57.某幽门梗阻患者,因反复呕吐入院,血气分析结果为:pH7.49,PaCO26.4kPa(48mmHg),HCO3-36mmol/L,应该诊断:A、代谢性酸中毒B、代谢性碱中毒C、呼吸性酸中毒D、呼吸性碱中毒E、混合性酸碱中毒(A)58.SB<AB表明可能有:A、呼吸性酸中毒B、呼吸性碱中毒C、代谢性酸中毒D、代谢性碱中毒E、代酸伴代碱(B)59.SB>AB表明可能有:A、呼吸性酸中毒B、呼吸性碱中毒C、代谢性酸中毒D、代谢性碱中毒E、代酸伴代碱(E)60.血浆中pH值主要取决于:A、PaCO2B、AB C、血浆中/[HCO3-] D、血浆中[H2CO3-]E、血浆中[HCO3-]与[H2CO3]的比值(E )61.下列指标中反映呼吸性因素的最佳指标是:A.BEB.SB C.AB D.CO2CPE.PaCO2(A)62.下列指标中反映血液碱储备状况的是:A.BE B.SBC.AB D.CO2CP E.BB(B)63.下列哪项不是代谢性酸中毒的原因:A.休克 B.呕吐C.缺氧 D.饥饿E.急性肾小管坏死(C )64.碱中毒引起手足抽搐的主要原因是:A.血清Na+↓ B.血清K+↓ C.血清Ca2+↓D.血清Mg2+↓ E.血清CL-↓(A )65.血浆中最重要的缓冲对是:A.NaHCO3/H2CO3B.NaPr/HPr C.Na2HPO4/NaH2PO4D.KHb/HHbE.KHbO2/HHbO2( B )66.机体的正常代谢必须处于:A.弱酸性的体液环境中B.弱碱性的体液环境中C.较强的酸性体液环境中D.较强的碱性体液环境中E.中性的体液环境中(B )67.正常体液中的H+主要来自:ﻫ A.食物中摄入的H+B.碳酸释出的H+ C.硫酸释出的H+D.脂肪代谢产生的H+E.糖酵解过程中生成的H+( E )68碱性物的来源有:ﻫ A.氨基酸脱氨基产生的氨 B.肾小管细胞分泌的氨 C.蔬菜中含有的有机酸盐D.水果中含有的有机酸盐 E.以上都是(A)69.机体在代谢过程中产生最多的酸性物质是ﻫA.碳酸 B.硫酸C.乳酸D.三羧酸 E.乙酰乙酸ﻫ( C )70.血液中缓冲固定酸最强的缓冲对是ﻫ A.Pr-/HPrB.Hb-/HHb C.HCO3ˉ/H2CO3D.HbO2-/HHbO2E.HPO42-/H2PO4-ﻫ( C )71.血液中挥发酸的缓冲主要靠ﻫ A.血浆HCO3ˉ B.红细胞HCO3ˉ C.HbO2及Hb D.磷酸盐E.血浆蛋白ﻫ(B )72.产氨的主要场所是A.远端小管上皮细胞B.集合管上皮细胞C.管周毛细血管D.基侧膜E.近曲小管上皮细胞( D )73.能直接反映血液中一切具有缓冲作用的负离子碱的总和的指标是A.PaCO2B.实际碳酸氢盐(AB)C.标准碳酸氢盐(SB)D.缓冲碱(BB) E.碱剩余(BE)( B )74.标准碳酸氢盐小于实际碳酸氢盐(SB<AB)可能有ﻫ A.代谢性酸中毒 B.呼吸性酸中毒C.呼吸性碱中毒D.混合性碱中毒E.高阴离子间隙代谢性酸中毒( A )75.阴离子间隙增高时反映体内发生了A.正常血氯性代谢性酸中毒B.高血氯性代谢性酸中毒C.低血氯性呼吸性酸中毒D.正常血氯性呼吸性酸中毒E.高血氯性呼吸性酸中毒ﻫ( E )76.阴离子间隙正常型代谢性酸中毒可见于ﻫ A.严重腹泻 B.轻度肾功能衰竭 C.肾小管酸中毒ﻫ D.使用碳酸酐酶抑制剂 E.以上都是( C )77.下列哪一项不是代谢性酸中毒的原因ﻫA.高热 B.休克 C.呕吐D.腹泻 E.高钾血症( C )78.急性代谢性酸中毒机体最主要的代偿方式是A.细胞外液缓冲B.细胞内液缓冲C.呼吸代偿 D.肾脏代偿 E.骨骼代偿(A)79.一肾功能衰竭患者血气分析可见:pH7.28,PaCO23.7kPa(28mmHg),HCO3ˉ17mmol/L,最可能的酸碱平衡紊乱类型是A.代谢性酸中毒B.呼吸性酸中毒 C.代谢性碱中毒ﻫ D.呼吸性碱中毒E.以上都不是(B)80.一休克患者,血气测定结果如下:pH7.31,PaCO2 4.6kPa(35mmHg),HCO3ˉ 17mmol/L,Na+140mmol/L,Cl-104mmol/L,K+4.5mmol/L,最可能的酸碱平衡紊乱类型是A.AG正常型代谢性酸中毒B.AG增高型代谢性酸中毒C.代谢性酸中毒合并代谢性碱中毒D.代谢性酸中毒合并呼吸性酸中毒ﻫE.呼吸性酸中毒合并呼吸性碱中毒( E )81.治疗代谢性酸中毒的首选药物是A.乳酸钠B.三羟基氨基甲烷C.柠檬酸钠D.磷酸氢二钠E.碳酸氢钠(B )82.下列哪一项不是呼吸性酸中毒的原因A.呼吸中枢抑制B.肺泡弥散障碍C.通风不良D.呼吸道阻塞E.胸廓病变ﻫ( B)83.下列哪一项不是引起酸中毒时心肌收缩力降低的机制A.代谢酶活性抑制B.低钙C.H+竞争性地抑制钙与肌钙蛋白亚单位结合D.H+影响钙内流 E.H+影响心肌细胞肌浆网释放钙ﻫ( C )84.急性呼吸性酸中毒的代偿调节主要靠ﻫ A.血浆蛋白缓冲系统 B.碳酸氢盐缓冲系统 C.非碳酸氢盐缓冲系统ﻫ D.磷酸盐缓冲系统E.其它缓冲系统( B)85.某溺水窒息患者,经抢救后血气分析结果为:pH 7.18,PaCO29.9 kPa (75mm Hg),HCO3ˉ 28mmol/L,最可能的酸碱平衡紊乱类型是ﻫ A.代谢性酸中毒 B.急性呼吸性酸中毒C.慢性呼吸性酸中毒ﻫD.代谢性酸中毒合并代谢性碱中毒 E.代谢性碱中毒ﻫ( C )86.某肺心病患者,因感冒肺部感染而住院,血气分析为:pH 7.32,PaCO29.4 kPa (71mmHg),HCO3ˉ 37mmol/L,最可能的酸碱平衡紊乱类型是A.代谢性酸中毒B.急性呼吸性酸中毒 C.慢性呼吸性酸中毒ﻫ D.混合性酸中毒 E.代谢性碱中毒( C )87.呼吸衰竭时合并哪一种酸碱失衡时易发生肺性脑病A.代谢性酸中毒B.代谢性碱中毒 C.呼吸性酸中毒D.呼吸性碱中毒 E.混合性碱中毒ﻫ(C)88.严重失代偿性呼吸性酸中毒时,下列哪项治疗措施是错误的ﻫ A.去除呼吸道梗阻 B.使用呼吸中枢兴奋剂C.使用呼吸中枢抑制剂ﻫ D.控制感染 E.使用碱性药物ﻫ( A )89.下列哪一项不是代谢性碱中毒的原因A.严重腹泻B.剧烈呕吐C.应用利尿剂(速尿,噻嗪类)ﻫD.盐皮质激素过多E.低钾血症(E)90.如血气分析结果为PaCO2升高,同时HCO3-降低,最可能的诊断是ﻫ A.呼吸性酸中毒B.代谢性酸中毒 C.呼吸性碱中毒D.代谢性碱中毒 E.以上都不是(A )91.由于剧烈呕吐引起的代谢性碱中毒最佳治疗方案是A.静注0.9%生理盐水B.给予噻嗪类利尿剂 C.给予抗醛固酮药物D.给予碳酸酐酶抑制剂E.给予三羟基氨基甲烷(D)92.下列哪一项不是呼吸性碱中毒的原因ﻫA.吸入气中氧分压过低B.癔病C.发热D.长期处在密闭小室内E.脑外伤刺激呼吸中枢ﻫ( D)93.某肝性脑病患者,血气测定结果为:pH 7.48,PaCO2 3.4kPa(22.6mmHg),HCO3ˉ19mmol/L,最可能的酸碱平衡紊乱类型是ﻫA.代谢性酸中毒 B.呼吸性酸中毒 C.代谢性碱中毒D.呼吸性碱中毒 E.混合型碱中毒( B )94.碱中毒时出现手足搐搦的重要原因是A.血清K+降低B.血清Cl-降低 C.血清Ca2+降低D.血清Na+降低 E.血清Mg2+降低(B)95.酮症酸中毒时下列哪项不存在ﻫA.血K+升高B.AG升高C.PaCO2下降 D.BE负值增大 E.Cl-增高( B)96.肾小管酸中毒引起的代谢性酸中毒,下列哪项不存在A.血K+升高B.AG升高C.PaCO2下降D.BE负值增大E.C l-增高ﻫ(B)97.休克引起代谢性酸中毒时,机体可出现ﻫ A.细胞内K+释出,肾内H+-Na+交换降低 B.细胞内K+释出,肾内H+-Na+交换升高ﻫC.细胞外K+内移,肾内H+-Na+交换升高 D.细胞外K+内移,肾内H+-Na+交换降低ﻫE.细胞外K+内移,肾内K+-Na+交换升高ﻫ(E)98.下列哪一项双重性酸碱失衡不可能出现ﻫA.代谢性酸中毒合并呼吸性碱中毒B.代谢性酸中毒合并代谢性碱中毒C.代谢性碱中毒合并呼吸性碱中毒D.代谢性碱中毒合并呼吸性酸中毒E.呼吸性酸中毒合并呼吸性碱中毒( B )99.代谢性酸中毒时,下列哪项酶活性的变化是正确的ﻫA.碳酸酐酶活性降低B.谷氨酸脱羧酶活性升高 C.γ-氨基丁酸转氨酶活性升高D.谷氨酰胺酶活性降低E.丙酮酸脱羧酶活性升高(B )100.代谢性酸中毒的表现是:A.呼吸深快,口唇青紫B.呼吸深快,口唇樱红C.呼吸浅快,口唇青紫D.呼吸浅快,口唇樱红E.呼吸深慢,口唇樱红(B )101.代谢性酸中毒时,患者的主要化验改变是:A.血pH↓,PaCO2↑ B.血pH↓,PaCO2↓ C.血pH↑,PaCO2↑D.血pH↑,PaCO2↓ E.血pH↑,PaCO2无变化(A)102.重度代谢性酸中毒时,首选的药物是:A.5% NaHCO3 B.11.2% 乳酸钠 C.3.6% THAMD.5%葡萄糖盐水E.0.9%生理盐水( A)103.失代偿性呼吸性酸中毒时,下述哪个系统的功能障碍最明显A.中枢神经系统 B.心血管系统C.泌尿系统D.运动系统E.血液系统(C )104.血气分析结果为PaCO₂降低,同时HCO3-增高可判断为A.呼吸性酸中毒合并代谢性酸中毒 B.呼吸性酸中毒合并代谢性碱中毒ﻫC.呼吸性碱中毒合并代谢性碱中毒 D.呼吸性碱中毒合并代谢性酸中毒ﻫE.代谢性酸中毒合并代谢性碱中毒(A )105..血气分析结果为PaCO₂增高,同时伴有HCO3-降低可诊断为A.呼吸性酸中毒合并代谢性酸中毒B.呼吸性酸中毒合并代谢性碱中毒C.呼吸性碱中毒合并代谢性碱中毒D.呼吸性碱中毒合并代谢性酸中毒E.代谢性酸中毒合并代谢性碱中毒( D )106.某昏迷患者血气和电解质分析结果为pH7.5,PaCO₂1.9kPa(15mm-Hg),HCO3-12mmol/L,Na+140mmol/L,Cl-106mmol/L可诊断为A.呼吸性酸中毒合并代谢性酸中毒 B.呼吸性酸中毒合并代谢性碱中毒C.呼吸性碱中毒合并代谢性碱中毒D.呼吸性碱中毒合并代谢性酸中毒E.代谢性酸中毒合并代谢性碱中毒( D )107.某感染性休克有发热患者,血气分析结果为:pH7.36,HCO3-13mmol/L,Pa CO₂2.6kPa(20mmHg)可诊断为A.呼吸性酸中毒合并代谢性酸中毒B.呼吸性酸中毒合并代谢性碱中毒C.呼吸性碱中毒合并代谢性酸中毒 D.呼吸性碱中毒合并代谢性酸中毒E.代谢性酸中毒合并代谢性碱中毒( E)108.某尿毒症患者伴有剧烈呕吐,血气分析结果为:pH7.36,HCO3- 22 mmol/L,PaCO2 5.3 kPa(40 mmHg)可诊断为A. 呼吸性酸中毒合并代谢性酸中毒 B. 呼吸性酸中毒合并代谢性碱中毒C. 呼吸性碱中毒合并代谢性碱中毒D.呼吸性碱中毒合并代谢性酸中毒E. 代谢性酸中毒合并代谢性碱中毒(B)109.某肾功能衰竭患者伴有急性胃炎,血气分析结果为:pH 7.39,HCO3-24 mm ol/L,PaCO2 5.3kPa(40mmHg),Na+135mmol/L可诊断为A.AG正常型代谢性酸中毒合并代谢性碱中毒B. AG增高型代谢性酸中毒合并代谢性碱中毒C.代谢性酸中毒合并呼吸性碱中毒D.代谢性碱中毒合并呼吸性碱中毒E.无酸碱失衡发生( E)110.酮症酸中毒时下列哪项不存在A.血钾升高B.阴离子间隙升高C.PaCO2下降D.剩余碱负离子增大E.Cl-升高( B )111.肾小管酸中毒引起的代谢性酸中毒,下列哪项不存在A.血K+升高B.阴离子间隙升高C.PaCO2下降D.剩余碱负离子增大 E.Cl-升高( B)112.休克引起代谢性酸中毒时,机体可出现A.细胞内K+释出,肾内H+-Na+交换降低B.细胞内K+释出,肾内H+-Na+交换C.细胞内K+内移,肾内H+-Na+交换升高D.细胞外K+内移,肾内H+-Na+交换降低E. 细胞外K+内移,肾内K+-Na+交换升高(E)113.下列哪一项双重性酸碱失衡不可能出现ﻫA.代谢性酸中毒合并呼吸性碱中毒B.代谢性酸中毒合并代谢性碱中毒ﻫC.代谢性碱中毒合并呼吸性碱中毒 D.代谢性碱中毒合并呼吸性酸中毒ﻫE.呼吸性酸中毒合并呼吸性碱中毒(B)114.代谢性酸中毒时酶活性的变化下列哪项是正确的A.碳酸酐酶活性降低B.谷氨酸脱羧酶活性升高C.r-氨基丁酸转氨酶活性升高D.谷氨酰氨酶活性降低E.丙酮酸脱羧酶活性升高( C )115.代谢性酸中毒时酶活性的变化下列哪项是正确的A. 碳酸酐酶活性升高B.谷氨酸脱羧酶活性升高C.r-氨基丁酸转氨酶活性升高D.谷氨酰胺酶活性升高E.丙酮酸脱氨酶活性降低二、A3/A4型题(116~117题共用题干)病人因感冒,高热,3天来未能很好进食。
第三章 酸碱和溶剂化学

下面列出了硬酸、硬碱、软酸、软碱以及交界酸碱的一些例子。
软硬酸碱反应规则的理论解释
成键作用 硬酸硬碱的相互作用主要是一种静电相互作用。大 多属典型的硬酸硬碱都可以看成是离子键的化合物如 Li+、Na+、OH-、F-。阴阳离子的体积越小,相互之间 的静电能越大,结合就越紧密。 软酸软碱的相互作用主要是形成共价键。阳离子多是 半径大、d电子多的阳离子,有较强的极化作用;软碱则 多是变形性大的阴离子,相互极化作用,能使轨道发生 最大程度的重叠,形成稳定的共价键。 前线轨道理论控制作用 1968年,由Klopma基于多电子微扰理论对路易斯酸 碱的前线分子轨道的能量进行计算得到反应的总微扰能, 并根据静电作用与共价作用相对大小对软硬酸碱反应性 做出解释。
软硬酸碱原理的应用
1、判断反应进行的方向 KI + AgNO3 AgI + KNO3
软-硬
软-软 硬 -硬
硬-软
2、估计不同离子的配位性 [Cd (CN)4]2-, [Cd (NH3)4]2+
3、估计不同溶剂中盐类的溶解度(例SO2 F0.27 0.06 Cl64 0.012 Br145 0.05 I165 20
我国的戴安邦、刘祈涛教授提出用离子势作纵坐标, 用电负性作横坐标来作图,结果发现,硬酸和软酸之间有 一条明显分界线,从图中可以求出分界线的方程为: f=| Z | /r-3.0χ+2.2 用这个方程计算了106个阳离子酸,得出的结论为: f>0.5为硬酸;f<-0.5为软酸;f在-0.5到0.5之间为交界 酸,这就给出了一个定量的标准,它可以把酸按数值的大 小进行排队。 碱也可以同样处理, 得出相应结果, 分界线的方程为: ф= | Z | /r-6.25χ+17.00 当ф>0为软碱;ф<0为硬碱;ф≈0为交界碱。
第七章 酸碱反应3

【例7-8】
ΔpH = 3.80 - 2.89 = 0.91
23
【例5-9】计算 0.1mol· L-1 NH4Cl 和 0.1 mol· L-1 NH3· H2 O 如果在此溶液中分别加入 各 1L 混合后溶液的 pH 值。 【例7-9】 (1)0.02 mol 的HCl; (2)0.02 mol 的NaOH; (3)等体积的水。溶液的pH 值将分别是多少?
《普通化学》网络课件
第七章
酸 碱 反 应
Chapter 7 Acid — Base Reaction
授课教师 : 王 虹 苏 单 位 : 化学教研室
1
第二节
水溶液中的重要酸碱反应
一、水的质子自递反应
二、弱一元酸碱的离解
三、弱多元酸碱的离解
2
酸碱反应的实质——质子的转移(或得失) 水的质子自递常数
5
2.3 共轭酸碱 K a 与 K b 的关系
共轭酸碱 HB-B- 在水溶液中存在如下质子 转移反应: HB + H2O H3O+ + B-
[H3O ][B ] Ka ① [HB]
B- + H2O HB + OH-
[HB][OH ] Kb ② - [B ]
6
水溶液中同时存在:H2O H2O H3O+ OH 将以上两式相加得 K W =[H+ ][OH- ] ③
20
缓冲溶液pH值的计算
弱酸-共轭碱(盐)类型的缓冲溶液: 缓冲溶液pH 值的计 HB == H+ + B算 平衡浓度 c(HB)-x x c(B-) + x 同离子效应, c (HB) -x ≈ c(HB) , c (B-) + x ≈ c(B-) [ c ( H ) / c ][ c ( B ) / c ] 依据 K a [c(HB)/c ] c(HB) 可得 c( H )/c K a c(B )
大学分析化学第5章-1

Ac- + H2O
共轭酸碱对
醋酸与氨在水溶液中的中和反应 HAc + NH3 NH4+ + Ac-
共轭酸碱对
结论(conclusion)!
酸碱半反应不可能单独发生 酸碱反应是两对共轭酸碱对共同作用的结果 酸碱反应的实质是质子的转移 质子的转移是通过溶剂合质子来实现的
二、 酸碱反应的平衡常数
二、酸度对弱酸(碱)各形体分布的影响
• 分布分数(distribution fraction): • 溶液中某酸或碱组分的平衡浓度占其总浓度 的分数, 以表示. c
i
c
• 分布曲线——不同pH值溶液中酸碱存在形式 的分布
作用:
(1)深入了解酸碱滴定过程; (2)判断多元酸碱分步滴定的可能性。 滴定是溶液pH与溶液中各物种的量、比例 不断变化的过程。
• 则 [H2C2O4] = 0c, [HC2O4-] = 1c, [C2O42-] = 2c •
2
0+1+ 2=1
多 元 酸 溶 液
[ H 2C2O4 ] [ H 2C2O4 ] 0 2 c [ H 2C2O4 ] [ HC2O4 ] [C2O4 ] 1 1 2 K a1 K a1 k a2 [ HC2O4 ] [C2O4 ] 1 2 1 [H ] [H ] [ H 2C2O4 ] [ H 2C2O4 ] [ H ]2 2 [ H ] K a1 [ H ] K a1 k a2
+
展开得一元三次方程
[H+]3 + Ka[H+]2- (Kaca+Kw)[H+] - KaKw= 0
酸碱理论

酸碱理论查看“酸碱理论”的最新版∙历史版本:2 编辑时间:2008-08-02 14:33:33 作者:不3不4∙内容长度:3450字图片数:14个目录数:6个∙修改原因:新增内容美化页面∙评审意见:页面美观内容丰酸碱理论阐明酸、碱本身以及酸碱反应的本质的各种理论。
最早提出酸、碱概念的是英国R.玻意耳。
法国A.L.拉瓦锡又提出氧是所有酸中普遍存在的和必不可少的元素,英国H.戴维以盐酸中不含氧的实验事实证明拉瓦锡的看法是错误的,戴维认为:“判断一种物质是不是酸,要看它是否含有氢。
”这个概念带有片面性,因为很多有机化合物和氨都含有氢,但并不是酸。
德国J.von李比希弥补了戴维的不足,为酸和碱下了更科学的定义:“所有的酸都是氢的化合物,但其中的氢必须是能够很容易地被金属所置换的。
碱则是能够中和酸并产生盐的物质。
”但他不能解释为什么有的酸强,有的酸弱。
这一问题为瑞典S.A.阿伦尼乌斯解决。
目录∙•质子理论∙•路易斯酸碱理论∙•其他酸碱理论∙•酸碱食物合理搭配∙•相关条目∙•参考资料酸碱理论-质子理论1923年丹麦科学家J.N.布仑斯惕和英国科学家T.M.劳里同时提出酸碱质子理论:酸(A)是具有给出质子倾向的物质,而碱(B)是具有接受质子倾向的物质,例如:相差一个质子的两种物质(即A和B)叫共轭酸碱对。
按照这个理论,HCl、H3PO4是分子酸,NH嬃、Al(H2O)扟是阳离子酸,H2PO嬄是阴离子酸;而NH3是分子碱,Al(OH)(H2O)崬是阳离子碱,H2PO嬄、Cl-是阴离子碱。
有些物质(如H2PO嬄)在某一共轭酸碱对(如 H3PO4-H2PO嬄)中是碱,而在另一共轭酸碱对(H2PO嬄-HPO娸)中是酸。
酸给出质子的倾向愈强,则其共轭碱接受质子的倾向愈弱;若碱接受质子的倾向愈强,则其共轭酸给出质子的倾向愈弱。
质子传递反应只能发生在两个共轭酸碱对之间:若A(1)是强酸,B(2)是强碱,则质子传递反应向右进行;若B(1)、A(2)是弱碱和弱酸,则质子传递反应也能向右进行。
酸碱盐实验报告_3
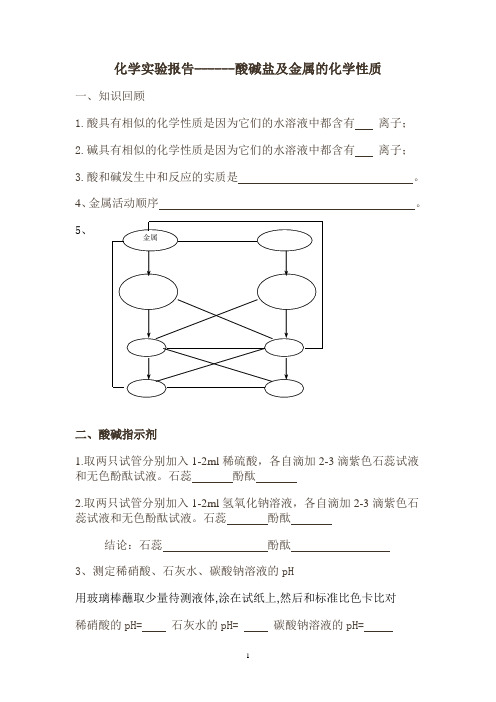
化学实验报告------酸碱盐及金属的化学性质
一、知识回顾
1.酸具有相似的化学性质是因为它们的水溶液中都含有离子;
2.碱具有相似的化学性质是因为它们的水溶液中都含有离子;
3.酸和碱发生中和反应的实质是。
4、金属活动顺序。
二、酸碱指示剂
1.取两只试管分别加入1-2ml稀硫酸,各自滴加2-3滴紫色石蕊试液和无色酚酞试液。
石蕊酚酞
2.取两只试管分别加入1-2ml氢氧化钠溶液,各自滴加2-3滴紫色石蕊试液和无色酚酞试液。
石蕊酚酞
结论:石蕊酚酞
3、测定稀硝酸、石灰水、碳酸钠溶液的pH
用玻璃棒蘸取少量待测液体,涂在试纸上,然后和标准比色卡比对
稀硝酸的pH= 石灰水的pH= 碳酸钠溶液的pH=
三、酸碱盐及金属的化学性质
四、拓展反思
1.滴有酚酞试液的氢氧化钠溶液与盐酸反应,如果溶液变无色,能否说二者恰好完全中和反应?
2.能否用无色酚酞溶液鉴别氢氧化钠溶液和碳酸钠溶液?若不能,则用何种试剂鉴别?
3.能否用氢氧化钠溶液干燥二氧化碳气体?若不能则用什么溶液来干燥?
4、请用三种方法鉴定氢氧化钠已变质。
3 酸碱平衡与酸碱滴定法(题库)-推荐下载

3 酸碱平衡与酸碱滴定法一、单项选择题(A )1、用基准无水碳酸钠标定0.100mol/L盐酸,宜选用()作指示剂。
A、溴钾酚绿—甲基红B、酚酞C、百里酚蓝D、二甲酚橙( C )2、配制好的HCl需贮存于( )中。
A、棕色橡皮塞试剂瓶B、塑料瓶C、白色磨口塞试剂瓶D、白色橡皮塞试剂瓶( B )3、用c(HCl)=0.1 mol·L-1 HCl溶液滴定c(NH3)=0.1 mol·L-1氨水溶液化学计量点时溶液的pH值为A、等于7.0B、小于7.0C、等于8.0D、大于7.0( A )4、欲配制pH=5.0缓冲溶液应选用的一对物质是A、HAc(Ka=1.8×10-5)~NaAc B 、HAc~NH4AcC、NH3·H2O (Kb=1.8×10-5)~NH4ClD、KH2PO4-Na2HPO4( C )5、欲配制pH=10.0缓冲溶液应选用的一对物质是()A、HAc(Ka=1.8×10-5)~NaAc B 、HAc~NH4AcC、NH3·H2O (Kb=1.8×10-5)~NH4ClD、KH2PO4-Na2HPO4( B )6、在酸碱滴定中,选择强酸强碱作为滴定剂的理由是()A、强酸强碱可以直接配制标准溶液B、使滴定突跃尽量大C、加快滴定反应速率D、使滴定曲线较完美( C )7、用NaAc·3H2O晶体,2.0mol/LNaOH来配制pH为5.0的HAc-NaAc缓冲溶液1升,其正确的配制是()A、将49克NaAc·3H2O放入少量水中溶解,再加入50ml 2.0mol/LHAc溶液,用水稀释1升B、将98克NaAc·3H2O放入少量水中溶解,再加入50ml 2.0mol/LHAc溶液,用水稀释1升C、将25克NaAc·3H2O放入少量水中溶解,再加入100ml 2.0mol/LHAc溶液,用水稀释1升D、将49克NaAc·3H2O放入少量水中溶解,再加入100ml 2.0mol/LHAc溶液,用水稀释1升( C )8、(1+5)H2SO4这种体积比浓度表示方法的含义是()A、水和浓H2SO4的体积比为1:6B、水和浓H2SO4的体积比为1:5C 、浓H 2SO 4和水的体积比为1:5D 、浓H 2SO 4和水的体积比为1:6( C )9、以NaOH 滴定H 3PO 4(kA 1=7.5×10-3,kA 2=6.2×10-8,kA 3=5.0×10-13)至生成Na 2HPO 4时,溶液的pH 值应当是 ( )A 、7.7B 、8.7C 、9.8D 、10.7( A )10、用0.10mol/LHCl 滴定0.10mol/L Na 2CO 3至酚酞终点,这里Na 2CO 3的基本单元数是( )A 、 Na 2CO 3B 、2 Na 2CO 3C 、1/3 Na 2CO 3D 、1/2 Na 2CO 3( A )11、下列弱酸或弱碱(设浓度为0.1mol/L )能用酸碱滴定法直接准确滴定的是( )A 、氨水(Kb=1.8×10-5)B 、苯酚(Kb=1.1×10-10)C 、NH 4+D 、H 3BO 3(Ka=5.8×10-10)( C )12、 用0.1mol/L HCl 滴定0.1mol/L NaOH 时的pH 突跃范围是9.7~4.3,用0.01mol/L HCl 滴定0.01mol/L NaOH 的突跃范围是( )A 、9.7~4.3B 、8.7~4.3C 、8.7~5.3D 、10.7~3.3( C ) 13、 某酸碱指示剂的KHIn=1.0×105,则从理论上推算其变色范围是() A 、4~5 B 、5~6 C 、4~6 D 、5~7 ( D )14、 用NaAc·3H 2O 晶体,2.0MHAc 来配制pH 为5.0的HAC-NaAc 缓冲溶液1升,其正确的配制是(,Ka=1.8×10-5)mol g M O H NaAC /1.13623 ·A 、将49克NaAc·3H 2O 放入少量水中溶解,再加入50ml2.0mol/LHAc 溶液,用水稀释1升B 、将98克NaAc·3H 2O 放少量水中溶解,再加入50ml 2.0mol/lHAc 溶液,用水稀释至1升C 、将25克NaAc·3H 2O 放少量水中溶解,再加入100ml 2.0mol/LHAc 溶液,用水稀释至1升D 、将49克NaAc·3H 2O 放少量水中溶解,再加入100ml 2.0mol/LHAc 溶液,用水稀释至1升( A )15、 NaOH 滴定H 3PO 4以酚酞为指示剂,终点时生成 ( )(H 3PO 4:Ka 1=6.9×10-3, Ka 2=6.2×10-8,Ka 3=4.8×10-13 )A 、 NaH 2PO 4B 、 Na 2HPO 4C 、 Na 3PO 4D 、 NaH 2PO 4 + Na 2HPO 4( A )16、用NaOH 溶液滴定下列( )多元酸时,会出现两个pH 突跃。
无机及分析化学第三章酸碱平衡

c(H )1. 310- 3
pH2.89
c(H )1.313 01.312 01.3%
c0
0.1
28
Question
(2) 0.10 mol·L–1的HAc溶液中加入少量固体NaAc,使NaAc的浓度为0.10 mol·L–1
解:在HAc水溶液中加入NaAc固体,由于同离子效应, HAc的解离度更小
25
3.2.5 同离子效应和盐效应
向HAc溶液中加入少量固 体NaAc固体可以使甲基橙指示 剂由红色变成黄色,为什么?
向体系中加入NaAc固体后, Ac¯浓度增大, 平衡向逆反应方向移动,HAc解离度降低。
HAc H+ + AcNaAc →Na+ + Ac-
在弱酸或者弱碱中加入其共轭碱或者共轭 酸,从而使平衡向着降低弱酸或者弱碱解离度方 向移动的作用称为同离子效应。
27
Question
解:
例3-1 计算下列两溶液的pH值和HAc的解离度: (1) 0.10 mol·L–1的 HAc溶液;
(1) 在HAc水溶液中存在如下解离平衡
HA + H2O
H3O+ + A¯
Ka (HA c(cH c)() H c(A A - )c c 1).810 5 K a (H A c c((c H H )2 ) A c(H 0 c .1 ))21.815 0
c0
0 .1
29
3.3 弱酸(碱)溶液中的型体分布
3.3.1酸(碱)的分析浓度
酸(碱)的浓度(分析浓度)是指某溶液中所含某酸 (碱)的总的物质的量浓度,它等于溶液中酸(碱) 各种型体的浓度之和,通常以c0来表示。
溶液的酸(碱)度是指溶液中H+(OH-)的浓度,通常 以pH(pOH)来表示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6/11/2015
23:23:14
分析化学讲稿 laozhu
第二章 酸碱滴定
. cn/bbs/
2.1 酸碱滴定概述
近似法
2.1.3 pH值的计算
忽略高价无穷小概念
不到5%,就忽略了!
简化公式,手工计算, 历史原因
6/11/2015
23:23:14
酸: 凡是能给出质子(H+)的物质
H2SO4、 HAc、NH4+、H2PO4- NaOH、Ac-、NH3、H2PO4-
碱: 凡是能接受质子(H+)的物质
6/11/2015
分析化学讲稿 laozhu
第二章 酸碱滴定
. cn/bbs/
2.1 酸碱滴定概述
NaOH滴定HCl 终点颜色: 无色 微红色
14 12 10 8 6 4 2 0 0 10 20 30 V /mL
6/11/2015
23:23:14
分析化学讲稿 laozhu
第二章 酸碱滴定
2.2.1
. cn/bbs/
2.2 酸碱指示剂
(CH )2N NaOH HCl 3滴定
第二章 酸碱滴定
. cn/bbs/
2.2 酸碱指示剂
原则 不宜过多
2.2.4 指示剂的用量
适量即可
一般滴加 1~2d,否则色变反而不明显 原因
1
实验室指示剂浓度已配得合适 指示剂本身是弱酸弱碱,会消耗滴定剂
6/11/2015
23:23:14
分析化学讲稿 laozhu
分析化学讲稿 laozhu
第二章 酸碱滴定
. cn/bbs/
第二章 酸碱滴定法
2.1 酸碱滴定概述 2.2 酸碱指示剂 2.1.1 酸碱平衡常数 2.1.2 质子条件 2.3 酸碱滴定原理 2.1.3 pH值的计算 2.4 酸碱滴定应用实例
2009这课提前了5min,中场到分布分数, 下次调整中场到软件。加入了软件,情况不 同了。
6/11/2015 23:23:14
分析化学讲稿 laozhu
第二章 酸碱滴定
2.2.1
. cn/bbs/
2.2 酸碱指示剂
OH OH
作用原理
酚酞(Phenolphthalein, PP)1%酒精溶液
O OH
无浓 色碱
OHC OH COO-
H+
变色范围
实际变色范围 1-2pH单位
理论:pKa±1
pKHIn=3.4 pKHIn=9.1 pKHIn=5.0
甲基橙:pH = 3.1-4.4(红-黄) 酚酞: pH = 8-10(无-红)
甲基红:pH = 4.4 -6.2(红-黄)
变色范围越窄,越敏锐,越好!
6/11/2015 23:23:14
分析化学讲稿 laozhu
2.1 酸碱滴定概述
分布曲线
2.1.4 其他基本概念
H3PO4与柠檬酸都是3元酸
随pH变化
1.0
两线交点潜含义
HL L
顶部接近1意义
H3L H2L
0.8
pKi=pH K1/K2足够大
分布分数
0.6
0.4
磷酸
0.2
0.0 0 2 4 6 pH 8 10 12 14
6/11/2015
pH
23:23:14
变色范围
中间色
酸色略带碱色 酸色
变 色 范 围
理论变色点pH=pKa
6/11/2015
pH<pKa-1,什么色?
23:23:14
理论变色范围:pH=pKa±1
分析化学讲稿 laozhu
第二章 酸碱滴定
2.2.2
. cn/bbs/
2.2 酸碱指示剂
23:23:14
分析化学讲稿 laozhu
第二章 酸碱滴定
. cn/bbs/
2.1 酸碱滴定概述
平衡浓度和分析浓度
+ HAc H +Ac
2.1.2 关于浓度
溶液中2种存在形式
平衡浓度: 分析浓度:
达平衡时实际存在的浓度 [ ] 有关形式平衡浓度的总和 cHAC
[HA][OH- ] Kb [A- ]
23:23:14
分析化学讲稿 laozhu
第二章 酸碱滴定
. cn/bbs/
2.1 酸碱滴定概述
一元酸碱 Ka Kb K w 二元酸碱 Ka1 Kb 2 Kw
2.1.1 酸碱平衡常数
共轭酸碱对离解常数的关系
cHA [H ]=Ka cA+
+
两性物质:如 H2 PO
4
+
缓冲溶液:如HAc-Ac6/11/2015
23:23:14
分析化学讲稿 laozhu
第二章 酸碱滴定
. cn/bbs/
2.1.3 pH值的计算
推荐软件运算法
pH计算软件
P27 0.0010 mol/L NaH2PO4 pH=4.66? 考虑了活度的才是精确的pH值
6/11/2015 23:23:14
分析化学讲稿 laozhu
第二章 酸碱滴定
. cn/bbs/
2.1 酸碱滴定概述
酸碱的定义:质子理论
酸 = 质子 + 碱
2.1.1 酸碱平衡常数 可 以 是 阴 、 阳 离 子 或 中 性 分 子
23:23:14
6/11/2015
偶氮类
23:23:14
分析化学讲稿 laozhu
第二章 酸碱滴定
2.2.2
. cn/bbs/
2.2 酸碱指示剂
理论变色范围
变色范围
HIn H In
[ H ][ In ] Ka [ HIn]
决定碱/酸式 比例
酸碱离解常数
2.1.1 酸碱平衡常数
1
+ A H O HA+OH HA H +A 酸碱强度定性描述: 给(受)质子的能力 2
1
酸碱强度定量描述: 离解常数 Ka Kb =[H ][OH ]=KW
+
-
1
[H+ ][A- ] Ka [HA]
6/11/2015
作用原理
甲基橙 (Methyl Orange, MO) 水溶液
pH N N 滴定HClSO-3 NaOH 14
H+ OH-
终点颜色:
终点颜色:
(CH3)2 N
12 10 8 6 4 2 0
红色) 橙色 黄色 橙色 碱 型, 黄色(偶氮式 +
N
NH
SO-3
0 红 10 20 酸型, 色(醌 式)
30 V /mL
分析化学讲稿 laozhu
第二章 酸碱滴定
. cn/bbs/
2.1 酸碱滴定概述
分布曲线
2.1.4 其他基本概念
HAc单元酸,pKa=4.74
交点pH=pKa
HAc
pH
Ac-
dHAc
0.50 0.09 0.01
dAc
0.50 0.91
pKa pKa+1
第二章 酸碱滴定
. cn/bbs/
2.2 酸碱指示剂
原则 不宜过多
2.2.4 指示剂的用量
适量即可
加多加少,对单/双色In 情况不同
PP无红 1d pH=8 10d MO黄红 1d 1d 5d 5d
PP多了加1d与加10d, 变色pH降1pH单位 6/11/2015
共轭酸碱对
2.1.1 酸碱平衡常数
因一个质子的得失而互相转变的一对酸碱。 H3PO4 NH3 H2PO4HPO42PO43NH4+
1
NH2-
6/11/2015
23:23:14
分析化学讲稿 laozhu
第二章 酸碱滴定
. cn/bbs/
2.1 酸碱滴定概述
分析化学讲稿 laozhu
第二章 酸碱滴定
常见情况的近似公式
. cn/bbs/
2.1.3 pH值的计算
一元强酸:如HCl
一元弱酸:如HAc
多元弱酸:如H3PO4
[H+ ]= c 4Ac NH + 氨基酸 [H ]= cK
a
[H ]= cK a1 [H ]= Ka1Ka 2
6/11/2015
23:23:14
分析化学讲稿 laozhu
第二章 酸碱滴定
2.2.1
Байду номын сангаас
. cn/bbs/
2.2 酸碱指示剂
变色原理
作用原理
指示剂一般是有机弱酸/碱 其共轭酸、碱颜色不同
HIn H In
酸式色
碱式色
常用的有酚酞(PP)和甲基橙(MO)等
MO多了, 色差不明显 23:23:14
分析化学讲稿 laozhu
第二章 酸碱滴定
. cn/bbs/
KH2PO4 0.025 mol/L
Na2HPO4 0.025 mol/L
6/11/2015
标准pH值 pH=4.008 pH=6.865
23:23:14
分析化学讲稿 laozhu
第二章 酸碱滴定
. cn/bbs/
2.1 酸碱滴定概述
分布曲线
C COO-
不 是 醌 式
酸式,无色
碱式,红色(醌式)
6/11/2015
三苯甲烷类
23:23:14
分析化学讲稿 laozhu
第二章 酸碱滴定
2.2.1
. cn/bbs/
2.2 酸碱指示剂
pH
作用原理
酚酞(Phenolphthalein, PP)
