水质氯化物的测定
水质氯化物的测定

氯化物1 概述氯化物是水和废水中一种常见的无机阴离子。
几乎所有天然水中都有氯离子存在,它的含量范围变化很大。
在河流、湖泊、沼泽地区,氯离子含量一般较低,而在海水、盐湖及某些地下水中,含量可高达数十克/L。
在人类的生存活动中,氯化物有很重要的生理作用及工业用途。
正因为如此,在生活污水和工业废水中,均含有相当数量的氯离子。
若饮水中氯离子含量达到250mg/L,相应的阳离子为钠时,会感觉到咸味;水中氯化物含量高时,会损害金属管道和建筑物,并妨碍植物的生长。
2 方法选择测定氯化物的方法较多,其中:离子色谱法是目前国内外最通用的方法,简便快捷。
硝酸银滴定法、硝酸汞滴定法所需仪器设备简单适合于清洁水测定,但硝酸汞滴定法适用的汞盐剧毒,因此这里不做推荐。
电位滴定法和电极流动法适合于测定带色或污染水样,在污染源监测中使用较多。
同时把电极法改为流通池测量,可保证电极的持久使用,并能提高测量精度。
(一)离子色谱法(1)方法原理本法利用离子交换的原理,连续对多种阴离子进行定性和定量分析。
水样注入碳酸盐-碳酸氢盐溶液并流经系列的离子交换树脂,基于待测阴离子对低容量强碱性阴离子树脂(分离柱)的相对亲和力不同而彼此分开。
被分开的阴离子,在流经强酸性阳离子树脂(抑制柱)室,被转换为高电导的酸型,碳酸盐-碳酸氢盐则转变成弱电导的碳酸(消除背景电导)。
用电导检测器测量转变为相应酸型的阴离子,与标准进行比较,根据保留时间定性,峰高或峰面积定量。
一次金阳可连续测定六种无机阴离子(、、、、-F -Cl -2NO -3NO 和)-24HPO -24SO (2)干扰及消除当水的负峰干扰F -或Cl -的测定时,可用于100ml 水样中加入1ml 淋洗贮备液来消除负峰的干扰。
保留时间相近的两种离子,因浓度相差太大而影响低浓度阴离子的测定时,可用加标的方法测定低浓度阴离子。
不被色谱柱保留或弱保留的阴离子干扰F -或Cl -的测定。
若这种共淋洗的现象显著,可改用弱淋洗液(0.005mol/L ) 进行742O B Na 洗脱。
水质 氯化物的测定 硝酸汞滴定法
3.3 硝酸汞标准溶液[½Hg(NO3)2=0.0250mol/L]:溶解 4.283 硝酸汞 [Hg(NO3)2·H2O]于 50mL 用 0.5mL 浓硝酸酸化了得蒸馏水中,移入
1000mL 容 量 瓶 中 , 用 蒸 馏 水 稀 释 至 标 线 , 有 混 浊 时 过 滤 , 以
0.0250mol/L 氯化钠标准溶液(3.1)标定之。贮存于棕色瓶中。
入 1000mL 容量瓶中稀释到标线。
3.2 氯化钠标准溶液(NaCl=0.0141mol/L):将氯化钠置于坩埚中,
在 500-600℃加热 40-50min。冷却后称取 8.248g 溶于蒸馏水,置
1000mL 容量瓶中,用水稀释至标线。吸取 10.0mL,用水定容至 100mL,
此溶液每毫升含 0.500mg 氯化物(Cl-)。
8 精密度和准确度
氯化物浓度为 88.29mg/L 的标准混合样品,经五个实验室分析,室
内相对标准偏差为 0.04%;室间相对标准偏差为 1.02%,相对误差
为 0.43%;加标回收率为 100.13%—101.07%。
时,相对标准偏差为 0.03-3.37﹪。
2. 原理
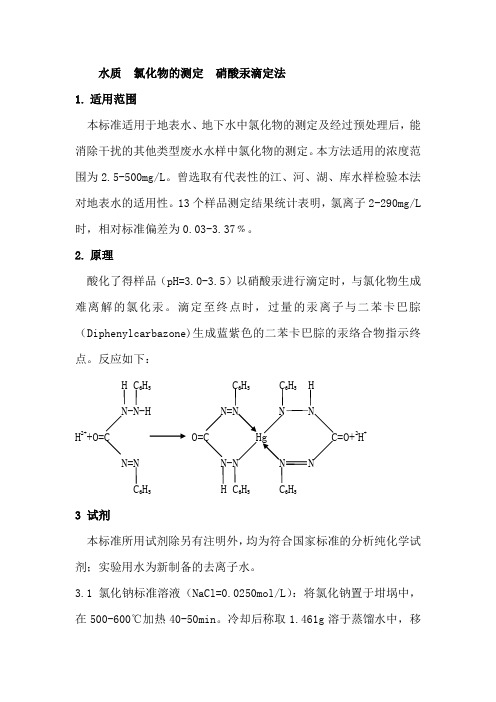
酸化了得样品(pH=3.0-3.5)以硝酸汞进行滴定时,与氯化物生成
难离解的氯化汞。滴定至终点时,过量的汞离子与二苯卡巴腙
(Diphenylcarbazone)生成蓝紫色的二苯卡巴腙的汞络合物指示终
点。反应如下:
H C6H5
C6H5
C6H5 H
N-N-H
细调节 PH 为 3.0-3.5。
6.9 用 0.025mol/L 硝酸汞标准溶液(3.3)滴定至蓝紫色即为终点。
若氯化物浓度小于 2.5mg/L,则改用 0.014mol/L 硝酸汞标准溶液
水质 氯化物的测定 硝酸银滴定法

水质氯化物的测定硝酸银滴定法1 主题内容与适用范围本标准规定了水中氯化物浓度的硝酸银滴定法.本标准适用于天然水中氯化物的测定,也适用于经过适当稀释的高矿化度水如咸水、海水等,以及经过预处理除去干扰物的生活污水或工业废水.本标准适用的浓度范围为10 ~ 500 mg/L 的氯化物,高于此范围的水样经稀释后可以扩大其测定范围。
溴化物、碘化物和氰化物能与氯化物一起被滴定。
正磷酸盐及聚磷酸盐分别超过250mg/L及25mg/L时有干扰.铁含量超过10mg/L 时使终点不明显。
2 原理在中性至弱碱性范围内(pH6.5~ 10.5 )、以铬酸钾为指示剂.用硝酸银滴定氯化物时,由于氯化银的溶解度小于铬酸银的溶解度,氯离子首先被完全沉淀出来后,然后铬酸盐以铬酸银的形式被沉淀.产生砖红色,指示滴定终点到达。
该沉淀滴定的反应如下:Ag++Cl-—→AgCl↓2Ag++CrO4—→AgCr04↓(砖红色)3 试剂分析中仅使用分析纯试制及蒸馏水或去离子水。
3.1 高锰酸钾,C(1/5KMnO4)=0.01 mol/L。
3.2 过氧化氢(H202) , 30%。
3.3 乙醉(C6H5OH) , 95%。
3.4 硫酸溶液,C(1/2H2SO4)=0.05mol/L 。
3.5 氢氧化钠溶液,C(NaOH)=0.05mol/L 。
3.6 氢氧化铝悬浮液:溶解125g 硫酸铝钾〔KAl(SO4)2· 12H2O〕于1L蒸馏水中.加热至60℃,然后边搅拌边缓缓加入55 mL 浓氨水放置约lh 后,移至大瓶中,用倾泻法反复洗涤沉淀物,直到洗出液不含氧离子为止。
用水稀至约为300 mL 。
3.7 氯化钠标准溶液,C( Nacl )=0.0l4lmol/L,相当于500 mg/L氯化物含量:将氯化纳(Nacl )置于瓷坩祸内.在500~600℃下灼烧40~50min 。
在干燥器中冷却后称取8.2400g ,溶于蒸馏水中,在容量瓶中稀释至1000mL。
氯化物的测定-国标法(水质检测)

氯化物的测定-国标法(水质检测)背景介绍氯化物是一种常见的水质指标之一,它是许多水体中存在的一种常见离子。
测定水中氯化物的含量对于评估水质的安全性和适用性非常重要。
国标法是一种常用的测定方法,可以准确且快速地确定水中氯化物含量。
测定原理国标法测定水中氯化物的原理是基于离子反应通量法。
当加入硝酸银试剂和硝酸亚铁作为指示剂时,水中的氯化物会与试剂发生反应,生成白色的氯化银沉淀。
通过测定氯化银沉淀的质量,可以间接测定水中氯化物的含量。
实验步骤1. 准备工作:将所需试剂,如硝酸银试剂、硝酸亚铁等准备齐全。
2. 采样:从待测水样中用适量采集适量的样品。
3. 处理样品:将采集的水样经过预处理,如过滤、降温等。
4. 加入试剂:取一定体积的处理好的水样,加入适量的硝酸银试剂和硝酸亚铁指示剂。
5. 摇匀:在保持恒定温度下,用试剂瓶轻轻摇晃。
6. 沉淀分离:待反应完全后,将生成的氯化银沉淀用滤纸分离。
7. 干燥与称重:将分离的氯化银沉淀放入干净的烧杯中,放入烘箱中干燥,直至质量不再变化。
最终称重得到沉淀质量。
8. 结果计算:根据沉淀质量,依据国家标准中的测定公式,计算出水样中氯化物的含量。
注意事项1. 实验中应注意安全,避免试剂的吸入、溅入,避免与皮肤直接接触。
2. 实验环境应保持洁净,避免杂质的干扰。
3. 实验过程中应严格控制温度,以保证实验结果的准确性。
4. 所有试剂和仪器设备都应符合相关的质量标准,并严格按照实验步骤进行操作。
5. 在分析结果时,应参考国家标准,进行合理的结果分析和判断。
结论国标法是一种可靠、准确、简单的方法来测定水中氯化物的含量。
通过实验可以得到水中氯化物的浓度,对于水质的监测和评估具有重要意义。
然而,在实际应用中,还应综合考虑其他水质参数,以完整评估水体的安全性和适用性。
水质氯化物的测定硝酸银滴定法

水质-氯化物的测定-硝酸银滴定法水质氯化物的测定硝酸银滴定法1.范围本方法规定了水中氯化物浓度的硝酸银滴定法。
本方法适用于天然水中氯化物的测定,也适用于经过适当稀释的高矿化度水如咸水、海水等,以及经过预处理除去干扰物的生活污水或工业废水。
本方法适用的浓度范围为10~500mg/L的氯化物。
高于此范围的水样经稀释后可以扩大其测定范围。
溴化物、碘化物和氰化物能与氯化物一起被滴定。
正磷酸盐及聚磷酸盐分别超过250mg/L及25mg/L时有干扰。
铁含量超过10mg/L时使终点不明显。
2.原理在中性至弱碱性范围内(pH6.5~10.5)。
以铬酸钾为指示剂,用硝酸银滴定氯化物时,由于氯化银的溶解度小于铬酸银的溶解度,氯离子首先被完全沉淀出来后,然后铬酸盐以铬酸银的形式被沉淀,产生砖红色,指示滴定终点到达。
该沉淀滴定的反应如下:Ag++Cl-―AgCl2Ag++CrO42-―Ag2CrO4 (砖红色)3.试剂分析中仅使用分析纯试剂及蒸馏水或去离子水。
3.1高锰酸钾,c(1/5KMnO4)=0.01mol/L。
3.2过氧化氢(H2O2),30%。
3.3乙醇(C2H5OH),95%。
3.4硫酸溶液,c(1/2H2SO4)=0.05mol/L。
3.5氢氧化钠溶液,c(NaOH)=0.05mol/L。
3.6氢氧化铝悬浮液:溶解125g硫酸铝钾[KAl(SO4)2·12H2O]于1L蒸馏水中,加热至60℃,然后边搅拌边缓缓加入55mL浓氨水放置约1h后, 移至大瓶中,用倾泻法反复洗涤沉淀物,直到洗出液不含氯离子为止。
用水稀至约为300mL。
3.7氯化钠标准溶液,0.0141mol/L,相当于500mL/L氯化物含量:将氯化钠(NaCl)置于瓷坩埚内,在500~600℃下灼烧40~50min。
在干燥器中冷却后称取8.2400g,溶于蒸馏水中,在容量瓶中稀释至1000mL。
用吸管吸取10.0mL,在容量瓶中准确稀释至100mL。
氯化物的测定-硝酸银滴定法GB11896-89

水质氯化物的测定硝酸银滴定法1 主题内容与适用范围本标准规定了水中氯化物浓度的硝酸银滴定法.本标准适用于天然水中氯化物的测定,也适用于经过适当稀释的高矿化度水如咸水、海水等,以及经过预处理除去干扰物的生活污水或工业废水.本标准适用的浓度范围为10 ~ 500 mg/L 的氯化物,高于此范围的水样经稀释后可以扩大其测定范围。
溴化物、碘化物和氰化物能与氯化物一起被滴定。
正磷酸盐及聚磷酸盐分别超过250mg/L及25mg/L时有干扰.铁含量超过10mg/L 时使终点不明显。
2 原理在中性至弱碱性范围内(pH6.5~ 10.5 )、以铬酸钾为指示剂.用硝酸银滴定氯化物时,由于氯化银的溶解度小于铬酸银的溶解度,氯离子首先被完全沉淀出来后,然后铬酸盐以铬酸银的形式被沉淀.产生砖红色,指示滴定终点到达。
该沉淀滴定的反应如下:++Ag++Cl-—→AgCl↓2Ag++CrO4—→AgCr04↓(砖红色)3 试剂分析中仅使用分析纯试制及蒸馏水或去离子水。
3.1 高锰酸钾,C(1/5KMnO4)=0.01 mol/L。
3.2 过氧化氢(H202) , 30%。
3.3 乙醉(C6H5OH) , 95%。
3.4 硫酸溶液,C(1/2H2SO4)=0.05mol/L 。
3.5 氢氧化钠溶液,C(NaOH)=0.05mol/L 。
3.6 氢氧化铝悬浮液:溶解125g 硫酸铝钾〔KAl(SO4)2· 12H2O〕于1L蒸馏水中.加热至60℃,然后边搅拌边缓缓加入55 mL 浓氨水放置约lh 后,移至大瓶中,用倾泻法反复洗涤沉淀物,直到洗出液不含氧离子为止。
用水稀至约为300 mL 。
3.7 氯化钠标准溶液,C( Nacl )=0.0l4lmol/L,相当于500 mg/L氯化物含量:将氯化纳(Nacl )置于瓷坩祸内.在500~600℃下灼烧40~50min 。
在干燥器中冷却后称取8.2400g ,溶于蒸馏水中,在容量瓶中稀释至1000mL。
水质氯化物的测定硝酸银滴定法
水质-氯化物的测定-硝酸银滴定法水质氯化物的测定硝酸银滴定法一、实验目的通过硝酸银滴定法测定水质中的氯化物含量,了解其在水质中的重要性。
二、实验原理氯化物是水中常见的无机盐类,主要包括氯离子(Cl-)和溴离子(Br-)。
硝酸银与氯离子反应生成白色沉淀的氯化银(AgCl),通过滴定法可以测定水中氯化物的含量。
三、实验步骤1.样品采集与保存:用干净的玻璃瓶或聚乙烯瓶采集水样,将水样摇匀后立即进行测定,避免沉淀和污染。
2.样品预处理:将采集的水样摇匀后,用滤纸过滤,除去悬浮物和杂质。
3.绘制标准曲线:分别吸取0、50、100、200、300、400、500ml的氯化钠标准溶液(浓度为100mg/ml),置于250ml烧杯中,加入50ml水,滴加硝酸银溶液直至生成白色沉淀,记录消耗的硝酸银体积。
根据测定的结果绘制标准曲线。
4.样品测定:移取25.0ml预处理后的水样于250ml烧杯中,加入50ml水,滴加硝酸银溶液直至生成白色沉淀,记录消耗的硝酸银体积。
5.结果计算:根据测定的结果从标准曲线上查得相应的氯化物含量。
四、注意事项1.样品采集后应尽快测定,以免发生变化。
2.滴定过程中要控制好滴定速度,避免过快或过慢。
3.绘制标准曲线时,要保证各个标准点的浓度和体积准确可靠。
4.水样的预处理可以有效去除悬浮物和杂质,保证测定结果的准确性。
五、实验数据分析表1:标准曲线数据记录表积之间的关系。
在样品测定过程中,需要准确记录消耗的硝酸银体积,从而计算出相应的氯化物含量。
六、实验结论通过硝酸银滴定法测定水质中的氯化物含量,可以得到较为准确的结果。
本实验测得水样中氯化物的含量为X mg/L。
从实验结果可以看出,硝酸银滴定法是一种可靠的测定方法,可以应用于水质分析中氯化物的测定。
通过对水中氯化物的监测,可以了解水质的基本情况,为环境保护和水资源管理提供科学依据。
重铬酸钾法测定cod水质氯化物的测定硝酸银滴定法
重铬酸钾法测定cod 水质氯化物的测定硝酸银滴定法水质氯化物的测定硝酸银滴定法1 主题内容与适用范围本标准规定了水中氯化物浓度的硝酸银滴定法(本标准适用于天然水中氯化物的测定,也适用于经过适当稀释的高矿化度水如咸水、海水等,以及经过预处理除去干扰物的生活污水或工业废水( 本标准适用的浓度范围为10 ~ 500 mg/L 的氯化物,高于此范围的水样经稀释后可以扩大其测定范围。
溴化物、碘化物和氰化物能与氯化物一起被滴定。
正磷酸盐及聚磷酸盐分别超过250mg/L及25mg/L时有干扰(铁含量超过10mg/L 时使终点不明显。
2 原理在中性至弱碱性范围内(pH6.5~ 10.5 )、以铬酸钾为指示1剂(用硝酸银滴定氯化物时,由于氯化银的溶解度小于铬酸银的溶解度,氯离子首先被完全沉淀出来后,然后铬酸盐以铬酸银的形式被沉淀(产生砖红色,指示滴定终点到达。
该沉淀滴定的反应如下:Ag++Cl-—?AgCl?2Ag++CrO4—?AgCr04?(砖红色)3 试剂分析中仅使用分析纯试制及蒸馏水或去离子水。
3.1 高锰酸钾,C(1/5KMnO4 )=0.01 mol/L。
3.2 过氧化氢(H202) , 30,。
3.3 乙醉(C6H5OH) , 95,。
3.4 硫酸溶液,C(1/2H2SO4)=0.05mol/L 。
3.5 氢氧化钠溶液,C(NaOH)=0.05mol/L 。
3.6 氢氧化铝悬浮液:溶解125g 硫酸铝钾〔KAl(SO4)212H2O〕于1L蒸馏水中.加热至60? ,然后边搅拌边缓缓加入55 mL 浓氨水放置约lh 后,移至大瓶中,用倾泻法反复洗涤沉淀物,直到洗出液不含氧离子为止。
用水稀至约为300 mL 。
3.7 氯化钠标准溶液,C( Nacl )=0.0l4lmol/L,相当于500 mg/L氯化物含量:将氯化纳(Nacl )置于瓷坩祸内(在500~600?下灼烧40~50min 。
在干燥器中冷却后称取8.2400g ,溶于蒸馏水中,在容量瓶中稀释至1000mL。
水质 氯化物的测定
六、计算:
氯化物含量C(mg/L)按下式计算:
( V2 V1 ) M 35.45 1000 C V
式中:V1—蒸馏水消耗硝酸银标准溶液量,mL; V2—试样消耗硝酸银标准溶液量,mL; V—试样体积,mL;
M—硝酸银标准溶液浓度,mol/L。
水质 氯化物的测定
硝酸银滴定法
一、原理:
在中性至弱碱性范围内( PH6.5~10.5 ),以铬 酸钾为指示剂,用硝酸银滴定氯化物。氯化银的溶 解度小于铬酸银的溶解度,故氯离子会先被完全沉 淀(白色),再生成铬酸银沉淀(砖红色)。 Ag++AgCrO4 ↓(砖红色)
四、仪器设备:
1、锥形瓶,250mL。 2、滴定管,25mL,棕色。 3、吸管,50mL,25mL。 4、量筒,烧杯等
五、测定步骤:
a 、用吸管吸取 50mL 水样或经过预处理的水样,置于锥形瓶中。另取 一锥形瓶加入50mL蒸馏水作空白试验。 b、如水样PH值在6.5~10.5范围时,可直接滴定,超出此范围的水样应 以酚酞作指示剂,用稀硫酸或氢氧化钠的溶液调节至红色刚刚退去。 c、各加入1mL铬酸钾溶液,摇匀,用硝酸银标准溶液滴定至砖红色沉 淀刚刚出现即为滴定终点。同法做空白滴定。
7、过氧化氢,30%。
三、干扰排除:
1、如果水样中含有硫化物、亚硫酸盐或硫代硫酸盐,则加氢氧化钠溶 液将水样调至中性或弱碱性,加入1mL30%过氧化氢,摇匀。一分钟后 加热至70~80℃,以除去过量的过氧化氢。 2、如果水样浑浊及带有颜色、有机物含量高或色度高、由有机质而产 生的较轻色度,都需另外处理。
二、试剂
1、NaCl标准溶液:C(NaCl)=0.0141mol/L。将氯化钠置于瓷坩埚内于 500~600℃下灼烧40~50min,在干燥器内冷却后称取8.2400g溶于蒸馏 水中,再在容量瓶中稀释至1000mL。用吸管吸取10.0mL,在容量瓶中 准确稀释至100mL。1.00mL此标准溶液含0.50mg氯化物。 2、AgNO3标准溶液:C(AgNO3)=0.0141mol/L。将AgNO3于105℃烘 30min,在干燥器内冷却后称取 2.3950g,溶于蒸馏水,在容量瓶中稀 释至1000mL,贮存在棕色瓶中。注:需用氯化钠标准溶液标定其浓度。 (吸取25.00mLNaCl标准溶液于250mL锥形瓶中,加蒸馏水25mL。另取 一锥形瓶,量取蒸馏水50mL做空白。各加入1mL铬酸钾溶液,在不断 摇动下用硝酸银标准溶液滴定至砖红色沉淀刚刚出现为终点。计算每 mL硝酸银溶液所相当的氯化物量,然后校正其浓度,再做最后标定。)
(完整word版)氯化物的测定-硝酸银滴定法GB11896-89
水质氯化物的测定硝酸银滴定法1 主题内容与适用范围本标准规定了水中氯化物浓度的硝酸银滴定法.本标准适用于天然水中氯化物的测定,也适用于经过适当稀释的高矿化度水如咸水、海水等,以及经过预处理除去干扰物的生活污水或工业废水.本标准适用的浓度范围为10 ~ 500 mg/L 的氯化物,高于此范围的水样经稀释后可以扩大其测定范围。
溴化物、碘化物和氰化物能与氯化物一起被滴定。
正磷酸盐及聚磷酸盐分别超过250mg/L及25mg/L时有干扰.铁含量超过10mg/L 时使终点不明显。
2 原理在中性至弱碱性范围内(pH6.5~ 10.5 )、以铬酸钾为指示剂.用硝酸银滴定氯化物时,由于氯化银的溶解度小于铬酸银的溶解度,氯离子首先被完全沉淀出来后,然后铬酸盐以铬酸银的形式被沉淀.产生砖红色,指示滴定终点到达。
该沉淀滴定的反应如下:++Ag++Cl-—→AgCl↓2Ag++CrO4—→AgCr04↓(砖红色)3 试剂分析中仅使用分析纯试制及蒸馏水或去离子水。
3.1 高锰酸钾,C(1/5KMnO4)=0.01 mol/L。
3.2 过氧化氢(H202) , 30%。
3.3 乙醉(C6H5OH) , 95%。
3.4 硫酸溶液,C(1/2H2SO4)=0.05mol/L 。
3.5 氢氧化钠溶液,C(NaOH)=0.05mol/L 。
3.6 氢氧化铝悬浮液:溶解125g 硫酸铝钾〔KAl(SO4)2· 12H2O〕于1L蒸馏水中.加热至60℃,然后边搅拌边缓缓加入55 mL 浓氨水放置约lh 后,移至大瓶中,用倾泻法反复洗涤沉淀物,直到洗出液不含氧离子为止。
用水稀至约为300 mL 。
3.7 氯化钠标准溶液,C( Nacl )=0.0l4lmol/L,相当于500 mg/L氯化物含量:将氯化纳(Nacl )置于瓷坩祸内.在500~600℃下灼烧40~50min 。
在干燥器中冷却后称取8.2400g ,溶于蒸馏水中,在容量瓶中稀释至1000mL。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水质 氯化物的测定 硝酸银滴定法方法确认报告
一、方法概述
本方法依据为GB 11896-1989。
在中性至弱碱性范围内(~),以铬酸钾为指示剂,用硝酸银滴定氯化物时,由于氯化银的溶解度小于铬酸银的溶解度,氯离子首先被完全沉淀出来后,然后铬酸盐以铬酸银的形式被沉淀,产生砖红色,指示滴定终点到达。
本方法适用于天然水中氯化物的测定,也适用于经过适当稀释的高矿化度水如咸水、海水等,以及经过预处理除去干扰物的生活污水或工业废水。
二、仪器和试剂 1. 仪器及设备 250ml 锥形瓶 25ml 滴定管 2. 试剂 硫酸溶液,L 氢氧化钠溶液,L 氢氧化铝悬浮液 氯化钠标准溶液,L 硝酸银标准溶液,L 铬酸钾,50g/L 酚酞指示剂溶液 三、分析步骤 1. 试样的测定
用吸管吸取50ml 水样或经过预处理的水样,置于锥形瓶中。
如水样pH 值在~范围时,可直接滴定,超出此范围的水样应以酚酞作指示剂,用稀硫酸或氢氧化钠的溶液调节至红色刚刚退去。
加入1ml 铬酸钾溶液,用硝酸银标准溶液滴定至砖红色沉淀刚刚出现即为滴定终点。
四、数据处理及计算
试样中氯化物含量C (mg/L )按下式计算
式中:V 1——蒸馏水消耗硝酸银标准溶液量,ml V 2——试样消耗硝酸银标准溶液量,ml M ——硝酸银标准溶液浓度,mol/L V ——试样体积,ml 六、方法检出限
测定7次的空白溶液消耗硝酸银标准溶液量,其标准偏差的三倍即为检出限。
具体计算结果
V
1000
×35.45×M ×)(12V V C -=
见表1。
表1 硝酸银滴定法检出限计算表
由上表可看出因此本方法的检出限完全能满足评价标准的要求。
七、方法精密度
配制并测定浓度为µg/mL 的标准样品6次,方法精密度见表2。
表2 方法精密度计算表
八、方法准确度
测定实际样品加标回收率,在10mL 实际样品中加入甲醛标准溶液µg/mL ,测定6次,加标回收率见表4。
表4
实际样品加标回收率结果表 九、总结
采用本方法测定工业废气和环境空气中的甲醛的方法检出限满足相关评价标准的要求;实际样品中的加标回收率为%,能满足有关技术规范中质量控制的要求。
编写人:日期:年月日审核人:日期:年月日批准人:日期:年月日。
