极性和非极性分子
高一化学极性分子和非极性分子
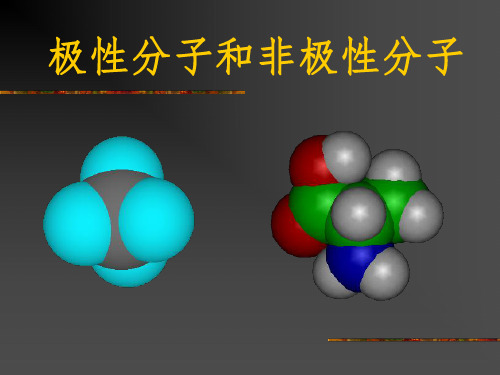
分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 范德华力
原子间 作用力大 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
思考:比较氟、氯、溴、碘分子的熔沸点高低并说明理由
练习
1. 下列化学键中,都属于极性共价键的是(
)
A. 共价化合物中的化学键
B. 离子化合物中的共价键
极性分子:分子中正负电荷中心不重合,从整个分子来看, 电荷的分布是不均匀的,不对称的,这样的分子为极性分子。
非极性分子:分子中正负电荷中心重合,从整个分子来看, 电荷的分布是均匀的,对称的,这样的分子为极性分子。
键的极性与分子的极性的区别与联系
概念
键的极性
分子的极性
含义
极性键和非极性键 极性分子和非极性分子
C. 同种元素原子间的共价键
D. 不同元素原子间的共价键
2. X、Y、Z是三种常见的短周期元素,可以形成XY2、Z2Y、XY3
Z2Y2、Z2X等化合物,已知Y的离子和Z的离子有相同的电子层结
构,X离子比Y离子多1个电子层。 (1)X离子符号为____S_2_-_______
(2)Z2Y对应水化物的碱性比LiOH____强_______ (3)Z2X属于__离__子___(共价或离子)化合物,它与氯水反应的 化学方程式为____N_a_2_S_+__C__l2_=__2_N_a_C__l _+__S____________ (4)Z2Y2中含有_离__子_ 键和__非__极__性__共__价___键,它溶于水时发生 反应的化学方程式为__2_N_a_2_O__2+___2_H_2_O__=__4_N_a_O__H__+__O__2↑_____
极性分子和非极性分子

如果分子中所有的化学键都是非极性的,那么价电子就被键合原子相等地共用。
因而,在分子中电子是呈对称均匀分布的。
这种均匀分布的发生与化学键的数目和它们在空间的伸展方向无关。
具有这种特性的分子叫做非极性分子。
如H2,Cl2,N2,O2等。
像HCl和HBr这类双原子分子只有一对电子形成化学键,并且是极性键。
其电子云分布是不对称、不均衡的,被叫做极性分子。
如果分子含有多个极性键,从分子的整体来看,它可能是极性的,也可能是非极性的,这取决于分子中化学键的空间排布。
如果分子中的极性键都相同,从分子的极性的总体来说,它只取决于化学键的空间排布。
以上的看法可以从用带静电荷的棒来靠近细水流及四氯化碳流所发生的现象来证实,细的水流受到吸引而四氯化碳流不受影响。
可以说明水分子是极性分子,而四氯化碳分子尽管是由4个极性键构成但因为其排布均匀,就其总体来说是非极性分子,具有类似结构的还有CH4、C2H6等。
非极性分子与极性分子

非极性分子与极性分子分子是由原子组成的。
当原子相互结合时,它们所形成的分子可以是极性的或非极性的。
在对分子进行分类时,需要了解一些基本的化学知识,例如化学键的类型、电子云的分布等等。
本文将介绍非极性分子和极性分子的概念,以及它们的区别。
一、什么是非极性分子?非极性分子是由原子组成的分子,其中原子之间不会产生极性化学键。
这些分子通常由相同性质的原子组成,例如氧气(O2)、氢气(H2)和氮气(N2)。
这些分子的化学键是非极性化学键,这意味着它们是由共价键组成的,共享电子对在两个原子之间平均分布,没有正负极性区。
非极性分子的化学键非常稳定,因为它们通常不与其他分子形成氢键或离子键。
这些分子的化学性质较为稳定,不易被其他物质影响。
例如在空气中,氧气、氮气和氢气都具有较高的稳定性,它们不会被其他物质影响,从而不易被氧化和/或还原。
极性分子是由两种或更多种不同原子组成的分子,其中至少一个化学键是极性化学键。
化学键的极性是由于电子云的分布不均匀所导致的。
每个原子中的电子云在分子中形成了偏移,这意味着它们的电荷分布不再对称。
正因为如此,分子在两端存在带有相反的电荷部分,并能与其他分子发生氢键或离子键。
极性分子的极性化学键会导致分子间的分子间相互作用增强,因此分子更容易被其他分子吸引。
这导致了极性分子在不同物理和化学条件下表现出不同的性质。
例如水(H2O)是一种重要的极性分子,因为其中的氧原子和氢原子之间形成了一个极性化学键。
水具有许多特殊的性质,例如可溶性高、极性化学反应性强等等。
1、化学键类型非极性分子和极性分子的显著区别在于它们的化学键类型。
非极性分子通常由非极性化学键组成,而极性分子则包括至少一个极性化学键。
2、电子云分布非极性分子和极性分子的电子云分布也是不同的。
非极性分子原子间的电子云均匀分布,而极性分子原子间的电子云分布不均匀。
3、化学性质由于极性化学键的存在,极性分子在化学方面表现出不同的性质,例如易溶于水、易发生化学反应等。
极性分子和非极性分子1

1. 非极性共价键
共用电子对不偏移
相同元素的原子间 (A-A型) 2. 极性共价键
共用电子对有偏移
不同元素的原子间 (A-B型)
关于极性键、非极性键的判断
练习:指出下列物质中哪些物质含极性 键,哪些物质含非极性键?
CO2、Cl2、HCl、MgCl2、H2O
二、非极性分子和极性分子:
1. 非极性分子——正、负电荷重心重合的分子。
2. 极性分子——正、负电荷重心不重合的分子。 考虑:H2、HCl、 H2O、 CO2 、 NH3 、CH4 的分子的极性。
共价键 分子式 的类型
分子的空 间构型
分子的极性 非极性分子
H2 HCl CO2 H2O NH3 CH4
非极性键 直线型
极性键
极性键 极性键 极Байду номын сангаас键
分子间作用力 分子之间 (范德华力)
分子之间作用力对物质物理性质的影响
分子间力大的物质,其熔沸点也就越高 ——对于组成和结构相似的物质(由分子构成的物质) 来说,随分子量的增大,分子间作用力也增大,物 质的熔沸点随之升高;
练习: 1. 下列物质受热熔化时,不需要破坏化学键 的是(C D ) A.食盐 B.纯碱 C.干冰 D.冰
极性分子的溶质易溶于极性溶剂,非
极性分子的溶质易溶于非极性溶剂中。
如:Cl2、Br2、I2在水中溶解度不大,但在
苯、四氯化碳等非极性溶剂中的溶解度大。
三、分子间作用力(范德华力) ——分子与分子间的作用力。
化学键 与分子间作用力的比较
作用粒子 作用力大小 化学键 相邻原子 大 小 意义
主要影响物质 的化学性质 主要影响物质的物 理性质(熔、沸点)
极性非极性分子判断口诀

极性非极性分子判断口诀
极性分子与非极性分子判断口诀如下:
1、双原子的单质分子都是非极性分子,例如氢气,氧气。
2、双原子的化合物分子都是极性分子,如HCl,一氧化碳等。
3、多原子分子的极性和非极性具体要看其空间构型是否对称,对称的就是非极性分子,不对称的就是极性分子。
4、对于AnBm类的分子,n=1,m>1。
若A化合价等于主族数则为非极性。
5、若已知分子之间的键角,可对分子进行受力分析,合力为零的就是非极性分子。
如:CO2,C2H4等等。
扩展资料:
(1)极性分子:正电荷中心和负电荷中心不相重合的分子
(2)非极性分子:正电荷中心和负电荷中心相重合的分子
(3)分子极性的判断:分子的极性由共价键的极性及分子的空间构型两个方面共同决定
1非极性分子和极性分子的比较
2举例说明:。
极性分子和非极性分子课件

1
溶解性测试
将分子置于极性溶剂中观察其溶解性。
2
化学反应测试
与其他物质进行反应,观察化学反应是否发生。
3
电荷分布测试
使用分子模型分析分子中正负电荷的分布情况。
总结和回顾
极性分子
两个或更多不同元素组成,电荷不均匀分布。
非极性分子
相同元素组成,电荷均匀分布或不存在电荷。
极性分子的性质
1 溶解性
极性分子可以溶解在其他 极性溶剂中,如水。
2 静电作用
极性分子之间的正负电荷 吸引力较强,容易发生静 电强,其沸点通常 较高。
非极性分子的性质
1 溶解性
非极性分子通常不溶解在 极性溶剂中,如水。
2 惰性
非极性分子具有较低的反 应性,不容易与其他物质 发生化学反应。
3 低沸点
由于非极性分子之间的相 互作用力较弱,其沸点通 常较低。
极性分子和非极性分子的例子
极性分子
水分子 (H2O)
非极性分子
氧气分子 (O2)
极性分子和非极性分子的应用
极性分子
被广泛用于溶剂、草药提取和医药领域。
非极性分子
被用于润滑剂、绝缘材料和塑料制品等方面。
如何区分极性分子和非极性分子
极性分子和非极性分子
本课件将介绍分子的极性和非极性,包括其定义、性质、例子和应用。我们 还会分享如何区分极性分子和非极性分子。让我们开始探索这个有趣的话题 吧!
分子的极性和非极性定义
1 极性分子
极性分子是由两个或更多不同元素组成的分子,其中正负电荷在分子内分布不均匀。
2 非极性分子
非极性分子是由相同元素组成的分子,其中正负电荷在分子内分布均匀,或者不存在正 负电荷。
高一化学极性分子和非极性分子
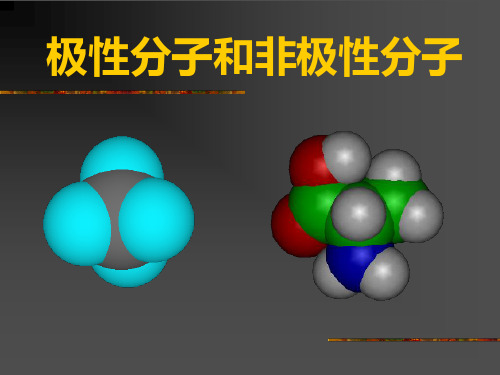
键的极性与分子的极性的区别与联系
概念 键的极性
极性键和非极性键
分子的极性
极性分子和非极性分子
含义
决定因素
是否由同种元素原子形成 极性分子和非极性分子 1. 以非极性键结合的双原子分子必为非极性分子; 2. 以极性键结合的双原子分子一定是极性分子; 3. 以极性键结合的多原子分子,是否是极性分子, 由该分子的空间构型决定。
极性分子和非相同,共用电子对不偏向任何一个原子,因此成键的原子都不显
电性。这样的共价键叫做非极性共价键,简称非极性键。
在化合物分子中,不同种原子形成 的共价键,由于不同原子吸引 电子的能力不同,共用电子对必然偏向吸引电子能力强的原子一
由相同元素的原子形成的共价键是非极性键。如单质分子(Xn,
n>1,如H2、Cl2、O3、P4等)和某些共价化合物(如乙醇、乙烯等)
某些离子化合物(如Na2O2等)含有非极性键。
极性分子:分子中正负电荷中心不重合,从整个分子来看,
电荷的分布是不均匀的,不对称的,这样的分子为极性分子。
非极性分子:分子中正负电荷中心重合,从整个分子来看, 电荷的分布是均匀的,对称的,这样的分子为极性分子。
方,因而吸引电子能力较强的原子一方相对地显负电性,吸引电
子能力较弱的原子一方相对地显正电性。这样的共价键叫做极性 共价键,简称极性键。
极性键
共价键的分类 非极性键
极性键的判断方法
由不同元素的原子形成的共价键一般是极性键,如HCl、CO2 CCl4、SO42-、OH-等都含有极性键。
非极性键的判断方法
极性分子
类型
实例 H2O
结构
键的极性
分子极性
X2Y型
极性键 H2S
极性分子和非极性分子

3、同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了!
简单判断方法
对于AnBm型 n=1 m>1 若A化合价等于主族数 则为非极性
简单判断方法
对于AnBm型 n=1 m>1 若A化合价等于主族数 则为非极性
有机极性判断
有机化合作大多难溶于水,易溶于汽油、苯、酒精等有机溶剂。原因何在?中学课本、大学课本均对此进行了解释。尽管措词不同,但中心内容不外乎是:有机化合物一般是非极性或弱极性的,它们难溶于极性较强的水,易溶于非极性的汽油或弱极性的酒精等有机溶剂。汽油的极性在课本中均未做详细说明,故而在教学中常常做如下解释:所有的烷烃,由于其中的O键的极性极小,以及结构是对称的,所以其分子的偶极矩为零,它是一非极性分子。烷烃易溶于非极性溶剂,如碳氢化合物、四氯化碳等。以烷烃为主要成分的汽油也就不具有极性了。 确切而言,上述说法是不够严格的。 我们知道,分子的极性(永久烷极)是由其中正、负电荷的“重心”是否重合所引起的。根据其分子在空间是否绝对对称来判定极性,化学键极性的向量和——弱极矩μ则是其极性大小的客观标度.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
联系
说明
键有极性,分子不一定有极性。 键有极性,分子不一定有极性。
相似相溶
极性分子易溶于极性溶剂中; 极性分子易溶于极性溶剂中; 非极性分子易溶于非极性溶剂中。 非极性分子易溶于非极性溶剂中。 例如: 例如: 碘(非极性分子)易溶于四氯化碳(非 非极性分子)易溶于四氯化碳( 极性分子),但是在水(极性分子) 极性分子),但是在水(极性分子)中 ),但是在水 溶解度很小。 溶解度很小。
键的极性与分子的极性的区别与联系
概念 含义
极性键和非极性键 极性分子和非极性分子
键的极性
分子的极性
决定因素
是否由同种元素原子形成 极性分子和非极性分子 1. 以非极性键结合的双原子分子必为非极性分子; 以非极性键结合的双原子分子必为非极性分子; 2. 以极性键结合的双原子分子一定是极性分子; 以极性键结合的双原子分子一定是极性分子; 3. 以极性键结合的多原子分子,是否是极性分子, 以极性键结合的多原子分子,是否是极性分子, 由该分子的空间构型决定。 由该分子的空间构型决定。
类型 实例 XY HF
结构
键的极性 分子极性 极性键 极性分子
NO 均为直线型
思考
含有极性键的分子一定是极性分子吗? 含有极性键的分子一定是极性分子吗? 分析方法: 分析方法:从力的角度分析
分子中, 键看作AB原 在ABn分子中,A-B键看作 原 键看作 子间的相互作用力,根据中心原子A 子间的相互作用力,根据中心原子 所受合力是否为零来判断, 所受合力是否为零来判断,F合=0,为 , 非极性分子(极性抵消), 非极性分子(极性抵消), F合≠0, , 为极性分子(极性不抵消) 为极性分子(极性不抵消)
不显电性
H
i i
H
a=b, , 共用电子对无偏向
ab
相对显 正电性 相对显 负电性
ii i i
H
Cl
ii
i i
a> b, > , 共用电子对偏向Cl 共用电子对偏向Cl
ab
思 考
1、键的极性的判断依据是什么? 、键的极性的判断依据是什么? 共用电子对是否有偏向 2、共用电子对不偏向或有偏向是由什 、 么因素引起的呢? 么因素引起的呢 这是由于原子对共用电子对的吸引力不同 这是由于原子对共用电子对的吸引力不同 造成的。 造成的。
H
H
O F合≠0
F2
104º30'
类型 实例
X2Y型 H2O 型
结构
键的极性 分子极性
极性键 极性分子
H2S
均为角形
XY3型 NH3: H
N
107º18' 三角锥型, 不对称, 三角锥型 不对称,键的极 性不能抵消, 性不能抵消,是极性分子 F3 BF3: 平面三角形,对称, 平面三角形,对称, 120º 键的极性互相抵消 ) F2 ( F合=0) ,是非极 F1 F’ 性分子
H
H
C H
CCl4
对称结构, 正四面体型 ,对称结构,C-H键的极性 键的极性 互相抵消( 互相抵消( F合=0) ,是非极性分子 )
H
H 109º28' H
1、常见分子的构型及分子的极性 、
常见分子 双原 子分 子 三原 子分 子 H2、Cl2 、 HCl CO2 H2O 键的极 性 键角 分子构型 分子类型
无 有 有 有 有 有
有
无 无 180º
直线型 直线型 直线型
非极性 极性 非极性 极性 极性
四原 NH3 子分 BF3 子 五原 CH 4 子
104º30' 折线型 107º18' 三角锥型 120º
平面三角形 非极性
109º28 ' 正四面体型 非极性
小结: 小结:
键的极性
决定 分子的空 键角 决定
间结构
分子的 极性
2、判断ABn型分子极性的经验规律: 、判断 型分子极性的经验规律: 若中心原子A的化合价的绝对值等于 若中心原子 的化合价的绝对值等于 该元素原子的最外层电子数 最外层电子数, 该元素原子的最外层电子数,则为非 极性分子,若不等则为极性分子。 极性分子,若不等则为极性分子。 [练习 判断下列分子是极性分子还是 练习] 练习 非极性分子: 非极性分子: PCl3、CCl4、CS2、SO2 非极性分子
只含有非极性键的分子因为共用电 只含有非极性键的分子因为共用电 子对无偏向, 分子是非极性分子 子对无偏向,∴分子是非极性分子
常见分子的构型及其分子的极性 类型 实例 结构 键的极性 分子极性
X2型 H2
非极性键 非极性分子
N2
均为直线型
二、非极性分子和极性分子
非极性分子:分子中正负电荷中心重合, 非极性分子:分子中正负电荷中心重合,从 整个分子来看,电荷的分布是均匀的, 整个分子来看,电荷的分布是均匀的,对称 这样的分子为极性分子。 的,这样的分子为极性分子。
分子的极性又是根据什么来判定呢?
二、非极性分子和极性分子
非极性分子: 非极性分子: 电荷分布均匀对 称的分子
Cl
Cl
Cl
Cl
共用电子对 2个Cl原子吸引电子的能力相同,共用电 个 原子吸引电子的能力相同, 原子吸引电子的能力相同 子对不偏向任何一个原子, 子对不偏向任何一个原子,整个分子的 电荷分布均匀, 电荷分布均匀,∴为非极性分子
一、 非极性键和极性键
非极性键: 非极性键 共用电子对无偏向 电荷分布均匀) (电荷分布均匀)
如:H2(H-H) Cl2(Cl-Cl) N2(N N) 极性键 共用电子对有偏向 电荷分布不均匀) (电荷分布不均匀)
如:HCl(H-Cl) H2O(H-O-H)
[练习 指出下列物质中的共价键类型 练习]指出下列物质中的共价键类型 练习
1、O2 、 2 、CH4 3 、CO2 4、 H2O2 、 5 、Na2O2 6 、NaOH (H-O-O-H) 非极性键 极性键 极性键 极性键 非极性键 非极性键 极性键
根据电荷分布是否均匀, 根据电荷分布是否均匀,共价键 有极性、非极性之分, 有极性、非极性之分,以共价键 结合的分子是否也有极性、 结合的分子是否也有极性、非极 性之分呢? 性之分呢?
本节小结 离子键 化学键 非极性键
组成
离子化合物
组成
非极性分子
共价键 组成 非极性分子 极性键 主要决定 少数多原子分子) (少数多原子分子) 化学性质 极性分子 分子间作用力 主要决定物理性质
F1
F合=0
180º
类型 实例
X2Y型 CO2 型
结构
键的极性 分子极性 极性键 非极性分子
O-H键是极性键,共用电 键是极性键, 键是极性键 子对偏O原子 原子, 子对偏 原子,由于分子 折线型构型,两个O-H 是折线型构型,两个 F1 键的极性不能抵消( 键的极性不能抵消( F合 ≠0),∴整个分子电荷分 ),∴ ), 布不均匀, 布不均匀,是极性分子
O
C
O C=O键是极性键,但 键是极性键, 键是极性键 从分子总体而言CO2 从分子总体而言 直线型分子 分子, 是直线型分子,两个 C=O键是对称排列的, 键是对称排列的, 键是对称排列的 两键的极性互相抵消 ),∴ ), F2 ( F合=0),∴整个 分子没有极性,电荷 分子没有极性, 分布均匀, 分布均匀,是非极性 分子
电荷分布均匀对称的分子
极性分子:分子中正负电荷中心不重合, 极性分子:分子中正负电荷中心不重合,从 整个分子来看,电荷的分布是不均匀的, 整个分子来看,电荷的分布是不均匀的,不 对称的,这样的分子为极性分子。 对称的,这样的分子为极性分子。
电荷分布不均匀不对称的分子
δ+ H Cl H
δCl
共用电子对 共用电子对偏向 原子, HCl分子中,共用电子对偏向Cl原子 分子中, 原子, 分子中 原子一端相对地显负电性, 原子 ∴Cl原子一端相对地显负电性,H原子 原子一端相对地显负电性 一端相对地显正电性, 一端相对地显正电性,整个分子的电荷 分布不均匀,∴为极性分子 分布不均匀, ∴以极性键结合的双原子分子为极性分子
