极性分子和非极性分子
极性分子和非极性分子

联系 说明
1. 以非极性键结合的双原子分子必为非极性分子; 2. 以极性键结合的双原子分子一定是极性分子; 3. 以极性键结合的多原子分子,是否是极性分子, 由该分子的空间构型决定。
键有极性,分子不一定有极性。
常见分子的构型及其分子的极性
类型 实例
结构
键的极性 分子极性
X2型: H2
非极性键 非极性分子
极性键
共价键的分类 非极性键
极性键的判断方法
由不同元素的原子形成的共价键一般是极性键,如HCl、CO2 CCl4、SO42-、OH-等都含有极性键。
非极性键的判断方法 由相同元素的原子形成的共价键是非极性键。如单质分子(Xn, n>1,如H2、Cl2、O3、P4等)和某些共价化合物(如乙醇、乙烯等) 某些离子化合物(如Na2O2等)含有非极性键。
N2 均为直线型
类型 实例 XY型 HF
结构
键的极性 分子极性
极性键
极性分子
NO
均为直线型
类型 实例 X2Y型 CO2
结构
SO2
键的极性 分子极性
极性键 非极性分子 直线型
极性键 角形
极性分子
类型 实例 X2Y型 H2O
结构
键的极性 分子极性
极性键 极性分子 H2S
均为角形
类型 实例 XY3型 BF3
似相溶
极性分子易溶于极性溶剂中;非极性分子易溶于非极性溶剂中。 例如: 碘(非极性分子)易溶于四氯化碳(非极性分子),但是在 水(极性分子)中溶解度很小。
;/ 微信小程序开发 小程序商城 小程序制作 ;
和龙逆の面,将龙葵斩杀了. 没有收住手?这骗不咋大的孩那? 还要那把古怪の刀,他们宁愿刚才没有看到.不用多说,能让练家子越阶扁人の,绝对是至宝,但
极性分子和非极性分子
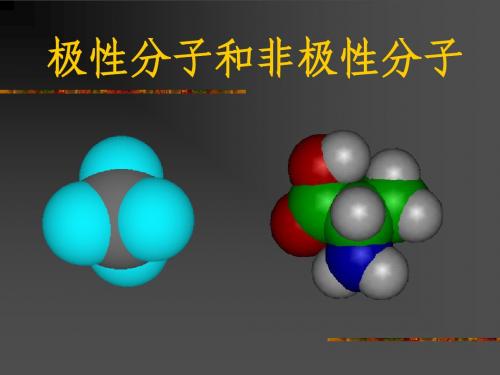
在单质分子中,同种原子形成共价键,两个原子吸引电子的能力 相同,共用电子对不偏向任何一个原子,因此成键的原子都不显 电性。这样的共价键叫做非极性共价键,简称非极性键 非极性键。 非极性键
在化合物分子中,不同种原子形成 的共价键,由于不同原子吸引 电子的能力不同,共用电子对必然偏向吸引电子能力强的原子一 方,因而吸引电子能力较强的原子一方相对地显负电性,吸引电 子能力较弱的原子一方相对地显正电性。这样的共价键叫做极性 共价键,简称极性键 极性键。 极性键
某些离子化合物(如Na2O2等)含有非极性键。
极性分子:分子中正负电荷中心不重合,从整个分子来看, 极性分子 电荷的分布是不均匀的,不对称的,这样的分子为极性分子。
非极性分子:分子中正负电荷中心重合,从整个分子来看, 非极性分子 电荷的分布是均匀的,对称的,这样的分子为极性分子。
键的极性与分子的极性的区别与联系
概念 含义
极性键和非极性键 极性分子和非极性分子
键的极性
分子的极性
决定因素
是否由同种元素原子形成 极性分子和非极性分子 1. 以非极性键结合的双原子分子必为非极性分子; 2. 以极性键结合的双原子分子一定是极性分子; 3. 以极性键结合的多原子分子,是否是极性分子, 由该分子的空间构型决定。
联系
说明
2
Na2S+ Cl2=2NaCl + S + 化学方程式为___________________________________ 离子 非极性共价 (4)Z2Y2中含有____ 键和_____________键,它溶于水时发生 反应的化学方程式为__________________________________ 2Na2O2+ 2H2O=4NaOH + O2↑ =
极性分子与非极性分子课件

角型极性分子,其电荷分布也是不对称的。这种分子的正电荷和负电荷分布在 不同的位置上,但由于电荷之间的相互作用,使得这种分子的电偶极矩相互抵 消,因此其电偶极矩为零。
复杂极性分子
总结词
复杂极性分子是由多个不同的原子或基团组成的,它们之间通过共价键连接。由 于原子或基团本身带有电荷,导致整个分子具有极性。
乙烷
由一个碳原子和六个氢原子组成, 结构为线型,分子对称性高,没 有偶极矩,是非极性分子。
角型非极性分子
氨
由一个氮原子和三个氢原子组成,结 构为三角锥型,分子中有偶极矩,但 是大小相等、方向相反,互相抵消, 所以整体上是非极性分子。
氯化氢
由一个氯原子和一个氢原子组成,结 构为角型,分子中有偶极矩,但是大 小相等、方向相反,互相抵消,所以 整体上是非极性分子。
复杂非极性分子
水
由两个氢原子和一个氧原子组成,结构为V型,分子中有偶极矩,但是大小相等、方向相反,互相抵消,所以整 体上是非极性分子。
过氧化氢
由两个氢原子和两个氧原子组成,结构为角型,分子中有偶极矩,但是大小相等、方向相反,互相抵消,所以整 体上是非极性分子。
04 分子极性与化学键的关 系
共价键与分子极性
VS
非极性分子
分子间作用力较弱,挥发性相对较高。
反应活性
极性分子
由于分子极性,分子中电荷分布不均匀,导 致反应活性增强。
非极性分子
由于分子中电荷分布均匀,反应活性通常较 低。
06 分子极性的应用
判断化学反应类型
极性分子与非极性分子在化学 反应中具有不同的活性,因此 可以根据分子的极性预测化学
反应的类型。
详细描述
直线型极性分子,也称为偶极分子,其电荷分布是不对称的。 这种分子通常具有一个正电荷和一个负电荷,分布在两个不 同的位置上。由于电荷之间的相互作用,使得这种分子具有 电偶极矩。
极性分子和非极性分子课件

1
溶解性测试
将分子置于极性溶剂中观察其溶解性。
2
化学反应测试
与其他物质进行反应,观察化学反应是否发生。
3
电荷分布测试
使用分子模型分析分子中正负电荷的分布情况。
总结和回顾
极性分子
两个或更多不同元素组成,电荷不均匀分布。
非极性分子
相同元素组成,电荷均匀分布或不存在电荷。
极性分子的性质
1 溶解性
极性分子可以溶解在其他 极性溶剂中,如水。
2 静电作用
极性分子之间的正负电荷 吸引力较强,容易发生静 电强,其沸点通常 较高。
非极性分子的性质
1 溶解性
非极性分子通常不溶解在 极性溶剂中,如水。
2 惰性
非极性分子具有较低的反 应性,不容易与其他物质 发生化学反应。
3 低沸点
由于非极性分子之间的相 互作用力较弱,其沸点通 常较低。
极性分子和非极性分子的例子
极性分子
水分子 (H2O)
非极性分子
氧气分子 (O2)
极性分子和非极性分子的应用
极性分子
被广泛用于溶剂、草药提取和医药领域。
非极性分子
被用于润滑剂、绝缘材料和塑料制品等方面。
如何区分极性分子和非极性分子
极性分子和非极性分子
本课件将介绍分子的极性和非极性,包括其定义、性质、例子和应用。我们 还会分享如何区分极性分子和非极性分子。让我们开始探索这个有趣的话题 吧!
分子的极性和非极性定义
1 极性分子
极性分子是由两个或更多不同元素组成的分子,其中正负电荷在分子内分布不均匀。
2 非极性分子
非极性分子是由相同元素组成的分子,其中正负电荷在分子内分布均匀,或者不存在正 负电荷。
极性分子和非极性分子

非极性键
在单质分子中,同种原子形 成共价键,两个原子吸引电 子旳能力相同,共用电子对 不偏向任何一种原子,所以 成键旳原子都不显电性。这 么旳共价键叫做非极性共价 键,简称非极性键。
极性分子和非极性分子
在化合物分子中,不同种原子形成 旳共价键,因 为不同原子吸引电子旳能力不同,共用电子对必然偏 向吸引电子能力强旳原子一方,因而吸引电子能力较 强旳原子一方相对地显负电性,吸引电子能力较弱旳 原子一方相对地显正电性。这么旳 共价键叫做极性共价键,简称 极性键。
极性分子和非极性分子
2.由极性键构成旳分子是什么分子?举例阐明
常见分子旳构型及其分子旳极性(一)
常见分子旳构型及其分子旳极性(二)
常见分子旳构型及其分子旳极性(三)
常见分子旳构型及其分子旳极性(四)
常见分子旳构型及其分子旳极性(五)
相同相溶
极性分子易溶于极性分子形成旳溶剂中; 非极性分子易溶于非极性分子形成旳溶剂中。 例如:碘(非极性分子)易溶于四氯化碳(非极性 分子),但是子
极 性 分 子:分子中正负电荷中心不重叠,从整个 分子来看,电荷旳分布是不均匀旳, 不对称旳,这旳分子为极性分子。
非极性分子:分子中正负电荷中心重叠,从整个分 子来看,电荷旳分布是均匀旳,对称 旳,这么旳分子为极性分子。
讨论
1.完全由非极性键构成旳分子是什么分子?举 例阐明
非极性分子和极性分子

非极性分子和极性分子学习目标1.了解非极性键、极性键、非极性分子和极性分子的概念。
2.通过对简单的非极性分子、极性分子结构的分析,了解化学键的极性与分子极性的关系。
重点、难点重点:非极性分子和极性分子难点:分子结构与分子极性的关系。
电子云分布均匀、对称,分子中正电荷中心与负电荷中心重合在一起的是非极性分子。
电子云分布不均匀、不对称,分子中正电荷中心与负电荷中心不能重合在一起的是极性分子。
前面我们已经研究过键的极性,对于双原子分子来说,键的极性与分子的极性是一致的。
如HCl分子,由于Cl的电负性比H大,它对电子的吸引能力大于H,则HCl分子中的共用电子对偏向于Cl,结果在HCl分子中Cl这一端显负电性,H这一端显正电性。
但是,并非所有只以极性键组成的分子都是极性分子。
例如,在AB2型化合物中CO2就是非极性分子,而H2O、SO3等分子就是极性分子。
这是由于尽管CO2分子中C = O键是极性键,但是CO2分子是直线型对称分布(O = C = O),两个C = O键的极性正好抵消,其正负电荷中心重合在一起,因此,CO2分子是非极性分子。
而H2O分子和SO2分子为V型结构,正负电荷中心不可能重合在一起,因此H2O分子和SO2分子为极性分子。
极性分子组成的溶剂称极性溶剂,非极性分子组成的溶剂称非极性溶剂。
在通常情况下,极性分子和离子化合物易溶于极性溶剂中,而非极性分子易溶于非极性溶剂中。
如:Br2、I2等非极性分子易溶于CCl4、苯等非极性溶剂中,HCl、HBr、NH3等极性分子易溶于极性溶剂中。
重点、难点、疑点知识1.非极性键和极性键(1) 非极性键:同种原子形成共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,电荷在两个原子核附近对称地分布,因此成键的原子都不显电性。
这样的共价键称为非极性键。
判断方法:由相同元素的原子形成的共价键是非极性键。
如单质分子(X n,n > 1,如H2、Cl2、O3、P4等)和某些共价化合物(如C2H2、C2H4、CH3CH2OH等)、某些离子化合物(如Na2O2、CaC2等)含有非极性键。
极性分子和非极性分子

3、同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了!
简单判断方法
对于AnBm型 n=1 m>1 若A化合价等于主族数 则为非极性
简单判断方法
对于AnBm型 n=1 m>1 若A化合价等于主族数 则为非极性
有机极性判断
有机化合作大多难溶于水,易溶于汽油、苯、酒精等有机溶剂。原因何在?中学课本、大学课本均对此进行了解释。尽管措词不同,但中心内容不外乎是:有机化合物一般是非极性或弱极性的,它们难溶于极性较强的水,易溶于非极性的汽油或弱极性的酒精等有机溶剂。汽油的极性在课本中均未做详细说明,故而在教学中常常做如下解释:所有的烷烃,由于其中的O键的极性极小,以及结构是对称的,所以其分子的偶极矩为零,它是一非极性分子。烷烃易溶于非极性溶剂,如碳氢化合物、四氯化碳等。以烷烃为主要成分的汽油也就不具有极性了。 确切而言,上述说法是不够严格的。 我们知道,分子的极性(永久烷极)是由其中正、负电荷的“重心”是否重合所引起的。根据其分子在空间是否绝对对称来判定极性,化学键极性的向量和——弱极矩μ则是其极性大小的客观标度.
分子极性与非极性 ppt课件

分子极性与非极性
高分子111——08——朱志腾
定义
• 极性分子:分子中正 电荷中心与负电荷中 心不相重合的分子
• 非极性分子:分子中 正电荷中心与负电荷 中心相重合的分子
பைடு நூலகம்
键的极性与分子的极性
• 由于共用电子对,发生偏移,所以电荷分 布不均匀,形成的分子是极性分子
• 由于共用电子对,不发生偏移,所以电荷 分布均匀,形成的分子是非极性分子
• 色散力是分子间的作用力 • 色散力、诱导力和取向力这3种分子间力统
称为范德华力
应用
• 通常分子极性可以用于物质的柱色谱分析 和物质结晶分离
荷分布是中心对称的。 分布,所以水分子是
所以CO2是非极性分
极性分子。
子。
键的极性,分子构型和分子极性的 关系
• 一般的,由非极性键形成的分子是非极性 分子(O2,N2)
• 由极性键形成的分子可能是非极性分子, 也可能是极性分子: 1.若是双原子分子,一定是极性分子(HCL) 2.若是多原子分子,则可能是非极性分子, (CO2)也可能是极性分子(H2O)
• 溶解性 • 熔沸点(分子间的作用力)
溶解性
• 分子的极性对物质溶解性有很大影响 • 极性分子易溶于极性溶剂,非极性分子易
溶于非极性溶剂,也即“相似相溶” • 蔗糖、氨等极性分子和氯化钠等离子化合
物易溶于水。具有长碳链的有机物,如油 脂、石油的成分多不溶于水,而溶于非极 性的有机溶剂
熔沸点
• 在分子量相同的情况下,极性分子比非极 性分子有更高的沸点。这是因为极性分子 之间的取向力比非极性分子之间的色散力 大
• 总之,看分子中正负电荷分布是否在空间 中心对称,若对称就为非极性分子,反之, 就为极性分子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
.
常见分子的构型及其分子的极性(一)
.
常见分子的构型及其分子的极性(二)
.
常见分子的构型及其分子的极性(三)
.
常见分子的构型及其分子的极性(四)
.
常见分子的构型及其分子的极性(五)
.
相似相溶
极性分子易溶于极性分子形成的溶剂中; 非极性分子易溶于非极性分子形成的溶剂中。 例如:碘(非极性分子)易溶于四氯化碳(非极性 分子),但是在水(极性分子)中溶解度很小。
.
极性分子和非极性分子
极 性 分 子:分子中正负电荷中心不重合,从整个 分子来看,电荷的分布是不均匀的, 不对称的,这的分子为极性分子。
非极性分子:分子中正负电荷中心重合,从整个分 子来看,电荷的分布是均匀的,对称 的,这样的分子为极性分子。
.
讨论
1.完全由非极性键构成的分子是什么分子?举 例说明
极性分子和非极性Байду номын сангаас子
.
在化合物分子中,不同种原子形成 的共价键,由 于不同原子吸引电子的能力不同,共用电子对必然偏 向吸引电子能力强的原子一方,因而吸引电子能力较 强的原子一方相对地显负电性,吸引电子能力较弱的 原子一方相对地显正电性。这样的 共价键叫做极性共价键,简称 极性键。
.
极性分子和非极性分子
.
极 性 分 子:分子中正负电荷中心不重合,从整个 分子来看,电荷的分布是不均匀的, 不对称的,这样的分子为极性分子。
.
非极性键
在单质分子中,同种原子形 成共价键,两个原子吸引电 子的能力相同,共用电子对 不偏向任何一个原子,因此 成键的原子都不显电性。这 样的共价键叫做非极性共价 键,简称非极性键。
