美国环保局 EPA 试验 方法 3541
美国EPA 关于空气自动监测系统性能指标的规定和测试方法
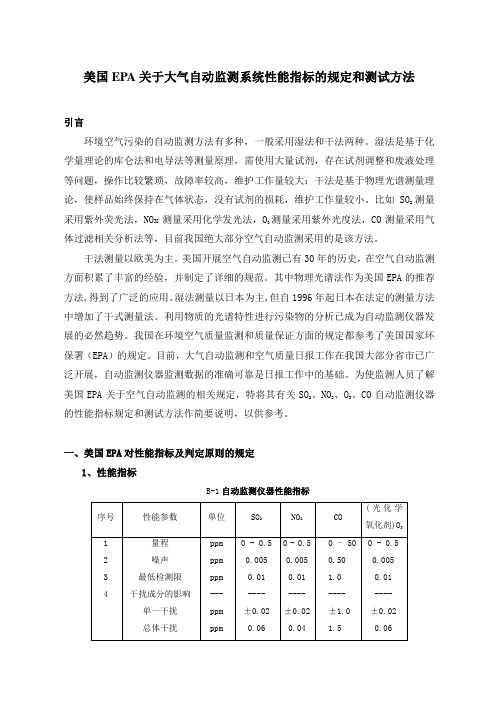
美国EPA关于大气自动监测系统性能指标的规定和测试方法引言环境空气污染的自动监测方法有多种,一般采用湿法和干法两种。
湿法是基于化学量理论的库仑法和电导法等测量原理,需使用大量试剂,存在试剂调整和废液处理等问题,操作比较繁琐,故障率较高,维护工作量较大;干法是基于物理光谱测量理论,使样品始终保持在气体状态,没有试剂的损耗,维护工作量较小。
比如SO2测量采用紫外荧光法,NOx测量采用化学发光法,O3测量采用紫外光度法,CO测量采用气体过滤相关分析法等,目前我国绝大部分空气自动监测采用的是该方法。
干法测量以欧美为主。
美国开展空气自动监测已有30年的历史,在空气自动监测方面积累了丰富的经验,并制定了详细的规范。
其中物理光谱法作为美国EPA的推荐方法,得到了广泛的应用。
湿法测量以日本为主,但自1996年起日本在法定的测量方法中增加了干式测量法。
利用物质的光谱特性进行污染物的分析已成为自动监测仪器发展的必然趋势。
我国在环境空气质量监测和质量保证方面的规定都参考了美国国家环保署(EPA)的规定。
目前,大气自动监测和空气质量日报工作在我国大部分省市已广泛开展,自动监测仪器监测数据的准确可靠是日报工作中的基础。
为使监测人员了解美国EPA关于空气自动监测的相关规定,特将其有关SO2、NO2、O3、CO自动监测仪器的性能指标规定和测试方法作简要说明,以供参考。
一、美国EPA对性能指标及判定原则的规定1、性能指标B-1自动监测仪器性能指标M/0.02447,M是该气体的摩尔质量。
2、判定原则对于每个性能指标(量程除外),测试程序从开始起要重复7次,得到7组测试结果。
每组结果要和表B-1中的规定指标相比较,高于或超出规定指标的值是一个超标值。
每个参数的7个结果说明如下:(1)0次超标:被测的参数合格;(2)3次或更多次超标:该参数不合格;(3)1次或2次超标:再重复测试该参数 8次,得到共15个测试结果。
将此15个测试结果说明如下:a:1次或2次超标:通过测试;b:3次以上:该参数不合格。
epa测试标准

epa测试标准
EPA(美国环保局)的测试标准是针对各种污染物和产品制定的,旨在确保产品符合相关法规和标准,以保护环境和人类健康。
以下是一些EPA的测试标准:
污染物排放限制:EPA制定了一系列污染物排放限制,要求企业、工厂和机构遵守。
这些限制涵盖了空气、水和土壤中的污染物,如二氧化硫、氮氧化物、挥发性有机化合物等。
消费品安全标准:EPA负责制定和执行消费品安全标准,以确保消费品不会对人类健康造成危害。
这些标准涵盖了家电、家具、儿童用品、玩具、化妆品等产品。
农药注册与评价:EPA负责评价农药的安全性和有效性,以确保农药的使用不会对人类健康和环境造成危害。
化学物质管理:EPA负责管理和限制化学物质的生产和使用,以确保这些物质不会对环境和人类健康造成危害。
环保设备与系统性能测试:EPA还制定了各种环保设备与系统性能测试标准,以确保这些设备能够有效地降低污染物的排放。
以上是一些EPA的测试标准,具体标准可能因产品、污染物和法规而有所不同。
在进行相关测试时,建议咨询专业的环保机构或实验室,以确保测试结果的准确性和可靠性。
EPA3540

方法3540C索氏萃取如有问题请mail至:piery2006@1.0范围及应用1.1方法3540是从土壤、淤泥和废弃物等固体中萃取不挥发性或半挥发性的有机化合物程序.索氏萃取过程确保样品基体同萃取溶剂能紧密地结合.1.2本方法适用于能溶于水和微溶于水的有机物质分离和浓缩,是多种色谱程序前置处理方法.1.3本方法仅限于受过训练的分析者,或在有受过训练的分析者的监控下进行,每个分析者必须展示其利用此方法获得可接受的结果的能力.2.0方法概述2.1将固体样品同无水硫酸钠混合,放置于抽取套管中或玻璃纤维的两栓之间,在索氏提取器内利用合适的溶剂萃取.2.2萃取物然后经干燥、浓缩(如有必要),并根据需要,被交换进入一种能和所使用的提纯或测试步骤相容的溶剂中.3.0干扰参考方法3500.4.0仪器及材料4.1索氏提取器-内径为40mm,有500mL的圆底烧瓶.4.2干燥柱-内径为20mm的派莱克斯色谱柱,底部有派莱克斯玻璃纤维.备注:在严重污染的萃取物经过后,多孔的玻璃圆盘很难去除污染.可以购买到无孔的柱.使用一小垫的玻璃纤维来放置吸收剂.在将色谱柱装上吸收剂之前,先用50mL丙酮接着用50mL的洗脱溶剂清洗玻璃纤维垫.4.3 K-D浓缩装置4.3.1浓缩管-10mL,有刻度(Kontes K-570050-1025型或同级品).有圆形玻璃塞,防止萃取物的挥发.4.3.2蒸馏烧瓶-500mL(Kontes K-570001-500型或同级品).用弹簧,夹子或其物体将它与浓缩管连接。
4.3.3斯奈德柱-三大球式(Kontes K-503000-0121型或同级品).4.3.4斯奈德柱-两小球型(Kontes K-569001-0219型或同级品).4.3.5弹簧-1/2英寸(Kontes K-662750型或同级品).备注:以下玻璃器皿推荐在需要使用K-D蒸发浓缩器的浓缩程序中使用,用来回收溶剂.各州或当地政府管理挥发性有机物气体排放的法令中可能需要包括这些仪器.环境保护署推荐采用此类型的回收系统来执行排放减量项目.溶剂回收是遵守废弃物减量和防止污染的一项措施.4.4溶剂蒸汽回收系统-(Kontes K-545000-1006或K-547300-0000型,A级玻璃6614-30或同级品).4.5沸腾片-溶剂萃取时用,约10/40筛网(材质为碳化硅或同级品).4.8恒温水槽-加热用,有同心环盖,能够控制温度(±5℃),水槽应该在通风橱内使用.4.7小瓶-容量为2mL,具有聚四氟乙烯(PTFE)线型螺纹盖或小瓶顶端为卷曲的.4.8玻璃或纸质套管或玻璃纤维-没有被污染.4.9加热套-流变式控制.4.10一次性玻璃的巴氏吸管和烧瓶.4.11测试干重百分率的仪器.4.11.1干燥炉-能够维持温度105℃.4.11.2干燥器.4.11.3坩锅-瓷坩锅或一次性的铝坩锅.4.12研磨设备. 4.13分析天平-能够精确至0.0001g.5.0试剂5.1所有测试用到的无机化学药品均为试剂等级.除非有特别说明,所有的无机试剂必须符合美国化学协会分析试剂委员会的说明书.如果其它等级的化学试剂探明的纯度足够高,使用时不会降低测试的准确度,则也可以使用.5.2不含有机物的试剂水.本方法中提到的水都是不含有机物的试剂水,见本手册第一章的定义.5.3硫酸钠(颗粒状,无水)Na 2SO 4.放在浅盘中在400℃下加热4小时提纯,或是用二氯甲烷预先清洗硫酸钠.如果预先用二氯甲烷清洗硫酸钠,必须分析一个方法空白溶液,证明硫酸钠中不存在干扰.5.4萃取溶剂-所有的溶剂都是农药等级或是同等级的试剂.5.4.1泥土/沉积物和含水的淤泥样品应使用下列溶剂组合中任何一种萃取.5.4.1.1丙酮/已烷(1:1的体积比),CH 3COCH 3/C 6H 14.备注:这种溶剂组便具有较低的处理成本和较低的毒性.5.4.1.2二氯甲烷/丙酮(1:1的体积比),CH 2Cl 2/ CH 3COCH 3.5.4.2其它的样品应使用以下的溶剂萃取:5.4.2.1二氯甲烷, CH 2Cl 2.5.4.2.2甲苯/甲醇(10:1的体积比),C 6H 5CH 3/CH 3OH.5.5交换溶剂-所有的溶剂都是农药等级或是同级品.5.5.1已烷, C 6H 14.5.5.2 2-丙醇,(CH 3)2CHOH.5.5.3环已酮,C 6H 12.5.5.4氰甲烷,CH 3CN.6.0样品的收集,储存和处理见《有机分析物》第4.1节的介绍说明.7.0程序7.1样品的处理7.1.1沉积物/泥土样品-倒去沉积物样品上的水层,将样品充分混合均匀,特别是复杂样品.将一些异物如树枝,树叶和石头去除.7.1.2废弃物样品-在萃取之前,由多相组成的样品必须由第二章的相分离方法进行制备.本萃取程序仅适用于固体.7.1.3将废弃物样品干燥有助于研磨-研磨或者将废弃物再细分,让它能通过1mm的筛网或是能从1mm的小孔挤出.向研磨机中加入足够多的样品,在研磨后能产生至少10g样品.7.1.4胶质,纤维状或油状的材料不适用于研磨的样品应将它切碎,撕碎,或是其它的将样品颗粒最小化,便于混合和使样品的表面最大利于萃取.将样品中加入无水硫酸钠(1:1)有利于样品的研磨.7.2测试干重的百分率-当样品以干重为基础计算结果时,在称量一份用作分析测试样品的同时应称量一份样品用于计算干重的百分率.警告:干燥炉应放在橱中或通风条件下进行.当干燥严重受污染的样品时,可能会对实验室产生严重的污染.在称量要萃取的样品之后,接着称5-10g样品放入空的坩锅中.将此份试样在105℃烘烤过夜.在称量之前,使试样在干燥器中冷却.计算干重百分率的公式如下:干重%=干重(g)/样品重(g)×100这种干燥炉中的样品不适用于萃取.一旦干重测量好后,应适当地处理掉.7.3将10g固体样品与10g无水硫酸钠混合好之后,放入抽取套管中.在萃取期间,抽取套管能够自由地排放溶剂.另外,在索氏抽取器中,样品的上方下方各放一块玻璃纤维栓来代替套管也是可以接受的.7.3.1向样品上加1.0mL代用标准掺料溶液(代用标准物质及基体掺料溶液详见方法3500).7.3.2向每个分析批次选择作为掺料的样品中加入1.0mL基体掺料标准溶液.7.3.3选择合适的基体掺料化合物及其浓度请参照《方法3500》的5.5和8.3节.7.4将大约300mL的萃取溶剂(5.4节)加入到一个500mL的圆底烧瓶中, 烧瓶中放有一两块的沸腾片.将烧瓶装到提取器上, 萃取样品16-24小时,每小时萃取4-6个循环.7.5萃取完成后,让萃取物冷却.7.6组装好一个K-D浓缩器(节4.3),如有必要,将1个10mL的浓缩管接到500mL 的蒸馏烧瓶上.7.7遵照仪器生产商的指导,将溶剂蒸汽回收玻璃器皿(浓缩和收集装置)( 4.4节)与K-D仪器的斯奈德柱连接.7.8将萃取物通过含有大约10mm无水硫酸钠的干燥柱,将收集到的干燥后的萃取物加入至K-D浓缩器中,使用100到125mL的萃取溶剂清洗萃取烧瓶及硫酸钠柱,以完成量的转移.7.9向烧瓶加入一两块干净的沸腾片,接上一个三球的斯奈德柱.往斯奈德柱的顶端加大约1mL二氯甲烷预先使柱湿润,将K-D装置放入热的恒温水槽中(温度高于溶剂的沸点15-20℃),浓缩管部分地浸入热水中,烧瓶的整个圆形底部则完全浸入在热的蒸汽中.按照需要,调节仪器在竖直方向上的位置和水的温度,在10-20分钟内完成浓缩.在适当的蒸馏速度下,斯奈德柱的球形部分会快速振动作响,但是腔内却没有大量的液体流动.当液体的体积明显达到1-2mL时,将K-D装置从水浴中取出来,让液体冷却回流至少10分钟.7.10如果需要交换溶剂 (如表1),则快速移开斯奈德柱,加入大约50mL交换溶剂和一块新的沸腾片,重新接上斯奈德柱.依7.9所述,将萃取物浓缩,如果有必要,需提高水浴的温度来维持合适的蒸馏,当液体的体积再次达到1-2mL时,将K-D装置从水浴中取出,让液体冷却回流至少10分钟.7.11移开斯奈德柱,用1-2mL的二氯甲烷或交换溶剂冲洗烧瓶及其底部与浓缩器的接口,洗液冲入浓缩管中.如果有硫的晶体析出造成困扰,继续使用方法3660净化.萃取的物质可进一步使用第7.12节所述的技术浓缩或使用最后一次使用的溶剂调节体积至10.0mL.7.12如果依照表1需进一步浓缩,使用微斯奈德柱技术(节7.12.1)或氮气排放技术(节7.12.2)调节萃取物至最终需要的体积.7.12.1微斯奈德柱技术7.12.1.1加入一至两块干净的沸腾片至浓缩管中,然后接上一个两球的微斯奈德柱.往柱的顶部加入大约0.5mL二氯甲烷预先使斯奈德柱湿润.将K-D装置放入热的水浴槽中,使浓缩管部分地浸入热水中. 根据需要,调节仪器在竖直方向上的位置和水的温度,在5-10分钟内完成浓缩. 在适当的蒸馏速度下,斯奈德柱的球形部分会快速振动作响,但是腔内却无大量的液体流动。
美国EPA最新参考方法标准

特别规定的样品采集过滤器。
手动参考方法: 配备 RAAS-10 PM10 进气口或
RFPS-0699-131 40 联邦法规(CFR)第 50 部分,
附录 L, 图 L-2 到 L-19 中特定的
联邦公告:卷 64, 有通气孔的进口,作为 PM10
第 33481 页 , 参考方法配置,流量为 16.67 升
图 L-2 参考方法
第 33481 页 , 配置,流量为 16.67 升/分钟,24
BGI 公司 BGI 公司 DKK-TOA 公司 Ecotech 公司
PQ100 型空气采样器
PQ200 型空气采样器
FPM-222/222C,FPM223 /223C 及 DUB-222(S)型 PM10 监测器 3000 型 PM10 大容量空 气采样器
或
12/01/87 及卷 53, GMW-IP-10-8000 中的任一型号
第 1062 页 , 大容量采样器,这些采样器含有
01/15/88
以下部件:带有丙烯腈-丁二烯-
苯乙烯塑胶过滤器托架和电机/
鼓风机外壳或不锈钢过滤器托
架和酚醛塑料电机/鼓风机外壳
的阳极氧化处理铝制大容量外
壳;0.6 大功率电机/鼓风机; 压
06/23/99
小时连续采样周期操作。符合
RAAS105-300 操作说明书,遵
循 40 CFR 第 50 部分,附录 J
或附录 M 中有关要求和特别规
定的样品采集过滤器。
手动参考方法: 配备 BGI16.7 进气口装置或附
RFPS-0699-132 录 L,40 联邦法规(CFR)50,
图 L-2 到 L-19 中特定的有通气
7.0 说明书,适当的还带有特制
epa评估方法

epa评估方法EPA评估方法EPA(美国环境保护署)评估方法是一种用于评估环境影响和风险的科学方法。
它在环境保护领域得到广泛应用,用于评估化学品、污染物、废物和其他环境因素对人类健康和生态系统的潜在影响。
本文将介绍EPA评估方法的基本原理和应用。
一、EPA评估方法的基本原理EPA评估方法基于科学研究和风险评估的原则,通过收集、整理和分析大量的环境和健康数据,评估特定环境因素对人类和生态系统的潜在影响。
其基本原理包括以下几个方面:1. 数据收集和整理:EPA评估方法首先需要收集相关的环境数据和健康数据,包括化学物质的物理化学性质、毒性数据、环境浓度和暴露途径等。
同时,还需要收集人类健康效应和生态效应的相关数据。
2. 风险评估模型:EPA评估方法使用风险评估模型来分析环境因素对人类和生态系统的潜在影响。
这些模型基于流行病学、毒理学和环境科学等学科的知识,通过定量分析和预测来评估风险水平。
3. 不确定性分析:EPA评估方法还包括不确定性分析,用于评估评估结果的可靠性和确定性。
不确定性分析可以通过敏感性分析、模拟和统计方法等来进行。
二、EPA评估方法的应用EPA评估方法广泛应用于环境监测、风险评估和决策支持等领域。
其主要应用包括以下几个方面:1. 环境污染评估:EPA评估方法可以用于评估污染物对环境的潜在影响。
通过收集环境数据和污染物的毒性数据,结合风险评估模型,可以评估污染物的暴露水平和潜在风险。
2. 化学品评估:EPA评估方法可以用于评估化学品对人类健康和环境的潜在影响。
通过收集化学品的物理化学性质、毒性数据和暴露途径等信息,结合风险评估模型,可以评估化学品的致癌、致畸和致突变等潜在风险。
3. 废物管理评估:EPA评估方法可以用于评估废物对环境和人类健康的潜在影响。
通过收集废物的组成、毒性数据和处理方式等信息,结合风险评估模型,可以评估废物的处理风险和环境影响。
4. 环境政策制定:EPA评估方法可以用于支持环境政策的制定和实施。
EPA3540C中文版

方法3540(3)1.0应用范围1.13540是•个从土壤,淤泥以及废弃物中萃取挥发性和半挥发性物质的过程,索氏萃取过程保证了样品与萃取试剂充分接触1.2这个方法应用在-些溶于水或微溶于水的有机物质分离和浓缩过程中.13这种方法使用所得结果可靠性的能力,必须要经过论证.2.0方法概述2」固体样品与无水硫酸钠混合后放置在萃取管或是玻璃纤维的两个塞/之间,并且加入适当的溶剂进行萃取.2.2萃取是•个利用匹配溶剂对测试成分进行•提取然后的过程,必要时要进行•浓缩.3.0干扰参考方法35004.0设备及材料4」索氏萃取装置:直径40毫米,体积为500ml的圆底烧瓶4.2干燥柱:由宜径为20毫米的耐热玻璃层析柱和底部的耐热玻璃纤维组成注意:萃取时被污染的层析柱很难再次净化,现在市场上可以买到非玻璃层析柱,它是用•小块耐热玻璃棉垫来保存吸附剂,玻璃棉垫用润洗后再用50ml丙酗洗涤剂淸洗柱了和吸附剂.4.3 K-D装置4.3.1浓缩管10mh是从Konies K-57OO5O-IO25或同等设备改进而来.平而玻璃塞f用来防止萊取蒸干.4.3.2蒸僻瓶:500ml,连接有浓缩管,弹赘以及夹(与之类似设备.4.3.3斯耐徳柱带有三个微球4.3.4斯耐德柱带有两个微球4.3.5弹簧1/2英寸注总:在溶剂浓缩回收装置中,推荐使用K-D玻璃器件,组装这些部件并要满足当地政府所妥求的挥发性物质扌II:放标准的和关规定,美国环保署建议组装这些设备应与方法结合起来,从而达到降低押:放的目的•溶剂回收相当于废弃物最小限度排放以及污染控制.4.4溶剂回收系统(K-545000-1006 or K-547300-0000,优级玻璃6614-30.或等同物)4.5沸石溶剂萃取,可通过10/40网孔(碳化硅或等同物)4.6热水浴装置带有同心圆形盖,温度控制能力在±5'C,整个装置需要安装•外罩中.4.7小玻璃瓶2ml,带有聚四氟乙烯螺口上盖.4.8玻璃.纸质套管或玻璃棉无污染4.9加热套可变电阻控制4.10巴氏徳球形瓶,巴氏德管4.11干燥设备4.11.1烘箱温度保持在105°C4.11.2干燥器4.11.3堆圳陶瓷或铝材质4.12碾磨装置4.13分析天平精度0.000lg5.0试剂5.1所有的无机试剂级别都要经过验证,除非有美国化学联合会的简要说明书,其它级别的试剂也可能会用到,首先要确定这些试剂的纯度使之不会降低检测的准确度.5.2无机试剂水方法中所有的试剂参考第-章中无机试剂水的定义.5.3硫酸钠无水,粉末状,将其铺成•薄层,在4009加热净化4小时,或是用二氯甲烷进行清洗.经过二氯甲烷清洗过硫酸钠需要进行空白分析.以证明硫酸钠中不含有任何干扰.5.4萃取溶剂所有溶剂都必须匹配或是和类似.5.4.1土壤/沉积物以及淤泥都可以使用下列溶剂进行萃取:541」丙酮/己烷(l:l)(v/v) CH3COCH3/C6H14注意:这种萃取低毒低成本5.4.1.2 二氯甲烷炳酮(1:1 v/v) CH2C12/CH3COCH35.4.2其它样品可用下列溶剂萃取5.4.2.1二氯甲烷CH2C125.4.2.2甲苯/ 甲醇(10:l)(v/v) C6H5CH3/CH3OH5.5.1 己烷Hexane C6H145.5.2 2-丙醇(CH3)2CHOH5.5.3 环己烷C6H125.5.4 乙報CH3CN5.5替代溶剂所有的溶剂都应匹配或相类似6.0样品采集,保存,抽样.在这个章节主要介绍样品材料,有机分析在4.1中介绍.7.0步骤:7.1取样7.1.1沉积物/土壤样品倒沉积样品上而水层,充分地混匀,特别是复合样品,去除任何外来物质,如植物枝叶以及岩石等.7.1.2废弃物样品这种多相样品在萃取之前需要进行第二章中捉到的预处理过程. 这种萃取方法只针对固体样品.7.1.3废弃物样品灘磨碾磨细分后的样品可通过1mm滤网或是挤压通过1mm孔.碾磨后的样品质量至少要有10g.7.1.4橡胶,纤维或油性材料这些样品不需要碾磨,但要剪切成细统或小颗粒,使样品衣面积尽可能最人力I入与样品1:1比例的无水硫酸钠混合后,碾磨.7.2干燥后的样品比重当样品的测试结果以干样计算时,平行称取两份,在样品分析的同时,另外一份用于比重计算,注意:烘箱应该放置在•外罩中或通风口处,因为干燥过程是样品最主要的污染源. 样品称取后应立即进行萃取.称取5・10g样品于堆砌中,在105°C的温度下保持•个晚上, 要求称取之前在干燥器中冷却.样品的干重计算如下:••日•样品干燥过程完成后,用过的干燥器不能马上再次利用,而应该经过适当处理后才能投入使 用.7.3将10g 样品与10g 无水硫酸钠混合均匀后放入萃取容器中,索氏装置中的套管可以根据萃 取过程中玻璃棉上下样品的萃取能力,选择合适的套管.7.3.1 在样品中加入1.0ml 替代标准溶液(参考方法3500中关于参考物的描述) 7.3.2 针对每一批分析样品选取最强峰,加入1.0ml 参考溶液. 7.3.3参考方法3500的5.5和8.3选择合适的参考物及其浓度.7.4在500ml 的圆底烧瓶中加入300萃取溶剂(5.4).同时加入1到2块沸石,连接烧瓶与抽提装 置,以每小时溶液循环4力周的速度连续萃取16-24小时.7.5萃取完成后要求萃取装置完成冷却.7.6将样品置于K-D 浓缩器,必要话将10ml 的浓缩管连在烧瓶上.7.7按照装置结构将回收溶剂的玻璃装置(冷凝器,接收器)与K-D 斯奈德层析柱联接.7.8用含有10cm 无水硫酸钠的干燥柱干燥萃取装置,将干燥过的萃取装置与K-D 装置联接后, 用100到125ml 的萃取液淸洗萃取烧瓶以及硫酸钠干燥柱等定量转移容器.7.9在烧瓶中加入1~2块沸石后与三孔斯耐德联接,从斯耐德柱的上端加入约lml 二氯甲烷进 行润洗,将K-D 装置置于水浴锅上(温度高于溶剂沸点15-20左右)使浓缩管浸入在热水中, 整个圆底烧瓶的衣面约处在水浴蒸汽中,调整设备位置以及合适的温度.按照耍求浓缩 10~20min.以•定的速率提取,但不外溢,当液体体积达到l~2ml 时.从水浴锅上移开K-D 装 置,至少冷却lOmin.7.10如果需要更换溶剂,(如衣1所示),立即移开斯耐徳柱,加入人约50ml 的更换溶剂以及新的沸 石,重新接好仪器.按照7.9浓缩萃取液,必要的话升高温度进行蒸係.当浓缩体积再次达到 l~2ml 时,从水浴锅上移开K ・D 装置,至少冷却lOmin.7.11移开斯耐德柱并且用卜2ml 的二氯甲烷或更换溶剂冲洗圆底烧瓶及浓缩管,如果出现硫磺 结晶,则应用方法3660淸理,应用7.12所描述的方法对萃取液进•步浓缩,用溶剂稀释至 10ml.7.12进•步的浓缩如衣1所示,无论是微斯耐徳柱技术(7.12.1)或是氮粉碎技术(7.12.2)都能满足 最终的萃取要求.7.12.1微斯耐德柱技术7.12.1.1在浓缩管中加入1~2块沸石,连二口的微斯耐德柱,从柱端加入0.5ml 二氯甲烷或萃 取溶剂润洗斯耐德柱.将K-D 装置放入到热水浴中使浓缩管部分浸入水中,调整仪 器位置以及水的温度,浓缩5-10min.在不外溢的情况下以•定的速率抽扌是.7.12.1.2当液体体积达到0.5ml 时.从水浴锅上移开K-D 装置,冷却lOmin,再移开斯耐德柱并 且用0.2ml 的溶剂冲洗烧瓶以及浓缩装置•最后将萃取液稀释至1.0~2.0ml,如衣1所 述.7.12.2氮粉碎技术7.12.2.1将浓缩装置置于温水浴中(人约35摄氏度),利用清洁干燥的氮缓慢蒸发溶剂至•定体 积,(经活性炭柱过滤).警告:在炭阱与样品之间不能使用塑料管,因为它可能会引入污染源.%干重干燥後的樣品質量 干燥前樣品質量7.12.2.2在分离的过程中管的内壁必须用合适的溶剂多次冲洗,在精谓过程中,应调整溶剂的液面高度防止水进入样品中(溶剂液而高度应该低于水浴高度),在正常的操作下,是不允许水浴锅变干的.警告:当溶剂的体积少于lml时,挥发性分析物可能有部分损失.7.13萃取是选用介适的有机溶剂对目标物进行分析的技术(参考本章4.3),如果萃取分析不能立即完成,则打开浓缩管盖使之冷却.如果萃取液储存时间超过2天,应该将其转入带有特氟隆瓶塞的螺口玻璃瓶中,适当分类.8.0质量控制&1使用的任何空白试剂,基质或平行样品的处理过程应该与样品的分析程序相同.8.2参考第•章中的质量控制程序的具体细节,以及方法3500中样品处理过程.9.0参考方法如方法中所述10.0参考无农1不同举取方法萃取状况描述a.对所有方法而言,建议分析最佳体积是lO.OmL当液体体积为1.0m】时,达到侦测极限范围.b.方法8041中,1.0ml的2•甲醇萃取后用GC/FID分析样品中的苯酚,同时8041也包含另外•种分析程序,即用0.5ml的己烷萃取后,上GC/ECD分析.c.有必要的话•对GC/MS的萃取样品进行•净化•参考方法3600中的净化程序.方法3540索氏萃取开始结束萃取过程。
EPA方法索引

EPA方法索引EPA(Environmental Protection Agency,环境保护局)是美国联邦政府机构,负责制定环境保护政策和监督执行,旨在保护人类健康和自然环境。
EPA通过开发和更新一系列的方法和准则来评估和监测环境中的各种污染物。
以下是EPA方法的索引,其中包含了一些常用的方法。
1.水质分析方法:-EPA方法6010:使用电感耦合等离子体质谱仪对水样中的重金属进行测定。
-EPA方法160.2:测定饮用水中总溶解性氟化物的浓度。
-EPA方法200.7:使用火焰原子吸收光谱法测定水样中的金属。
-EPA方法365.2:测定地下水中40种有机化合物的浓度。
2.大气质量监测方法:-EPA方法305:测定大气中颗粒物(PM10)的质量浓度。
-EPA方法1664:对水和底泥中的油脂进行提取和测定。
-EPA方法321.8:通过气浓度梯度法测定大气中的苯系化合物。
-EPA方法327:使用红外光谱法测定大气中的多环芳烃。
3.土壤和底泥分析方法:-EPA方法3540:对土壤和底泥中的有机物进行提取。
-EPA方法8000:使用气相色谱质谱法分析土壤和底泥中的挥发性有机化合物。
-EPA方法3051:测定土壤样品中重金属的浓度。
-EPA方法8240:使用气相色谱质谱法分析土壤和底泥中的半挥发性有机化合物。
4.垃圾和固体废物分析方法:-EPA方法8015:使用气相色谱质谱法分析固体废物中的多环芳烃。
-EPA方法8082:使用气相色谱质谱法分析土壤、底泥和固体废物中的戴奥辛和类似化合物。
-EPA方法8260:使用气相色谱质谱法分析固体废物中的挥发性有机化合物。
-EPA方法8280:使用气相色谱质谱法分析固体废物中的多氯联苯。
5.生物监测方法:-EPA方法1600:测定饮用水和海水中的大肠杆菌和肠球菌数量。
-EPA方法1613:使用液相色谱质谱法测定鱼类组织中的多氯联苯和多溴联苯醚。
-EPA方法2050:测定水和生物体中蓝绿藻的数量和类群组成。
美国环保署(EPA)对炼油厂废气排放管理的启示

美国环保署(EPA)对炼油厂废气排放管理的启示1 美国环保署对炼油厂废气排放的主要管理方式美国环保署自2000年前就对美国炼油厂SO2和NO x排放制定了强制要求: “新污染源的排放执行标准”(New Source Performance Standards,简称 NSPS),NSPS要求每个催化裂化装置必须满足排放要求,任何需要提高产能的催化裂化装置,均需要重新向环保署申请并获得批准,扩能获得批准后会执行更为严苛的排放标准。
2000年左右,美国环保署发现美国的催化裂化产能增加很多,但几乎没有炼厂提出申请,美国环保署质疑炼厂通过“消除瓶颈”的借口“逐步”提高产能,而不是采用一次性扩能,因此美国环保署对每个炼厂单独制定了SO2和NO x的排放标准,称为“许可法令”(Consent Decree简称CD)。
这些排放标准非常苛刻,但美国环保署并未强制炼油厂使用何种方法达到标准,而是允许采用各种手段满足排放标准。
至今EPA已经与32家美国炼油公司签署控制排放的“许可法令”,这32家公司的炼油能力占美国总炼油能力的90%,EPA目前仍在与一些炼油公司进行协商,这些公司约占美国炼油能力的5%,对于其余炼油公司,EPA正在对它们进行调查(见图1)。
图1 签署“许可法令”的美国炼油厂分布自从EPA与炼油公司签署“许可法令”以后,炼油公司用于控制排放技术项目的总投资超过60亿美元,因未达标上缴的罚款超过8000万美元,追加的环境项目投资超过7500万美元.与1999年相比,2011年美国炼油厂中催化裂化装置、硫磺回收装置、加热炉、锅炉和火炬的排放中总计减少超过93000吨/年的SO2和超过256000吨/年的NO x,比“许可法令”前的SO2和NO x排放量减少了75%(见图2)。
图2 美国炼油厂SO2和NO x减排情况美国119套催化裂化装置中,已经有104套装置在“许可法令”的控制范围内,其中有82套装置(占104套催化裂化总能力的81%)的SO2长期控制目标(一年排放平均值)为25ppm、短期控制目标(一周排放平均值)为50ppm。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
METHOD 3541AUTOMATED SOXHLET EXTRACTION1.0SCOPE AND APPLICATION1.1Method 3541 describes the extraction of organic analytes from soil, sediment, sludges, and waste solids. The method uses a commercially available, unique, three stage extraction system to achieve analyte recovery comparable to Method 3540, but in a much shorter time. There are two differences between this extraction method and Method 3540. In the initial extraction stage of Method 3541, the sample-loaded extraction thimble is immersed into the boiling solvent. This ensures very rapid intimate contact between the specimen and solvent and rapid extraction of the organic analytes. In the second stage the thimble is elevated above the solvent, and is rinse-extracted as in Method 3540. In the third stage, the solvent is evaporated, as would occur in the Kuderna-Danish (K-D) concentration step in Method 3540. The concentrated extract is then ready for cleanup (Method 3600) followed by measurement of the organic analytes.1.2The method is applicable to the extraction and concentration of water insoluble or slightly water soluble polychlorinated biphenyls (PCBs) in preparation for gas chromatographic determination using either Method 8080 or 8081. This method is applicable to soils, clays, solid wastes and sediments containing from 1 to 50 µg of PCBs (measured as Arochlors) per gram of sample. It has been statistically evaluated at 5 and 50 µg/g of Arochlors 1254 and 1260, and found to be equivalent to Method 3540 (Soxhlet Extraction). Higher concentrations of PCBs are measured following volumetric dilution with hexane.1.3The method is also applicable the extraction and concentration of semivolatile organics in preparation for GC/MS analysis by Method 8270 or by analysis using specific GC or HPLC methods.2.0SUMMARY OF METHOD2.1PCBs: Moist solid samples (e.g., soil/sediment samples) may be air-dried and ground prior to extraction or chemically dried with anhydrous sodium sulfate. The prepared sample is extracted using 1:1 (v/v) acetone:hexane in the automated Soxhlet following the same procedure as outlined for semivolatile organics in Sec. 2.1. The extract is then concentrated and exchanged into pure hexane prior to final gas chromatographic PCB measurement.2.2Other semivolatile organics: A 10-g solid sample (the sample is pre-mixed with anhydrous sodium sulfate for certain matrices) is placed in an extraction thimble and usually extracted with 50 mL of 1:1 (v/v) acetone/hexane for 60 minutes in the boiling extraction solvent. The thimble with sample is then raised into the rinse position and extracted for an additional 60 minutes. Following the extraction steps, the extraction solvent is concentrated to 1 to 2 mL.CD-ROM3541 - 1Revision 0September 19943.0INTERFERENCES3.1Refer to Method 3500.3.2The extraction thimble and the o-rings used to seal the extraction cup are both a source of interference. Both should be checked by including a method blank and following the extraction procedure as written. Solvent rinsing or extraction, prior to use, may be necessary to eliminate or reduce interferences. Viton seals contributed least to the interference problem, however, even they contributed some interference peaks when the extraction solvent was analyzed by the electron capture detector. Use of butyl or EPDM rings are not recommended since they were found to contribute significant background when the extraction solvent was 1:1 v/v hexane/acetone or 1:1 v/v methylene chloride/acetone.4.0APPARATUS AND MATERIALS4.1Automated Soxhlet Extraction System - with temperature-controlled oil bath (Soxtec, or equivalent). Tecator bath oil (catalog number 1000-1886) should be used with the Soxtec. Silicone oil must not be used because it destroys the rubber parts. See Figure 1. The apparatus is used in a hood.4.2Accessories and consumables for the automated Soxhlet system. (The catalog numbers are Fisher Scientific based on the use of the Soxtec HT-6, however, other sources that are equivalent are acceptable.)4.2.1Cellulose extraction thimbles - 26 mm ID x 60 mmcontamination free, catalog number 1522-0034, or equivalent.4.2.2Glass extraction cups (80 mL) - (set of six required for theHT-6), catalog number 1000-1820.4.2.3Thimble adapters - (set of six required for the HT-6),catalog number 1000-1466.4.2.4Viton seals - catalog number 1000-2516.4.3Syringes - 100 and 1000 µL and 5 mL.4.4Apparatus for Determining Percent Dry Weight4.4.1Drying Oven.4.4.2Desiccator.4.4.3Crucibles, porcelain.4.4.4Balance, analytical.4.5Apparatus for grinding - Fisher Cyclotec, Fisher Scientific catalog number 1093, or equivalent.CD-ROM3541 - 2Revision 0September 1994CD-ROM 3541 - 3Revision 0September 19944.6Spatula 4.7Graduated cylinder - 100 mL.4.8Aluminum weighing dish - VWR Scientific catalog number 25433-008 or equivalent.4.9Graduated, conical-bottom glass tubes - 15 mL, Kimble catalog number 45166 or equivalent, or 10 mL KD concentrator tube.5.0REAGENTS5.1Reagent grade chemicals shall be used in all tests. Unless otherwise indicated, it is intended that all reagents shall conform to the specifications of the Committee on Analytical Reagents of the American Chemical Society, where such specifications are available. Other grades may be used, provided it is first ascertained that the reagent is of sufficiently high purity to permit its use without lessening the accuracy of the determination.5.2Organic-free reagent water. All references to water in this method refer to organic-free reagent water, as defined in Chapter One.5.3Sodium sulfate (granular, anhydrous), Na SO . Purify by heating at 24400C for 4 hours in a shallow tray, or by precleaning the sodium sulfate with omethylene chloride. A method blank must be analyzed, demonstrating that there is no interference from the sodium sulfate. 5.4Extraction solvents:5.4.1Organochlorine pesticides/PCB extraction:5.4.1.1Acetone/hexane (1:1 v/v), CH C0CH /C H . Pesticide33614quality or equivalent.5.4.2Semivolatile organics extraction:5.4.2.1Acetone/hexane (1:1 v/v), CH COCH /C H . Pesticide33614quality or equivalent.5.4.2.2Acetone/methylene chloride (1:1 v/v),CH COCH /CH Cl . Pesticide quality or equivalent.33225.5Hexane, C H . Pesticide quality or equivalent.6146.0SAMPLE COLLECTION, PRESERVATION, AND HANDLING6.1See the introductory material to this chapter, Organic Analytes,Sec. 4.1.7.0PROCEDURE7.1Sample handling7.1.1Sediment/soil samples - Decant and discard any water layeron a sediment sample. Mix sample thoroughly, especially composited samples. Discard any foreign objects such as sticks, leaves, and rocks.7.1.1.1PCBs or high-boiling organochlorine pesticides -Air-dry the sample at room temperature for 48 hours in a glass trayor on hexane-cleaned aluminum foil, or dry the sample by mixing withanhydrous sodium sulfate until a free-flowing powder is obtained(see Sec. 7.2).NOTE:Dry, finely ground soil/sediment allows the bestextraction efficiency for non-volatile, non-polarorganics, e.g., PCBs, 4,4'-DDT, etc. Air-dryingis not appropriate for the analysis of the morevolatile organochlorine pesticides (e.g. theBHCs) or the more volatile of the semivolatileorganics because of losses during the dryingprocess.7.1.2Dried sediment/soil and dry waste samples amenable togrinding - Grind or otherwise subdivide the waste so that it either passes through a 1 mm sieve or can be extruded through a 1 mm hole. Introduce sufficient sample into the grinding apparatus to yield at least 20 g after grinding. Disassemble grinder between samples, according to manufacturer's instructions, and clean with soap and water, followed by acetone and hexane rinses.NOTE:The same warning on loss of volatile analytes applies to the grinding process. Grinding should only be performed whenanalyzing for non-volatile organics.7.1.3Gummy, fibrous, or oily materials not amenable to grindingshould be cut, shredded, or otherwise broken up to allow mixing, and maximum exposure of the sample surfaces for extraction. If grinding of these materials is preferred, the addition and mixing of anhydrous sodium sulfate with the sample (1:1) may improve grinding efficiency. The professional judgment of the analyst is required for handling such difficult matrices.7.1.4Multiple phase waste samples - Samples consisting of multiplephases must be prepared by the phase separation method in Chapter Two before extraction. This procedure is for solids only.7.2For sediment/soil (especially gummy clay) that is moist and cannot be air-dried because of loss of volatile analytes - Mix 5 g of sample with 5 g of anhydrous sodium sulfate in a small beaker using a spatula. Use this approach for any solid sample that requires dispersion of the sample particles to ensure greater solvent contact throughout the sample mass.CD-ROM3541 - 4Revision 0September 1994CD-ROM 3541 - 5Revision 0September 19947.3Determination of sample percent dry weight - In certain cases, sample results are desired based on dry weight basis. When such data are desired, a portion of sample for this determination should be weighed out at the same time as the portion used for analytical determination.WARNING:The drying oven should be contained in a hood or vented.Significant laboratory contamination may result from thedrying of a heavily contaminated hazardous waste sample.7.3.1Immediately after weighing the sample for extraction, weigh5-10 g of the sample into a tared crucible. Determine the % dry weight of the sample by drying overnight at 105C. Allow to cool in a desiccator o before weighing:% dry weight = g of dry sample x 100g of sample7.4Check the heating oil level in the automated Soxhlet unit and add oil if needed. See service manual for details. Set the temperature on the service unit at 140C when using hexane-acetone (1:1, v/v) as the extraction solvent.o 7.5Press the "MAINS" button; observe that the switch lamp is now "ON".7.6Open the cold water tap for the reflux condensers. Adjust the flow to 2 L/min to prevent solvent loss through the condensers.7.7Weigh 10 g of sample into extraction thimbles. For samples mixed with anhydrous sodium sulfate, transfer the entire contents of the beaker (Sec.7.2) to the thimble. Add surrogate spikes to each sample and the matrix spike/matrix spike duplicate to the selected sample.NOTE:When surrogate spikes and/or matrix spikes contain relativelyvolatile compounds (e.g., trichlorobenzenes, BHCs, etc.), steps 7.8,7.9, and 7.10 must be performed quickly to avoid evaporation lossesof these compounds. As the spike is added to the sample in eachthimble, the thimble should immediately be transferred to thecondenser and lowered into the extraction solvent.7.8Immediately transfer the thimbles containing the weighed samples into the condensers. Raise the knob to the "BOILING" position. The magnet will now fasten to the thimble. Lower the knob to the "RINSING" position. The thimble will now hang just below the condenser valve.7.9Insert the extraction cups containing boiling chips, and load each with 50 mL of extraction solvent (normally 1:1 (v/v) hexane:acetone, see Sec.5.4). Using the cup holder, lower the locking handle, ensuring that the safety catch engages. The cups are now clamped into position. (The seals must be pre-rinsed or pre-extracted with extraction solvent prior to initial use.)7.10Move the extraction knobs to the "BOILING" position. The thimbles are now immersed in solvent. Set the timer for 60 minutes. The condenser valves must be in the "OPEN" position. Extract for the preset time.CD-ROM 3541 - 6Revision 0September 19947.11Move the extraction knobs to the "RINSING" position. The thimbles will now hang above the solvent surface. Set timer for 60 minutes. Condenser valves are still open. Extract for the preset time.7.12After rinse time has elapsed, close the condenser valves by turning each a quarter-turn, clockwise.7.13When all but 2 to 5 mL of solvent have been collected, open the system and remove the cups.7.14Transfer the contents of the cups to 15 mL graduated, conical-bottom glass tubes. Rinse the cups using hexane (methylene chloride if 1:1 methylene chloride-acetone was used for extraction and analysis is by GC/MS) and add the rinsates to the glass tubes. Concentrate the extracts to 1 to 10 mL. The final volume is dependent on the determinative method and the quantitation limit required. Transfer a portion to a GC vial and store at 4C until analyses are o performed.NOTE:The recovery solvent volume can be adjusted by addingsolvent at the top of the condensers. For more detailsconcerning use of the extractor, see the operating manualfor the automated extraction system.7.15Shutdown7.15.1Turn "OFF" main switch.7.15.2Turn "OFF" cold water tap.7.15.3Ensure that all condensers are free of solvent. Emptythe solvent that is recovered in the evaporation step into an appropriate storage container.7.16The extract is now ready for cleanup or analysis, depending on the extent of interfering co-extractives. See Method 3600 for guidance on cleanup methods and Method 8000 for guidance on determinative methods. Certain cleanup and/or determinative methods may require a solvent exchange prior to cleanup and/or determination.8.0QUALITY CONTROL8.1Refer to Chapter One for general quality control procedures and to Method 3500 for specific extraction and sample preparation QC procedures.8.2Before processing any samples, the analyst should demonstrate through the analysis of an organic-free solid matrix (e.g., reagent sand) method blank that all glassware and reagents are interference-free. Each time a set of samples is extracted, or when there is a change in reagents, a method blank should be processed as a safeguard against chronic laboratory contamination. The blank samples should be carried through all stages of the sample preparation and measurement. This is especially important because of the possibility of interferences being extracted from the extraction cup seal.8.3Standard quality assurance practices should be used with this method. Field duplicates should be collected to validate the precision of the sampling technique. Each analysis batch of 20 or less samples must contain: a method blank, either a matrix spike/matrix spike duplicate or a matrix spike and duplicate sample analysis, and a laboratory control sample, unless the determinative method provides other guidance. Also, routinely check the integrity of the instrument seals.8.4Surrogate standards must be added to all samples when specified in the appropriate determinative method.9.0METHOD PERFORMANCE9.1Multi-laboratory accuracy and precision data were obtained for PCBs in soil. Eight laboratories spiked Arochlors 1254 and 1260 into three portions of 10 g of Fuller's Earth on three non-consecutive days followed by immediate extraction using Method 3541. Six of the laboratories spiked each Arochlor at 5 and 50 mg/kg and two laboratories spiked each Arochlor at 50 and 500 mg/kg. All extracts were analyzed by Oak Ridge National Laboratory, Oak Ridge, TN, using Method 8081. These data are listed in a table found in Method 8081, and were taken from Reference 1.9.2Single-laboratory accuracy data were obtained for chlorinated hydrocarbons, nitroaromatics, haloethers, and organochlorine pesticides in a clay soil. The spiking concentrations ranged from 500 to 5000 µg/kg, depending on the sensitivity of the analyte to the electron capture detector. The spiking solution was mixed into the soil during addition and then immediately transferred to the extraction device and immersed in the extraction solvent. The data represents a single determination. Analysis was by capillary column gas chromatography/electron capture detector following Methods 8081 for the organochlorine pesticides, 8091 for the nitroaromatics, 8111 for the hydrocarbons, and 8121 for the chlorinated hydrocarbons. These data are listed in a table located in their respective methods and were taken from Reference 2.9.3Single-laboratory accuracy and precision data were obtained for semivolatile organics in soil by spiking at a concentration of 6 mg/kg for each compound. The spiking solution was mixed into the soil during addition and then allowed to equilibrate for approximately 1 hr prior to extraction. Three determinations were performed and each extract was analyzed by gas chromatography/mass spectrometry following Method 8270. The low recovery of the more volatile compounds is probably due to volatilization losses during equilibration. These data are listed in a Table located in Method 8270 and were taken from Reference 2.10.0REFERENCES1.Stewart, J. "Intra-Laboratory Recovery Data for the PCB ExtractionProcedure"; Oak Ridge National Laboratory, Oak Ridge, TN, 37831-6138;October 1989.CD-ROM3541 - 7Revision 0September 19942.Lopez-Avila, V. (Beckert, W., Project Officer), "Development of a SoxtecExtraction Procedure for Extracting Organic Compounds from Soils and Sediments", EPA 600/X-91/140, US EPA, Environmental Monitoring Systems Laboratory-Las Vegas, October 1991.CD-ROM3541 - 8Revision 0September 1994CD-ROM 3541 - 9Revision 0September 1994Figure 1Automated Soxhlet Extraction SystemCD-ROM 3541 - 10Revision 0September 1994METHOD 3541AUTOMATED SOXHLET EXTRACTION。
