(整理)包涵体的分离纯化.
包含体纯化步骤(精)

同样采用Ni-NTA His结合树脂亲和纯化重组目的蛋白,1、200mL菌液离心收集大量诱导的菌体,并用1×PBS缓冲液洗涤两次。
2、将保存的菌体沉淀用总体积为20mL的1×Bind Buffer (300mM NaCl,50MmNaH2PO4; 10mM imidazote,pH8.0)重悬,在冰浴中超声波破菌至溶液呈白色澄清。
3、4℃12,000rpm离心30分钟,然后用20mL的包涵体洗涤Buffer (50mmol/L Tris-HCl,100mmol/L NaCl,1mmol/L EDTA,0.5% Triton x-100,pH8.0)洗涤沉淀两次。
4、加20mL的包涵体溶解Buffer(50mmol/L Tris-HCl,100mmol/L NaCl,8mol/L Urea,pH8.0)充分溶解,(旋涡溶解,最好溶解时间长一点,1h左右,也可以用冰盒装放摇床上1h),4℃10,000 r/min离心30min,收集上清。
2.2.2 亲和层析纯化表达的蛋白pQE40和pET-32a(+)载体表达的蛋白C﹑N端均融合了6个组氨酸的tag,可用金属螯和层析纯化,也可用抗6个组氨酸的单克隆抗体检测表达蛋白的正确性。
根据表达蛋白的溶解情况分两种方法对蛋白进行纯化。
2.2.3 天然条件下纯化可溶形式的目的蛋白目的蛋白的表达和收获:用3.2.2.1所述的方法大量表达目的蛋白。
4℃下10,000 rpm离心5min弃上清,向细菌沉淀中加入4℃用冰预冷的1×Ni-NTA结合缓冲液(50 mmol/L NaH2PO4, 300 mmol/L NaCl, 10 mmol/L咪唑, pH8.0),每100mL培养液加入4mL结合缓冲液,重悬菌体。
-40℃冷冻,室温溶解,反复冻融三次。
再在冰水浴中超声10min(超声10s, 间隔10s),破碎菌体。
4℃下10,000 rpm离心20min,保留上清液。
包涵体产物的纯化工艺

包涵体产物的纯化工艺
纯化涉及从原料中分离和去除杂质以获得纯净化合物的工艺。
对于包含有机或无机物的体产物,其纯化工艺可以根据具体情况进行调整,但以下是一般常用的几种纯化工艺:
1. 结晶:通过温度控制和溶剂选择,使目标化合物从溶液中结晶出来,然后进行过滤、洗涤和干燥等步骤,以获得纯净的产物。
2. 蒸馏:利用成分之间的沸点差异来分离和纯化混合物。
通过加热混合物,使成分按照沸点的高低逐渐蒸发和冷凝,从而分离目标化合物。
3. 萃取:利用不同物质在不同溶剂中的溶解度差异,将目标化合物从混合物中分离提取出来。
常见的萃取方法包括溶剂萃取、液液萃取和固相萃取等。
4. 色谱:利用样品成分在移动相和固定相之间的差异,通过一系列分离和纯化步骤来分离和纯化产物。
常见的色谱方法包括薄层色谱、柱层析、高效液相色谱和气相色谱等。
5. 活性炭吸附:通过将目标化合物吸附在活性炭上,去除混合物中的杂质物质,从而纯化产物。
这种方法常用于水处理、空气净化和溶剂回收等领域。
6. 晶体化学:通过对化合物晶体结构的解析和再合成,消除晶体中的杂质,实
现产物纯化。
以上是一些常见的纯化工艺,具体选择哪种工艺取决于产物性质、目标纯度要求、经济性和实际应用等因素。
包涵体的纯化和复性总结--最全的前人经验

包涵体旳纯化和复性总结ﻫ二、包涵体旳洗涤ﻫ1、包涵体旳洗涤问题ﻫ一般旳洗涤措施一般是洗不干净旳,我此前是这样做旳,先把包涵体用6M盐酸胍溶解充足,过滤除去未溶解旳物质,注意留样跑电泳,然后用水稀释到4M,离心把沉淀和上清分别跑电泳,如此类推可以始终稀释到合适旳浓度,你可以找到一种合适清除杂质旳措施,其实这就是梯度沉淀旳措施,我觉得比一般旳直接洗脱效果好。
ﻫﻫ包涵体一般难溶解,因此你要注意未溶解旳部分,你可以跑电泳对比,由于有时候难溶解旳就是你旳目旳蛋白,因此每次解决都要把上清和沉淀跑电泳对比,免得把目旳蛋白弄丢了。
ﻫ此外刚解决完旳包涵体好溶解。
冷冻后难溶解,溶解也需要长点时间,也需要大量旳溶剂。
如果说是不少不溶解旳不是你要旳,那就不用管了。
2、如何得到比较纯旳包涵体对于包涵体旳纯化,包涵体旳前解决是很重要旳。
ﻫ包涵体中重要具有重组蛋白,但也具有某些细菌成分,如某些外膜蛋白、质粒DNA和其他杂质。
洗涤常用1%如下旳中性去垢剂,如Tween、Triton、Lubel和NP40等加EDTA和还原剂2-巯基苏糖醇(DTT)、β-巯基乙醇等反复多次进行,因去垢剂洗涤能力随溶液离子强度升高而加强,在洗涤包涵体时可加50 mM NaCL。
这样提取旳包涵体纯度至少可达50%以上,并且可保持元构造。
也可用低浓度旳盐酸胍或尿素/中性去垢剂/EDTA/还原剂等洗去包涵体表面吸附旳大部分不溶性杂蛋白。
洗涤液pH以与工程菌生理条件相近为宜,使用旳还原剂为0.1-5mM。
EDTA为0.1-0.3 mM。
去垢剂如Triton X-100、脱氧胆酸盐和低浓度旳变性剂如尿素充足洗涤清除杂质,这一步很重要,由于大肠杆菌外膜蛋白Omp T(37 KDa)在4-8mol/L尿素中具有蛋白水解酶活性,在包涵体旳溶解和复性过程中可导致重组蛋白质旳降解。
对于尿素和盐酸胍旳选择:尿素和盐酸胍属中强度变性剂,易经透析和超滤除去。
它们对包涵体氢键有较强旳可逆性变性作用,所需浓度尿素8-10M,盐酸胍6-8M。
包涵体纯化实验报告

一、实验目的1. 掌握包涵体纯化的基本原理和操作步骤。
2. 学习利用离子交换层析法对包涵体进行纯化。
3. 评估包涵体纯化效果,并探讨优化纯化条件的方法。
二、实验原理包涵体是细菌表达外源蛋白时形成的一种不溶性蛋白质聚集体。
由于包涵体中的蛋白质缺乏生物活性,因此需要通过一系列操作将其溶解、复性,并最终纯化得到具有生物活性的蛋白质。
本实验采用离子交换层析法对包涵体进行纯化,通过改变缓冲液中的离子强度和pH值,使包涵体中的蛋白质与层析柱上的亲和基团结合,从而实现蛋白质的分离和纯化。
三、实验材料1. 包涵体样品2. 离子交换层析柱3. 标准蛋白样品4. 标准缓冲液5. 蛋白质浓度测定试剂盒6. 超声波破碎仪7. 离心机8. 荧光分光光度计9. 数据处理软件四、实验步骤1. 包涵体样品的处理将包涵体样品用超声波破碎仪处理,使包涵体溶解。
然后将溶液离心,取上清液作为后续实验的样品。
2. 样品预处理将样品用缓冲液稀释,调整离子强度和pH值,使包涵体中的蛋白质与层析柱上的亲和基团结合。
3. 离子交换层析将预处理后的样品上柱,用缓冲液进行洗脱,收集洗脱液。
4. 蛋白质纯化效果评估采用蛋白质浓度测定试剂盒对洗脱液进行蛋白质浓度测定,比较不同洗脱液中的蛋白质浓度,评估纯化效果。
5. 数据处理与分析利用数据处理软件对实验数据进行统计分析,探讨优化纯化条件的方法。
五、实验结果1. 包涵体样品经过超声波破碎后,溶液变得清澈,说明包涵体已成功溶解。
2. 通过离子交换层析法,成功将包涵体中的蛋白质与层析柱上的亲和基团结合,实现了蛋白质的分离和纯化。
3. 通过蛋白质浓度测定,发现洗脱液中的蛋白质浓度明显高于未处理的样品,说明纯化效果良好。
4. 通过数据分析,发现改变缓冲液中的离子强度和pH值对包涵体纯化效果有显著影响。
在一定范围内,增加离子强度和降低pH值有利于提高蛋白质的纯化效果。
六、实验结论1. 本实验成功实现了包涵体的纯化,并获得了具有生物活性的蛋白质。
包涵体纯化方法及包涵体蛋白制备
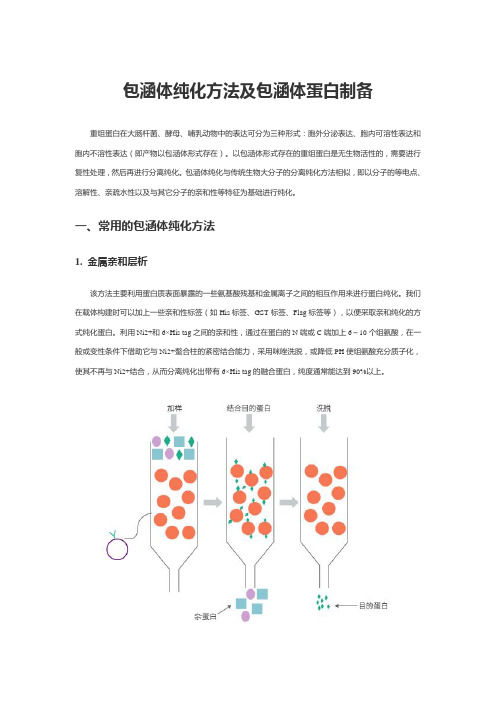
包涵体纯化方法及包涵体蛋白制备重组蛋白在大肠杆菌、酵母、哺乳动物中的表达可分为三种形式:胞外分泌表达、胞内可溶性表达和胞内不溶性表达(即产物以包涵体形式存在)。
以包涵体形式存在的重组蛋白是无生物活性的,需要进行复性处理,然后再进行分离纯化。
包涵体纯化与传统生物大分子的分离纯化方法相似,即以分子的等电点、溶解性、亲疏水性以及与其它分子的亲和性等特征为基础进行纯化。
一、常用的包涵体纯化方法1. 金属亲和层析该方法主要利用蛋白质表面暴露的一些氨基酸残基和金属离子之间的相互作用来进行蛋白纯化。
我们在载体构建时可以加上一些亲和性标签(如His标签、GST标签、Flag标签等),以便采取亲和纯化的方式纯化蛋白。
利用Ni2+和6×His tag之间的亲和性,通过在蛋白的N端或C端加上6~10个组氨酸,在一般或变性条件下借助它与Ni2+螯合柱的紧密结合能力,采用咪唑洗脱,或降低PH使组氨酸充分质子化,使其不再与Ni2+结合,从而分离纯化出带有6×His tag的融合蛋白,纯度通常能达到90%以上。
2.离子交换层析离子交换层析是根据在一定pH条件下,蛋白质所带电荷不同而进行的分离的方法。
常用的离子交换剂有羧甲基纤维素(阳离子交换剂,弱酸型)和二乙基氨基乙基纤维素(阴离子交换剂,弱碱型)。
阴离子交换基质结合带有负电荷的蛋白质,所以这类蛋白质被留在柱子上,需要通过提高洗脱液中的盐浓度等措施将其洗脱下来。
根据蛋白质结合能力不同,洗脱的速度会存在差异,通常结合较弱的蛋白质先被洗脱。
反之,阳离子交换基质会结合带有正电荷的蛋白质,可以通过提高洗脱液的PH或增加洗脱液中的盐浓度将蛋白洗脱下来。
3.凝胶过滤层析凝胶过滤层析通常又称为分子筛方法,主要是根据蛋白质的大小和形状达到分离和纯化的目的。
一般是大分子先流出来,小分子后流出来。
此方法的优点在于层析所用的凝胶属于惰性载体,不带电荷并且吸附力弱,可较广的温度范围内进行。
包涵体纯化全过程

一、包涵体的纯化和复性总结(二)关于包涵体的纯化是一个令人头疼的问题,包涵体的复性已经成为生物制药的瓶颈,关于包涵体的处理一般包括这么几步:菌体的破碎、包涵体的洗涤、溶解、复性以及纯化,内容比较庞杂。
一、菌体的裂解1、怎样裂解细菌?细胞的破碎方法1.高速组织捣碎:将材料配成稀糊状液,放置于筒内约1/3体积,盖紧筒盖,将调速器先拨至最慢处,开动开关后,逐步加速至所需速度。
此法适用于动物内脏组织、植物肉质种子等。
2.玻璃匀浆器匀浆:先将剪碎的组织置于管中,再套入研杆来回研磨,上下移动,即可将细胞研碎,此法细胞破碎程度比高速组织捣碎机为高,适用于量少和动物脏器组织.3。
超声波处理法:用一定功率的超声波处理细胞悬液,使细胞急剧震荡破裂,此法多适用于微生物材料,用大肠杆菌制备各种酶,常选用50-100毫克菌体/毫升浓度,在1KG至10KG频率下处理10-15分钟,此法的缺点是在处理过程会产生大量的热,应采取相应降温措施,时间以及超声间歇时间、超声时间可以自己调整,超声完全了菌液应该变清亮,如果不放心可以在显微镜下观察。
对超声波及热敏感的蛋白和核酸应慎用。
4。
反复冻融法:将细胞在—20度以下冰冻,室温融解,反复几次,由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。
5.化学处理法:有些动物细胞,例如肿瘤细胞可采用十二烷基磺酸钠(SDS)、去氧胆酸钠等细胞膜破坏,细菌细胞壁较厚,可采用溶菌酶处理效果更好,我用的浓度一般为1mg/ml。
无论用哪一种方法破碎组织细胞,都会使细胞内蛋白质或核酸水解酶释放到溶液中,使大分子生物降解,导致天然物质量的减少,加入二异丙基氟磷酸(DFP)可以抑制或减慢自溶作用;加入碘乙酸可以抑制那些活性中心需要有疏基的蛋白水解酶的活性,加入苯甲磺酰氟化物(PMSF)也能清除蛋白水解酶活力,但不是全部,而且应该在破碎的同时多加几次;另外,还可通过选择pH、温度或离子强度等,使这些条件都要适合于目的物质的提取.这是标准配方:裂解液:50mM Tris—HCl(pH8。
包涵体纯化方案

包涵体纯化方案缓冲液配方:1. 变性复性缓冲液①②缓冲液 A: 50mM Tris-HCl (pH8.5), 1mM EDTA , 100mM NaCl ,1%Triton③X-100缓冲液 B:50mM Tris-HCl (pH8.5), 1mM EDTA, 100mM NaCl ,1%Triton X-100 ,④2M 脲素缓冲液 C: 50mM Tris-HCl (pH8.5), 1mM EDTA, 100mM NaCl ,1%Triton X-100 缓冲液 D:50mM Tris-HCl (pH8.5), 1mM EDTA, 100mM NaCl ,1%Triton X-100 ,④2M 盐酸胍溶解缓冲液 E: 50mM Tris-HCI (pH8.5), 1mM EDTA, 100mM NaCI , 1OmM B -巯基⑤⑥乙醇 /DTT , 2mM 脱氧胆酸钠, 8M 脲素复性缓冲液: 50mM Tris-HCI (pH8.5), 100mM NaCI , 6M/4M/2M 脲素, 1 %甘氨⑦ ⑧ ⑨酸,5%甘油,0.2%PEG , 1mM氧化型谷胱甘肽,1mM还原型谷⑩ 胱甘肽2. 纯化缓冲液Binding buffer : 50mM Tris-HCI, 100mM NaCI, 10mM 咪唑, pH8.5EIution buffer : 50mM Tris-HCI, 100mM NaCI, 不同浓度梯度咪唑 , pH8.5具体实施步骤:1. 大量诱导表达的菌液7000rpm离心10min。
弃上清,用1 >PBS重悬,洗涤菌体细胞,7000rpm,离心10min。
再用PBS重复洗一遍。
离心后留菌体沉淀。
2. 将菌体细胞用缓冲液 A重悬,液氮中反复冻融后,超声破碎。
13000rpm离心 10min,弃上清,收集包涵体沉淀。
2.分别用缓冲液B、C、D超声清洗包涵体沉淀。
13000rpm离心10min收集沉淀。
基因工程包涵体的纯化方法

基因工程包涵体的纯化方法基因工程可真是个神奇的领域,像是现代科技的魔法师,把DNA这个小家伙们玩弄得团团转。
在这片神秘的土地上,包涵体就像是隐藏的宝藏,得先把它们找出来,再通过纯化的方法把这些小宝贝洗净,才能让它们为我们所用。
今天,我们就来聊聊基因工程包涵体的纯化方法,让这趟旅程轻松愉快。
1. 什么是包涵体?首先,包涵体可不是某种古怪的生物,它们其实是细胞在生产某些蛋白质时,形成的一种颗粒。
就像是做饭时,锅里油烟聚集的那些小油滴,虽然它们看起来不太好,但里面可藏着好东西。
你要知道,包涵体里面有大量的目标蛋白质,但通常它们会和其他杂质混在一起,像是大海捞针,得费点功夫才能捞出来。
1.1 包涵体的形成当细胞用上基因工程的技术,强行让某种蛋白质“上班”时,有时候它们就会不太乖,聚集成包涵体。
这就像你在做作业时,有的题目就特别难,结果一堆答案写错了,最后只好把它们堆到一边。
虽然包涵体一开始可能看起来像个废物,但其实它们是生产特定蛋白质的一种“副产品”。
1.2 包涵体的用途那包涵体有什么用呢?别小看了它们,它们可是制药、疫苗开发的重要角色。
有的包涵体能转化为活跃的蛋白质,成为我们需要的药物,甚至可以用于研究新治疗方法,简直就是科研界的“黑马”。
所以,找到它们、纯化它们,那可是相当重要的任务。
2. 包涵体的纯化步骤接下来,我们就要聊聊如何把这些包涵体给纯化出来,步骤其实不复杂,但得有点耐心。
2.1 细胞裂解首先,得把细胞给撬开,就像剥开一个鸡蛋,才能见到里面的蛋黄。
这里我们通常会用一些裂解缓冲液,像是加盐的水,帮助细胞膜变得松软。
然后,咱们可以用超声波处理、化学试剂或者冷冻融化的方式把细胞打散,让包涵体慢慢浮出来。
2.2 离心分离一旦细胞裂解,包涵体就会在液体中游荡。
这时候,就要用离心机来大显身手了。
离心机就像是一位厨师,用强大的“旋转功力”把细胞残骸和包涵体分开。
你可以想象,把一大锅汤放进离心机,旋转后,沉淀物就会在底下,清汤会在上面。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
包涵体的纯化和复性总结(二)关于包涵体的纯化是一个令人头疼的问题,包涵体的复性已经成为生物制药的瓶颈,关于包涵体的处理一般包括这么几步:菌体的破碎、包涵体的洗涤、溶解、复性以及纯化,内容比较庞杂一、菌体的裂解1、怎样裂解细菌?细胞的破碎方法1.高速组织捣碎:将材料配成稀糊状液,放置于筒内约1/3体积,盖紧筒盖,将调速器先拨至最慢处,开动开关后,逐步加速至所需速度。
此法适用于动物内脏组织、植物肉质种子等。
2.玻璃匀浆器匀浆:先将剪碎的组织置于管中,再套入研杆来回研磨,上下移动,即可将细胞研碎,此法细胞破碎程度比高速组织捣碎机为高,适用于量少和动物脏器组织。
3.超声波处理法:用一定功率的超声波处理细胞悬液,使细胞急剧震荡破裂,此法多适用于微生物材料,用大肠杆菌制备各种酶,常选用50-100毫克菌体/毫升浓度,在1KG至10KG 频率下处理10-15分钟,此法的缺点是在处理过程会产生大量的热,应采取相应降温措施,时间以及超声间歇时间、超声时间可以自己调整,超声完全了菌液应该变清亮,如果不放心可以在显微镜下观察。
对超声波及热敏感的蛋白和核酸应慎用。
4.反复冻融法:将细胞在-20度以下冰冻,室温融解,反复几次,由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。
5.化学处理法:有些动物细胞,例如肿瘤细胞可采用十二烷基磺酸钠(SDS)、去氧胆酸钠等细胞膜破坏,细菌细胞壁较厚,可采用溶菌酶处理效果更好,我用的浓度一般为1mg/ml。
无论用哪一种方法破碎组织细胞,都会使细胞内蛋白质或核酸水解酶释放到溶液中,使大分子生物降解,导致天然物质量的减少,加入二异丙基氟磷酸(DFP)可以抑制或减慢自溶作用;加入碘乙酸可以抑制那些活性中心需要有疏基的蛋白水解酶的活性,加入苯甲磺酰氟化物(PMSF)也能清除蛋白水解酶活力,但不是全部,而且应该在破碎的同时多加几次;另外,还可通过选择pH、温度或离子强度等,使这些条件都要适合于目的物质的提取。
这是标准配方:裂解液:50mM Tris-HCl(pH8.5~9.0), 2mM EDTA, 100mM NaCl, 0.5% Triton X-1 00, 1mg/ml溶菌酶。
(溶菌酶在这个pH范围内比较好发挥作用)但我个人的经验是:如果你裂解细菌是为了提取蛋白的话,而且蛋白的分子量又小于20kd的话,尽量减少溶菌酶的用量,会引入溶菌酶这种杂蛋白.一般配60ml裂解液用药匙匙柄盛一点就够.判断裂解好坏的标准是,溶液很粘.protocol是10ml-50ml缓冲液(菌体洗涤液,裂解液等)/1g湿菌体.如果只做一个鉴定,我觉得100-200ml菌就够了.但凡超声,我都用60ml裂解液,因为我们的超声仪(现代分子生物学实验技术录象里的那种)很适合用100ml小烧杯,装60ml裂解液,这样能让超声头离液面不高不低,不会冒泡泡,也不会洒出来.菌多我就延长超声时间.沉淀,也就是包涵体沉淀了,如果要上柱纯化,一定要先用4M尿素洗涤一下再用8M尿素溶解.如果不上柱,只是跑跑电泳,可以直接用8M尿素溶解以后,离心取上清,加入适量体积的load ing buffer.loading buffer对于包涵体的溶解能力是较弱的."取200微升菌液,离心后直接加上样buffer,100度3分钟后上样,然后SDSPAGE. 这个方法到底能不能溶解细菌中的包涵体? "而楼主的问题,虽然loading buffer对于包涵体的溶解能力是较弱的,但是我觉得你的做法只是在鉴定有无表达,用loading buffer是没有问题的.2、表达重组蛋白时,细菌裂解方法都有哪些?在表达重组蛋白时,诱导以后跑SDS-PAGE发现表达都很好,但是在裂解细胞时遇到问题。
总是不能彻底裂解细胞。
首先我采用超声裂解,可是不管我如何超声总有部分细菌没有裂解。
我的超声条件如下:宁波新芝超声细胞破碎仪,功率400W,超5秒,间隔5秒,重复99次。
然后显微镜观察,不彻底时再重复99次。
菌体来自200 ml培养液,用20 ml PBS重悬。
然后我又尝试加溶菌酶,首先加至终浓度100 ug/ml,4C半小时菌液不变粘,加大浓度至1 mg/ml,半小时后仍无明显变化。
因为我用的PBS是pH7.4,我怀疑是pH不合适,换用p H8.0 TE buffer,1 mg/ml溶菌酶,4C半小时仍无明显变粘。
因为这次使用的溶菌酶是前一天配好的,担心溶菌酶失效,重新称取冻干粉末,直接加入菌液,仍然没有明显变化。
真是郁闷。
到底出了什么事?请高手解答,并介绍优化的方案。
同时希望能介绍一下如何选择细胞破碎方法,以及如何确定最佳条件。
溶菌酶在pH7.4时是否没有活性了?可否配成浓缩液保存溶菌酶,如果可以,应如何保存?加入溶菌酶以后,如果细胞壁已破坏,菌液应该变粘吧,因为核酸被释放出来。
而超声破碎细胞,我觉得菌液是不会变粘的,因为超声可以把大分子核酸打碎成小片段。
我判断细胞破碎不完全是因为,在将破碎后样品离心分离上清和沉淀跑SDS-PAGE观察,发现在细胞碎片组分中除了经常出现的一两条带以外,还有菌体总蛋白样品中的很多带出现。
据此可以判断细胞只是部分破碎。
不知我的分析是否正确,请版主和各位高手指教。
如果溶菌酶效果还可以,我觉得先用溶菌酶初步裂解细胞,然后再用超声进一步破碎并断裂大分子核酸以降低粘度的细胞破碎策略可能比较好。
因为超声有可能使蛋白变性,但单用溶菌酶不能确定是否完全破碎,还要再加核酸酶降低粘度。
这种两步法策略应该还可以减少破碎条件优化的时间。
我用的溶菌酶放置时间比较长了,有可能失活了。
我刚从生工又定了一支,不过得后天到货,但愿它有用。
如何观察溶菌酶是否已裂解细胞,通过观察粘度变化是否可以?只反复冻融是否可以有效裂解大肠杆菌细胞?溶菌酶只有在pH值大于8.0的条件下才能发挥溶菌作用,请务必保持PBS的pH>8.0,同时溶菌酶的量一定要足!在加入溶菌酶后,最好放于磁力搅拌器上搅拌30分钟,再进行超声破菌,我的超声条件是:功率400W,工作2秒,间隔2秒,重复199次。
菌体来自500 ml培养物,用30 ml PB S重悬,超声效率还是可以的。
哪儿的溶菌酶好用?我用生工的溶菌酶,称取干粉20mg。
200ml菌液用18 ml NaCl重悬,加入2 ml 25mM T ris-HCl(pH8.0),将溶菌酶干粉加入体系,混匀,测pH降低到5-6,加20 ul 2M Tri s碱,体系pH升到~8。
4C放置1小时,菌液上层变澄清,摇动发现体系没有变粘。
测pH 仍在8左右。
再37C保温1小时,还没有变化,我简直不知如何才好了。
另一瓶200ml培养物,溶菌酶处理1小时后超声。
条件:300W,超5秒停5秒,重复99次。
菌液有变化,但很不明显。
继续超声400次,从外观来看没有太大区别。
我简直要说tmd 了。
见鬼了。
我的操作有什么地方不妥当,请各位指正。
溶菌酶的厂商要求是否很重要?我的诱导物来自1:20过夜培养物接种,37C生长3小时后30C诱导2小时(0.8mM IPTG)。
是否菌液太浓,Pharmacia的说明书200 ml培养物用10 ml重悬,我用20 ml,仍然不够稀?有人告诉我菌液应该稀一些,200 ml用30-40 ml重悬。
但实际操作也不够理想SDS-PAGE总是观察到细胞破碎效果不够彻底。
超声那么多次,蛋白都要被超碎变性了。
3、酵母的破碎酵母是一类单细胞真菌的总称,其成员分别属于不同的真菌纲,细胞壁成分是否会有较大差别,这些都是做破碎酵母细胞前要考虑的。
我归纳了一下,做破碎酵母的几种方法:1 机械的方法:一般的PROTOCOL都是用glass beads:如sigma G-8772,加玻璃珠后超声,蛋白活性保持较好。
2 化学裂解的方法:10g酵母加1ml的乙酸乙酯,充分搅拌至液体状(希望高手点评)3 尿素裂解液(尿素8mol/L, NaCl 0.5mol/L,Tris 20mmol/L, EDTA 20mmol/L, 2% SDS, PH值8.0)高压匀浆。
(这个好象也该在方法2中)4 液氮冻融并研磨酵母破壁,我认为这种可能在小试中比较合适。
5 温和的酶法,可能不会会破坏酵母原生质体酶法裂解主要用两种酶:1。
蜗牛酶,可以直接从蜗牛的胃液中获得;2。
lyticase,可以从sigma定购。
这两种酶解法都可以和上面的几种方法结合使用,尤其是glass beads方法,效果很好。
我用过化学裂解的方法,10g酵母加1ml的乙酸乙酯,充分搅拌至液体状。
此法的裂解效果不错的,不妨试一下。
一篇文章是加尿素裂解液(尿素8mol/L, NaCl 0.5mol/L,Tris 20mmol/L, EDTA 20mm ol/L, 2%SDS, PH值8.0),据说效果可以酵母破碎效果好的我所做过的方法中还是玻璃珠,就象microbe 和rongjunli所说的那样,效率很高的,而且对目的蛋白活性不会有什么影响。
一般应该用这个方法。
4、超声破碎的条件选择超声破碎的条件不能一概而论,要看你的实验要求,有的是细菌破碎,有的是对组织细胞进行破碎,要掌握好功率和每次超声时间,功率大时,每次超声时间可缩短,不能让温度升高,必要时在冰浴条件下进行超声破碎。
至于每次超声时是否起泡沫到不是关键的问题,这与你超声的量明显有关。
5、如何鉴定细菌超声破碎的程度最简单的方法:涂片--革兰氏结晶紫溶液染色0.5分钟---显微镜观察切记:只用结晶紫染色,别忘了染色后再用水稍冲洗一下6、细菌裂解的DNaseI不同纯度的酶换算标准不同,所以你最好查查是哪个公司的酶?仔细看说明书,可能会有换算说明。
另外看一下参考文献所用的酶是哪个公司的,到该公司的主页也可能有收获。
我用过华美和TAKARA的DNA酶,华美的是用mg/ml。
华美也有RNase free的DNA酶,定量用活性单位。
TAKARA的两种酶都是用活性单位定量的。
我在超声裂解细菌时加入一些DNA酶,一般用超声液加不同量的酶做一个预实验,选取符合你需要的酶量。
其实根据目的和方法的不同,所需要的酶量也是可调节的,比如酶切温度(16度或37度)。
7、超声裂解细菌是否完全?最简单的方法:涂片--革兰氏结晶紫溶液染色0.5分钟---显微镜观察切记:只用结晶紫染色二、包涵体的洗涤1、包涵体的洗涤问题通常的洗涤方法一般是洗不干净的,我以前是这么做的,先把包涵体用6M盐酸胍溶解充分,过滤除去未溶解的物质,注意留样跑电泳,然后用水稀释到4M,离心把沉淀和上清分别跑电泳,如此类推可以一直稀释到合适的浓度,你可以找到一个合适去除杂质的办法,其实这就是梯度沉淀的方法,我觉得比通常的直接洗脱效果好。
包涵体一般难溶解,所以你要注意未溶解的部分,你可以跑电泳对比,因为有时候难溶解的就是你的目标蛋白,所以每次处理都要把上清和沉淀跑电泳对比,免得把目标蛋白弄丢了。
