高中化学奥林匹克竞赛 专题二 溶液练习
化学溶液测试题及答案(K12教育文档)

化学溶液测试题及答案(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(化学溶液测试题及答案(word 版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为化学溶液测试题及答案(word版可编辑修改)的全部内容。
第九单元《溶液》测试题(一)说明:1.本试卷包含选择题(第1题~第20题,共40分)、非选择题(第21题~第27题,共60分)两部分。
本卷满分100分,考试时间为90分钟。
2.可能用到的相对原子质量: H :1 Cl: 35.5 Zn : 65第Ⅰ卷(选择题 40分)一、选择题(本大题包括20个小题,每小题只有一个选项符合题意,请将正确答案的序号填到第Ⅱ卷的表格中。
)1、下列各组物质中前一种是溶液,后一种是化合物的是()A、酒精、二氧化碳B、稀硫酸、液氧C、汽水、干冰D、冰水混合物、氧化铜2、下列说法不正确的是()A、厨房洗涤剂清洗油污后形成溶液B、用硬水洗衣服不如用软水洗得干净C、硝酸铵溶于水制得的冰袋可用于给高烧病人降温D、冬季向公路上的积雪撒盐,可使冰雪快速融化3、在实验室,有一瓶失去标签的蒸馏水和一瓶失去标签的氯化钾溶液,鉴别它们的正确方法是()A.尝液体的味道 B.蒸发液体看是否结晶C.加入白色硫酸铜粉末 D.看颜色4、炎热的夏天,小林打开冰箱,从4℃的储藏室中拿出一杯内有少量蔗糖晶体的溶液m.在室温下放置一段时间后,发现晶体消失了。
得到溶液n.下列说法正确的是()A .4℃时 m溶液一定是饱和溶被 B.室温下,n溶液一定是饱和溶液C。
蔗糖晶体的溶解度随温度的升高而降低D.m溶液的溶质的质量分数大于n溶液的溶质的质量分数5、下列变化属于化学变化的是()A.蔗糖溶解于水 B.食盐水蒸干后出现白色粉末C.饱和石灰水升温后变浑浊 D.澄清石灰水在空气中表面形成一层白膜6、据文字记载,我们的祖先在神农氏时代就开始利用海水晒盐.海水晒盐的原理是( )A。
高中化学奥林匹克竞赛辅导

高中化学奥林匹克竞赛辅导-无机元素化学习题2氧族元素1. 写出臭氧与下列物质发生反应的化学方程式(1) 在酸性溶液中I-到I2。
(2) S到硫酸(在水存在下)(3) [Fe(CN)6]4-到[Fe(CN)6]3- (在碱性介质中)2. 写出H2S与Fe3+、MnO4-、Br2和Cr2O72-反应的离子方程式(在酸性条件下)3. 用化学方程式表示以下各反应(1) 过氧化氢在酸性介质中与高锰酸钾溶液的反应(2) CaS5与盐酸反应(3) SO2(OH)Cl与水反应(4) PCl5和SO2反应(5) 二氯氧化硫(VI)慢慢地加入硫氢化钾(KHS)的水溶液内(6) 硫代硫酸钠溶液与碘反应(7) 亚硫酸钠溶液与碘的反应(8) 以过量的硫代硫酸盐处理酸化的碘酸钾溶液4. 用化学方程式表示以下各物质发生的作用(1) 通二氧化硫于二氧化硒的稀硝酸溶液中(2) 用盐酸酸化多硫化铵(3) 三硫化二铬溶于水(4) 通H2S于三氯化铁溶液中(5) 金溶于浓热的硒酸中5. 从标准电极电位看φөH2O2/H2O(+1.776V)>φөMnO4-/Mn2+(+1.491V)>φөCl2/Cl-(+1.358V)但为什么H2O2遇KMnO4和Cl2时都起还原剂的作用?写出相应的离子方程式。
6. 实验室中制备H2S气体,为何用FeS与盐酸反应?而不用CuS与盐酸反应?也不用FeS与硝酸反应?H2S在空气中长期放置为什么变浑浊?7. 画出下列各阴离子的结构式:S2O32-,S2O42-,S2O62-,S2O82-8. 为什么氧的单质分子是O2,而硫的单质分子是S8?9. 为什么SOCl2既可以作Lewis酸,又可以作Lewis碱?在SeOCl2Py2中Se原子采取什么杂化类型,说明Se与每个配位原子的成键类型,并画出该分子所有可能的几何构型。
()10. 试解释:(1) S2Cl2与H2O2的结构式相似(2) SO2有偶极距,但SO3没有偶极距(3) 亚稳态的紫色的S2具有顺磁性11. 硫代硫酸钠为何可用作卤素、重金属离子,氰化物中毒的解毒剂?硫代硫酸钠溶液在保存时,为何加入微量的Na2CO3,以保持溶液偏碱性?12. 一种盐A溶于水,在水溶液中加入稀盐酸,有一种刺激性气体B生成,同时有黄色沉淀C析出,该气体B能使KMnO4溶液退色。
高中化学溶液的试题及答案

高中化学溶液的试题及答案一、选择题(每题3分,共30分)1. 下列物质中,属于电解质的是()A. 蔗糖B. 乙醇C. 氯化钠D. 二氧化碳2. 溶液的浓度是指()A. 溶液的质量B. 溶液的体积C. 溶质的质量分数D. 溶液的密度3. 溶液的酸碱性可以通过()来测定。
A. 温度计B. 密度计C. pH试纸D. 比重计4. 以下物质中,不能形成溶液的是()A. 食盐水B. 植物油C. 糖水D. 盐水5. 饱和溶液是指()A. 溶液中已经不能再溶解更多的溶质B. 溶液中溶质的质量比溶剂的质量大C. 溶液中溶质的质量比溶剂的质量小D. 溶液中溶质的质量与溶剂的质量相等6. 溶液的稳定性与下列哪个因素无关?()A. 温度B. 压力C. 溶质的性质D. 溶液的颜色7. 配制一定浓度的溶液时,需要使用的仪器是()A. 烧杯B. 量筒C. 滴定管D. 所有选项8. 溶液的稀释过程中,溶质的质量()A. 增加B. 减少C. 不变D. 无法确定9. 以下哪种物质不属于酸?()A. 盐酸B. 硫酸C. 氢氧化钠D. 醋酸10. 溶液的导电性与下列哪个因素有关?()A. 溶质的浓度B. 溶质的类型C. 溶剂的类型D. 所有选项二、填空题(每题4分,共20分)1. 溶液的酸碱性通常用______来表示。
2. 当溶液的pH小于7时,溶液呈______性;当pH大于7时,溶液呈______性。
3. 饱和溶液与不饱和溶液的区别在于______。
4. 溶液的稳定性与溶质的______和溶剂的______有关。
5. 配制一定浓度的溶液时,需要准确测量溶质的______和溶剂的______。
三、简答题(每题10分,共20分)1. 请简述溶液的均一性和稳定性的特点。
2. 为什么说溶液是混合物?四、计算题(每题10分,共30分)1. 某学生配制了100mL 0.1mol/L的氯化钠溶液,求该溶液中氯化钠的质量。
2. 已知某溶液的pH值为3,求该溶液中氢离子的浓度。
高考化学 奥林匹克竞赛习题

【高中化学】奥林匹克竞赛练习题
第一部分 无机化学
4.已知反应:
HCl + HAc
H2Ac+ + Cl (在冰醋酸溶液中进行)的平衡常数为 2.8 10-9,又知
HAc 的自偶电离后的离子积常数为 3.6 10-15,试计算 1.0 10-4 moldm-3 的 HCl 的 HAc 溶
液中、H2Ac+、Cl、Ac的浓度。
5.氢氧化银(AgOH)不溶于水(Ksp=1.0 10-8)。试设计一种简单的定性实验来确定 AgOH
(14) PbO2 + Mn2+ MnO4- + Pb2+
(15) CrO42- + S2O32- + H+ SO42- + Cr3+ + H2O
4.在开采硫铁矿地区,开采出的矿石暴露在空气中,逐渐被氧化,有关的反应可表示如下:
Fe2+
+
S 2- 2
②
③
FeS2(s) + O2 ①
SO42- + Fe2++ O2
(1) 在碱性溶液中,溶解氧与 Mn(OH)2 反应
(2) 在酸性条件下,Mn(III)水合氧化物与碘离子反应
(3) 碘与硫代硫酸钠溶液反应
9.四氮化四硫(S4N4)是氮化硫类化合物中的一个。它可由二氯化二硫和氨合成为橙色晶体,
高中化学溶液的试题及答案

高中化学溶液的试题及答案一、选择题1. 下列物质中,不属于溶液的是:A. 盐水B. 牛奶C. 糖水D. 果汁答案:B2. 溶液的浓度可以用质量分数来表示,质量分数是指:A. 溶质质量与溶剂质量之比B. 溶质质量与溶液总质量之比C. 溶剂质量与溶质质量之比D. 溶剂质量与溶液总质量之比答案:B3. 饱和溶液与不饱和溶液的区别在于:A. 溶质的多少B. 溶剂的多少C. 温度的高低D. 溶质能否继续溶解答案:D二、填空题4. 溶液的均一性指的是溶液中各部分的_________和_________完全相同。
答案:组成;性质5. 当温度升高时,大多数固体溶质的溶解度会_________,但极少数固体溶质的溶解度会_________。
答案:增大;减小三、简答题6. 解释什么是溶液的饱和度,并举例说明。
答案:溶液的饱和度是指在一定温度下,一定量的溶剂中能够溶解某种溶质的最大量。
当溶液中溶质的浓度达到最大值,无法再溶解更多的溶质时,该溶液就称为饱和溶液。
例如,食盐在水中的溶解度在室温下是有限的,当食盐的量超过这个限度时,即使继续搅拌,食盐也不会再溶解,此时的溶液就是饱和溶液。
四、计算题7. 已知某溶液的质量分数为20%,溶液总质量为100g,求溶质的质量。
答案:溶质的质量 = 溶液总质量× 质量分数= 100g × 20% =20g8. 如果将上述溶液蒸发掉50g水后,求剩余溶液的质量分数。
答案:剩余溶液的质量分数 = (溶质质量 / (溶液总质量 - 蒸发掉的水的质量)) × 100% = (20g / (100g - 50g)) × 100% = 40%五、实验题9. 设计一个实验来证明溶液的均一性。
答案:实验步骤如下:- 取一定量的溶液放入试管中。
- 在试管的不同高度取样,分别滴入几个干净的试管中。
- 将这些试管中的溶液分别进行蒸发,观察是否有沉淀物形成。
- 如果所有试管中都没有沉淀物形成,说明溶液具有均一性。
【化学】化学《溶液》专项习题及答案解析及解析

【化学】化学《溶液》专项习题及答案解析及解析一、选择题1.甲和乙两种固体的溶解度曲线如图所示.下列说法中,正确的是A.10℃时,甲的溶解度大于乙的溶解度B.通过降温可以将甲的饱和溶液变为不饱和溶液C.20℃时,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数D.30℃时,分别在100g水中加入40g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液【答案】D【解析】A.10℃时,甲的溶解度小于乙的溶解度,不是大于,故A错误;B.通过升温可以将甲的饱和溶液变为不饱和溶液,不是降温,故B错误;C.20℃时,在甲乙的饱和溶液中,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数,必须指明在饱和溶液中,故C 错误;D.30℃时,分别在100g水中加入40g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液,因为在20℃,甲、乙的溶解度相等,都是40g,故D正确;故选D。
点睛:根据题目信息和溶解度曲线可知:甲、乙两种固体物质的溶解度,都是随温度升高而增大,10℃时,甲的溶解度小于乙的溶解度;通过升温可以将甲的饱和溶液变为不饱和溶液;20℃时,在甲乙的饱和溶液中,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数;30℃时,分别在100g水中加入40g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液,因为在20℃,甲、乙的溶解度相等,都是40g。
2.盐场晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,它们的溶解度曲线如下图所示。
下列说法正确的是A.MgSO4的溶解度始终随温度的升高而减小B.t1℃时,KCl和MgSO4两溶液所含溶质质量一定相等C.t2℃时,100gMgCl2的饱和溶液中含有agMgCl2D.将t1℃时的KCl饱和溶液升温到t2℃,溶液由饱和变为不饱和【答案】D【解析】【分析】【详解】A、由溶解度曲线可知,MgSO4的溶解度不是始终随温度的升高而减小,故A错误;B、t1℃时,氯化钾和硫酸镁的溶解度相等,如果两种溶液是饱和溶液,并且溶液质量相等,则溶质质量一定相等,但题目未告知两溶液质量是否相等,故B错误;C、t2℃时,溶解度的含义是100g水中最多能溶解ag氯化镁,因此100gMgCl2的饱和溶液中含有氯化镁的质量小于ag,故C错误;D、氯化钾的溶解度随着温度的升高而增大,将t1℃时的KCl饱和溶液升温到t2℃,溶液由饱和溶液变成不饱和溶液,故D正确。
高中化学奥林匹克竞赛辅导讲座:第2讲《溶液》
高中化学奥林匹克竞赛辅导讲座第2讲溶液【竞赛要求】分散系。
胶体。
溶解度。
亨利定律。
稀溶液通性。
溶液浓度。
溶剂(包括混合溶剂)。
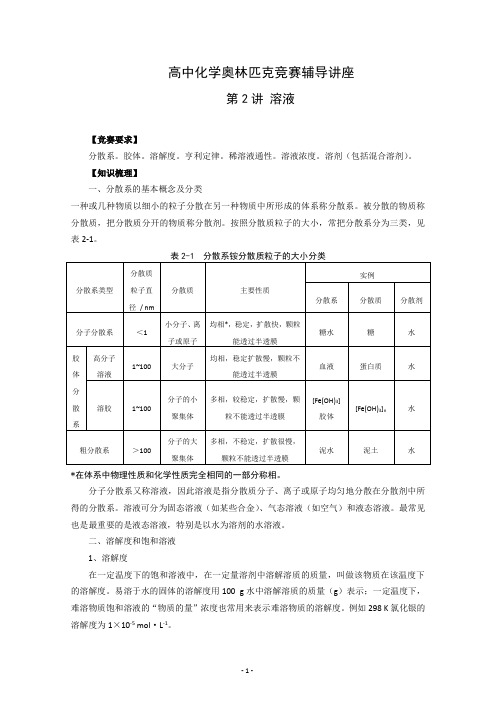
【知识梳理】一、分散系的基本概念及分类一种或几种物质以细小的粒子分散在另一种物质中所形成的体系称分散系。
被分散的物质称分散质,把分散质分开的物质称分散剂。
按照分散质粒子的大小,常把分散系分为三类,见表2-1。
*在体系中物理性质和化学性质完全相同的一部分称相。
分子分散系又称溶液,因此溶液是指分散质分子、离子或原子均匀地分散在分散剂中所得的分散系。
溶液可分为固态溶液(如某些合金)、气态溶液(如空气)和液态溶液。
最常见也是最重要的是液态溶液,特别是以水为溶剂的水溶液。
二、溶解度和饱和溶液1、溶解度在一定温度下的饱和溶液中,在一定量溶剂中溶解溶质的质量,叫做该物质在该温度下的溶解度。
易溶于水的固体的溶解度用100 g水中溶解溶质的质量(g)表示;一定温度下,难溶物质饱和溶液的“物质的量”浓度也常用来表示难溶物质的溶解度。
例如298 K氯化银的溶解度为1×10-5 mol·L-1。
2、饱和溶液在一定温度下,未溶解的溶质跟已溶解的溶质达到溶解平衡状态时的溶液称为饱和溶液。
在饱和溶液中,存在着下列量的关系:溶质的质量= 常数溶液的质量溶质的质量= 常数溶剂的质量3、溶解度与温度溶解平衡是一个动态平衡,其平衡移动的方向服从勒沙特列原理。
一个已经饱和的溶液,如果它的继续溶解过程是吸热的,升高温度时溶解度增大;如果它的继续溶解过程是放热的,升高温度时溶解度减小。
大多数固体物质的溶解度随温度的升高而增大。
气体物质的溶解度随着温度的升高而减小。
4、溶解度与压强固体或液体溶质的溶解度受压力的影响很小。
气体溶质的溶解度受压力影响很大。
对于溶解度很小,又不与水发生化学反应的气体,“在温度不变时,气体的溶解度和它的分压在一定范围内成正比”,这个定律叫亨利(Henry)定律。
其数学表达式是:C g = K g·p g (2-1)式中p g为液面上该气体的分压,C g为某气体在液体中的溶解度(其单位可用g·L-1、L(气)·L1 (水)、mol·L-1表示),K g称为亨利常数。
_2016年上学期高一化学奥赛培训习题集(2)

高一化学奥赛培训习题集(2)一、选择题1.某溶液中可能含有Na +、Ca 2+、Br -、2-3CO 、I -、2-3SO 六种离子中的几种。
①在该溶液中滴加足量氯水后,有气泡产生、溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl 2溶液时无沉淀生成;③橙黄色溶液不能使淀粉溶液变蓝。
根据上述实验事实推断,在该溶液中肯定都存在的离子组是( )A .Na +、Br -、2-3CO B .Na +、2-3SO 、I -C .Ca 2+、I -、2-3SO D .Ca 2+、2-3CO 、Br -2.若将100g 物质的量浓度为18.4 mol·L -1、密度为ρ的浓硫酸稀释成9.2 mol·L -1的硫酸,则所加水的体积为( )A .100mLB .小于100mLC .大于100mLD .等于100g/ρ 3.有些反应从表面上看不能进行。
如:① KClO 4 + H 2SO 4→HCIO 4 + KHSO 4 ②Na + KCl→NaCl + K ③ Mg +2RbCl→MgCl 2 +2Rb ④ KCl + NaNO 3→NaCl + KNO 3而实际生产中恰好被用来制取带横线的物质。
这4个反应中所利用的反应原理相同的是( ) A . ①④ B . ②④ C .①③④ D . ①②③4.将两种硫酸盐按一定比例混合后共熔,制得化合物X ,X 溶于水能电离出K +、Cr 3+、2-4SO ,若将2.83 g X 中的Cr 3+全部氧化为2-27Cr O 后,溶液中的2-27Cr O 和过量KI 溶液反应,得3.81 g I 2,反应的离子方程式为:2+3+2722Cr O +6I +14H =2Cr +3I +7H O --,若向溶有2.83 g X 的溶液中,加入过量的BaCl 2溶液,可得到4.66 g 白色沉淀.由此可推断出X 的化学式为( ) A .242243K (SO ) Cr (SO ) B .242432K SO Cr (SO ) C .24243K SO Cr (SO ) D .242431K SO Cr (SO )25.将固体MnC 2O 4·2H 2O 放在坩锅里加热,固体质量随温度变化的数据如下表:温度/℃ 25 50 75 100 214 280固体质量/g17.917.916.014.314.37.15下列说法错误的是( )(MnC 2O 4摩尔质量143g/mol ) A .25℃~50℃,MnC 2O 4·2H 2O 未发生变化 B .75℃时,MnCO 4·2H 2O 部分失去结晶水 C .100℃时,坩锅内固体均为MnC 2O 4 D .200℃时,坩锅内固体为混合物6.把NH4Cl从几乎饱和NaHCO3溶液中分离出来是联合制碱法中的关键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题二溶液
学号姓名得分
1、现有50 g 5 %的硫酸铜溶液,要使其溶液浓度提高至10 %,应该采取措施有:
(1)可蒸发水 g。
(2)加入12.5 %的硫酸铜溶液 g。
(3)加入无水硫酸铜粉末 g。
(4)加入蓝矾晶体 g。
2、在1 L水中溶解560 L(标准状况)的氨气,所得氨水的密度是0.9 g/cm3,该氨水溶液的质量分数是(1),物质的量浓度是(2),质量摩尔浓度是(3),摩尔分数是(4)。
3、分子的相对质量为M,化学式为A的物质(不含结晶水),在温度t1℃时,用W g水配制成饱和溶液,该溶液中若按物质的量计算,A占a %,问:
(1)t1℃时该物质的溶解度为若干?
(2)当温度降至t2℃时,析出A·n H2O结晶多少克?(已知t2℃时每克水中能溶解S g 该物质)。
(3)t2℃时,剩余溶液的溶质质量分数为若干?
(4)若A是Na2CO3,将t2 = 373 K,W = 180g,a % = 6.96 %,t2 = 393 K,S = 0.22,n = 10,分别代入(1)、(2)、(3)题所得关系式中得到什么结果?
4、已知CO2过量时,CO2与NaOH反应生成NaHCO3(CO2+NaOH=NaHCO3)。
参照物质的溶解
度,用NaOH(固)、CaCO3(固)、水、盐酸为原料制取33 g纯NaHCO3。
(1)若用100 g水,则制取时需用NaOH g。
(2)若用17.86 g NaOH(固),则需用水 g。
5、下表是四种盐的溶解度(g)。
请设计一个从硝酸钠和氯化钾制备纯硝酸钾晶体的实验(要求写出化学方程式及实验步骤)。
6、下面是四种盐在不同温度下的溶解度(g /100g 水)
(计算时假定:①盐类共存时不影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计) 取23.4 g NaCl 和40.4 g KNO 3,加70.0 g H 2O ,加热溶解,在100℃时蒸发掉50.0 g H 2O ,维持该温度,过滤析出晶体。
计算所得晶体的质量(高温m );将滤液冷却到10℃,待充分结晶后、过滤,计算所得晶体的质量(低温m )。
7、25℃时,水的饱和蒸气压为3.166 kPa ,求在相同温度下5.0 %的尿素[CO(NH 2)2]水溶液的饱和蒸气压。
8、烟草的有害成分尼古丁的实验式是C 5H 7N ,今将496 mg 尼古丁溶于10.0 g 水中,所得溶液的沸点是100.17℃。
求尼古丁的分子式。
(水的K = 0.512 K ·kg ·mol -1
)
9、把1.00 g 硫溶于20.0 g 荼中,溶液的凝固点为351.72 K ,求硫的分子量。
10、在1.00 dm 3
溶液中,含有5.0 g 马的血红素,在298 K 时测得溶液的渗透压为1.82×102
Pa ,求马的血红素分子量。
11、含I 2的水溶液100 mL ,其中含I 2 10.00 mg ,用90 mL CCl 4按下述两种方法进行萃取:
( 1)90 mL 一次萃取;(2)每次用30 mL ,分三次萃取。
试比较其萃取效率(K = c 42
CCi I /c O H I
22
= 85)。
12、已知A + B → C + 水。
t ℃、A 、B 、C 三种物质的溶解度分别为S 1、S 2、S 3 g 。
现取
t ℃时A 的饱和溶液M g ,B 的饱和溶液N g ,混合后恰好完全反应生成C 物质P g 。
(1)求反应中生成水多少g ?
(2)通过计算推断:在此反应中C 物质沉淀的条件是什么?
专题二 参考答案:
1、(1)25 g (2)100 g (3)2.78 g (4)4.63 g
2、(1)29.82 % (2)15.79 mol / L (3)25 mol / kg H 2O (4)0.31
3、(1)
)
100(18100a Ma - (2)nS M SW m n M 18)(18--+ (3)S S
+1×100% (4)44.1;171;18.03
4、(1)20 (2)50
5、化学方程式为:NaNO 3+KCl
KNO 3+NaCl
步骤如下:①将NaNO 3和KCl 按化学方程式中要求的用量用水加热溶解。
加热至沸,不断搅拌,蒸发水分。
当析出晶体时,趁热过滤,晶体必为NaCl ,因在100℃其溶解度最小。
接收滤液容器中预先加入少量蒸馏水,预防NaCl 饱和液降温时析出。
②由于过滤出NaCl 晶
体,上述反应强烈向右进行,当滤液冷却后析出大量KNO 3(因其溶解度随温度下降迅速降低)时,过滤,得KNO 3晶体。
③将所得KNO 3用少量水加热溶解,冷却后析出较纯的KNO 3,过滤。
滤液含NaCl 及KNO 3。
可重复第③步,获得更纯的KNO 3。
6、100℃析出的NaCl 质量:高温m =15.58克 10℃析出NaCl 晶体质量为:0.68克;析出KNO 3晶体的质量为36.22克;析出晶体总质量低温m =36. 9克
7、利用p = p 0A ·x A
p = p 0A ·
B
A A n n n += 3.166×60/0.518/0.9518
/0.95+ = 3.12 k Pa
8、解:利用△T ≈ K ·b 求解
(273.15 + 100.17)-(273.15 + 100.00) = 0.512×
1000
/0.10/496.0M
512.017.0 = M
0100.0496.0 ; M = 1.5×102 g ·mol -1
9、利用△T f ≈K f ·b 353.00-351.72 = 6.90×1000
/0.20/00.1M ; M = 270 g ·mol -1
故M =270
10、利用π=V
n RT
0.182 =
00
.1/0.5M ×8.31×298 ;M = 6.8×104 g ·mol -1 故M = 6.8×104
11、(1)用90 mL 一次萃取时,
m 1 = 10.00 ×(100
9085100
+⨯)= 0.13 mg
E =
00
.1013
.000.10-×100% = 98.7 %
(2)每次用30 mL ,分三次萃取时,
m 3 = 10.00 ×(100
3085100+⨯)3
= 0.00054 mg
E =
00
.1000054
.000.10-×100% = 99.99%
由此可见,同样量的萃取溶剂,分几次萃取的效率比一次萃取的效率高。
12、(1)
11100S MS + + 2
2
100S NS +-P
(2)P >
100
)(3
S P N M -+。
