1-4-4-1氨 硝酸 硫酸1
【学海导航】安徽省高中化学(第1轮)总复习 第4章第16课时 氨 硝酸 硫酸(1)课件 新人教版

氨和铵盐
• 1.氨气和氨水氨气是无色、有刺激性气味
的气体,密度比空气小,易液化,极易溶
于水(常温常压下,1体积水约能溶解700
体积的氨气)。氨气能与水、氯化氢、氧
气等物质发生反应,其中与水反
• 应的产物NH3·H2O是一种弱碱。 • 氨水的性质:氨水是氨气溶于水形成的混
•
(4)氨的氧化反应是一个放热反应 有
红棕色气体产生
•
(5)4NH3+5O催2△化剂
4NO+6H2O
•
(6)NH4+ NO3-
•
已知甲、乙、丙均为常见气体,
其中甲在空气中含量最多,乙在相同条件下
密度最小,丙有刺激性气味,且一个丙分子 由四个原子构成。
• (1)实验室中可用下图A或B装置与相应的 药品制得丙。
Cu(OH)2↓,所以n(OH-)=2n(Cu2+),
• 因此V(NaOH)=
=0.06 L=60
mL。
(n NaOH)
(c NaOH)
答案:A .60 mL
• 如图所示,向一定量的铁粉中加入一定体 积12 mol·L-1的硝酸,加热充分反应后, 下列微粒在体系中一定存在的是B( )
• ①NO3- ②Fe3+ ③H+ ④NO ⑤NO2 • A.只有①
• (4)氨水密度小于水,当把氨水稀释 时,随质量分数的减小,氨水的密度增 大。
• +O(H5- )弱N O(碱4与性易,挥具发有的碱酸的反通应性产:生NH白3烟·H,2O可 用于检验氨气、氨水的存在)。氨水是很好
的沉淀剂,能使Al3+、Fe3+、Mg2+分别转化
成Al(OH)3、Fe(OH)3、Mg(OH)2沉 淀,但氨水中滴加Ag+溶液开始出现沉淀
人教高中化学必修1全册课件:第四节《氨硝酸硫酸》第一课时

一、氨 阅读材料:
2004年4月20日上午10时,杭州市一 制冷车间发生液氨泄漏事件,整个厂区 是白茫茫的一片,方圆数百米,空气中 弥漫着一股浓烈的刺激性气味。厂区内 寒气逼人。
思考:氨气有哪些物理性质?
[实 验4—8] 氨的性质,注意观察现象。
现象:烧杯中的水由玻璃导管进入 烧瓶形成红色的喷泉。
NH4Cl △= NH3 ↑ + HCl ↑ NH4HCO3 △= NH3 ↑ + H2O ↑ + CO2 ↑ (NH4)2CO3 △= 2NH3 ↑ + H2O ↑ + CO2 ↑
由上面的反应可以看出, NH4Cl 、 NH4HCO3、 (NH4)2CO3 受热都能分解,都有NH3产生,但不是所有的铵盐受热分 解都能产生NH3的,例如NH4NO3的分解:
2NH4Cl+Ca(OH)2=△=2NH3↑+2H2O+CaCl2
(3)制取装置:
固固加热装置
棉花的作用: 防止空气对流,保证 氨气纯度
④集气方法:向下排空气法
⑤验满方法: ①将湿润的红色石蕊试纸置于试管口(试纸变蓝) ②将蘸有浓盐酸的玻璃棒靠近试管口(白烟)
⑥干燥方法: 碱石灰(CaO和NaOH混合物)等碱性干燥剂 注意:无水CaCl2不能用来干燥NH3(形成CaCl2.8NH3)
小结:浓硫酸的脱水性是指浓硫酸能把有机物中 的氢氧原子按2∶1(H2O)的个数比脱去。
吸水性、脱水性的比较
性质
吸水性
脱水性
吸收物质中的游 吸收对 离水、水蒸气、 将有机物中的氢、氧
象 结晶水,直接与 元素按水的比例脱去 水分子结合
本
质
与水发生水合作 用,放出热量
必修1 第4章 第4节 氨 硝酸 硫酸 第1课时

氨极易溶于水,那么如果向盛有氨气的 瓶子中加入少量水,瓶子内压强如何变 化? 请根据此原理解释实验。 溶液为什么会变红? 溶液为什么会变红?说明什么?试从课本 上寻找答案。
氨水
化学学习的神器
H L D
思考
氨是一种酸碱 性怎样的气体? 性怎样的气体? HCl是一种酸碱 性怎样的气体? HCl是一种酸碱 性怎样的气体? 他们相遇会不会发生反应? 他们相遇会不会发生反应? 生成的物质是什么? 生成的物质是什么? 查阅课本,寻找答案。
氨 硝酸 硫酸
氨气及铵盐的性质
Duty Honor Love
化学学习的神器
H L D
观看并思考
氨气泄漏事故 据新闻报道来看, 氨气是一种怎样的气 体?具有那些性质?
无色Байду номын сангаас
刺激性气味 气体 (极)易溶于水 有一定毒性
化学学习的神器
H L D
猜想与验证
化学学习的神器
H L D
阅读记忆
阅读课本,据以下要点记忆氨气的制备。 1 反应原理 2 试管倾斜方式 3 氨气的收集方法 4 氨气的检验方法
化学学习的神器
H L D
小结
氨气 无色 刺激性气味 极易溶于水 碱性 铵盐 加热易分解(但不一定生成氨气) 加热易分解(但不一定生成氨气) 与碱共热放出氨气
化学学习的神器
H L D
作
业
完成学案
化学学习的神器
H L D
铵盐的受热分解
用方程式表达你看到的现象。 与加热碘有什么相同?有什么不同? 是不是所有的铵盐分解都是非氧化还原 反应?
化学学习的神器
H L D
观察并思考
观察实验,思考下面的问题: 观察实验,思考下面的问题: 1 产生的是什么气体?如何检验的? 产生的是什么气体?如何检验的? 2 你能用解释氨水显碱 性的理论来解释为 什么放入碱 并加热能够产生氨气? 并加热能够产生氨气? 3 据此原理,你觉得实验室若需制备氨气, 其原理应当是怎样的? 其原理应当是怎样的?
高中化学 氨、硫酸、硝酸

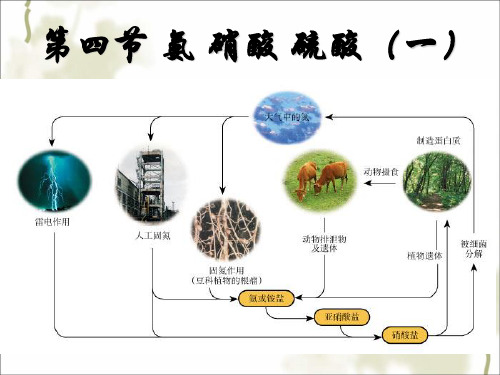
第四节氨硝酸硫酸课时1 氨气知识分层讲解学知识基础知识讲解敲黑板知识点 1 氨气【重点】1.氮的固定(1)氮元素的存在游离态:N2,占空气总体积的78%或总质量的75%。
氮元素化合态:硝酸盐等无机盐,蛋白质等有机物。
(2)氮的固定:将游离态的氮转变为氮的化合物叫做氮的固定。
【易错1】目前工业制取氨气的反应原理即人工固氮的反应。
2. 氨气的物理性质及喷泉实验(1)氨的物理性质①氨气是无色、有刺激性气味的气体。
②氨气的密度为0.771 g/L,比空气小;氨气极易溶于水,常温下,1体积水大约能溶解700体积NH3。
因此一般用向下排空气法收集氨气。
③氨气的沸点为-33.5℃,易液化,常用作制冷剂。
(2)氨气溶于水的喷泉实验示例1实验装置实验准备实验操作实验现象在干燥的圆底烧瓶中充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口,倒置烧瓶,使玻璃管插入盛有水(含酚酞)的烧杯中打开橡胶管上的夹子,轻轻挤压滴管的胶头使少量水进入烧瓶。
烧杯中的溶液由玻璃管进入烧瓶,形成美丽的喷泉,烧瓶内液体颜色呈红色。
氮的循环【易错1】在判断氮的固定时,学生往往把由气态的含氮化合物转化为固态的含氮化合物的过程认为是氮的固定。
如:由氨气合成碳酸氢铵的过程。
喷泉划重点:氨气喷泉实验的解释①能形成喷泉说明氨气极易溶于水,使烧瓶内的压强迅速减小,烧杯内的水在大气压的作用下进入烧瓶;烧瓶内液体呈红色,说明氨气溶于水得到的溶液呈碱性。
②氨气喷泉实验成功的关键是:①装置气密性良好;②圆底烧瓶要干燥;③装置内气体的纯度要高。
3. 氨气的化学性质(1)氨与水的反应氨气溶于水时,大部分NH3与H2O反应生成一水合氨(NH3·H2O);常温下,一水合氨中有一小部分(约1%)电离成NH4+和OH-,所以氨水显弱碱性,发生反应的化学方程式为:NH3+H2O NH3·H2O、NH3·H2O NH4++OH-,或表示为:NH3+H2O NH3·H2O NH4++OH-。
人教版高中化学必修一第四章第四节氨硝酸硫酸

(3)若V L烧瓶充满标况下的氨气,喷泉实验后溶液充满
整个烧瓶,所得溶液的物质的量浓度是
1 22.4
。mol/L
2、氨气的化学性质 (1)氨与水反应
NH3+H2O
NH3 H2O
NH4++OH-
关于氨水——氨的水溶液
① 氨水中含有的主要微粒有:
分子:H2O、NH3、NH3•H2O 离子:NH4+、OH注意:计算氨水的质量分数时,以NH3为溶质。 ② 氨水密度小于水(氨水浓度越大,密度越小)
③ NH3•H2O不稳定
△
NH3•H2O == NH3+ H2O
氨水是一种不稳定、易挥发的一元弱碱
讨论1:在1L 1mol/L的氨水中( D ) A、含有1mol NH3 B、含NH3和NH4+的物质的量之和为1mol C、含1mol NH3• H2O D、含NH3、 NH3• H2O和NH4+的物质的量之和为1mol
注意:NH4Cl受热分解,产生的气体冷却又生成NH4Cl,
NH4HCO3 NH3↑+H2O+CO2↑
都产生NH3,
△
非氧化还原反应
(NH4)2CO3 = 2NH3 ↑ + H2O + CO2 ↑
2NH4NO3△= 4H2O + 2N2 ↑ +O2 ↑ 无NH3产生,是氧化还原反应 注意:不是所有的铵盐受热分解都生成氨气。
保存:硝酸盛放于棕色瓶中,置于冷暗处
2、强氧化性
浓氨水 CaO
讨论2:通常情况下能大量共存,并且都能用浓硫酸和碱石灰
干燥的是( B )
A、NH3、NO、HCl C、H2S、SO2、O2
B、N2、H2、O2 D、NO、NO2、O2
高一化学第四节氨、硝酸、硫酸
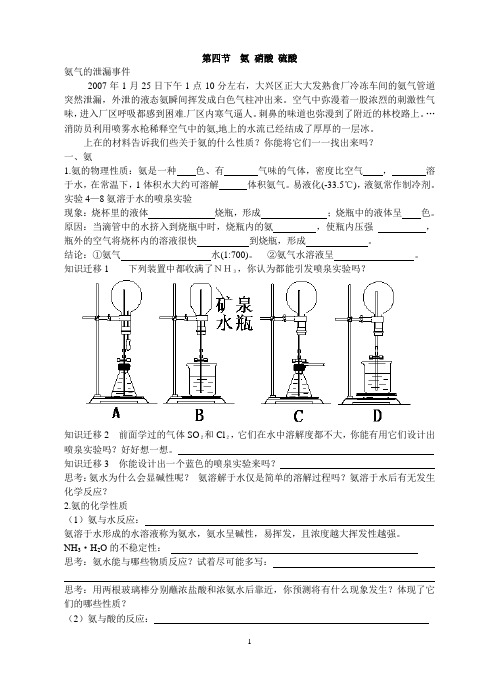
第四节氨硝酸硫酸氨气的泄漏事件2007年1月25日下午1点10分左右,大兴区正大大发熟食厂冷冻车间的氨气管道突然泄漏,外泄的液态氨瞬间挥发成白色气柱冲出来。
空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难.厂区内寒气逼人。
刺鼻的味道也弥漫到了附近的林校路上。
…消防员利用喷雾水枪稀释空气中的氨,地上的水流已经结成了厚厚的一层冰。
上在的材料告诉我们些关于氨的什么性质?你能将它们一一找出来吗?一、氨1.氨的物理性质:氨是一种色、有气味的气体,密度比空气,溶于水,在常温下,1体积水大约可溶解体积氨气。
易液化(-33.5℃),液氨常作制冷剂。
实验4—8氨溶于水的喷泉实验现象:烧杯里的液体烧瓶,形成;烧瓶中的液体呈色。
原因:当滴管中的水挤入到烧瓶中时,烧瓶内的氨,使瓶内压强,瓶外的空气将烧杯内的溶液很快到烧瓶,形成。
结论:①氨气水(1:700)。
②氨气水溶液呈。
知识迁移1 下列装置中都收满了NH3,你认为都能引发喷泉实验吗?知识迁移2 前面学过的气体SO2和Cl2,它们在水中溶解度都不大,你能有用它们设计出喷泉实验吗?好好想一想。
知识迁移3 你能设计出一个蓝色的喷泉实验来吗?思考:氨水为什么会显碱性呢?氨溶解于水仅是简单的溶解过程吗?氨溶于水后有无发生化学反应?2.氨的化学性质(1)氨与水反应:氨溶于水形成的水溶液称为氨水,氨水呈碱性,易挥发,且浓度越大挥发性越强。
NH3·H2O的不稳定性:思考:氨水能与哪些物质反应?试着尽可能多写:思考:用两根玻璃棒分别蘸浓盐酸和浓氨水后靠近,你预测将有什么现象发生?体现了它们的哪些性质?(2)氨与酸的反应:氨与酸反应生成铵盐。
铵盐又叫铵态氮肥。
思考:有一位农民看到自己买的一袋碳酸氢铵化肥受了潮,就在太阳底下晒,等他下午去取时,发现少了许多,是谁偷了他的氮肥?铵盐可以做氮肥体现了铵盐的什么物理性质?铵盐的性质①铵盐都易溶于水②铵盐受热易分解NH4HCO3受热:NH4Cl受热:③铵盐与碱反应(NH4)2SO4 + NaOH:实质:(离子方程式)NH4HCO3 + NaOH:实质:(离子方程式)一切铵盐的共同性质,实验室可利用这个性质来检验NH4+的存在。
人教版高中化学精品系列 必修一 氨气 课件
△
2NH3+H2SO4 ==(NH4)2SO4
催化剂
2 NO + O2 === 2NO2 3NO2 + H2O === 2HNO3 + NO
催化剂
△
制硝酸
2NH3+CO2 ==== CO(NH2)2+ H2O
NH3(g)
放热 吸热
制尿素
NH3(l) 制冷剂
NH3 水
酚酞
【实验现象】 : 烧杯中的水进入烧 瓶中,形成红色的 喷泉。 ——“ 喷 泉 实 验 ”
①烧瓶里为什么会形成喷泉? ②胶头滴管的作用是什么? ③烧瓶中的溶液为什么变成红色?
①烧瓶内外产生压强差。
②引发“喷泉”实验 ③水溶液呈碱性,有OH-离子存在。
一、氨(NH3): 1.氨的物理性质: 颜色: 无色 气味: 有刺激性气味 状态: 气体 密度: 比空气的密度小 水溶性:极易溶于水(1:700)
氨易液化.
2.氨气的化学性质: ⑴氨与水反应: NH3+H2O NH3· H2O 一水合氨
氨的溶解更主要的是化学反应。 氨溶于水时,大部分氨与水结合, 形成一水合氨(NH3· H2O)。
NH3· H2O可以部分电离形成NH4 和OH ,所以氨水显弱碱性。
NH3· H2O
NH3+H2O
+
NH4
NH3· H2O
++OH-
NH4++OH-
【小结】:氨水的成分 分子:NH3、H2O、NH3· H2 O 离子:NH4+、OH-等
【探究实验】:
将氨的酚酞溶液倒入栓有小气球的试管 中,加热。
高中化学必修1 第四章 第四节 氨 硝酸 硫酸

(2)强氧化性: 浓硝酸和稀硝酸都能与铜发生反应: • 4HNO3(浓)+ Cu ═ Cu(NO3)2 + 2NO2 ↑ + 2H2O
H2SO4 ═
Zn H2SO4 +
Cu(OH)2 CuO BaCl2
2H+ + SO42变红
ZnSO4 + H2↑
CuSO4 + 2H2O CuSO4 + H2O BaSO4 +
@皮皮课件
紫色石蕊试液
2HCl
17
第二章 硫酸和硝酸的氧化性
2.2 硫酸 A.浓硫酸的特性:
① 吸水性:
向蔗糖中加入浓硫酸时,蔗糖变黑,体积 膨胀,变成疏松多孔的海绵状炭,并放出 刺激性气味。
@皮皮课件
20
第二章 硫酸和硝酸的氧化性
2.2 硫酸
小贴士
有些气体可以用浓硫酸干燥,有些气体却不能用浓硫酸干燥:
能用浓硫酸干燥的气体: H2、O2、N2、CO、CO2、CH4、SO2、HCl、Cl2
不能用浓硫酸干燥的气体:
① 碱性气体(NH3) ② 还原性气体(H2S、HI、HBr)
@皮皮课件 21
• 氧化非金属单质:
加热盛有浓硫酸和木炭的试管,碳就被氧化成二 氧化碳,而硫酸被还原为二氧化硫。
C + 2H2SO4(浓)
==
CO2↑ +
2SO2↑ + 2H2O
@皮皮课件
24
第二章 硫酸和硝酸的氧化性
2.4 硫酸的用途
@皮皮课件
25
第二章 硫酸和硝酸的氧化性
2.5 硝酸
(1)不稳定性(易分解): 4HNO3 ═ 4NO2 + 2H2O + O2↑
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子: NH4+
OH-Байду номын сангаас
在氨水溶质的质量分数、物质的量浓度计算
时, 以NH3为溶质
氨水的密度: ρ小于1g/cm3 , ω越大, ρ越小.
氨水与液氨的对比: 名 称 形 成 氨 水
氨气溶于水 混合物
液 氨
氨气降温加压液化
纯净物(非电解质) NH3
物质分类
H2O、NH3、 H 微粒种类 NH3· 2O NH4+ OH-
催化剂
4NH3 + 5O2
高温
4NO+6H2O
工业制硝酸的重要步骤
③氨的用途 铵盐 纯碱 NH3
有机合成工业原料
硝酸 用稀氨水治疗 蚊虫叮咬 消除 二氧化 氮 的污染
吸收硫酸 生产中的 二氧化硫
致冷 剂
动脑:
通过今天的学习, 若当你遇到氨气泄漏事 故, 你将如何应对? 在遇到氨气泄漏时, 应该马上疏散到室外, 最
a. 装置的气密性好;b. 气体的纯度高;
c. 烧瓶必须干燥。
思考
3. 从上述实验来看, 溶液都
不能完全充满烧瓶, 为什么?
收集到的氨气中混有空气
探究
(4)滴有酚酞的溶液变
为红色说明什么? 氨气溶于水, 溶液显碱性。
②化学性质
(1)氨跟水的反应
NH3· 2O==NH3↑+H2O H 氨水的成份: 分子: NH3· 2O NH3 H2O H
好到开阔地带, 并站在上风头。
在撤离时, 最好准备一块湿毛巾捂住嘴巴。 如果是在距离水面比较近的地方, 就尽量跑 到水边, 因为氨气溶于水。
思考
如图所示,在一盛有 蒸馏水的烧杯中有一 悬浮的小球(小球不会 被酸碱腐蚀),当向烧 杯中不断通入氨后,会 出现什么现象?
第四章
第四节
氨 硝酸 硫酸 (1)
周广林
2010.1
1918年, 德国化学家哈伯因为在合成
氨方面的巨大贡献而获诺贝尔化学奖.
1931年, 诺贝尔化学奖再次垂青于与 合成氨有关的研究。
哈尔滨氨气泄漏数百人紧急疏散
2007年9月17日10时40分许,在南岗区 学府路287号附近,一冷冻厂内的供液管出 从这则新闻可知氨气 有哪些物理性质? 现漏点,致使部分氨气泄漏,厂内工人及附 近群众数百人被疏散,11时许,记者赶到事 故发生现场,进入厂区后,一股浓烈的气味 扑鼻而来,让人感到呼吸困难, 记者的双 眼被熏得泪流不止。
一、氨
1. 氨的性质 ①物理性质 无色、有刺激性气味气体, 密度比空气小, 易液化, 极易溶
于水(1:700)。
探究:喷泉实验
探究
(1)氨为什么会形成喷泉?
氨气极易溶于水,使烧瓶内压强减小,
瓶内外形成较大的压差; 大气压将水压入
烧瓶.
思考
1. 形成喷泉的原理?
烧瓶内外形成压强差 2. 喷泉实验成功的关键?
思考
氨能否与酸反应?
(2)氨跟酸的反应 NH3+HCl = NH4Cl (现象: 白烟) NH3+HNO3 = NH4NO3
(现象: 白烟) 2NH3+H2SO4 = (NH4)2SO4 NH3+H+=NH4+(与酸反应的本质)
分析NH3中N元素化合价,推断 NH3应该具有什么性质? (3)还原性:
