述最终灭菌的小容量注射剂生产工艺流程及区域划分
最终灭菌小容量注射剂通用工艺规程

最终灭菌小容量注射剂通用工艺规程###动物药业有限公司GMP管理文件药生产质量管理规范》的要求,产品质量符合产品法定质量标准的规定。
二、适用范围:适用于最终灭菌小容量注射剂通用生产工艺管理。
三、责任者:技术部负责人、生产部负责人、质管部负责人、车间主任、QC检验员、QA检查员。
四、内容目录:一、产品简介 (2)二、工艺流程及环境区域划分 (2)三、处方和依据 (3)四、操作过程及工艺条件 (3)五、设备一览表及主要设备生产能力 (6)六、技术安全、劳动保护及卫生要求 (7)七、包装要求、标签说明书管理与产品贮存方法 (9)八、劳动组织与定岗定员 (9)九、产品质量标准 (10)十、各工序质量控制要点和检查方法 (10)十一、消耗定额、技术经济指标、物料平衡以及各项指标的计算方法 (13)十二、产品相关验证的具体要求 (14)十三、主要标准操作规程(SOP)名称及要求 (16)十四、附录(常见理化常数、曲线、图表、计算公式及换算表等) (21)十五、附页(变更记录) (22)一、产品简介包括产品名称(通用名、商品名)、批准文号、剂型、规格和包装等,这些都必须以国家法定质量标准或国家兽药行政管理部门所批准的为准。
二、工艺流程及环境区域划分100000级区10000级区三、处方和依据1 处方:根据具体产品处方而定,详见产品工艺规程。
2 依据:根据具体产品执行标准而定,详见产品工艺规程。
四、操作过程及工艺条件1 瓶处理:1.1 批生产制造指令下达后到理瓶前,操作人员按最终灭菌小容量注射剂领料岗位操作规程,领取经质管部检验合格的安瓿。
1.2 操作人员严格按最终灭菌小容量注射剂瓶处理岗位操作规程、冷瓶岗位操作规程对领取的安瓿进行理瓶、瓶粗洗、瓶精洗、干燥灭菌和冷瓶操作。
1.3 洗净的安瓿在存放和传送时,应有防止污染的措施。
1.4 瓶处理工艺参数:1.4.1 第一生产线:粗洗纯化水水温35℃、电机转速600转/分、超声波旋钮400~500;精洗安瓿的注射用水须用孔径为0.45μm滤芯过滤且澄明度合格;粗洗和精洗各进行1次,洗后用甩水机甩干;除最后一盘外,其余瓶盘都必须按最大装载量进行装载,安瓿干燥灭菌温度为320℃,恒温时间为5分钟。
小容量注射剂工艺规程

一、概述:最终灭菌小容量注射剂(水针剂)是装量小于50 ml,采用湿热灭菌法制备的最终灭菌注射剂,除一般理化性质外,无菌、热原或细菌内毒素、澄明度、pH 值等项目检查均应符合规定。
根据GMP要求制定最终灭菌小容量注射剂****注射液生产工艺规程,规范整个生产操作过程,确保在正常的生产条件下,生产出合格、均一、稳定的小容量注射剂****注射液产品。
二、产品名称、剂型、规格、代码1.产品名称1.1.通用名称:___1.2.英文名称:___拼音名称:___2.产品代码:___3.产品剂型:小容量注射液4.规格及批准文号:___4.1.产品规格:___4.2.包装规格:纸箱___4.3.批准文号:___国药准字H三、生产处方及依据1.处方处方量 (_)万支(_)万支原料_________辅料_________注射用水加至__ml __ml2.批量:最大量:_ml 支最小量_ml 支最大量:_ml 支最小量_ml 支3.依据:《中国药典》2010年版二部《产品注册要求文件》四、生产工艺流程及环境区域划分五、操作过程及工艺条件1、纯化水制备将饮用水经石英砂过滤和活性碳过滤去除水中有机质及微粒,再经过阳离子交换柱(软化器)制的软化水,精密过滤器过滤后经二级反渗透制得纯化水。
1.1.纯化水制备操作过程:饮用水→机械过滤→活性炭过滤→精密过滤→阳离子交换柱→一级反渗透→二级反渗透→贮罐→至各用水点。
1.2. 纯化水制备工艺条件1.2.1、纯水制备以合格饮用水为水源,纯化水水质≤2.0us/cm或≥0.5Ω/cm。
1.2.2、纯化水贮存在密闭不锈钢(316L)罐。
1.2.3纯化水制备存放时间不超过72小时。
1.2.4纯化水经紫外灯灭菌用泵输送至各使用点,各使用点使用前须安装0.45um 和0.22um滤芯(膜)过滤后使用。
1.2.5反渗透装置在进口处须安装保安过滤器。
1.2.6机械过滤器和活性炭过滤器正常工作时每班生产前进行反冲一次。
小容量注射剂生产工艺流程图及流程说明
注射用水为蒸馏水或去离子水经蒸馏所得的水,又称重蒸馏水。其质量要求见《中国药典》,除氯化物、硫酸盐、钙盐、硝酸盐、亚硝酸盐、二氧化碳、易氧化物、不挥发物与重金属按蒸馏水检查应符合规定外,还规定pH应为5.0~7.0,氨含量不超过0.00002%,热原检查应符合规定,应于制备后12h内使用。
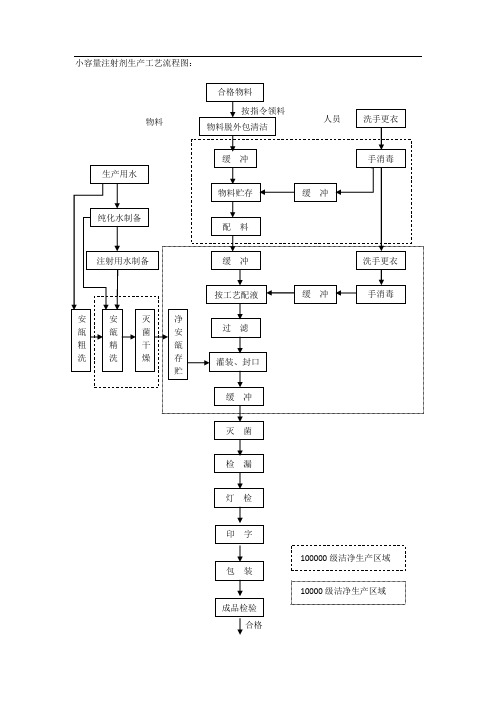
小容量注射剂生产工艺流程图:
一、生产用物料
包括原辅料、纯化水、注射用水、包装材料。
原辅料、包装材料(包括安瓿)应检验合格后使用。
纯化水为原水制得,清洗安瓿使用;注制得后及时使用。
二、纯化水、注射用水
1、原水处理(纯化水的制备)
原水处理方法有离子交换法、电渗析法及反渗透法。离子交换法制得的去离子水可能存在热原、乳光等问题,主要供蒸馏法制备注射用水使用,也可用于洗瓶,但不得用来配制注射液。
小容量注射剂生产工艺流程图及流程说明

物料 人员小容量注射剂生产工艺流程图:生产用水 合格物料 按指令领料 物料脱外包清洁缓 冲洗手更衣手消毒物料贮存 缓 冲纯化水制备注射用水制备 配 料 缓 冲洗手更衣安 瓿 粗 洗安 瓿 精 洗灭 菌 干 燥净 安 瓿 存 按工艺配液过 滤灌装、封口 缓 冲手消毒贮缓 冲灭 菌检 漏 灯 检 印 字 100000 级洁净生产区域包 装 10000 级洁净生产区域成品检验合格 成 品一、生产用物料包括原辅料、纯化水、注射用水、包装材料。
原辅料、包装材料(包括安瓿)应检验合格后使用。
纯化水为原水制得,清洗安瓿使用;注射用水为纯化水制得,清洗安瓿和配制使用,均应定时检查,制得后及时使用。
二、纯化水、注射用水1、原水处理(纯化水的制备)原水处理方法有离子交换法、电渗析法及反渗透法。
离子交换法制得的去离子水可能存在热原、乳光等问题,主要供蒸馏法制备注射用水使用,也可用于洗瓶,但不得用来配制注射液。
2、注射用水的制备注射用水为蒸馏水或去离子水经蒸馏所得的水,又称重蒸馏水。
其质量要求见《中国药典》,除氯化物、硫酸盐、钙盐、硝酸盐、亚硝酸盐、二氧化碳、易氧化物、不挥发物与重金属按蒸馏水检查应符合规定外,还规定pH应为5.0~7.0,氨含量不超过0.00002%,热原检查应符合规定,应于制备后12h内使用。
三、人员操作人员应身体健康,每年体检一次,并建立健康档案。
操作作人员按生产区域进行划分,严格遵守工作服穿戴制度,并不得将工作服穿出该区域。
不得将头发、胡须外露,不得化妆,不得佩带饰物、手表,操作前后、接触污物后均应洗手并且消毒。
工作服应定期清洗,更换。
四、领料按生产指令领取处方原料,核对物料品名,批号、规格、数量应相符,所领物料应有检验合格报告书。
五、配料领取的原料核对品名、批号、数量、合格证,按生产处方配料,装入清洁容器转入下一工序。
称量时需由第二人复核。
六、安瓿清洗将安瓿轩洗瓶机内,依次用饮用水、纯化水、注射用水进行清洗,清洗后干燥灭菌,置相应区域,检验合格后及时使用。
注射剂生产车间工程设计
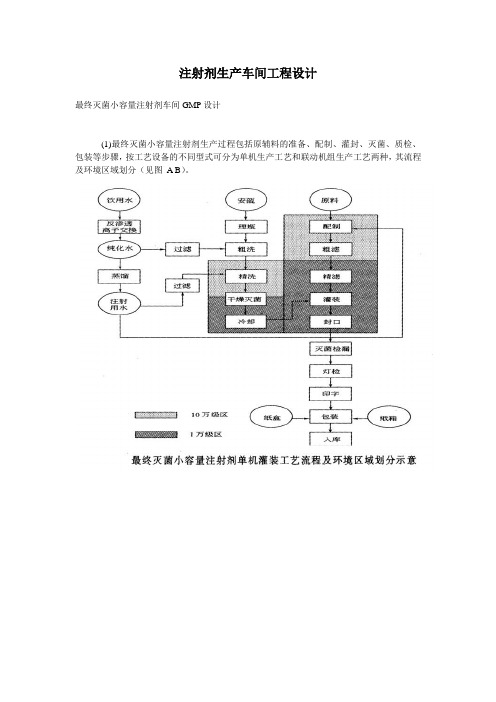
注射剂生产车间工程设计最终灭菌小容量注射剂车间GMP设计(1)最终灭菌小容量注射剂生产过程包括原辅料的准备、配制、灌封、灭菌、质检、包装等步骤,按工艺设备的不同型式可分为单机生产工艺和联动机组生产工艺两种,其流程及环境区域划分(见图A B)。
关于水针各单机设备和联动机组设备的具体内容详见前。
(2)按照GMP的规定最终灭菌小容量注射剂生产环境分为三个区域:一般生产区、10万级洁净区、1万级洁净区。
一般生产区包括安瓿外清处理、半成品的灭菌检漏、异物检查、印包等;10万级洁净区包括物料称量、浓配、质检、安瓿的洗烘、工作服的洗涤等;1万级洁净区包括稀配、灌封,且灌封机自带局部100级层流。
洁净级别高的区域相对于洁净级别低的区域要保持5~10Pa的正压差。
如工艺无特殊要求,一般洁净区温度为18~26℃,相对湿度为45%~65%。
各工序需安装紫外线灯。
(3)车间设计要贯彻人、物流分开的原则。
人员在进入各个级别的生产车间时,要先更衣,不同级别的生产区需有相应级别的更衣净化措施。
生产区要严格按照生产工艺流程布置,各个级别相同的生产区相对集中,洁净级别不同的房间相互联系中设立传递窗或缓冲间,使物料传递路线尽量短捷、顺畅。
物流路线的一条线是原辅料,物料经过外清处理,进行浓配、稀配;另一条线是安瓿瓶,安瓿经过外清处理后,进入洗灌封联动线清洗、烘干.两条线汇聚于灌封工序。
灌封后的安瓿再经过灭菌、检漏、擦瓶、异物检查,最后外包成整个生产过程。
具体进出水针车间的人流、物流路线(见图)所示。
(4)辅助用房的合理设置是制剂车间GMP没计的一个重要环节。
厂房内设置与生产规模相适应的原、辅材料,半成品、成品存放区域,且尽可能靠近与其联系的生产区域,减少运输过程中的混杂与污染。
存放区域内应安排待验区、合格品区和不合格品区;贮料称量室,并且要有利于包括空调风管在内的公用管线的布置。
(5)水针生产车间内地面一般做耐清洗的环氧自流坪地面,隔墙采用轻质彩钢板,墙与墙、墙与地面、墙与吊顶之间接缝处采用圆弧角处理,不得留有死角。
小容量注射剂生产工艺

小容量注射剂生产工艺
小容量注射剂是指容量在1毫升以内的注射剂,其生产工艺包括原料准备、配方调配、制剂工艺、灭菌和包装等环节。
首先是原料准备。
原料包括溶剂、药物、辅料等。
溶剂主要用于配制注射剂的溶剂系统,可以是水、油剂或乳剂等。
药物则是注射剂的主要有效成分,根据药物性质和剂型要求选择合适的药物。
辅料则用于调节药物的性状和溶解度等。
原料的准备包括检验原料的质量和纯度,然后对其进行称量和分装等操作。
接下来是配方调配。
根据注射剂的配方要求,将准备好的原料按照一定比例混合和溶解。
配方调配需在洁净的操作台上进行,操作人员要穿戴合适的防护服和手套等,以确保产品的安全性和质量。
然后是制剂工艺。
首先是制剂中的卫生问题,如操作人员要保持身体清洁,操作的容器和设备要经过严格的清洁和消毒,以防止细菌污染。
然后是药液的配制和溶解,按照一定的工艺步骤和工艺参数进行操作。
接着是药物的过滤,以去除杂质和微生物等。
最后是制剂的灭菌处理,常见的灭菌方法有高压蒸汽灭菌和紫外线辐射灭菌等。
最后是包装。
合格的注射剂需要进行适当的包装,以确保产品的密封性和稳定性。
包装材料应符合药品包装要求,防止外界物质的污染。
包装工艺包括灌装、倒瓶、贴标签、瓶盖装封等。
包装后的产品要进行质量检验,包括外观检查、容量检测、溶解度测定等,以确保产品符合药典的规定。
总之,小容量注射剂的生产工艺包括原料准备、配方调配、制剂工艺、灭菌和包装等环节。
每个环节都需要严格按照工艺要求进行操作,以确保产品的安全性和质量。
第四章 小容量 注射剂
a、高位静压滤过装置。此种装置适用于生产 量不大、缺乏加压或减压设备的情况,此 法压力稳定、质量好,但滤速稍慢。 b、减压滤过装置。设备要求简单,但压力不 够稳定,操作不当易使滤层松动,影响质 量。 c、加压滤过装置。适用于大量生产、压力稳 定、率速快、质量好、产量高。
饮用水 反渗透 离子交换 纯化水 过滤 过滤
概 述
1、注射剂的定义 2、注射剂的分类(按分散系统):
(1)溶液型注射剂 (2)注射用无菌粉末 (3)混悬型注射剂 (4)乳剂型注射剂
3、注射剂的特点:
(1)药效作用迅速 (2)适用于不宜口服的药物。 (3)适用于不能口服给药的病人。 (4)可以产生局部定位作用 (5)使用方便且注射疼痛。 (6)制备工配制 供注射用的原料药,必须符合中国药典所规定 的各项杂质检查与含量限度,活件炭要使用剂用 炭。配制时,如原料含有结品水应注意换算、在 计算处方时应将附加剂的用量一起算出,然后分 别准确称量。称量时应两人核对。
(一)最终灭菌小容量注射剂工艺技术
配制用具的选择与处理
(一)最终灭菌小容量注射剂工艺技术
3、生产控制及工艺技术要点: 注射剂用溶剂
(1)注射用水 • 为纯化水经蒸馏所得的水。灭菌注射用水为注射 用水经灭菌所得的水。 • 纯化水可作为配制普通药物制剂的溶剂或试验用 水,不得用于注射剂的配制。 • 注射用水为配制注射剂用的溶剂。
(一)最终灭菌小容量注射剂工艺技术
(4)热原的特点
①耐热性 ②滤过性 ③水溶性 ④不挥发性 ⑤其他
(一)最终灭菌小容量注射剂工艺技术
(3)污染热原的主要途径 ①溶剂 ②原辅料 ③容器具 ④管道和装置
(一)最终灭菌小容量注射剂工艺技术
(5)热原的除去方法 ①高温法 ②酸碱法 ③吸附法 ④交换法 ⑤过滤法
注射剂生产工艺流程与厂方设计布局
注射剂生产工艺流程与厂方设计布局1.原料准备:根据配方要求,准备所需原料,包括溶剂、药物活性成分、辅料等。
2.洁净区准备:将注射剂生产车间的洁净区进行洁净处理,确保符合注射剂生产的洁净要求。
3.材料配制:按照工艺要求,将原料按照一定的比例进行配装或配溶。
4.清洗与消毒:对生产设备、容器、管道等进行清洗和消毒,确保生产环境的无菌状态。
5.生产操作:根据工艺要求,通过输送设备将原料送入生产设备,进行混合、搅拌、过滤等操作。
6.灭菌:对生产过程中产生的产品进行灭菌处理,以确保产品的安全性。
7.储存与包装:将灭菌后的产品进行储存,然后进行包装,包括冷藏、冷冻等方式。
8.质量检验:对注射剂进行质量检验,包括外观、包装、药效等多个方面。
9.清洁消毒:对生产区域进行清洁和消毒处理,以确保下一次生产的安全性。
10.废物处理:对生产过程中产生的废弃物进行处理,采取环保措施,确保环境的卫生与安全。
厂方设计布局:1.洁净区域:注射剂生产车间应设有洁净区域,以满足注射剂生产的洁净要求。
洁净区域应具备恒定的温湿度、洁净度和空气流动,防止微生物污染。
2.生产区域:生产区域应设有符合注射剂生产工艺要求的设备,包括混合设备、过滤设备、灭菌设备等。
设备应布置合理,方便操作和清洁维护。
3.材料准备区:材料准备区需要配备精确的称量设备,以确保原料的准确配制。
同时,还应设有材料储存区,方便材料的及时供应。
4.包装区域:包装区域应设备注射剂的包装设备,包括灭菌、充填和封尾等设备。
同时,还应设有包装材料的储存区,方便包装材料的供应。
5.检验区域:检验区域应设备注射剂的质量检验设备,包括外观检验、药效检验和包装检验等设备。
同时,还应设有实验室,进行产品质量的监控和研究。
6.废物处理区:废物处理区应设备废物的处理设备,包括废物收集器、消毒设备和储存设备等。
废物处理区应符合环保要求,防止环境的污染。
总体来说,注射剂生产工艺流程和厂方设计布局需要结合注射剂的特点和工艺要求来设计。
小容量注射剂生产工艺
小容量注射剂生产工艺
一、小容量注射剂生产流程
1.原料配料:根据生产工艺文件称取所需原料,进行定量称取混合成样品;
2.粉碎加工:将原料称取的样品粉碎,达到投料要求;
3.成型加工:将粉碎后的样品经过模具加工成小容量注射剂;
4.粘合:将成型后的小容量注射剂经过挤出机筒面的粘合,保证其结实;
5.包装:将粘合完成的小容量注射剂成型包装;
6.过程检验:将小容量注射剂抽送样品检验,小容量注射剂及其包装检验;
7.成品检验:按要求随机抽送成品,进行成品检验,并按要求保存检验记录;
8.交付:小容量注射剂完成检验,满足要求即可交付。
二、小容量注射剂生产质量管理
1.原料管理:定期检查原料传送系统、投料设备、消毒系统等,确保原料得到充分稳定的保护;
2.过程控制:仔细查看生产工艺文件,确保投料工艺、成型工艺等各个工序质量控制;
3.检验质量:定期抽样检验,检验包装材料、原料成份、投料加工、成型加工等,确保质量符合要求;
4.后期管理:根据产品样品质量要求,实施后期恒温管理,确保温湿度的稳定性;。
述最终灭菌的小容量注射剂生产工艺流程及区域划分
.述最终灭菌的小容量注射剂生产工艺流程及区域划分
原料——称量——配制——粗滤——精滤——灌装
I —封口-灭菌检测-灯检-印字-包装-入库
安瓿——理瓶——粗洗——精洗-干燥灭菌——冷却
区域划分:精洗、配制、粗滤应为D级洁净区,安瓿干燥灭菌、冷却,料液的精滤、灌装、封口应为C级洁净区,其他都为一般生产区
.简述合剂生产工艺流程及环境区域划
原料——称量——配料——配制——过滤——灌装
I —压盖-灭菌检测-灯检-印字-包装-入库瓶子——理瓶——粗洗——精洗-干燥灭菌——冷却
区域划分:称量、配料、配制、过滤,瓶子的精洗、干燥灭菌,冷却,灌装、压盖应为D 级洁净区,其他都为一般生产区
简述湿法制粒片剂的生产工艺流程及车间设计的方法方案。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
述最终灭菌的小容量注射剂
生产工艺流程及区域划分-标准化文件发布号:(9556-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII
.述最终灭菌的小容量注射剂生产工艺流程及区域划分
原料——称量——配制——粗滤——精滤——灌装
I —封口-灭菌检测-灯检-印字-包装-入库
安瓿——理瓶——粗洗——精洗-干燥灭菌——冷却
区域划分:精洗、配制、粗滤应为D级洁净区,安瓿干燥灭菌、冷却,料液的精滤、灌装、封口应为C级洁净区,其他都为一般生产区
.简述合剂生产工艺流程及环境区域划
原料——称量——配料——配制——过滤——灌装
I —压盖-灭菌检测-灯检-印字-包装-入库
瓶子——理瓶——粗洗——精洗-干燥灭菌——冷却
区域划分:称量、配料、配制、过滤,瓶子的精洗、干燥灭菌,冷却,灌装、压盖应为D级洁净区,其他都为一般生产区
简述湿法制粒片剂的生产工艺流程及车间设计的方法方案。
