述最终灭菌的小容量注射剂生产工艺流程及区域划分
小容量注射剂的工艺流程

小容量注射剂的工艺流程小容量注射剂是一种常见的药物剂型,通常用于静脉、肌肉或皮下注射。
它具有剂量准确、易于使用、不易污染等优点,因此在临床上得到广泛应用。
小容量注射剂的生产工艺流程对于保证其质量和安全性至关重要。
下面将介绍小容量注射剂的生产工艺流程。
首先,小容量注射剂的生产需要准备原料。
常见的原料包括药物原料、辅料和溶剂。
药物原料是小容量注射剂的主要成分,它需要经过严格的质量控制和检验。
辅料则是用于调节药物的性状和稳定性的物质,例如调节pH值、增稠剂等。
溶剂则是用于溶解药物原料和辅料的溶剂,通常为无菌水或生理盐水。
其次,小容量注射剂的生产需要进行配方设计。
配方设计是根据药物的性质、剂量、使用途径等因素进行设计的,需要考虑药物的稳定性、溶解度、注射性等。
配方设计需要经过严格的实验验证和优化,确保药物的质量和安全性。
接下来是生产工艺的制定。
生产工艺包括原料的配制、混合、灭菌、充填、封口等环节。
在原料的配制过程中,需要严格控制原料的质量和比例,确保配方的准确性。
混合过程需要确保药物原料和辅料的均匀混合,避免出现不均匀的情况。
灭菌是小容量注射剂生产中非常重要的环节,需要采用适当的灭菌方法,确保产品的无菌性。
充填和封口则需要采用自动化设备进行操作,确保产品的质量和安全性。
最后是质量控制的过程。
质量控制包括原料的检验、生产过程的监控和产品的检验。
原料的检验需要对原料进行严格的质量控制,确保原料符合要求。
生产过程的监控需要对生产过程进行实时监控,确保生产过程的稳定性和一致性。
产品的检验则需要对成品进行严格的检验,包括外观、溶解度、pH值、无菌性等指标的检验。
综上所述,小容量注射剂的生产工艺流程包括原料准备、配方设计、生产工艺制定和质量控制等环节。
通过严格的操作和质量控制,可以确保小容量注射剂的质量和安全性,满足临床使用的要求。
小容量注射液生产工艺规程

制药有限公司小容量注射液生产工艺规程文件编号:1颁发单位:GMP办公室工艺规程批准程序1. 剂型、规格 (2)2. 生产工艺流程 (2)3. 操作过程及工艺条件 (3)4.质量控制要点 (6)5.设备一览表、主要设备生产能力 (6)6.工艺过程中的SOP (7)7.中间产品的控制 (8)8.验证工作要点 (8)9.工艺验证的具体要求 (9)10.工艺卫生和环境卫生 (9)11.劳动组织及岗位定员 (9)一、制剂类型:最终灭菌小容量注射液,10ml规格,安瓿瓶包装。
二、流程图:小容量注射液生产工艺流程图三、操作过程及工艺条件1 生产前的检查与确认1.1 是否还留有前批生产的产品或物料,是否已清洁并取得“清场合格证”。
1.2 检查确认生产现场的机器设备和器具是否已清洁并准备完毕挂上“合格”标示。
1.3 所使用原辅料是否准备齐全。
是否有质量检验报告单,合格品才能使用。
1.4 检查工艺用水是否新鲜制备,贮存不得超过24小时。
1.5 检查确认与生产品种相适应的批生产指令、配套文件及有关记录是否已准备齐全。
1.6 检查确认生产场所的温度是否在规定范围内(18-26℃,相对湿度在30%-65%)。
2 洗瓶、干燥灭菌2.1理瓶:根据“批生产指令”准备所需的清洁盘、领取必须的安瓶。
在理瓶室将安瓶的合格品摆满瓶盘。
2.2粗洗:把安瓿瓶盘放在不锈钢传送链条上,开动洗瓶机用高压循环纯化水洗安瓿瓶内外壁。
将安瓿瓶盘对称放置,固定在甩水机上,启动甩水机,甩水处理8分钟,至安瓶甩干。
重复上述操作。
2.3 精洗:用水温50--60℃,经孔径0.45um滤膜滤过的澄明度合格的注射用水清洗安瓿瓶内外壁,重复粗洗步骤。
定时检查安瓿的清洁度:目检1000ml注射用水无可见异物,抽50支,毛、块≤2%。
2.4 干燥与灭菌:安瓿盘均匀放入烘干箱内,150℃烘干1小时,或350℃烘干5分钟,消除热原。
2.5 灭菌后的安瓿立即使用或清洁存放,贮存不得超过48小时。
小容量注射剂生产工艺流程图及流程说明知识讲解

小容量注射剂生产工艺流程图及流程说明小容量注射剂生产工艺流程图:一、生产用物料包括原辅料、纯化水、注射用水、包装材料。
原辅料、包装材料(包括安瓿)应检验合格后使用。
纯化水为原水制得,清洗安瓿使用;注射用水为纯化水制得,清洗安瓿和配制使用,均应定时检查,制得后及时使用。
二、纯化水、注射用水1、原水处理(纯化水的制备)原水处理方法有离子交换法、电渗析法及反渗透法。
离子交换法制得的去离子水可能存在热原、乳光等问题,主要供蒸馏法制备注射用水使用,也可用于洗瓶,但不得用来配制注射液。
2、注射用水的制备注射用水为蒸馏水或去离子水经蒸馏所得的水,又称重蒸馏水。
其质量要求见《中国药典》,除氯化物、硫酸盐、钙盐、硝酸盐、亚硝酸盐、二氧化碳、易氧化物、不挥发物与重金属按蒸馏水检查应符合规定外,还规定pH应为5.0~7.0,氨含量不超过0.00002%,热原检查应符合规定,应于制备后12h 内使用。
三、人员操作人员应身体健康,每年体检一次,并建立健康档案。
操作作人员按生产区域进行划分,严格遵守工作服穿戴制度,并不得将工作服穿出该区域。
不得将头发、胡须外露,不得化妆,不得佩带饰物、手表,操作前后、接触污物后均应洗手并且消毒。
工作服应定期清洗,更换。
四、领料按生产指令领取处方原料,核对物料品名,批号、规格、数量应相符,所领物料应有检验合格报告书。
五、配料领取的原料核对品名、批号、数量、合格证,按生产处方配料,装入清洁容器转入下一工序。
称量时需由第二人复核。
六、安瓿清洗将安瓿轩洗瓶机内,依次用饮用水、纯化水、注射用水进行清洗,清洗后干燥灭菌,置相应区域,检验合格后及时使用。
七、配液按生产工艺进行配液八、过滤将配置完成的药液过滤,除去其中所含的杂质。
九、灌封滤液经检查合格后进行灌装和封口,即灌封。
十、灭菌除采用无菌操作生产的注射剂外,注射液在灌封后须尽快进行灭菌,以保证产品的无菌。
(灭菌要求是杀灭微生物,以保证用药安全,同时避免药物的降解,以免影响药效。
小容量注射剂工艺规程

一、概述:最终灭菌小容量注射剂(水针剂)是装量小于50 ml,采用湿热灭菌法制备的最终灭菌注射剂,除一般理化性质外,无菌、热原或细菌内毒素、澄明度、pH 值等项目检查均应符合规定。
根据GMP要求制定最终灭菌小容量注射剂****注射液生产工艺规程,规范整个生产操作过程,确保在正常的生产条件下,生产出合格、均一、稳定的小容量注射剂****注射液产品。
二、产品名称、剂型、规格、代码1.产品名称1.1.通用名称:___1.2.英文名称:___拼音名称:___2.产品代码:___3.产品剂型:小容量注射液4.规格及批准文号:___4.1.产品规格:___4.2.包装规格:纸箱___4.3.批准文号:___国药准字H三、生产处方及依据1.处方处方量 (_)万支(_)万支原料_________辅料_________注射用水加至__ml __ml2.批量:最大量:_ml 支最小量_ml 支最大量:_ml 支最小量_ml 支3.依据:《中国药典》2010年版二部《产品注册要求文件》四、生产工艺流程及环境区域划分五、操作过程及工艺条件1、纯化水制备将饮用水经石英砂过滤和活性碳过滤去除水中有机质及微粒,再经过阳离子交换柱(软化器)制的软化水,精密过滤器过滤后经二级反渗透制得纯化水。
1.1.纯化水制备操作过程:饮用水→机械过滤→活性炭过滤→精密过滤→阳离子交换柱→一级反渗透→二级反渗透→贮罐→至各用水点。
1.2. 纯化水制备工艺条件1.2.1、纯水制备以合格饮用水为水源,纯化水水质≤2.0us/cm或≥0.5Ω/cm。
1.2.2、纯化水贮存在密闭不锈钢(316L)罐。
1.2.3纯化水制备存放时间不超过72小时。
1.2.4纯化水经紫外灯灭菌用泵输送至各使用点,各使用点使用前须安装0.45um 和0.22um滤芯(膜)过滤后使用。
1.2.5反渗透装置在进口处须安装保安过滤器。
1.2.6机械过滤器和活性炭过滤器正常工作时每班生产前进行反冲一次。
小容量注射剂生产工艺流程图及流程说明

物料 人员小容量注射剂生产工艺流程图:生产用水 合格物料 按指令领料 物料脱外包清洁缓 冲洗手更衣手消毒物料贮存 缓 冲纯化水制备注射用水制备 配 料 缓 冲洗手更衣安 瓿 粗 洗安 瓿 精 洗灭 菌 干 燥净 安 瓿 存 按工艺配液过 滤灌装、封口 缓 冲手消毒贮缓 冲灭 菌检 漏 灯 检 印 字 100000 级洁净生产区域包 装 10000 级洁净生产区域成品检验合格 成 品一、生产用物料包括原辅料、纯化水、注射用水、包装材料。
原辅料、包装材料(包括安瓿)应检验合格后使用。
纯化水为原水制得,清洗安瓿使用;注射用水为纯化水制得,清洗安瓿和配制使用,均应定时检查,制得后及时使用。
二、纯化水、注射用水1、原水处理(纯化水的制备)原水处理方法有离子交换法、电渗析法及反渗透法。
离子交换法制得的去离子水可能存在热原、乳光等问题,主要供蒸馏法制备注射用水使用,也可用于洗瓶,但不得用来配制注射液。
2、注射用水的制备注射用水为蒸馏水或去离子水经蒸馏所得的水,又称重蒸馏水。
其质量要求见《中国药典》,除氯化物、硫酸盐、钙盐、硝酸盐、亚硝酸盐、二氧化碳、易氧化物、不挥发物与重金属按蒸馏水检查应符合规定外,还规定pH应为5.0~7.0,氨含量不超过0.00002%,热原检查应符合规定,应于制备后12h内使用。
三、人员操作人员应身体健康,每年体检一次,并建立健康档案。
操作作人员按生产区域进行划分,严格遵守工作服穿戴制度,并不得将工作服穿出该区域。
不得将头发、胡须外露,不得化妆,不得佩带饰物、手表,操作前后、接触污物后均应洗手并且消毒。
工作服应定期清洗,更换。
四、领料按生产指令领取处方原料,核对物料品名,批号、规格、数量应相符,所领物料应有检验合格报告书。
五、配料领取的原料核对品名、批号、数量、合格证,按生产处方配料,装入清洁容器转入下一工序。
称量时需由第二人复核。
六、安瓿清洗将安瓿轩洗瓶机内,依次用饮用水、纯化水、注射用水进行清洗,清洗后干燥灭菌,置相应区域,检验合格后及时使用。
注射剂生产车间工程设计
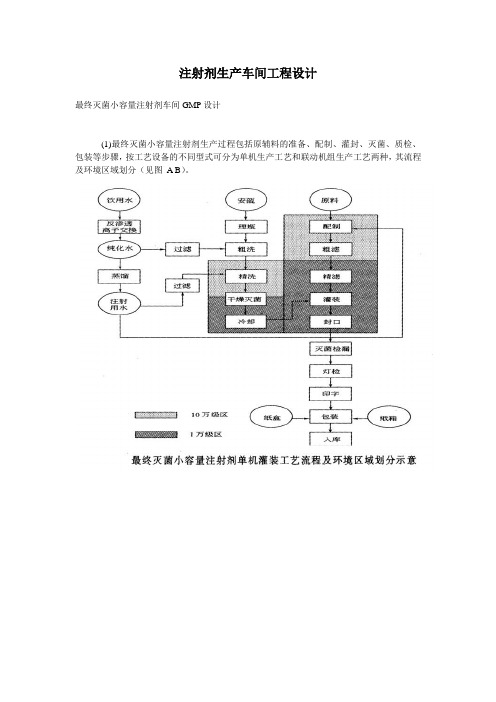
注射剂生产车间工程设计最终灭菌小容量注射剂车间GMP设计(1)最终灭菌小容量注射剂生产过程包括原辅料的准备、配制、灌封、灭菌、质检、包装等步骤,按工艺设备的不同型式可分为单机生产工艺和联动机组生产工艺两种,其流程及环境区域划分(见图A B)。
关于水针各单机设备和联动机组设备的具体内容详见前。
(2)按照GMP的规定最终灭菌小容量注射剂生产环境分为三个区域:一般生产区、10万级洁净区、1万级洁净区。
一般生产区包括安瓿外清处理、半成品的灭菌检漏、异物检查、印包等;10万级洁净区包括物料称量、浓配、质检、安瓿的洗烘、工作服的洗涤等;1万级洁净区包括稀配、灌封,且灌封机自带局部100级层流。
洁净级别高的区域相对于洁净级别低的区域要保持5~10Pa的正压差。
如工艺无特殊要求,一般洁净区温度为18~26℃,相对湿度为45%~65%。
各工序需安装紫外线灯。
(3)车间设计要贯彻人、物流分开的原则。
人员在进入各个级别的生产车间时,要先更衣,不同级别的生产区需有相应级别的更衣净化措施。
生产区要严格按照生产工艺流程布置,各个级别相同的生产区相对集中,洁净级别不同的房间相互联系中设立传递窗或缓冲间,使物料传递路线尽量短捷、顺畅。
物流路线的一条线是原辅料,物料经过外清处理,进行浓配、稀配;另一条线是安瓿瓶,安瓿经过外清处理后,进入洗灌封联动线清洗、烘干.两条线汇聚于灌封工序。
灌封后的安瓿再经过灭菌、检漏、擦瓶、异物检查,最后外包成整个生产过程。
具体进出水针车间的人流、物流路线(见图)所示。
(4)辅助用房的合理设置是制剂车间GMP没计的一个重要环节。
厂房内设置与生产规模相适应的原、辅材料,半成品、成品存放区域,且尽可能靠近与其联系的生产区域,减少运输过程中的混杂与污染。
存放区域内应安排待验区、合格品区和不合格品区;贮料称量室,并且要有利于包括空调风管在内的公用管线的布置。
(5)水针生产车间内地面一般做耐清洗的环氧自流坪地面,隔墙采用轻质彩钢板,墙与墙、墙与地面、墙与吊顶之间接缝处采用圆弧角处理,不得留有死角。
第四章 小容量 注射剂
a、高位静压滤过装置。此种装置适用于生产 量不大、缺乏加压或减压设备的情况,此 法压力稳定、质量好,但滤速稍慢。 b、减压滤过装置。设备要求简单,但压力不 够稳定,操作不当易使滤层松动,影响质 量。 c、加压滤过装置。适用于大量生产、压力稳 定、率速快、质量好、产量高。
饮用水 反渗透 离子交换 纯化水 过滤 过滤
概 述
1、注射剂的定义 2、注射剂的分类(按分散系统):
(1)溶液型注射剂 (2)注射用无菌粉末 (3)混悬型注射剂 (4)乳剂型注射剂
3、注射剂的特点:
(1)药效作用迅速 (2)适用于不宜口服的药物。 (3)适用于不能口服给药的病人。 (4)可以产生局部定位作用 (5)使用方便且注射疼痛。 (6)制备工配制 供注射用的原料药,必须符合中国药典所规定 的各项杂质检查与含量限度,活件炭要使用剂用 炭。配制时,如原料含有结品水应注意换算、在 计算处方时应将附加剂的用量一起算出,然后分 别准确称量。称量时应两人核对。
(一)最终灭菌小容量注射剂工艺技术
配制用具的选择与处理
(一)最终灭菌小容量注射剂工艺技术
3、生产控制及工艺技术要点: 注射剂用溶剂
(1)注射用水 • 为纯化水经蒸馏所得的水。灭菌注射用水为注射 用水经灭菌所得的水。 • 纯化水可作为配制普通药物制剂的溶剂或试验用 水,不得用于注射剂的配制。 • 注射用水为配制注射剂用的溶剂。
(一)最终灭菌小容量注射剂工艺技术
(4)热原的特点
①耐热性 ②滤过性 ③水溶性 ④不挥发性 ⑤其他
(一)最终灭菌小容量注射剂工艺技术
(3)污染热原的主要途径 ①溶剂 ②原辅料 ③容器具 ④管道和装置
(一)最终灭菌小容量注射剂工艺技术
(5)热原的除去方法 ①高温法 ②酸碱法 ③吸附法 ④交换法 ⑤过滤法
小容量注射剂生产工艺
小容量注射剂生产工艺1.原材料准备:首先需要准备好所需的原材料。
通常,注射剂的主要原材料包括药物成分、溶剂、辅料等。
这些原材料需要经过严格的质量控制,确保安全有效。
2.溶液准备:根据配方要求,将所需的药物成分和辅料加入到溶剂中,通过搅拌和加热等操作,使其溶解均匀,得到稳定的注射剂溶液。
3.灭菌过滤:注射剂生产过程中,灭菌是非常重要的步骤。
注射剂通常需经过灭菌处理,以确保最终产品的无菌性。
通常采用的灭菌方法包括高温高压灭菌和过滤灭菌。
过滤灭菌是较常用的方法,通过使用0.22微米的滤膜,将溶液过滤,去除其中的微生物。
4.注射剂灌装:经过灭菌处理的注射剂溶液可进行灌装。
灌装是将溶液装入注射剂瓶或注射器中的过程。
通常使用自动化的灌装设备进行操作,确保灌装的准确性和稳定性。
5.注射剂包装:灌装完成后,需要对注射剂进行包装。
常见的包装方式有瓶装和装前加装两种。
瓶装是将灌装好的注射剂瓶进行密封,以防止外界污染。
装前加装是将瓶装注射剂再次放入含有吸收性剂的容器中,以吸收可能产生的水分。
6.监控和检验:在整个生产过程中,需要对关键参数进行监控和检验,以确保注射剂的质量。
常见的监控和检验项目包括注射剂溶液的pH值、重金属污染、溶解度等。
这些项目可通过标准化的实验方法进行测定。
7.清洁和消毒:在生产过程中,需要对生产设备和工作区域进行定期的清洁和消毒,以防止交叉污染和微生物污染。
小容量注射剂生产工艺需要严格遵守药品生产质量管理规范,并遵循相关的法律法规要求。
同时,质量控制和质量保证是整个生产过程中的重要环节,确保所生产的注射剂符合质量标准。
为了达到更高的质量标准,生产工艺也需要根据不同药物成分的特性和要求进行相应的调整和改进。
综上所述,小容量注射剂生产工艺涉及到原材料准备、溶液准备、灭菌过滤、注射剂灌装、注射剂包装、监控和检验、清洁和消毒等环节。
通过合理的生产管理和质量保证,可以生产出符合质量标准的小容量注射剂。
小容量注射剂生产工艺
小容量注射剂生产工艺
一、小容量注射剂生产流程
1.原料配料:根据生产工艺文件称取所需原料,进行定量称取混合成样品;
2.粉碎加工:将原料称取的样品粉碎,达到投料要求;
3.成型加工:将粉碎后的样品经过模具加工成小容量注射剂;
4.粘合:将成型后的小容量注射剂经过挤出机筒面的粘合,保证其结实;
5.包装:将粘合完成的小容量注射剂成型包装;
6.过程检验:将小容量注射剂抽送样品检验,小容量注射剂及其包装检验;
7.成品检验:按要求随机抽送成品,进行成品检验,并按要求保存检验记录;
8.交付:小容量注射剂完成检验,满足要求即可交付。
二、小容量注射剂生产质量管理
1.原料管理:定期检查原料传送系统、投料设备、消毒系统等,确保原料得到充分稳定的保护;
2.过程控制:仔细查看生产工艺文件,确保投料工艺、成型工艺等各个工序质量控制;
3.检验质量:定期抽样检验,检验包装材料、原料成份、投料加工、成型加工等,确保质量符合要求;
4.后期管理:根据产品样品质量要求,实施后期恒温管理,确保温湿度的稳定性;。
液体制剂车间布局与工艺流程设计
一、注射剂车间 在制剂工程上,根据注射剂制备工艺的特 点将其分为最终可灭菌小容量注射剂、最终可 灭菌大容量注射剂、无菌分装注射剂(粉针 剂)、冻干粉针剂等四种类型。
1
( 一 ) 、 最终可灭菌小容量注射剂工艺流程 及车间布局
最终可灭菌小容量注射剂指装量小于50ml, 采用湿热灭菌法制备的灭菌注射剂。其生产过程 包括原辅料的准备、配制、灌封、灭菌、质检、 包装等步骤。
17
(1)冻干粉针剂工艺流程
18
19
(2)生物疫苗(冻干粉针剂)车间布局
无菌分装注射剂指在无菌条件下将符合要 求的药粉通过工艺操作制备的非最终灭菌无菌 注射剂。
其生产步骤。
14
(1)无菌分装注射剂工艺流程示意图及环境区域划分(10
万级、l万级、*局部100级)
15
(2)无菌分装注射剂车间布局图
16
( 四 ) 、 冻干粉针剂工艺流程及车间布局
根据生产工艺条件和药物性质,用冷冻干 燥法制得的注射用无菌粉末称为冻干粉针剂。 凡是在常温下不稳定的药物,如干扰素、白介 素、生物疫苗等生物工程药品以及一些医用酶 制剂(胰蛋白酶、辅酶A)和血浆等生物制剂, 均需制成冻干制剂才能推向市场。
注射用无菌粉末的生产必须在无菌室内进 行,特别是一些关键工序要求严格,可采用层 流洁净装置,保证无菌无尘。
(2)可灭菌大容量注射剂车间布局图
9
(3)用玻璃瓶制成的最终可灭菌大容量注射剂工艺流程 10
(4)用玻璃瓶制成的最终可灭菌大容量注射剂车间布局图 11
(5)用塑料容器制成的最终可灭菌大容量注射剂工艺流程12
(6)用塑料容器制成的最终可灭菌大容量注射剂车间布局13
( 三 ) 、 无菌分装注射剂工艺流程及车间布局
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
.述最终灭菌的小容量注射剂生产工艺流程及区域划分
原料——称量——配制——粗滤——精滤——灌装
I —封口-灭菌检测-灯检-印字-包装-入库
安瓿——理瓶——粗洗——精洗-干燥灭菌——冷却
区域划分:精洗、配制、粗滤应为D级洁净区,安瓿干燥灭菌、冷却,料液的精滤、灌装、封口应为C级洁净区,其他都为一般生产区
.简述合剂生产工艺流程及环境区域划
原料——称量——配料——配制——过滤——灌装
I —压盖-灭菌检测-灯检-印字-包装-入库瓶子——理瓶——粗洗——精洗-干燥灭菌——冷却
区域划分:称量、配料、配制、过滤,瓶子的精洗、干燥灭菌,冷却,灌装、压盖应为D 级洁净区,其他都为一般生产区
简述湿法制粒片剂的生产工艺流程及车间设计的方法方案。
