物理化学7
物理化学-第7章统计热力学公式
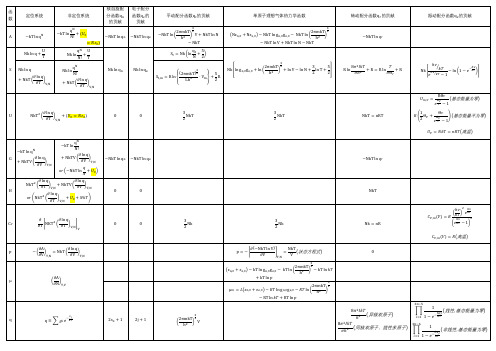
定位系统
非定位系统 q +( N! = ) q U + N! T
Hale Waihona Puke 核自旋配 分函数q 的贡献 −NkT ln q
电子配分 函数q 的 贡献 −NkT ln q
平动配分函数q 的贡献
单原子理想气体热力学函数
转动配分函数q 的贡献
振动配分函数q 的贡献
A
−kT ln q U T
−kT ln
−NkT ln
,
=
RΘ −1
基态能量为零
U
NkT
∂ ln q ∂T
+(
,
=
)
0
0
3 NkT 2
3 NkT 2
NkT = nRT
1 Θ + 2 =
Θ −1 =
基态能量不为零
高温
−kT ln q G + NkTV ∂ ln q ∂V
,
q N! ∂ ln q + NkTV ∂V −kT ln −NkT ln +
−NkT ln q
,
−NkT ln q
−NkT ln
NkT H
∂ ln q ∂T NkT
+ NkTV
,
∂ ln q ∂V +
,
∂ ln q ∂T
0
0
NkT
+
,
ℎ CV ∂ NKT ∂T ∂ ln q ∂T 0 0 3 Nk 2 3 Nk 2
,
( )= −1 ( )=
,
Nk = nR
,
高温
p
−
∂A ∂V
= NkT
,
∂ ln q ∂V
2πmkT V + NkT ln N h − NkT q 5 + N 2
物理化学第七章

粗分散物系
>10-7m
混浊泥水,牛 奶,豆浆
3、胶体四大特征:(同溶液相比较)
①聚结不稳定性(热不稳自发聚沉)②多相不均匀性 聚结不稳定性 ②多相不均匀性(一相分散 于另一相,有相界面)③高分散性 ③高分散性(颗粒大小及胶团量不相同) 结构组成不确定性(受添加剂或添加物影响) ④结构组成不确定性 (真溶液:热稳,均相物系,组成,结构,分子量恒定) 4、胶体化学研究内容:表面现象,分散物系及高分子溶液 5、表面:物体处于真空或与本身饱和蒸气达平衡的面。 6、界面:物体与空气或其他物体相接触的面(存在于两相之间 几个nm厚度薄层) 7、表面现象(Surface phenomenon):凡物质处于凝聚状态时, 其界面上发生的一切物理化学现象。(包括s-g,s-l,l-g,ss,l-l等统称表面)严格讲为界面现象,如:毛细现象,润湿 作用,液体过热,蒸气过饱和,吸附作用等统称界面现象 AS Sο (Interface phenomenon)。
(1)按分散相和分散介质的聚集状态分类
分散相 分散介质 名称 气 泡沫 液 液 乳状液 固 悬浮体,溶液胶 气 液 固 固溶胶 固 气 液 气 气溶胶 固
实例 肥皂泡沫 牛奶 泥浆,金溶胶 浮石,泡沫玻璃 珍珠,某些矿石 某些合金 雾 烟
(2)按分散相的分散度分类
类型 低分子 分散物系 分散相粒子半 径 <10-9m 分散相 原子 离子,小分子 性质 均相,热力学稳定物 系,扩散快,能透过 半透膜,形成真溶液 均相,热力学稳定物 系,扩散慢,不能透 过半透膜,形成真溶 液 举例 NaCI、蔗糖的 水溶液,混合 气体等 聚乙烯醇水溶 液
之一):当毛细管插入润湿性液体水中时,管内液面呈凹面, △P背向 液面,使液体受到向上提升力而沿管内壁上升,当液柱产生的静压 力ρgh=△P时达平衡停止移动;反之,当毛细管插入非润湿性液体 汞中时产生管内凸液面,因△P向下,使管内液面下降至ρgh=△P 达平衡时停止,此为毛细现象。
物理化学-7公开课获奖课件

t
Q Q
u u u
t
Q Q
u u u
第14页
§7.2电解质溶液电导
(1)电导、电导率和摩尔电导率
电解质溶液和金属导体同样,有如下关系:
溶液电阻R,外加电压V和通过溶液电流I之间服从欧姆定 律,即V=IR;
溶液电阻R与两电极间距离l成正比,与浸入溶液电极面积 A成反比,
第20页
m (HAc) m (H ) m ( Ac ) m (H ) m (Cl ) m (Na ) m ( Ac ) m (Na ) m (Cl )
m (HCl) m (NaAc) m (NaCl)
m (HAc) m (H ) m ( Ac )
m
(H
)
1 2
m
E 0 rGm0 zF
E
E0
RT zF
ln Qa
E0
RT zF
ln
aGg aHh
a
a A
aBb
第41页
2.电池原则电动势E0测定和求算 a. E 0 rGm0
zF b. 假如参与反应物质均以纯态出现, 则电池电动势E=E0
Pb-PbO(s)|OH-|HgO(s)-Hg(l)
Pb(s) HgO(s) PbO(s) Hg(l)
上分别发生氧化还原作用时导致电子得失而形成。
上述两个过程缺一不可, 否则电能与化学能之间互相 转换是不也许持续进行。
第9页
本书中对电化学装置中电极命名约定: (i)电化学装置两个电极, 电势高称为正极, 电势低称为负 极; (ii)电化学装置两个电极, 发生氧化反应称为阳极, 发生 还原反应称为阴极; (iii)一般在习惯上对原电池常用下极和负极命名, 对电解 池用阴极和阳极命名。
物理化学第七章课后题答案

7.13 电池电动势与温度的关系为263)/(109.2/10881.10694.0/K T K T V E --⨯-⨯+= (1)写出电极反应和电池反应;(2)计算25℃时该反应的ΘΘΘ∆∆∆m r m r m r H S G ,,以及电池恒温可逆放电时该反应过程的。
(3)若反应在电池外在相同温度下恒压进行,计算系统与环境交换的热。
解:(1)电极反应为阳极 +-→-H e H 221阴极 --+→+Cl Hg e Cl Hg 2221电池反应为(2)25 ℃时{}VV E 3724.015.298109.215.19810881.10694.0263=⨯⨯-⨯⨯+=--1416310517.115.298108.510881.1)(-----⋅⨯=⋅⨯⨯-⨯=∂∂KV KV TE因此,1193.35)3724.0309.964851(--⋅-=⋅⨯⨯-=-=∆molkJ molkJ zEF G m r1111464.1410157.1309.964851-----⋅⋅=⋅⋅⨯⨯⨯=∂∂=∆KmolJ KmolJ TE zFS m r11357.3164.1415.2981093.35--⋅-=⋅⨯+⨯-=∆+∆=∆molkJ molkJ S T G H m r m r m r11,365.479.1615.298--⋅=⋅⨯=∆=molkJ molkJ S T Q m r m r(3)1,57.31-⋅-=∆=molkJ H Q m r m p7.14 25℃时,电池AgCl s AgCl kg mol ZnCl Zn )()555.0(1-⋅电动势E=1.015V ,已知,,7620.0)(2V Zn Zn E -=+ΘV Ag AgCl Cl E 2222.0)(=-Θ,电池电动势的温度系数141002.4)(--⋅⨯-=∂∂KV TE p(1)写出电池反应;(2)计算电池的标准平衡常数; (3)计算电池反应的可逆热;(4)求溶液中2ZnCl 的标准粒子活度因子。
物理化学-第七章-电化学

通入的总电量:Q I t 0.23060 360库仑
电极上起化学反应物质的量:
n Q 360 0 00373mol zF 196500
析出Ag的质量: m=n×MAg=0.00373×107.88=0.403g
二、电导、电导率和摩尔电导率
体积与浓度的关系如何呢?
c n V
(mol·m-3)
若n为1mol
Vm
1 c
m
Vm
c
S·m2·mol-1
注意:c的单位:mol﹒m-3
3.电导、电导率和摩尔电导率之间的关系
G 1 R
K l A
G K
m
Vm
c
例: 298K时,将0.02mol·dm-3的KCl溶液放入 电导池,测其电阻为82.4Ω,若用同一电导池充 0.0025mol.dm-3的K2SO4溶液,测其电阻为 326Ω,已知298K时,0.02mol·dm-3的KCl溶液 的电导率为0.2768S.m-1 (1)求电导池常数; (2)0.0025mol.dm-3的K2SO4溶液的电率; (3)0.0025mol.dm-3的K2SO4溶液的摩尔电 导率。
★电池 汽车、宇宙飞船、照明、通讯、 生化和医学等方面都要用不同类型的化学 电源。
★ ⒊电分析 ★ ⒋生物电化学
§7-1 电解质溶液的导电性质 一、电解质溶液的导电机理
1.导体: 能够导电的物体叫导体。
第一类: 靠导体内部自由电子的定向运动而导电的物体
如 金属导体
石墨
性质:
A.自由电子作定向移动而导电
F:法拉第常数,即反应1mol电荷物质所需电量 1F=96500库仑/摩尔
物理化学课件7-熵变计算-A判据,G判据等(1)

p
T
S V V S
Maxwell关系式
V S
p
T p
S
S p V T T V
S p
T
V T
p
用途:(1) 以易测量 代替难测量
(2) 导出其他具 有普遍意义 的公式
四、基本关系式应用举例
➢ 解释规律(结论):基本关系式是武器
p T S V V S
S + S环 ≥ 0
S Q 0 T环
S Q T环
> 自发 =R
Clausius Inequality
➢ 展望未来 封闭系统中等温等容条件下自发过程的方向和限度; 封闭系统中等温等压条件下自发过程的方向和限度。
§Helmholtz函数判据和Gibbs函数判据
Helmholtz function criterion and Gibbs function criterion
G
S
T p
U p V S
H p
S
V
A p V T
G
p
T
V
对应系数关系式
用途:证明题 分析问题
三、Maxwell关系式 若 dZ = Mdx + Ndy 是全微分,则据Euler倒易关系:
M y
x
N x
y
dU TdS pdV dH TdS Vdp dA SdT pdV
熵增加原理(namely, entropy criterion):
由S确定方向和限度,解决问题方便
熵判据的弊端:
(1) 计算S难度大。 (2) 适用范围小:只适用于孤立系统。 (3) 关于重新划定系统的问题:
Siso = S + S环 * 所答非所问:
物理化学第7章 电化学

放置含有1 mol电解质的溶液,这时溶液所具有的
电导称为摩尔电导率 Λ m
Λ m
def
kVm
=
k c
Vm是含有1 mol电解质的溶液
的体积,单位为 m3 mol1,c 是电解
质溶液的浓度,单位为 mol m3 。
摩尔电导率的单位 S m2 mol1
注意:
Λ 在 后面要注明所取的基本单元。 m
b、强电解质: 弱电解质:
强电解质的Λ m
与
c
的关系
随着浓度下降,Λ 升高,通 m
常当浓度降至 0.001mol dm3 以下
时,Λ 与 m
c 之间呈线性关系。德
国科学家Kohlrausch总结的经验
式为:
Λ m
=Λm (1
c)
是与电解质性质有关的常数
将直线外推至 c 0
得到无限稀释摩尔电导率Λm
-
- 电源 +
e-
+
e-
阴
阳
极
极
CuCl2
电解池
阳极上发生氧化作用
2Cl aq Cl2(g) 2e
阴极上发生还原作用
Cu2 aq 2e Cu(s)
三、法拉第定律
Faraday 归纳了多次实验结果,于1833年总结出该定律
1、内容:当电流通过电解质溶液时,通过电极 的电荷量与发生电极反应的物质的量成正比;
作电解池 阴极: Zn2 2e Zn(s)
阳极 2Ag(s) 2Cl 2AgCl(s) 2e
净反应: 2Ag(s) ZnCl2 Zn(s) 2AgCl(s)
2.能量变化可逆。要求通过的电流无限小。
二、可逆电极的种类
1、第一类电极
材料物理化学7

第一节
单元系统相图的应用
4、熔融状态的SiO2由于粘度很大,冷却时往往成为过冷的液 、熔融状态的 由于粘度很大, --石英玻璃 虽然它是介稳态, 石英玻璃。 相--石英玻璃。虽然它是介稳态,由于粘度很大在常温下可 以长期不变。如果在1000℃以上持久加热,也会产生析晶。熔 以长期不变。如果在 ℃以上持久加热,也会产生析晶。 融状态的SiO2,只有极其缓慢的冷却,才会在 融状态的 ,只有极其缓慢的冷却,才会在1713℃可 ℃ 逆地转变为α-方石英。 逆地转变为α 方石英。
第一节
单元系统相图的应用
3、 α-鳞石英缓慢加热,在1470℃时转变为α-方石英,继续加 、 鳞石英缓慢加热, ℃时转变为α 方石英, 热到1713℃熔融。当缓慢冷却时,在1470℃时可逆地转变为α- 热到 ℃熔融。当缓慢冷却时, ℃时可逆地转变为α 鳞石英;当迅速冷却时, 线过冷, 鳞石英;当迅速冷却时,沿虚 线过冷,在230℃转变为介稳状态的 ℃ 方石英;当加热β 方石英仍在 β-方石英;当加热β-方石英仍在230℃迅速转变为稳定状态的α ℃迅速转变为稳定状态的α -方石英。 方石英。
第二节
二 元 凝 聚 系 统 相 图 的 基 本 类 型
二元系统相图的基本类型
四、形成固溶体的二元系统相图
第二节
二 元 凝 聚 系 统 相 图 的 基 本 类 型
二元系统相图的基本类型
有限固溶体:
有两种固溶体, SA(B)表示B组分溶 解在A晶体中所形成 的固溶体, SB (A) 表示A组分溶解在B 晶体中所形成的固 溶体。
第五节
判 读 三 元 相 图 的 几 条 重 要 规 则
三元系统相图的基本类型
第五节
判 读 三 元 相 图 的 几 条 重 要 规 则
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 21. 溶胶的动力性质是由于粒子的不规则运动而产生, 在下列各现象中,不属于溶胶动力性质的是:
• (A)渗透压;(B)扩散 ; (C)沉降平衡; (D) 电泳
0.0033mol·dm-3 Na3PO47.4×10-3dm3. 试 计 算 各 电 解
质的聚沉能力之比,从而可判断胶粒带什么电荷.
• 5. 两个等体积的0.200mol·dm-3 NaCl水溶液被一半 透 膜 隔 开 , 将 摩 尔 质 量 为 55.0kg·mol-1 大 分 子 化 合 物Na6P置于膜的左边,其浓度为0.050kg·dm-3.试 求膜平衡时两边Na+和Cl-的浓度.
(
),化学吸附的吸附反应有两种反应历程,其中
Langmuir-Hinshelwood历程研究( )反应,
Langmuir-Rideal历程是研究(
)。
• 7. 溶胶是热力学(
)体系,动力学( )
体系;而大分子溶液是热力学( )体系,动力学
( )体系。
• 8. 对于Au溶胶而言,当以NaAuO2作为稳定剂时,其
胶团结构是(
)。
• 9. 以KI和AgNO3为原料制备AgI溶胶时,如果KI过量,
则制得的AgI胶团结构为(
);如果AgNO3过量
则制得的AgI胶团结构为(
)
三.计算题
1. 298K时,水-空气的表面张力=0.07197 N·m-1, ( ∂ /∂T)p,A=-1.57×10-4N·m-1·K-1, 试 计 算 2 9 8 K、 标 准 压 力pΘ下可逆地增大2×10-4m2的表面积时,体系所做 的功(假设只做表面功)、体系的G、 H、 S及 体系所吸收的热量Qr。
• (A)-2.868×10-5J,(B)20868×10-5J, • (C)-7.17×10-5J(D)7.17×10-5J
• 2. 液体的表面张力可表示为: • (A)(H/A)T,p,n(B)(F/A)T,p,n
(C)(U/A)S,V,n(D)(G/A)T,V,n
• 3. 在相同的温度下固体冰和液体水的表面张 力哪个大?
• 2. 室温时,水在一根粗细均匀的玻璃毛细管中,将
上升到高度h,如将毛细管折断至h/2处,水将沿
壁升至(
)处,此时管中水面的曲率半径将
(
)
• 3. 凡能产生正吸附的物质,其表面超额为( )
值,溶液的表面张力随浓度的增加而(
)
• 4. 苯不能溶于水而能较好地溶于肥皂水是由于肥
皂的(
)作用。
• 5. 一般说来,物理吸附的吸附量随温度升高而
物理化学练习七
界面科学与胶体化学部分 (与化学热力学、化学动力学具有 紧密联系,对材料科学、生命科学
意义重大且应用前景广阔)
一、选择题
• 1 . 2 9 8 K 时 , 水 - 空 气 的 表 面 张 力 =7.17×102N·m-1,若在298K,标准压力pΘ下可逆地增加 4×10-4m2水的表面积,环境对体系做的功W为: ( ) (△U=Q+W)
• (A)微小晶粒的大 • (C)一样大
(B)大块颗粒的大 (D)无法比较
• 10. 设水在玻璃毛细管内上升的高度为h,若此毛 细管被折断,露在水面以上的长度是h/2,则水在毛细 管上升到h/2后,
• (A)不断从管中流出
• (B)不从管中流出,管内液面曲率半径缩小到1/2倍
• (C)不从管中流出,管内液面曲率半径增大到2倍
• 16. 设θ为表面覆盖度,根据Langmuir理论,其吸附速 率为:
• (A)kaθ; (B) ka θp; (C) ka (1-θ)p; (D) ka (1-θ);
• 17. 称为催化剂毒物的物质,其主要行为是: • (A)和反应物之一发生化学反应;(B)增加逆反
应的速度;(C)使产物变的不活波;(D)占据催化 剂的活性中心
• 26. • 明矾净水的主要原理是: • (A)电解质对溶胶的聚沉作用 • (B)溶胶的相互聚沉作用 • (C)电解质的敏化作用 • (D)电解质的对抗作用
二.填空题
• 1. 从表面热力学的角度看比表面吉布斯自由能表达式 是( ),其量纲为( ),从力学平衡角度看表 面张力是( ),其量纲为( )。
• Fe2O3溶胶的聚沉能力次序为: • (A)KCl > Na2SO4>MgSO4 > K3[Fe(CN)6] • (B)KCl< Na2SO4< MgSO4< K3[Fe(CN)6] • (C) KCl< MgSO4< Na2SO4<K3[Fe(CN)6] • (D) Na2SO4> K3[Fe(CN)6]>KCl> MgSO4
• 7. 用同一支滴管滴下水的滴数和滴相同体积苯的 滴数哪个多?
• (A)水的多 • (B)苯的多 • (C)一样多 • (D)随温度而改变
• 8. 同一固体,大块颗粒和粉状颗粒,其熔点哪个高? • (A)大块的高 (B)粉状的高 • (C)一样高 (D)无法比较
• 9. 在同一温度下微小晶粒的饱和蒸汽压和大块颗 粒的饱和蒸汽压哪个大?
• (A)大 (B)一样(C)小 (D)不定
• 6. 能在毛细管中产生凝聚现象的物质是由于该物质 的液体在毛细管中形成:
• (1)凸面 (2)凹面 (3)平面,
• 其在毛细管上的饱和蒸气压p:
• (4)大于平面的 (5)等于平面的 于平面的。
(6)小
• 正确的答案是:(A)(2)(4);(B)(1) (5);(C)(3)(6);(D)(2)(6)
• (A)冰的大 (B)水的大 (C)一样大 (D)无法比较
• 4. 弯曲表面上附加压力的计算公式:p=p′-p 0=2/R′中,R′的符号:
• (A)液面为凸面时为正,凹面为负 • (B)液面凸面时为负,凹面为正 • (C)总为正 • (D)总为负
• 5. 同外压恒温下,微小液滴的蒸气压比平面液体的 蒸气压:
• 5. 请在符合Langmuir吸附等温式的前提下,从反应 物和产物分子吸附性质解释下列事实:
• (1)氨在钨丝表面的分解是零级反应;(2)N2O在 金表面的分解是一级反应.
• 6. 在稀的砷酸溶液中通入H2S制备As2S3溶胶,稳定 剂是H2S.
• (1) 写出该胶团的结构,并指明胶粒的电泳方向. • (2)电解质NaCl,MgSO4,MgCl2,对该胶体的聚沉
• 22. 溶胶的光学性质是其高度分散性和不均匀(多相) 性的反映,丁铎尔效应是最显著的表现,在下列光学现 象中,它指的是:
• (A)反射;(B)散射;(C)折射;(D)透射
• 2加3.入在适等量体的积HA等c浓和度Na的NAOg3,NO则3和胶I粒K将的:混合液中,
• (A)优先吸附Ac-离子带负电;(B)优先吸附 NO3-离子带负电;(C)优先吸附H+离子带正电; (D)优先吸附Na+离子带正电
• 4. 在三个烧瓶中分别盛0.02 dm3的Fe(OH)3溶胶,分 别 加 入 NaCl,Na2SO4,Na3PO4 使 其 聚 沉 , 至 少 需 要 加入电解质的数量为(1)1mol·dm-3 NaCl 10.021dm3,
(2)0.005mol·dm-3
Na2SO40.125dm3,(3)
• 2. 25℃乙醇水溶液的表面张力(N·m-1)与活度
的关系如下:
• =0.072-5.0×10-4a+2.0×10-4a2,求活度为0.5的溶 液的表面超量。
• 3 . 在 一 定 温 度 下 , N2 在 某 催 化 剂 上 的 吸 附 服 从 Langmiur 方 程 , 已 知 催 化 剂 的 比 表 面 积 为 21.77m2·g-1,N2分子的截面积为16×10-20 m2。当平 衡 压 力 为 1 0 1 3 2 5 Pa 时 , 每 克 催 化 剂 吸 附 N2 的 量 为 2cm3(已换算成标准状态),问要使N2的吸附量增 加一倍,则平衡压力为多大?
• (D)不从管中流出,管内液面曲率半径不变
• 11. 当表面活性物质加入溶剂后,所产生的结 果是:
• (A) d/da <0,正吸附 • (B) d/da <0,负吸附 • (C) d/da > 0,正吸附 • (D) d/da >0,负吸附
• 12. 已知某溶液溶于水后,溶液表面张力与活度a的 关系为: = 0-Aln(1+ba),其中0为纯水表 面张力,A,b为常数,则此溶液中溶质的表面过剩Г与 活度a的关系为:
• 19. 只有典型的增液溶胶才能全面地表现出胶体的三 个基本特性,但有时把大分子溶液也作为胶体化学研 究的内容,一般地说是因为他们:
• (A)具有胶体所特有的分散性,不均匀(多相)性 和聚结不稳定性
• (B)具有胶体所特有的分散性, • (C)具有胶体的不均匀(多相)性 • (D)具有胶体的聚结不稳定性
• 18. 某气体A2在表面均匀的催化剂上发生离解反应, 其反应机理为:
• A2(g)+2K====2AK→C+D+2K • 第一步是快平衡,第二步是速控步,则速率方程为:
• (A)r = kpA 2 • (B)r = k2aA 2 p A 2/(1+a1/2A 2 p1/2A 2 ) 2 • (C)r =(k2a1/2A 2 p1/2A 2)/(1+a1/2A 2 p1/2A 2 ) • (D)r =kaA2 pA2 1/2
• 24. 由 等 体 积 的 1mol·dm-3 的 K I 溶 液 与 0加.8入m下ol·列dm电-3解的质Ag时N,O3其溶聚液沉制能备力的最A强gI者溶是胶,分别
• (A)K3[Fe(CN)6] (B) NaNO3
