高一化学提高班《原子结构与元素性质》讲义及练习
2024年新高一化学暑假提升精品讲义(人教版必修第一册)第18讲原子结构和元素周期表(解析版)
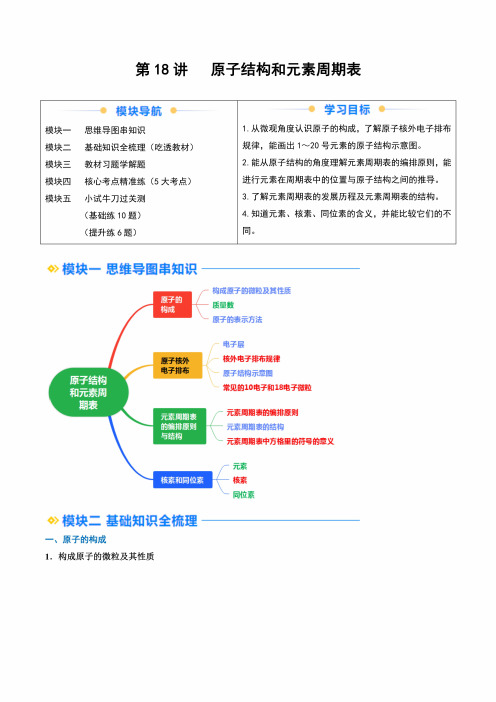
第18讲原子结构和元素周期表模块导航模块一 思维导图串知识模块二 基础知识全梳理(吃透教材)模块三教材习题学解题模块四核心考点精准练(5大考点)模块五小试牛刀过关测(基础练10题)(提升练6题)学习目标1 .从微观角度认识原子的构成,了解原子核外电子排布 规律,能画出1〜20号元素的原子结构示意图。
2. 能从原子结构的角度理解元素周期表的编排原则,能进行元素在周期表中的位置与原子结构之间的推导。
3. 了解元素周期表的发展历程及元素周期表的结构。
4. 知道元素、核素、同位素的含义,并能比较它们的不同。
模块一思维导图串知识模块二基础知识全梳理—、原子的构成i.构成原子的微粒及其性质[质子:相对质量近似为1,带1个原子核<单位正电荷原子〈〔中子:相对质量近似为1,不带电核外电子:带1个单位负电荷,质量很小<可忽略不计2.质量数(1)概念:将原子核内所有质壬和项的相对质量取近似整数值相加,所得的数值叫做质量数,常用A表示。
(2)构成原子的粒子间的两个关系①质量数(A)=质子数(Z)+中子数(N)o②质子数=核电荷数=核外电子数o3.原子的表示方法质量数一主出d质子数”zX—兀素符号如作为相对原子质量标准的Wc表示质子数为公质量数为的碳原子。
(1)一个信息丰富的符号解读"A------质量数Z一核电荷数或质子数H——离子所带的电荷数b——化学式中原子的个数(2)粒子中的电性关系①分子或原子:质子数=核外电子数②阳离子x〃+:质子数=核外电子数+〃③阴离子x〃—:质子数=核外电子数一〃二、原子核外电子排布1.电子层(1)概念:在含有多个电子的原子里,电子分别在能量不同的区域内运动。
我们把不同的区域简化为不连续的壳层,也称作电子层。
如图为电子层模型示意图:(2)不同电子层的表示及能量关系各电子层由内到外电子层数~~n~~[2~~n~~ri~~r6~~r?字母代号K L M N0P Q离核远近由近到远能量高低由低到亶2.核外电子排布规律下表是稀有气体元素原子的电子层排布,从中探究核外电子排布规律,回答相应的问题:各电子层的电子数核电荷数元素名称元素符号K L M N0P 2氮He210氧Ne2818Ar28836氟Kr2818854Xe281818886氛Rn281832188(1)电子总是尽可能先从内层排起,当一层充满后再填充下一层,即按K-L-M......顺序排列。
高三化学总复习《原子结构与性质》练习题及答案

高三化学总复习《原子结构与性质》练习题及答案学校:___________姓名:___________班级:___________考号:___________一、单选题1.含氰废水中氰化物的主要形态是HCN和CN-,CN-具有较强的配位能力,能与Cu+形成一种无限长链离子,其片段为;下列说法正确的是A.最高正价:① > ① > ①B.离子半径:① > ① > ①C.电负性:① > ① > ①D.金属性:① > ① > ①A.基态3Fe+的价电子轨道表示式为B.3sp杂化轨道模型:C.键线式为的有机物存在顺反异构D.Be原子最外层电子的电子云轮廓图为A .第三周期某元素的前5个电子的电离能如图1所示,该元素是AlB .铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示。
1个铝原子周围有12个镁原子最近且等距离C .某气态团簇分子结构如图3所示,该气态团簇分子的分子式为EF 或FED .图4所示是()236Zn NH +⎡⎤⎣⎦的部分结构,其中H -N -H 键的键角比3NH 的键角大,与3NH 中N 原子的孤电子对在该配离子中转化为成键电子对有关8.某螯合物(含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物)是一种矿物类饲料添加剂,结构简式如图所示。
已知W 、X 、Y 、Z 、M 为元素周期表中前四周期的元素,原子序数依次增大,Z 为地壳中含量最高的元素,M 形成的二价阳离子核外电子各层均全充满。
下列有关说法正确的是A .该物质中所有的非金属元素都分布在元素周期表的p 区B .该化合物中M 通过螯合作用形成的配位键是5C .第一电离能由小到大的顺序是:X Y Z <<D .Z 形成的简单气态氢化物的沸点比其同族的高9.铵明矾[NH 4Al(SO 4)2·12H 2O]是常用的食品添加剂。
下列判断正确的是A .原子半径:r(Al)<r(S)B .电负性:χ(O)<χ(S)C .第一电离能:I 1(N)<I 1(F)D .键角:NH 4+<H 2O 10.下列关于原子结构的叙述错误的是A .6027Co 中质子数是27,中子数是33 B .基态氮原子的最高能级上有5个电子B.d的一种酸的电子式:C .阿霉素与环糊精通过共价键结合形成超分子包合物D .阿霉素分子中,基态原子的第一电离能最大的元素为N二、实验题16.某课题组正在研究与3Cr +相关的课题,包括钢材酸洗废液中除去3Cr +原理以及含较高浓度3Cr +的工业废水中3Cr +资源化利用,过程如下:(1)配制模拟酸洗废液 配制pH 0.1=的4FeSO 和24H SO 混合溶液,向其中加入计算量的24Na CrO ,得到100mL 含铬量为500mg /L 的模拟酸洗废液。
高中化学(新教材)《原子结构与元素的性质》导学案+课后练习题

第四课时原子结构与元素的性质[明确学习目标] 1.了解碱金属、卤素在周期表中的位置。
2.了解碱金属、卤素原子结构特点,了解原子结构与元素性质的关系。
3.了解碱金属、卤素性质的相似性与递变性,并能初步运用原子结构理论解释。
学生自主学习碱金属元素1.结构特点(1)碱金属元素的原子结构(2)结构特点:碱金属元素原子结构的共同点是□16最外层电子数相同,都是1个电子,不同点是□17电子层数和原子半径不同,其变化规律是随着核电荷数的增加,电子层数逐渐□18增多,原子半径逐渐□19增大。
2.碱金属的性质(1)物理性质(2)化学性质①与O2反应②与水反应卤族元素1.卤族元素的原子结构及其特点卤族元素包括:□01F、Cl、Br、I(写元素符号)。
其原子结构示意图为:原子结构特点如下:(1)相似性:最外层电子数都是□027。
(2)递变性:F→I,核电荷数逐渐□03增大,电子层数逐渐□04增多,原子半径逐渐□05增大。
2.卤素单质的物理性质3.卤素单质的化学性质(1)与H2反应得出结论:从F2到I2,与H2反应剧烈程度依次□24减弱,生成气态氢化物的稳定性依次□25减弱。
(2)卤素单质间的置换反应得出结论:Cl2、Br2、I2三种卤素单质的氧化性由强到弱的顺序是□35 Cl2>Br2>I2,相应卤素离子的还原性由强到弱的顺序是□36I->Br->Cl-。
1.钾比钠活泼,钾能否从NaCl溶液中置换出钠?提示:不能,钾会先与NaCl溶液中的水反应。
2.如何从结构上理解碱金属元素从上到下金属性逐渐增强?提示:从上到下,碱金属元素原子半径逐渐增大,原子核对最外层电子的引力逐渐减弱,原子失电子变得越来越容易,故从上到下,金属性逐渐增强。
3.氯气能从NaBr溶液中置换出Br2,F2比Cl2活泼,F2能否从NaBr溶液中置换出Br2?提示:因为F2能与H2O发生反应(2F2+2H2O===4HF+O2),所以F2不能从其他卤化物的盐溶液中置换出卤素单质。
高中化学第一章原子结构与元素的性质章末核心素养整合讲义+精练(含解析)新人教版选修3

章末核心素养整合◇专题1 原子结构与元素的性质【例1】A、B、C、D、E代表5种元素.请填空:(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其基态原子的电子排布图为。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B-的结构示意图为,C元素在元素周期表的区.(3)D元素的正三价离子的3d能级为半充满状态,其基态原子的电子排布式为___________________________________________________________.试根据原子核外电子排布所遵循的原理解释D的二价阳离子具有较强的还原性,易被氧化为正三价离子的原因:___________________________________________________________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其基态原子的价电子排布式为.解析(1)A元素为N,核外7个电子分别在1s、2s、2p轨道上.(2)B-与C+的电子层结构都与氩相同,即核外都有18个电子,则B为Cl,C为K。
(3)D元素原子失去2个4s电子和1个3d电子后变成+3价离子,其原子的核外电子排布式为1s22s22p63s23p63d64s2,即26号元素铁。
(4)E元素基态原子的M层全充满,说明M层上的3s、3p、3d能级都充满电子,N 层没有成对电子,只有一个未成对电子,故电子排布式为1s22s22p63s23p63d104s1,价电子排布式为3d104s1,为铜元素。
答案(1)(2)s(3)1s22s22p63s23p63d64s2或[Ar]3d64s2Fe3+的核外电子排布式为1s22s22p63s23p63d5,3d轨道为半充满稳定结构,故Fe2+容易失去一个电子,被氧化为Fe3+(4)3d104s1【例2】A、B、C、D、E、F为硫酸铝钾和硫酸铝铵的组成元素,A原子核外只有1种运动状态的电子,B、C元素位于第二周期且原子半径B>C,D与C同主族,E、F元素的电离数据如下表:元素 E F第一电离能/(kJ·mol-1) 418.8 577.5第二电离能/(kJ·mol-1)3 0521 816。
高中人教版化学必修第1册学案:4.1 第3课时 原子结构与元素的性质 含答案
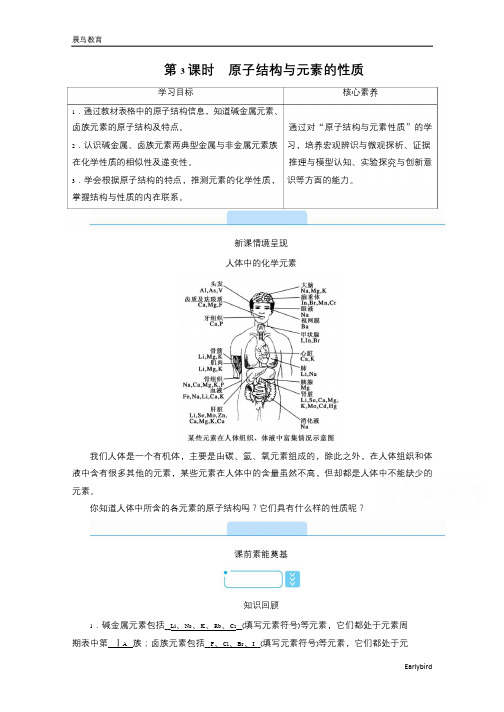
碱金属
钠
钾
单质
实验操作
实验现象
碱金属 单质 实验原理 实验结论
相同点 不同点
钠
__金属浮在水面上__;熔成闪亮的小球;小球四 处游动;发出嘶嘶的响声;反应后的溶液呈红色 __钾与水的反应有轻微爆炸声并着火燃烧__
钾
__2Na+ 2H2O===2NaOH+ H2↑__
__2K+2H2O===2KOH+H2↑__
Earlybird
晨鸟教育
知识点 问题探究:
课堂素能探究 碱金属元素单质化学性质的相似性和递变性
1.Li、Na、K 在空气中燃烧分别生成 Li2O、Na2O2、KO2(超氧化钾)说明什么问题?如何 保存单质钾?
2.请结合碱金属元素的原子结构的递变性探究其单质化学性质的递变性。 探究提示:1.说明 Li、Na、K 活动性依次增强;保存钾时保存在煤油中,以避免与空气 中的 O2、H2O 反应。 2.碱金属元素原子的最外层电子数都相等,但从 Li 到 Cs,随着核电荷数的增加,碱金 属元素原子的电子层数逐渐增多,原子核对核外电子的吸引能力逐渐减弱;失电子能力逐渐 增强,金属性逐渐增强。 知识归纳总结: 1.相似性
生成气态氢化物的稳定性依次__减弱__。
(2)卤素单质之间的置换反应 实验操作
实验现象
化学方程式
静置后,液体分层,上层接近无色,下层 呈__橙红__色
__Cl2+2KBr===2KCl+ Br2__
Earlybird
晨鸟教育
静置后,液体分层,上层接近无色,下层 呈__紫红__色
__Cl2+2KI===2KCl+I2__
__K__
__Rb__
__Cs__
符号
原子 结构
化学选修三第一章《原子结构与性质》知识点及全套练习题(含答案解析)

第一章原子结构与性质一。
原子结构1、能级与能层2、原子轨道3、原子核外电子排布规律(1)构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。
能级交错:由构造原理可知,电子先进入4s轨道,后进入3d轨道,这种现象叫能级交错.(说明:构造原理并不是说4s能级比3d能级能量低(实际上4s能级比3d能级能量高),而是指这样顺序填充电子可以使整个原子的能量最低。
)(2)能量最低原理原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理.(3)泡利(不相容)原理:一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓"表示),这个原理称为泡利原理。
(4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特规则。
比如,p3的轨道式为,而不是。
洪特规则特例:当p 、d 、f 轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。
即p0、d0、f0、p3、d5、f7、p6、d10、f14时,是较稳定状态.前36号元素中,全空状态的有4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3、15P 3s23p3、24Cr 3d54s1、25Mn 3d54s2、33As 4s24p3;全充满状态的有10Ne 2s22p6、18Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。
4、基态原子核外电子排布的表示方法(1)电子排布式①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K :1s22s22p63s23p64s1.②为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的元素符号外加方括号表示,例如K :[Ar]4s1。
第1讲 原子结构 元素周期表(讲义)-2022年暑假新高一化学衔接班课程 试卷及答案

第1讲原子结构元素周期表【学习目标】1.知道人类认识原子结构的历程;2.认识原子核的构成,了解核素、同位素的概念;3.了解原子核外电子排布的排布规律;4.了解元素周期表的结构和编排规律。
【基础知识梳理】一、人类认识原子结构的历程1.德谟克利特的古代原子学说2.道尔顿的近代原子学说——实心球模型英国科学家道尔顿总结了一些元素形成化合物时的_________关系,提出了原子学说。
认为物质由________构成,原子不能被创造,也不能被毁灭,在化学变化中不可再分割。
3.汤姆生的“葡萄干面包式”原子结构模型英国物理学家汤姆生他在1897年发现了原子中存在_____,并用实验方法测出了电子的质量。
他推测这种粒子均匀地嵌在云状的______________中。
4.卢瑟福的带核原子结构模型英国物理学家卢瑟福根据______________现象,提出了带核的原子结构模型。
推测原子中心存在_________,带_________,电子带负电,在其周围_________,就像行星围绕太阳运转一样。
5.玻尔的轨道原子结构模型丹麦物理学家玻尔指出:原子核外,电子在一系列__________________上运动,每个轨道都具有一个确定的_________;核外电子在这些__________________上运动时,既不放出能量,也不吸收能量。
6.电子云模型(现代原子结构学说)20世纪初,科学家提出,原子核外电子的运动不遵循经典力学的原理,必须用_________模型描述核外电子的运动。
即现代量子力学模型(电子云模型)。
【例1】如图所示的原子结构模型的演变图中,(1)为道尔顿实心球式原子模型,(2)为卢瑟福行星运转式原子模型,(3)为汤姆生葡萄干面包式原子模型,(4)为近代量子力学原子模型,(5)为玻尔轨道式原子模型。
其中符合历史演变的顺序的一组为()A.(1)(3)(2)(5)(4) B.(1)(2)(3)(4)(5)C.(1)(5)(3)(2)(4) D.(1)(3)(5)(4)(2)二、认识原子核1.原子的构成原子是由带正电的_________和带负电的_________构成的,原子核又是由_________和_________构成的,_________带正电,_________不带电。
高考化学《原子结构与性质》练习题(含答案)

高考化学《原子结构与性质》练习题(含答案)一、选择题(共10题)1.某元素原子外围电子构型为3d54s2,其应在( )A.第四周期ⅡA族B.第四周期ⅡB族C.第四周期ⅦA族D.第四周期ⅦB族2.下列对电负性的理解不正确的是( )A.电负性是人为规定的一个相对数值,不是绝对标准B.元素电负性的大小反映了元素对键合电子吸引力的大小C.元素的电负性越大,则元素的非金属性越强D.元素的电负性是元素固有的性质,与原子结构无关3.下列各组原子中,化学性质一定相似的是( )A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子C.2p轨道上只有2个电子的X原子与3p轨道上只有2个电子的Y原子D.最外层都只有一个电子的X、Y原子4.下列说法中正确的是( )A.第三周期所有元素中钠的第一电离能最小B.钠的第一电离能比镁的第一电离能大C.在所有元素中,氟的第一电离能最大D.钾的第一电离能比镁的第一电离能大5.下列化学用语的表述错误的是( )A.18O2-离子的结构示意图:B.甲烷分子的比例模型:C.二氧化碳分子的电子式:D.氮原子核外电子排布的轨道表示式:6.下列说法中正确的是( )A.所有金属元素都分布在d区和ds区B.最外层电子数为2的元素都分布在s区C.元素周期表中ⅢB族到ⅡB族10个纵列的元素都是金属元素D.s区均为金属元素7.已知X 、Y 是主族元素,I 为电离能,单位是kJ·mol -1。
请根据下表数据判断,下列选项错误的是( ) 元素I 1 I 2 I 3 I 4 X500 4 600 6 900 9 500 Y 580 1 800 2 700 11 600 A.元素X 的常见化合价是+1价B .元素Y 是第ⅢA 族元素C .元素X 与氯形成化合物时,化学式可能是XClD .若元素Y 处于第三周期,它可与冷水剧烈反应8.下列说法正确的是( )A .原子核外电子排布式为1s 2的原子与原子核外电子排布式为1s 22s 2的原子化学性质相似B .Zn 2+的最外层电子排布式为3s 23p 63d 10C .基态铜原子的外围电子排布图:D .基态碳原子的最外层电子排布图: 9.已知X 、Y 元素同周期,且电负性X >Y ,下列说法不正确的是( )A .X 与Y 形成化合物时,X 显负价,Y 显正价B .第一电离能Y 可能小于X ,也可能大于XC .含氧酸的酸性:X>YD .气态氢化物的稳定性:H m Y 小于H n X10.下列各组表述中,两个原子不属于同种元素原子的是( )A .3p 能级有一个空轨道的基态原子和核外电子的排布式为1s 22s 22p 63s 23p 6的原子B .2p 能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s 22p 6的原子C .M 层全充满而N 层为4s 2的原子和核外电子排布式为1s 22s 22p 63s 23p 64s 2的原子D .最外层电子数是核外电子总数15的原子和最外层电子排布式为4s 24p 6的原子 二、非选择题(共5题)11.(1)下面是s 能级与p 能级的原子轨道图:请回答下列问题:s电子的原子轨道呈________形,每个s能级有________个原子轨道;p电子的原子轨道呈________形,每个p能级有________个原子轨道。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高一化学提高班《原子结构与元素性质》讲义及练习一.原子核外电子的运动特征原子核外的电子是既不能静止不动也不能像行星绕太阳一样,在确定的轨道上做圆周运动,原子核外的电子的运动有以下特征(相对于宏观物体而言):①电子质量小(10-31Kg)带负电,运动的空间范围小(10-10m),运动的速度极快(接近光速)。
②无确定的轨道;不能描画其运动轨迹;不能同时准确地测定电子在某一时刻所处的位置和运动的速度(海森堡-Heisenberg测不准原理);仅能指出它在原子核外空间某处出现机会的多少(用电子云表示)。
③电子云:电子云是电子在核外某一区域的单位体积内出现的几率大小分布的一种形象化的描述方法;每一个小黑点不是代表一个电子,而是代表一个电子的一个可能的瞬间位置;离核愈近(远),电子在单位体积空间出现的机会愈多(少),电子云密度(几率密度)越大(小);电子云是用统计方法对电子运动规律的描述。
二、核外电子运动状态的描述核外电子的运动状态是由是由四个变量(或四个量子数:n、l、m、m s)来描述的。
1.电子层数(主量子数)n:表示的是核外电子距原子核的平均距离。
n = 1, 2, 3, 4, 5……(只能取正整数),电子层符号:K, L, M, N……电子层能量:K<L<M<N<O……2.电子亚层(角量子数)l:表示的是电子云的形状,不同的电子亚层能量不同。
l = 0, 1, 2, 3 ……, n-1。
(取值受n的限制),电子亚层符号:s, p, d, f, g……电子亚层能量:s< p< d< f<g3.电子云的伸展方向数(磁量子数)m:不同形状的电子云在空间的伸展方向数是不同的。
m = 0, ±1, ±2, ……, ±l。
(取值受l的限制)s电子云(m = 0),球形;p电子云(m = 0, ±1),亚铃形,有三个方向p x p y p z(称三个简并轨道,即能量相同的轨道)。
d电子云(m = 0, ±1, ±2)有五个方向dxy dxz dyz dx2-y2dz2(称五个简并轨道,即能量相同的轨道)f电子云(m = 0, ±1, ±2, ±3)有七个方向。
4.电子的自旋方向(自旋量子数)m s:电子不仅在核外空间不停的运动,而且还作自旋运动,自旋状态共有两种,顺时针“↑”和逆时针“↓”。
1.轨道的能量由电子层(n)和电子亚层(l)决定;n越小轨道能量越低,n确定时,l值越小电子亚层的能量也越低。
2.原子轨道数由n、l和m决定;n=1时,只有一个轨道,即1s;n=2时,有四个轨道,即2s(1个), 2p(3个);n=3时,有9个轨道,即3s(1个), 3p(3个), 3d(5个);n=n时,有n2个轨道;3.电子运动状态数由n、l、m和m s决定,即第n电子层上共有2 n2种不同的运动状态。
例1:下列说法是否正确?如不正确,应如何改正?(1)s电子绕核旋转,其轨道为一圆圈,而p电子是走∞字形。
(2)主量子数为1时,有自旋相反的两条轨道。
(3)主量子数为3时,有3s、3p、3d、3f四条轨道。
四、核外电子的排布规律1、能量最低原理:(1)电子总是尽先排在能量最低的轨道,而后依次进入能量较高的轨道。
规律:①当n相同,l不同时,l越大,能量则越大。
例如:E3s<E3p<E3d②当l相同,n不同时,n越大,能量则越大。
例如:E1s<E2s<E3s<E4s③“能级交错”现象。
例如Es4<Ed3<Ep4,Es6<Ef4<Ed5<Ep6。
2、泡利(Pauli)不相容原理(有三种说法):①每个原子轨道上最多容纳两个电子,且这两个电子必须具有不同的自旋。
②在同一个原子中,不可能有两个电子处于完全相同的运动状态。
③原子中两个电子所处状态的四个量子数(n、l、m、m s)不可能完全相同。
例2:按照能量最低原理和泡利不相容原理,请写出B原子的电子排布式并画出轨道表示式。
3、洪特规则:电子在能量相同的轨道上排布时,尽量分占不同的轨道且自旋平行,这样的排布方式使原子的能量最低。
可见,洪特规则是能量最低原理的一个特例。
例3:按照能量最低原理和泡利不相容原理及洪特规则,请写出C、N、O、F、Ne原子的电子排布式并画出轨道表示式。
4、全满、半满、全空规则:洪特规则的补充规则:等价轨道全充满、半充满、全空的状态比较稳定。
相对稳定的状态:例4:分别写出19号元素K、24号元素Cr和29号元素Cu的电子排布式。
5、核外电子的排布表示方法小结:根据以上电子排布的三条规则,就可以确定各元素原子基态时的排布情况,电子在核外的排布情况简半充满:s1,p3,d5,f7全空:s0,p0,d0,f0全充满:s2,p6,d10,f1412称电子构型,表示的方法通常有两种。
①轨道表示法如:C 一个方框表示一个轨道。
↑、↓表示不同自旋方向的电子。
②电子排布式(亦称电子组态)如:C 1s 2 2s 2 2p 2为了简化,常用“原子实”来代替部分内电子层构型。
所谓原子实,是指某原子内电子层构型与某一稀有气体原子的电子层构型相同的那一部分实体。
如26Fe :1s 2 2s 22p 63s 23p 63d 6 4s 2可表示为[Ar]3d 64s 2 例5.下列各组量子数哪些是不合理的,为什么?(1)n = 2,l = 1,m = 0 (2)n = 2,l = 2 m = -1 (3)n = 3,l = 0,m = 0 (4)n = 3,l = 1,m = +1 (5)n = 2,l = 0,m = -1 (6)n = 2,l = 3,m = +2 例6.试写出下列微粒的电子排布式(1)13Al 3+ (2)17Cl -(3)24Cr (4)47Ag 例7.试比较Li +离子的2s 和2p 轨道能量的高低。
例8. 某元素原子共有3个价电子,其中一个价电子的四个量子数为n = 3、l = 2、m = 2、m s = +21。
试回答:(1)写出该元素原子核外电子排布式(2)写出该元素的原子序数,指出在周期表中所处的分区、周期数和族序数,是金属还是非金属以及最高正价化合价。
例9.已知某元素在氪前,当此元素的原子失去3个电子后,它的角量子数为2的轨道内电子恰好为半充满,试推断该元素。
五、电离能(电离势)1.定义:元素的气态原子在基态时失去一个电子成为一价气态正离子所需要的能量,称元素的第一电离能。
基态M (g )−→−-e M +(g) −→−-e M 2+(g) −→−-e M 3+(g) ,例如:Al(g) −→−-eAl +(g)…… 第一电离能I 1= 578 kJ ·mol -1;第二电离能I 2=1823 kJ ·mol -1; 第三电离能 I 3=2751 kJ ·mol -1元素第一电离能的周期性2.规律:①各级电离能的大小顺序:I 1< I 2< I 3②电离能越大,则越难失电子,金属性越弱;电离能越小,则越易失电子,金属性越强; ③同一周期从左到右I 1逐渐增大;稀有气体元素的原子是同一周期中I 1最高的。
④同一族从上到下第一电离能逐渐减小;⑤具有全充满和半充满电子构型的原子的电离能比同周期的相邻元素原子的电离能高。
如上图中的Be 、N 、Mg 、P 、Zn 、As 、Cd 、Hg 等。
六、电子亲合能(电子亲合势)1.定义:一个基态的气态原子得到一个电子形成负一价气态阴离子所放出的能量。
称该原子的第一电子亲合能。
注意:习惯上把放出能量的电子亲合能E A 用正号表示。
O(g)+e −→−O -(g) E A =141.8 kJ ·mol -12.规律:①E A 反映原子得电子难易程度。
E A 大,易得电子,非金属性强。
②活泼的非金属一般具有较高的电子亲合势,电子亲合势越大,表明该元素越易获得电子。
③金属元素的电子亲合势都比较小,说明金属中通常情况下难获得电子形成阴离子。
④半充满,全充满时E A 小,例如:氮族,稀有气体。
⑤同一主族自上而下E A 呈减小趋势,但第二周期例外,如:F 、O 、N 比Cl 、S 、P 小。
(解释:第2周期的非金属元素因原子半径最小,电子密度最大,电子间排斥力很强,以致当加一个电子形成负离子时,放出的能量减小)⑥元素的第二电子亲合能都是负值。
(因为结合第二个电子时不是放出能量,而是吸收能量) 七、电负性:1.定义:电负性是用来表示元素相互化合时,原子对电子吸收能力大小的一个量。
或者说电负性是元素的原子在分子中吸引电子的能力。
1932年化学家鲍林(L. Pauling)指出:“电负性是元素的原子在化合物中吸引电子能力的标度。
”并提出:H的负电性为2.1,其它原子的负电性均为相对值,以Xp 表示。
2.规律: ①电负性数值越大, 表示该元素的原子吸引电子的能力就越强; 反之, 电负性数值越小, 表示该元素的原子吸引电子的能力就越弱。
②周期表中从左到右电负性逐渐增大,从上到下电负性逐渐减小。
③电负性可用于区分金属和非金属。
金属的电负性一般小于1.9,而非金属元素的电负性一般大于2.2,处于1.9与2.2之间的元素人们把它们称为“类金属”,它们既有金属性又有非金属性。
④除稀有气体元素外,电负性最高的元素是周期表是右上角的氟(F 4.19),电负性最小的元素是周期表是左下角的铯(Cs 0.66)⑤当其它条件相同时,两个电负性相差很大的元素形成的是离子键,电负性相差不大的两种元素形成的是共价键。
在共价键中两元素的电负性差别越大,则共价键的极性也越强,共用电子对偏向电负性大的原子越厉害。
At 270Po 183 Bi 91.3 Pb 35.1 Tl 19.3 Cs 45.5 I 295 Te 190 Sb 103Sn 107In 28.9Rb 46.9 Br 325 Se 195As 78.2 Ge 119 Ga 28.9 K 48.4 Cl 349S 200 P 72.0Si 134 Al 42.5 Na 59.6 F 328 O 141 N -7 C 122 B 26.7 Li 59.6 H 72.8部分元素的第一电子亲合能(kJ ·mol -1)RnXe Kr Ar Ne He At (2.39)I 2.36 Br 2.68 Cl 2.87 F 4.19 Po (2.19) Te 2.16 Se 2.42 S 2.59 O 3.61 Bi (2.01) Sb 1.98 As 2.21 P 2.25 N 3.07 Pb 1.85 Sn 1.82 Ge 1.99 Si 1.92 C 2.54 Tl 1.79 In 1.66 Ga 1.76 Al 1.61 B 2.05 Ba 0.88 Sr 0.96 Ca 1.03 Mg 1.29 Be 1.58 Cs 0.66 Rb 0.71 K 0.73 Na 0.87 Li 0.91 H 2.1部分元素的电负性高一化学提高班《原子结构与元素性质》练习题自主招生典型例题:【例1】写出Fe3+离子的电子组态,它有几个未成对电子?【例2】请应用原子核外电子的排布规律和元素周期律的有关知识预测:(1)已经制得的114号元素的价电子构型怎样?它应位于周期表的什么位置?(2)我们已经知道描述核外电子运动状态的一些电子亚层符号,如s、p、d、f,如果接下来的电子亚层符号为g,则第一个包含g亚层电子的元素的原子序数应为多少?(3)尚未填充的第八周期的元素可能有多少种?【例3】镧系元素从左到右,原子半径减小的幅度变小,这种现象称为镧系收缩,说说出现这一现象的原因。
