高考化学-不定项选择专项训练第一部分试题与答案
2020年高中化学学业水平考试不定项选择题专题训练及答案

不定项选择题专题训练2020选择题( 在每小题给出的四个选项中,有一个或两个选项符合题意,全部选对的得4分,选对但选不全的得2分,有选错的得0分)1.关于物质用途的说法不正确...的是( ) A .SiO 2用于制作光导纤维 B .Fe 2O 3用于红色油漆和涂料C .活性炭用于杀菌、消毒D .过氧化钠用于呼吸面具的供氧剂2.下列反应为吸热反应的是( )A .CaO 和H 2O 反应B .稀盐酸和NaOH 溶液反应C .Mg 和稀硫酸反应D .Ba(OH)2·8H 2O 晶体和NH 4Cl 晶体反应 3.下列有关实验操作不正确...的是A .给盛有32体积液体的试管加热 B .用药匙取用粉末或小颗粒状的固体 C .用胶头滴管滴加少量液体D .倾倒液体时试剂瓶标签面向手心4.下列有关煤、石油、天然气等资源的说法中,正确的是 A .煤、石油、天然气是不可再生资源 B .石油是纯净物 C .天然气的主要成分是甲烷 D .煤是单质 5.下列物质属于纯净物的是A .空气B .盐酸C .胆矾D .液氯 6.下列有机物,既能跟氢氧化钠反应,又能发生酯化反应的是A .乙醇B .葡萄糖C .乙酸乙酯D .乙酸7.某工厂发生Cl 2泄漏,以下应对措施中主要是基于Cl 2的物理性质考虑的是A .向远离污染源的高处撤离B .向被污染的土壤洒石灰C .用浸有纯碱溶液的毛巾捂住口鼻迅速撤离D .来不及撤离时可用纯碱溶液浸湿的棉被堵好门窗 8.下图所示的某有机反应,其反应类型为A .酯化反应B .取代反应C .水解反应D .加成反应9.下列互为同位素的是( )A .CH 4和CH 3CH 3B .12 6C 和146C C .CH 3CH 2CH 2CH 3和CH 3CH(CH 3)CH 3 D.O 2和O 3 10.下列化学用语正确的是( )A .甲烷分子的比例模型:B .乙烷的分子式:C 2H 6C .HCl 的电子式:H ×·Cl··,·· ··D .N 原子结构示意图:○+7+ + 氢原子 碳原子 氧原子11.下列物质属于电解质的是()A.KCl B.Cu C.蔗糖D.石墨12.下列物质属于电解质的是()A.酒精B.稀硫酸C.CO2D.NaCl13.下列离子方程式书写不正确...的是A.稀硫酸与铁锈(主要成分为Fe2O3)反应:Fe2O3+6H+=2Fe3++3H2OB.大理石与稀盐酸反应:CO23-+2H+=H2O+CO2↑C.NaHCO3溶液与稀盐酸反应:HCO-3+H+=H2O+CO2↑D.FeCl3溶液与KI溶液反应:Fe3++2I―=Fe2++I214.对下列反应类型的判断正确的是A.氯气与甲烷在光照条件下反应(取代反应)B.乙烯与水在催化剂等条件下反应(取代反应)C.乙烯与溴的四氯化碳溶液反应(加成反应)D.氯气与苯在氯化铁催化下反应(加成反应)15.下列实验过程中,不会..产生气体的是16.下列离子方程式书写正确的是A.碳酸钙与盐酸反应:-2CO+2H+=CO2↑+H2O3B.锌与稀硫酸反应:Zn+2H+=Zn2++H2↑C.钠与水反应:Na+2H2O=Na++2OH-+H2↑D.硫酸与BaCl2溶液反应:Ba2++-2SO=BaSO4↓417.下列物质的性质与用途对应关系正确的是选项性质用途A Cu具有良好的导电性Cu可以用作制导线的原料B Na具有强还原性Na可以置换CuSO4溶液中的Cu2+C Fe2O3呈红棕色Fe2O3常用作红色油漆和涂料D晶体硅熔点高、硬度大晶体硅常用作半导体材料18.输送氯气的管道有泄漏时,可用浓氨水检测泄漏的位置,检测时发生的反应为:8NH3(g)+3Cl2(g)=6NH4Cl(s)+N2(g)。
2024年上海市高考化学试卷(含答案)

2024年上海市普通高中学业水平等级性考试化学试卷考生注意:1. 试卷满分100分, 考试时间60分钟。
2.本考试分设试卷和答题纸。
答题前,务必在答题纸上填写学校、姓名、座位号(考号),并将核对后的条形码贴在指定位置上。
作答必须涂或写在答题纸上,在试卷上作答一律不得分。
3.选择类试题中,标注“不定项”的试题,每小题有1~2个正确选项,只有1个正确选项的,多选不给分,有2个正确选项的,漏选1个给一半分,错选不给分;未特别标注的试题,每小题只有1个正确选项。
相对原子质量: Mg-24Al-27Ca-40Br-80一、氟及其化合物氟元素及其化合物具有广泛用途。
1.下列关于氟元素的性质说法正确的是 ( )A.原子半径最小B.原子电离能最大C.元素的电负性最强D.最高正化合价为+72. (不定项) 下列关于18F与19F说法正确的是。
A.是同种核素B.是同素异形体C. ¹⁹F比¹⁸F多一个电子D. ¹⁹F比¹⁸F多一个中子3.萤石 (CaF₂)与浓硫酸共热可制备HF气体,写出该反应的方程式:;该反应中体现浓硫酸的性质是( )A.强氧化性B.难挥发性C.吸水性D.脱水性4.液态氟化氢(HF)的电离方式为:3HF X−+HF2−,其中X为。
HF₂的结构为F——H·····F-,其中F⁻与HF依靠相连接。
5.氟单质常温下能腐蚀Fe、Ag等金属,但工业上却可用Cu制容器储存,其原因是。
1/13PtF6是极强的氧化剂, 用 Xe 和PtF₆可制备稀有气体离子化合物。
六氟合铂酸氙([XeF]⁺[Pt₂F₁₁]⁻)的制备方式如图所示:6.上述反应中的催化剂为( )A. PtF₆B. PtF₇C. F⁻D. XeF⁺7.(不定项)上述过程中属于氧化还原反应的是。
A.②B.③C.④D.⑤8.氟气通入氙(Xe) 中会产生XeF₂、XeF₄、XeF₆三种氟化物气体。
2021高考化学二轮复习不定项选择题专练含解析打包12套
不定项选择题专练(1)(本练共7小题,每小题4分,共28分。
每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
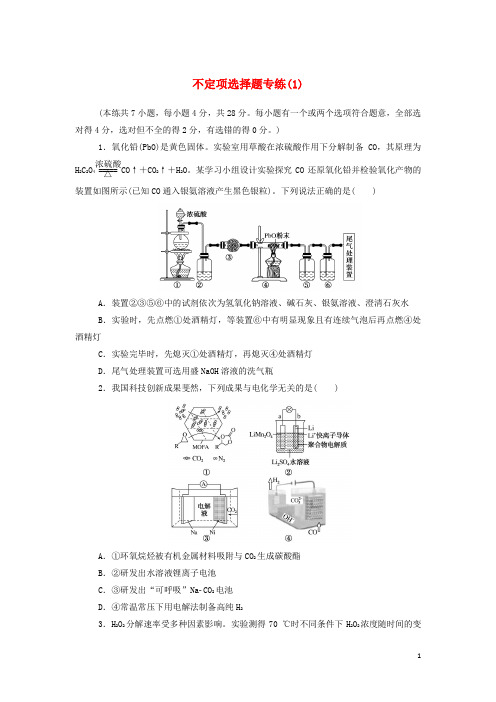
)1.氧化铅(PbO)是黄色固体。
实验室用草酸在浓硫酸作用下分解制备CO ,其原理为H 2C 2O 4=====浓硫酸△CO↑+CO 2↑+H 2O 。
某学习小组设计实验探究CO 还原氧化铅并检验氧化产物的装置如图所示(已知CO 通入银氨溶液产生黑色银粒)。
下列说法正确的是( )A .装置②③⑤⑥中的试剂依次为氢氧化钠溶液、碱石灰、银氨溶液、澄清石灰水B .实验时,先点燃①处酒精灯,等装置⑥中有明显现象且有连续气泡后再点燃④处酒精灯C .实验完毕时,先熄灭①处酒精灯,再熄灭④处酒精灯D .尾气处理装置可选用盛NaOH 溶液的洗气瓶2.我国科技创新成果斐然,下列成果与电化学无关的是( )A .①环氧烷烃被有机金属材料吸附与CO 2生成碳酸酯B .②研发出水溶液锂离子电池C .③研发出“可呼吸”NaCO 2电池D .④常温常压下用电解法制备高纯H 23.H 2O 2分解速率受多种因素影响。
实验测得70 ℃时不同条件下H 2O 2浓度随时间的变化如图所示。
下列说法正确的是( )甲乙丙丁A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大4.短周期元素X、Y、Z、W的原子序数依次增大,X和W为同主族元素,Z的单质能溶于W的最高价氧化物对应的水化物的稀溶液,却不溶于其浓溶液。
由这四种元素中的一种或几种组成的物质存在如下转化关系,甲+乙→丙+W,其中甲是元素X的氢化物,其稀溶液可用于伤口消毒,乙为一种二元化合物,常温下0.1 mol·L-1丙溶液的pH=13,下列说法错误的是( )A.X和Y、W均至少能形成两种化合物B .乙和丙均为既含有离子键又含有共价键的离子化合物C .四种元素简单离子半径中Z 的最小D .气态氢化物的稳定性:X<W5.已知H 2A 为二元弱酸,25 ℃时,用Na 2A 溶液吸收H 2A ,且最终吸收H 2A 的量小于原溶液中Na 2A 的物质的量,其吸收液pH 随n HA -n A 2-变化的关系如图所示,以下说法不正确的是( )A .NaHA 溶液中:c (H +)>c (OH -)B .Na 2A 溶液中:c (A 2-)>c (HA -)C .H 2A 的第一步电离常数为10-7.2 D .当吸收液呈中性时:c (Na +)=c (HA -)+2c (A 2-)6.利用废旧电池铜帽(含Cu 、Zn)制取海绵铜(Cu),并得到硫酸锌溶液的主要流程如下(反应条件已略去): 已知:2Cu +2H 2SO 4+O 2=====△2CuSO 4+2H 2O下列说法不正确的是( )A .过程Ⅱ中分离操作的名称为过滤,该操作过程中使用到的玻璃仪器有烧杯、漏斗、玻璃棒B .溶液A 中的溶质有H2SO4、CuSO4、ZnSO4C .上述流程中加入的物质B 为锌,物质D 为盐酸D. A ~E 中含铜、锌两种元素的物质有A 和C7.锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。
高中化学选择性必修一 高考训练 课时作业 习题 第1章综合测评

第1章综合测评(时间:90分钟满分:100分)一、选择题(本题共10小题,每小题2分,共20分。
每小题只有一个选项符合题意)1.用简易量热计测定中和反应的反应热的实验中,下列叙述错误的是()A.向量热计中加入盐酸,盖上杯盖,搅拌后的温度即为初始温度B.实验中选用不同的酸和碱时,只要操作正确,测得的反应热一定相同C.向量热计中加入碱液时,碱液的温度应与酸液的温度相同D.两溶液混合后,轻轻搅动溶液,准确读取混合溶液的最高温度为最终温度2.下列关于能量变化的说法正确的是()A.“冰,水为之,而寒于水”,说明相同质量的水和冰相比较,冰的能量高B.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种C.已知C(s,石墨)===C(s,金刚石)ΔH>0,则金刚石比石墨稳定D.化学反应遵循质量守恒的同时,也遵循能量守恒3.如图所示,烧杯中盛的是水,铁圈和银圈直接相连,在接头处用一根绝缘细丝吊住,并使之平衡。
小心地从烧杯中央滴入CuSO4溶液,反应一段时间后,观察到的现象是()A.两圈仍保持平衡B.有气泡产生,两圈摇摆不定C.铁圈向下倾斜D.银圈向下倾斜4.碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:①H2(g)+I2(?)⇌2HI(g)ΔH=-9.48 kJ·mol-1②H2(g)+I2(?)⇌2HI(g)ΔH=+26.48 kJ·mol-1下列判断正确的是()A.②中反应物的总能量比①中反应物的总能量低B.①中的I2为固态,②中的I2为气态C.①的产物比②的产物热稳定性更好D.1 mol固态碘升华时将吸热17 kJ5.实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量,1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。
下列热化学方程式的书写正确的是()①CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=890.3 kJ·mol-1②CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890.3 kJ③CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1④2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1A.仅有②④B.仅有④C.仅有②③④D.全部符合要求6.利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。
高三化学选择题专项训练及答案

高三化学选择题专项训练(2)一、选择题 (本题包括8小题,每小题4分,共32分。
每小题只有一个选项符合题意)1、下列物质一定不属于...有机高分子的是 A .树脂镜片 B .维生素 C .高碳钢 D .不粘锅上防粘物质2、不能..用有关胶体的性质来解释的现象是 A . 黑夜中观察到探照灯光在移动B .在氯化铁溶液中滴入硫氰化钾溶液,溶液变红色C .不同牌号的墨水,吸入同一支钢笔,造成钢笔堵塞D .水泥厂和冶金厂利用高压电来除去烟尘3、已知(l ))g (O 21)g (H 22+ =H 2O (g ) △H 1=a kJ ·1mol -(2))g (O )g (H 222+ =2H 2O (g ) △H 2=b kJ ·1mol -(3))g (O 21)g (H 22+=H 2O (l ) △H 3=c kJ ·1mol -(4))g (O )g (H 222+ =2H 2O (l ) △H 4=d kJ ·1mol -下列关系式中正确的是:A .a <c <0B .b >d >0C .2a =b <0D .2c =d >0 4、下列反应的离子方程式正确的是: A .次氯酸钙溶液中通入过量二氧化碳:Ca 2++2ClO -+H 2O +CO 2 = CaCO 3↓+2HClO B .硫酸亚铁溶液中加入过氧化氢溶液:Fe 2+ +2H 2O 2 +4H + = Fe 3++ 4H 2OC .用氨水吸收少量二氧化硫:NH 3·H 2O +SO 2 = NH 4++ HSO 3- D .硝酸铁溶液中加过量氨水:Fe 3+ +3NH 3·H 2O = Fe(OH)3↓+3NH 4+5、下列有关叙述正确的是A .电解质的导电性和金属晶体的导电性都随温度的升高而降低B .“加碘食盐”“高钙牛奶”“含氟牙膏”“富硒营养品”等等,这里的碘、钙、氟、硒指的是分子C .“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高D . 电解水制取氢气和氧气时,通常加入硫酸钠等强电解质,这说明强电解质的导电性比弱电解质的强6、将10 mL 淀粉胶体和5 mL 氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图所示),2 min后分别取袋内和烧杯内液体进行实验。
河北省2022年高考[化学]考试真题与答案解析
![河北省2022年高考[化学]考试真题与答案解析](https://img.taocdn.com/s3/m/6f3d77d5c9d376eeaeaad1f34693daef5ef71361.png)
河北省2022年高考[化学]考试真题与答案解析一、单项选择题本题共9小题,每小题3分,共27分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.定窑是宋代五大名窑之一,其生产的白瓷闻名于世。
下列说法正确的是()A.传统陶瓷是典型的绝缘材料SiO MgOB.陶瓷主要成分为和2C.陶瓷烧制的过程为物理变化D.白瓷的白色是因铁含量较高2.茯苓新酸是从中药茯苓中提取的一种化学物质,具有一定生理活性,其结构简式如图。
DM关于该化合物,下列说法正确的是()KMnOA.可使酸性溶液褪色4B.可发生取代反应和加成反应HC.可与金属钠反应放出2D.分子中含有3种官能团3.化学是材料科学的基础。
下列说法错误的是()A.制造5G芯片的氮化铝晶圆属于无机非金属材料B.制造阻燃或防火线缆的橡胶不能由加聚反应合成C.制造特种防护服的芳纶纤维属于有机高分子材料D.可降解聚乳酸塑料的推广应用可减少“白色污染”暂无4-7题,后续如有题目会及时更新~8.溶液可作为替代氟利昂的绿色制冷剂。
合成工艺流程如下:LiBr LiBr下列说法错误的是( )A ,还原工序逸出的用溶液吸收,吸收液直接返回还原工序2Br NaOHB .除杂工序中产生的滤渣可用煤油进行组分分离C .中和工序中的化学反应为2322Li CO 2HBrCO 2LiBr H O+↑++D .参与反应的为1∶1∶1()()224n Br :n(BaS):n H SO 暂无9题,后续如有题目会及时更新~二、不定项选择题本题共4小题,每小题4分,共16分。
在每小题给出的四个选项中,有一项或两项符合题目要求。
若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题得0分。
暂无10题,后续如有题目会及时更新~11.在沸石催化下,萘与丙烯反应主要生成二异丙基萘M 和N 。
EY下列说法正确的是( )A .M 和N 互为同系物B .M 分子中最多有12个碳原子共平面C .N 的一溴代物有5种D .萘的二溴代物有10种暂无12题,后续如有题目会及时更新~13.恒温恒容条件下,向密闭容器中加入一定量X ,发生反应的方程式为①;②X Y 。
江苏省2020年高考[化学]考试真题与答案解析
![江苏省2020年高考[化学]考试真题与答案解析](https://img.taocdn.com/s3/m/4747880e657d27284b73f242336c1eb91a3733a4.png)
江苏省2020年高考:化学卷考试真题与答案解析可能用到的相对原子质量H1 C12 N14 O16 Na23 Mg24 Al27 Cl35.5 K39 Ca40 Fe56 Cu64 Zn65 Br80 Ag108 Il27一、单项选择题本题包括10小题,每小题2分,共计20分。
每小题只有一个选项符合题意。
1.打赢蓝天保卫战,提高空气质量。
下列物质不属于空气污染物的是A .PM2. 5B .O 2C .SO 2D .NO2.反应可用于氯气管道的检漏。
下列表示相关微粒的化学用语正确的32428NH 3Cl 6NH Cl N +=+是A .中子数为9的氮原子:B .N 2分子的电子式:97N N NC .Cl 2分子的结构式:Cl—ClD .Cl −的结构示意图:3.下列有关物质的性质与用途具有对应关系的是A .铝的金属活泼性强,可用于制作铝金属制品B .氧化铝熔点高,可用作电解冶炼铝的原料C .氢氧化铝受热分解,可用于中和过多的胃酸D .明矾溶于水并水解形成胶体,可用于净水4.常温下,下列各组离子在指定溶液中能大量共存的是A .氨水溶液:Na +、K +、OH −、10.1m ol L -⋅3NO -B .盐酸溶液:Na +、K +、、10.1m ol L -⋅24SO -23SiO -C .KMnO 4溶液:、Na +、、I −10.1m ol L -⋅4NH +3NO -D .AgNO 3溶液:、Mg 2+、Cl −、10.1m ol L -⋅4NH +24SO -5.实验室以CaCO 3为原料,制备CO 2并获得CaCl 2·6H 2O 晶体。
下列图示装置和原理不能达到实验目的的是A .制备CO2 B .收集CO2C .滤去CaCO3 D .制得CaCl 2﹒6H 2O6.下列有关化学反应的叙述正确的是A .室温下,Na 在空气中反应生成Na 2O 2B .室温下,Al 与4.0 mol·L −1NaOH 溶液反应生成NaAlO 2C .室温下,Cu 与浓HNO 3反应放出NO 气体D .室温下,Fe 与浓H 2SO 4反应生成FeSO 47.下列指定反应的离子方程式正确的是A .Cl 2通入水中制氯水:22Cl H O 2H Cl ClO +--+++ B .NO 2通入水中制硝酸:2232NO H O 2H NO NO+-+=++C .NaAlO 2溶液中通入过量CO 2:10.1m ol L -⋅22233AlO CO 2H O Al(OH)HCO --++=↓+D .AgNO 3溶液中加入过量浓氨水:10.1m ol L -⋅324Ag NH H O AgOH NH ++++=↓+8.反应可用于纯硅的制备。
2024年山东省高考真题化学试卷及答案

2024年全省普通高中学业水平等级考试化学注意事项:1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。
回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
3.考试结束后,将本试卷和答题卡并交回。
可能用到的相对原子质量:H 1 C 12 O 16 S 32一、选择题:本题共10小题,每小题2分,共20分。
每小题只有一个选项符合题目要求。
1. 中国书画是世界艺术瑰宝,古人所用文房四宝制作过程中发生氧化还原反应的是A. 竹管、动物尾毫→湖笔B. 松木→油烟→徽墨C. 楮树皮→纸浆纤维→宣纸D. 端石→端砚2. 化学品在食品工业中也有重要应用,下列说法错误的是A. 活性炭可用作食品脱色剂B. 铁粉可用作食品脱氧剂C. 谷氨酸钠可用作食品增味剂D. 五氧化二磷可用作食品干燥剂3. 下列化学用语或图示正确的是A. 的系统命名:2-甲基苯酚O分子的球棍模型:B. 3C. 激发态H原子的轨道表示式:D. p-pπ键形成的轨道重叠示意图:4. 下列物质均为共价晶体且成键结构相似,其中熔点最低的是A. 金刚石(C)B. 单晶硅(Si)C. 金刚砂(SiC)D. 氮化硼(BN,立方相)5. 物质性质决定用途,下列两者对应关系错误的是Ca(OH)的碱性A. 石灰乳除去废气中二氧化硫,体现了2B. 氯化铁溶液腐蚀铜电路板,体现了3+Fe 氧化性C. 制作豆腐时添加石膏,体现了4CaSO 的难溶性D. 用氨水配制银氨溶液,体现了3NH 的配位性 6. 下列图示实验中,操作规范的是A .调控滴定速度B .用pH 试纸测定溶液pHC .加热试管中的液体D .向试管中滴加溶液A. AB. BC. CD. D7. 我国科学家在青蒿素研究方面为人类健康作出了巨大贡献。
在青蒿素研究实验中,下列叙述错误的是 A. 通过萃取法可获得含青蒿素的提取液 B. 通过X 射线衍射可测定青蒿素晶体结构 C. 通过核磁共振谱可推测青蒿素相对分子质量 D. 通过红外光谱可推测青蒿素分子中的官能团8. 植物提取物阿魏萜宁具有抗菌活性,其结构简式如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学-不定项选择题专项训练第一部分试题与答案第一部分60题(每题有一个或两个正确选项)1、某单质能与浓硝酸反应,若参加反应的单质与硝酸的物质的量之比为1:4,则该元素在反应中所显示的化合价可能是 A +1 B +2 C +3 D +4 E +52、把质量为m克的铜铜灼烧变黑,立即放入下列物质中,能使铜丝变红,且质量还是m 克的是A 稀硫酸B C2H5OHC 稀硝酸D CH3COOHE CO3、将一定量有机物充分燃烧后的产物通入足量石灰水中完全吸收,经过滤得到沉淀20克,滤液质量比原石灰水减少5.8克.该有机物可能是( ).(A)乙烯(B)乙二醇(C)乙醇(D)甲酸甲酯4、某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种.现将13.8克样品加入足量水,样品全部溶解.再加入过量的CaCl2溶液,得到9克沉淀.对样品所含杂质的正确判断是(A)肯定有KNO3 (B)肯定有KNO3,可能还含有Na2CO3(C)肯定没有Ba(NO3)2,可能有KNO3 (D)肯定没有Na2CO3和Ba(NO3)25、将可能混有下列物质的硫酸铵样品13.2克,在加热条件下与过量氢氧化钠溶液反应,可收集到气体4.3升(标准状况),则该样品内不可能含有的物质是A 碳酸氢铵和硝酸铵B 碳酸铵和硝酸铵C 氯化铵和碳酸氢铵D 氯化铵和碳酸铵6、在由Fe、FeO和Fe2O3组成的混合物中加入100毫升2摩/升的盐酸,恰好使混合物完全溶解,并放出448毫升气体(标准状况),此时溶液中无Fe3+离子。
则下列判断正确的是A 混合物里三种物质反应时消耗盐酸的物质的量之比为1:1:3B 反应后所得溶液中的Fe2+离子与Cl-离子的物质的量之比为1:2C 混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多D 混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多7、联合制碱法中关键的一步是把NH4Cl从几乎饱和的NaHCO3溶液中分离出来,为此根据NaCl 和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不夹带NaHCO3的NH4Cl.NaCl和NH4Cl共同存在时的溶解度曲线如图所示,以下操作正确的是8、第二主族元素R的单质及其相应氧化物的混合物12g,加足量水经完全反应后蒸干,得固体16g,试推测该元素可能为A MgB CaC SrD Ba9、由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同。
则该混合气体中CO2H 和CO的体积比为(A)29:8:13 (B)22:1:14 (C)13:8:29 (D)26:16:5710、.取pH值均等于2的盐酸和醒酸各100ml分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是A.醋酸与锌反应放出氢气多B.盐酸和醋酸分别与锌反应放出的氢气一样多C.醋酸与锌反应速率大D.盐酸和醋分别与锌反应的速度一样大11、铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为A.9.02g B.8.51g C.8.26g D.7.04g12、已知短周期元素的离子。
a A2+、b B+、c C3-、d D-都具有相同的电子层结构,则下列叙述正确的是A 原子半径A>B>D>CB 原子序数d>c>b>aC 离子半径C>D>B>AD 单质的还原性A>B>D>C13、C8H18经多步裂化,最后完全转化为C4H8、C3H6、C2H4、C2H6、CH4五种气体的混合物。
该混合物的平均相对分子质量可能是A 28B 30C 38D 4014、混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是A 向CuSO4溶液中加入适量铁粉B 等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液C 等物质的量的NaHCO3与Na2O2固体D 在NaBr溶液中通入过量氯气15、0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol。
该混合气体的平均相对分子质量可能是A 30B 46C 50D 6616、向NaBr、NaI、Na2SO3混合液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是A NaCl Na2SO4B NaCl NaBr Na2SO4C NaCl Na2SO4I2D NaCl NaI Na2SO421、常温时,向pH =2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是A .pH =12 的Ba(OH)2B .pH =12的氨水C .0.005mol/L NaOHD .0.05mol/LBaCl 2 22、某芳香族有机物的分子式为C 8H 6O 2,它的分子(除苯环外不含其他环)中不可能有A .两个羟基B .一个醛基C .两个醛基D .一个羧基23、碳跟浓硫酸共热产生的气体X 和铜跟浓硝酸反应产生的气体Y 同时通入盛有足量氯化钡溶液的洗气瓶中(如右图装置),下列有关说法正确的是 A 洗气瓶中产生的沉淀是碳酸钡 B 在Z 导管出来的气体中无二氧化碳 C 洗气瓶中产生的沉淀是硫酸钡 D 在Z 导管口有红棕色气体出现24、含8.0g NaOH 的溶液中通入一定量H 2S 后,将得到的溶液小心蒸干,称得无水物7.9g ,则该无水物中一定含有的物质是A Na 2SB NaHSC Na 2S 和NaHSD NaOH 和NaHS 25、室温下,下列溶液等体积混合后,所得溶液的pH 一定大于7的是A 0.1mol/L 的盐酸和0.1mol/L 的氢氧化钠溶液B 0.1mol/L 的盐酸和0.1mol/L 的氢氧化钡溶液C pH =4的醋酸溶液和pH =10的氢氧化钠溶液D pH =4的盐酸和pH =l0的氨水 26、为确定某溶液的离子组成,进行如下实验:①测定溶液的pH ,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO 3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO 3)2溶液至无沉淀时,再滴加Ag NO 3溶液,产生白色沉淀。
根据实验以下推测正确的是A 一定有SO 32-离子 B 一定有CO 32-离子C 不能确定Cl -离子是否存在D 不能确定HCO 3-离子是否存在 27、已知Ba(AlO 2)2可溶于水。
右图表示的是向A12(SO 4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y 与加入Ba(OH)2的物质的量x 的关系。
下列有关叙述正确的是A a -b 时沉淀的物质的量:A1(OH)3比BaSO 4多B c -d 时溶液中离子的物质的量:AlO 2-比Ba 2+多C a -d 时沉淀的物质的量:BaSO 4可能小于A1(OH)3D d -e 时溶液中离子的物质的量:Ba 2+可能等于OH -28.设N A 为阿伏加德罗常数,下列叙述中正确的是A 常温下11.2L 的甲烷气体含有甲烷分子数为0.5N A 个B 14g 乙烯和丙烯的混合物中总原子数为3N A 个C 0.1mol/L 的氢氧化钠溶液中含钠离子数为0.1N A 个D 5.6g 铁与足量的稀硫酸反应失去电子数为0.3N A 个 29.已知0.1mol/L 的醋酸溶液中存在电离平衡:CH 3COOHCH 3COO -+H +要使溶液中c(H +)/c(CH 3COOH)值增大,可以采取的措施是A 加少量烧碱溶液B 升高温度C 加少量冰醋酸D 加水30、今有一混合物的水溶液,只可能含有以下离子中的若干种:K +、NH 4+、Cl -、Mg 2+、Ba 2+、CO 32-、SO 42-,现取三份100mL 溶液进行如下实验:(1)第一份加入AgNO 3溶液有沉淀产生(2)第二份加足量NaOH 溶液加热后,收集到气体0.04mol(3)第三份加足量BaCl 2溶液后,得干燥沉淀6.27g ,经足量盐酸洗涤、干燥后,沉淀质量为2.33g 。
根据上述实验,以下推测正确的是A K +一定存在 B 100mL 溶液中含0.01mol CO 32-C Cl -可能存在 D Ba 2+一定不存在,Mg 2+可能存在31、设计学生试验要注意安全、无污染、现象明显。
根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(见右图)。
若关闭K ,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸出)。
下列气体的制取宜使用该装置的是A .用二氧化锰(粉末)与双氧水制氧气B .用锌粒与稀硫酸制氢气C .用硫化亚铁(块状)与盐酸制硫化氢D .用碳酸钙(块状)与稀硫酸制二氧化碳 32、下列离子方程式书写正确的是A .AgNO 3溶液中滴入少量的Na 2S 溶液 2Ag ++S 2-错误!未找到引用源。
Ag 2S↓B .过量CO 2通入Ca(ClO)2溶液中 ClO -+CO 2+H 2O 错误!未找到引用源。
HCO 3-+HClO C .向Na 2CO 3溶液中加入过量CH 3COOH 溶液 CO 32-+2H +错误!未找到引用源。
CO 2↑+H 2OD .向Ba(OH)2溶液中加入少量NaHSO 3溶液 2HSO 3-+Ba 2++2OH -错误!未找到引用源。
BaSO 3↓+SO 32-+2H 2O34、在石灰窑中烧制生石灰,1molCaCO 3完全分解所需要的能量,可燃烧0.453mol 碳来提供。
设空气中O 2体积分数为0.21,N 2为0.79,则石灰窑产生的气体中CO 2的体积分数可能是 A .0.43 B .0.46 C .0.49 D .0.52 35、下列离子方程式正确的是A .24H SO 与2Ba(OH)溶液反应: 2++2-442 B a +O H +H +S OB a S O +H O-→↓B .4CuSO 溶液吸收2H S 气体: 2++2Cu +H S CuS +2H →↓C .3AlCl 溶液中加入过量的浓氨水: 3+-+32242A l +4N HH OA 1O +4N H +2H O ∙→ D .等体积、等浓度的2Ba(OH)稀溶液与43NH HCO 稀溶液混合:2+-+-433322B a +2O H N H +H C O B a C O +N H H O +H O+→↓∙ 36、对于常温下pH 为1的硝酸溶液,下列叙述正确的是A .该溶液lmL 稀释至100mL 后,pH 等于3B .向该溶液中加入等体积、pH 为13的氢氧化钡溶液恰好完全中和C .该溶液中硝酸电离出的()c H +与水电离出的+(H )c 之比值为-1210。
