2018版化学总复习专题一物质的量与化学计算教学案苏教版
2018年高考化学一轮复习专题一1.1物质的量为中心的计算课件苏教版

1.[2016· 海南卷改编]利用太阳能分解制氢,若光解0.02
0.04 mol水,可生成H2的质量为________g ,可生成氢的原子数为 2.408×1022 ________ 0.04 个,生成H2的量理论上等于________mol Na与水
反应产生H2的量。
解析:根据方程式2H2O===2H2↑+O2↑,光解0.02
① <③ <② (1)摩尔质量_________________ ;
① <② <③ (2)物质的量__________________ ;
① <② <③ (3)分子数目_________________ ; ② <① <③ (4)原子数目________________ ; ① <② <③ (5)质量__________________ 。
的量为1 mol,则发生裂变时净产生的中子数为9NA。
3.[2015· 全国新课标卷Ⅰ改编]乌洛托品在合成、医药、 染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液 与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托
3∶2 品,则甲醛与氨的物质的量之比应为________ 。
解析:根据乌洛托品的结构式写出其分子式为C6H12N4, 因为乌洛托品是将甲醛水溶液与氨水混合蒸发而制得的,根据 原子守恒可得化学方程式为6HCHO+4NH3===C6H12N4+ 6H2O,根据反应物的物质的量之比等于化学计量数之比得, 甲醛与氨的物质的量之比为3∶2。
6.12.4
g
Na2R含Na 0.4
+
mol,则Na2R的摩尔质量为 g
16 62 g/mol ,R的相对原子质量为________ ________ 。含R的质量为1.6 0.1 mol 的Na2R,其物质的量为________ 。
高中化学苏教版物质的量教案

高中化学苏教版物质的量教案教学目标:1. 了解物质的量是物质的一种特性;2. 掌握物质的量的定义及计量单位;3. 能够运用物质的量的概念解决化学问题。
教学重点:1. 物质的量是什么;2. 物质的量的单位;3. 物质的量在化学中的应用。
教学难点:1. 理解物质的量概念的抽象性;2. 掌握物质的量的计量单位的转换。
教学准备:1. 课件、实验器材、实验材料;2. 教学活动设计、教学辅助材料。
教学过程:一、导入(5分钟)1. 引入物质的量的概念,简要介绍物质的量的意义;2. 利用日常生活例子,引发学生对物质的量的思考。
二、概念讲解(10分钟)1. 展示物质的量的定义和计量单位;2. 解释物质的量的概念和单位的含义,让学生理解物质的量是什么;3. 通过示意图等形式,帮助学生理解物质的量的概念。
三、实验操作(20分钟)1. 进行实验,观察物质的量对物质性质的影响;2. 让学生测量不同物质的量对物质的体积、密度等性质的影响;3. 引导学生通过实验结果,加深对物质的量的理解。
四、练习与讨论(15分钟)1. 布置相关练习题,让学生巩固物质的量的概念;2. 引导学生分组讨论实际生活中物质的量的应用;3. 指导学生归纳物质的量在化学中的应用实例。
五、作业布置(5分钟)1. 布置相关作业,巩固本节内容;2. 提醒学生认真复习物质的量的概念和计量单位。
教学总结:通过本节课的学习,学生们应该对物质的量有更深入的认识和理解,能够灵活运用物质的量概念解决化学问题。
同时,老师也应及时总结学生掌握的情况,对学习进度进行调整和优化。
高中化学物质的量教案苏教版必修

高中化学物质的量教案苏教版必修一、教学目标1. 理解物质的量的概念,掌握物质的量的表示方法。
2. 掌握摩尔的概念,了解物质的量与摩尔之间的关系。
3. 掌握物质的量的计算方法,能够进行相关计算。
二、教学重点1. 物质的量的概念及其表示方法。
2. 摩尔的概念及其与物质的量的关系。
3. 物质的量的计算方法。
三、教学难点1. 物质的量的抽象概念的理解。
2. 摩尔与物质的量之间的转换关系的理解。
3. 复杂计算题的解答。
四、教学准备1. 教学课件或黑板。
2. 教学素材,如例题和练习题。
3. 学生用书或教辅资料。
五、教学过程1. 引入:通过生活中的实例,如化学实验室中的药品配比,引入物质的量的概念。
2. 讲解:讲解物质的量的定义、表示方法,以及摩尔的概念和物质的量与摩尔之间的关系。
3. 示例:展示一些物质的量的计算示例,让学生理解并掌握计算方法。
4. 练习:让学生独立完成一些物质的量计算的练习题,巩固所学知识。
5. 总结:对本节课的内容进行总结,强调物质的量和摩尔的概念及其计算方法。
6. 布置作业:布置一些有关物质的量的计算作业,让学生进一步巩固所学知识。
六、教学评价1. 评价标准:能够准确理解物质的量的概念及其表示方法。
能够理解摩尔的概念,并掌握物质的量与摩尔之间的关系。
能够运用物质的量的计算方法,正确解答相关计算题。
七、教学拓展1. 物质的量的应用:介绍物质的量在化学实验、工业生产等方面的应用,让学生了解物质的量的重要性和实际意义。
2. 摩尔体积的概念:讲解摩尔体积的概念,让学生了解气体摩尔体积的应用。
八、教学反思1. 对本节课的教学内容进行反思,看是否清晰地讲解了物质的量和摩尔的概念。
2. 观察学生的学习情况,看是否掌握了物质的量的表示方法和计算方法。
3. 对教学方法和教学素材进行反思,看是否适合学生的学习需求。
九、教学反馈1. 收集学生的作业和练习题,对学生的学习效果进行评价。
2. 与学生进行交流,了解他们对物质的量和摩尔概念的理解程度。
高中化学:物质的量教案苏教版必修

高中化学:物质的量教案苏教版必修一、教学目标1. 理解物质的量的概念,掌握物质的量的表示方法。
2. 掌握物质的量的计量单位,包括摩尔、克/摩尔等。
3. 能够运用物质的量来描述和计算微观粒子,如原子、分子、离子等。
4. 培养学生的实验操作能力和观察能力,提高学生的科学思维能力。
二、教学内容1. 物质的量的概念及其表示方法。
2. 物质的量的计量单位,如摩尔、克/摩尔等。
3. 物质的量的计算,包括物质的量与微观粒子的关系。
4. 物质的量的实际应用,如化学方程式的计算、物质的量的浓度计算等。
三、教学重点与难点1. 重点:物质的量的概念、表示方法及计量单位。
2. 难点:物质的量的计算和实际应用。
四、教学方法1. 采用问题驱动法,引导学生主动探究物质的量的概念和计算方法。
2. 利用实验和案例分析,培养学生的观察能力和实验操作能力。
3. 运用小组讨论法,激发学生的合作意识和创新能力。
4. 采用多媒体辅助教学,增强课堂教学的趣味性和生动性。
五、教学过程1. 导入:通过生活中的实例,引发学生对物质的量的思考,导入新课。
2. 理论讲解:讲解物质的量的概念、表示方法及计量单位。
3. 实验演示:进行物质的量相关的实验,如溶液的配制、化学方程式的计算等。
4. 案例分析:分析实际案例,运用物质的量进行计算和分析。
5. 小组讨论:学生分组讨论,分享自己的理解和心得。
6. 总结与拓展:总结本节课的主要内容,布置课后作业,拓展学生的知识视野。
六、教学评估1. 课堂问答:通过提问方式检查学生对物质的量概念的理解和掌握程度。
2. 练习题:布置相关练习题,检查学生对物质的量计算和应用的能力。
3. 实验报告:评估学生在实验过程中的操作技能和观察能力。
4. 小组讨论:评价学生在小组讨论中的参与程度和合作能力。
七、教学资源1. 教材:苏教版必修高中化学教材。
2. 实验器材:实验室常用的仪器和设备,如滴定管、烧杯、试管等。
3. 多媒体课件:制作相关的多媒体课件,辅助教学。
苏教版物质的量教案.doc

苏教版物质的量教案导读:我根据大家的需要整理了一份关于《苏教版物质的量教案》的内容,具体内容:物质的量是高中化学中一个抽象的概念,也是教学的重点和难点。
下面我给你分享,欢迎阅读。
【教学目标】1、了解物质的量及其单位摩尔,懂得阿伏加德罗常数的含义。
2、了解物质的量...物质的量是高中化学中一个抽象的概念,也是教学的重点和难点。
下面我给你分享,欢迎阅读。
【教学目标】1、了解物质的量及其单位摩尔,懂得阿伏加德罗常数的含义。
2、了解物质的量、物质的微粒数、物质的质量、摩尔质量之间关系,初步学会它们之间的简单计算。
【教学重点】物质的量及其单位。
【教学难点】物质的量与微粒数之间的有关计算。
教学过程以2H2+O22H2O反应为例说明化学方程式的宏观和微观意义。
宏观:每4g氢气与32g氧气生成36g水。
微观:每2个氢分子与1个氧分子生成2个水分子。
36g水含有多少个水分子?2个水分子是多少克?要回答上述问题,就需要引入一个新的物理量——物质的量,从而把宏观可称量的物质与微观粒子(原子、分子、离子)建立起联系。
一、物质的量1、物质的量:将一定数目的微观粒子与可称量物质之间联系起来的物理量。
符号:n。
(1)物质的量是一个物理量的名称,它包括4个字,是一个整体,不可分割,不可加减字。
(2)物质的量是以微观粒子为计量的对象,而这里的"微粒"是指构成物质的"基本单元",这个基本单元可以是分子、原子、离子、中子、质子、电子等单一微粒,也可以是这些微粒的特定组合。
每一种物理量都有它相应的单位。
例如:质量的单位是"千克",长度的单位是"米",那么物质的量的单位是什么呢?科学上,物质的量用12g碳-12所含的碳原子这个微粒集体作为计数单位,我们称之为"摩尔"。
2、物质的量的单位--摩尔(mol)(1)摩尔:是表示物质的量的单位,简称:摩,符号:mol。
高中化学:物质的量教案苏教版必修

高中化学:物质的量教案苏教版必修一、教学目标:1. 理解物质的量的概念,掌握物质的量的表示方法。
2. 掌握物质的量的单位——摩尔,了解摩尔的定义和计算方法。
3. 能够运用物质的量描述微观粒子,如原子、分子、离子等。
4. 能够进行有关物质的量的简单计算。
二、教学重点:1. 物质的量的概念及表示方法。
2. 摩尔的定义和计算方法。
3. 物质的量在微观粒子中的应用。
三、教学难点:1. 物质的量的理解及与微观粒子的关系。
2. 摩尔的计算方法。
四、教学准备:1. 教材《高中化学》苏教版必修。
2. 教学PPT。
3. 教学视频或动画。
五、教学过程:1. 导入:通过生活中的实例,如氧气瓶、化肥袋等,引导学生思考物质的量概念。
2. 新课导入:介绍物质的量的概念,讲解物质的量的表示方法。
3. 知识讲解:讲解摩尔的定义,演示摩尔的计算方法。
4. 课堂互动:进行有关物质的量的计算练习,引导学生运用物质的量描述微观粒子。
5. 知识拓展:介绍物质的量在科学研究和工业生产中的应用。
6. 课堂小结:总结本节课的主要内容,强调物质的量的重要性。
7. 布置作业:布置有关物质的量的计算和应用的练习题。
8. 教学反思:根据学生的反馈,调整教学方法,提高教学效果。
六、教学评价:1. 课后作业:通过布置有关物质的量的计算和应用的练习题,检验学生对知识的掌握程度。
2. 课堂问答:观察学生在课堂上的参与程度和回答问题的准确性,了解学生对物质的量的理解和应用能力。
3. 单元测试:进行单元测试,全面评估学生对物质的量的概念、表示方法和应用的掌握情况。
七、教学拓展:1. 物质的量的进一步研究:引导学生深入研究物质的量的其他方面,如阿伏伽德罗常数等。
2. 物质的量在化学反应中的应用:讲解物质的量在化学反应中的重要性,如化学方程式的平衡等。
3. 物质的量与质量的关系:引导学生探究物质的量与质量之间的关系,加深对化学概念的理解。
八、教学反思:1. 学生反馈:根据学生的课后反馈,了解学生的学习情况和存在的问题。
高二化学专题一有关物质的量的计算会考复习教学案二 苏教版 必修一
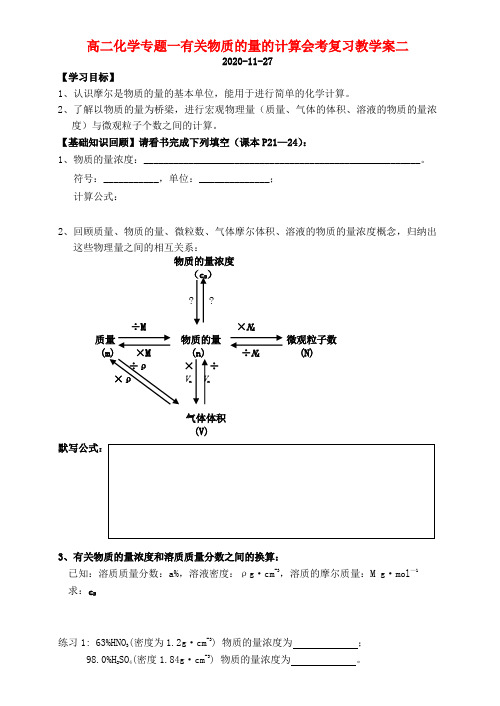
高二化学专题一有关物质的量的计算会考复习教学案二2020-11-27【学习目标】1、认识摩尔是物质的量的基本单位,能用于进行简单的化学计算。
2、了解以物质的量为桥梁,进行宏观物理量(质量、气体的体积、溶液的物质的量浓度)与微观粒子个数之间的计算。
【基础知识回顾】请看书完成下列填空(课本P21—24):1、物质的量浓度:_______________________________________________________。
符号:___________,单位:______________;计算公式:2、回顾质量、物质的量、微粒数、气体摩尔体积、溶液的物质的量浓度概念,归纳出这些物理量之间的相互关系:物质的量浓度(c B)? ?÷M ×N A质量物质的量微观粒子数×÷N A(N)÷ρ×÷×ρV m V m气体体积(V)3、有关物质的量浓度和溶质质量分数之间的换算:已知:溶质质量分数:a%,溶液密度:ρg·cm-3,溶质的摩尔质量:M g·mol—1求:c B练习1: 63%HNO3(密度为1.2g·cm-3) 物质的量浓度为;98.0%H2SO4(密度1.84g·cm-3) 物质的量浓度为。
4、有关溶液稀释与两溶液混合的计算:*计算原则:溶液中溶质的物质的量守恒(或溶质的质量守恒)。
例题1:欲配制250mL1.00 mol/L的硫酸溶液,需要 98.0%、密度1.84g·cm-3的浓硫酸多少mL?例题2:2.00 mol/L的盐酸溶液200mL和4.00 mol/L的盐酸溶液100mL混合.求:混合后溶液中盐酸的物质的量浓度。
5、一定物质的量浓度溶液的配制:主要仪器:(用NaCO3固体配制100mL0.100mol/L的NaCO3溶液)___________________________________________________________。
高中化学专题一第一单元第3课时《物质的量的有关计算》综合性学案苏教版必修

1.13物质的量的有关计算综合性学案班级姓名【目标诠释】——我来认识了解物质的量、物质的粒子数、物质的质量、摩尔质量之间的关系。
理解阿伏伽德罗常数、物质的量及其单位的意义。
初步学会物质的量、摩尔质量、质量之间的简单计算。
【导学菜单】——我来预习1.摩尔质量概念:符号:单位:表达式2.摩尔质量和一摩尔物质所具有的质量是不是可以划等号呢?3.摩尔质量与物质式量有什么关系呢?4.物质的量(n)与物质的质量(m)、物质的摩尔质量(M)之间的关系5.物质的量在描述化学方程式的意义中有什么作用?【困惑扫描】——我来质疑【感悟平台】——我来探究物质的量可以把宏观可以称量的质量和微观粒子数目联系在一起。
那么他们之间是如何联系的?【建立网络】——我来归纳摩尔质量(1)概念:单位物质的量的物质所具有的(2)单位符号(3)与相对原子质量的关系:当微粒(原子、离子、单质、化合物、原子团)的摩尔质量以克为单位时,在数值上等于例: M(O2)= M(-CH3)= M(H2SO4)= M(NH4+)= (4)有关计算: n = (m与M关系) m=(5)下列正确的是()A.摩尔可以把物质的宏观数量(质量、气体体积等)与微观粒子的数量联系起来B.水的摩尔质量和1mol水的质量均可计为18g·mol-1C.水的摩尔质量和1mol水的质量均可计为18g·mol-1D.硫酸和磷酸的摩尔质量相等 }【过关窗口】——我来练习1.下列说法中正确的是()A.1mol O的质量是16g/mol B.12g镁的物质的量为0.5C.CO2的摩尔质量为44g/mol D.氢的摩尔质量为2g /mol2.下列叙述正确的是()A. 1mol H2SO4的质量是98 g·mol-1B. CO2的摩尔质量等于CO2的相对分子质量C. 0.012kgC-12里所含C个数约6.02×1023个D. 1mol任何物质的质量等于该物质的相对分子质量3.1molPH3与1molH2S具有不同的是()A.分子数目B.原子数目C.质量D.摩尔质量4.1gN2中含有n个N2分子,则阿伏加德罗常数N A可以表示为()A.14n/molB. 28n/molC. n/14molD. n/28mol5.相等物质的量的CO和CO2相比较,下列有关叙述不正确的是:()A.它们所含的电子数目之比为1:1B.它们所含的O原子数目之比为1:2C.它们所含的C原子数目之比为1:1D.它们所含的原子总数目之比为2:36.5molNa2CO3中含有的Na+数目是,含有的CO32-的离子数是,含有的O原子数是。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课时4 物质的量与化学计算[课时诠释]在近几年高考中,对化学计算的考查逐年增加,而学生平时养成的重思维而轻结果的做题习惯,也使化学计算成为制约学生得高分的一个重要因素,因此加强化学计算能力也成为教学重点。
最常见的化学计算方法有关系式法、差量法、终态法、守恒法等。
在这几种计算方法中,充分体现了物质的量在化学计算中的核心作用和纽带作用,依据化学方程式的计算又是各种计算方法的基础,其解题步骤如下:①根据题意写出并配平化学方程式。
②依据题中所给信息及化学方程式判断过量物质,用完全反应物质的量进行计算。
③把已知的和需要求解的量分别写在化学方程式有关化学式的下面,两个量及单位“上下一致,左右相当”。
④选择有关量(如物质的量、气体体积、质量等)的关系作为计算依据,列比例式,求未知量。
解题模板:现以2H 2+O 点燃,2H 2O 为例,方程式中有关量的关系如下:2H 2 + O 2 =====点燃 2H 2O化学计量数之比 2 ∶ 1 ∶ 2物质的量之比 2 mol ∶ 1 mol ∶ 2 mol标况下气体体积之比2×22.4 L ∶ 1×22.4 L 质量之比 4 g ∶ 32 g ∶ 36 g化学方程式中各物质的化学计量数之比=各物质的物质的量之比,等于气体体积之比(相同状况下)≠质量之比。
根据化学方程式列比例式时应遵循上述比例关系。
注意:根据化学方程式计算时,所列比例是否正确的判断依据是:“上下单位要一致,左右单位要对应”。
如微点聚焦一 解答连续反应类型计算题的捷径——关系式法关系式法是表示两种或多种物质之间“物质的量”关系的一种简化式子。
在多步反应中,它可以把始态的反应物与终态的生成物之间的“物质的量”关系表示出来,把多步计算简化成一步计算。
正确书写关系式是用关系式法解化学计算题的前提。
[典题示例]【示例1】 (江苏高考节选)软锰矿(主要成分MnO 2,杂质金属元素Fe 、Al 、Mg 等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为:MnO2+SO2===MnSO4。
(1)质量为17.40 g纯净MnO2最多能氧化________L(标准状况)SO2。
(2)准确称取0.171 0 g MnSO4·H2O样品置于锥形瓶中,加入适量H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.050 0 mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00 mL。
计算MnSO4·H2O样品的纯度(请给出计算过程)。
解析(1)根据提供的化学方程式知,1 mol MnO2氧化1 mol SO2,则17.40 g纯净的MnO2最多能氧化标准状况下SO2的体积为17.4 g87 g·mol-1×22.4 L·mol-1=4.48 L。
(2)根据滴定原理可得关系式:Mn2+~Mn3+~Fe2+,n(Fe2+)=0.050 0 mol·L-1×0.02 L=1.00×10-3mol,则n(Mn2+)=n(Fe2+)=1.00×10-3mol,m(MnSO4·H2O)=1.00×10-3mol×169 g·mol-1=0.169 g,故MnSO4·H2O样品的纯度为:0.169 g0.171 0 g×100%=98.8%。
答案(1)4.48(2)n(Fe2+)=0.050 0 mol·L-1×20.00 mL1 000 mL·L-1=1.00×10-3mol n(Mn2+)=n(Fe2+)=1.00×10-3molm(MnSO4·H2O)=1.00×10-3mol×169 g·mol-1=0.169 gMnSO4·H2O样品的纯度为:0.169 g0.171 0 g×100%=98.8%【解法模板】关系式法解题步骤1.在多步连续进行的化学反应中考虑,关系式法。
在进行多步反应的计算时,一般的解题步骤为⇩⇩2.在涉及反应较多的化工流程或反应过程中考虑,特定关系式法。
在化工流程题中,计算某种物质的质量分数或在多步复杂的反应过程中进行某个特定量的计算,可以考虑利用某种微粒(或原子)的守恒关系或物质的特定组成关系建立关系式解题。
[体验感悟]1.在O2中燃烧0.22 g由硫元素和铁元素组成的化合物,使其中的硫元素全部转化为SO2,将这些SO2全部转化为SO3,生成的SO3完全被H2O吸收,所得的H2SO4可用10.0 mL 0.50 mol·L-1的NaOH溶液完全中和,则原化合物中硫元素的质量分数约为( )A.45% B.36%C.20% D.40%解析本题可用关系式法来求解,由S~SO2~SO3~H2SO4~2NaOH得:n(S)=12n(NaOH)=12×(10.0×10-3) L×0.50 mol·L-1=0.002 5 mol,w(S)=0.002 5 mol×32 g·mol-10.22 g×100%≈36%。
答案 B2.(2016·潍坊模拟节选)金属表面处理、皮革鞣制、印染等都可能造成铬污染。
六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
以下为废水中铬元素总浓度的测定方法:准确移取25.00 mL含Cr2O2-7和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O2-7,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol·L-1的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 mL。
计算废水中铬元素总浓度(单位:mg·L-1,写出..计算过程....)。
已知测定过程中发生的反应如下:①2Cr3++3S2O2-8+7H2O===Cr2O2-7+6SO2-4+14H+②Cr2O2-7+6I-+14H+===2Cr3++3I2+7H2O③I2+2S2O2-3===2I-+S4O2-6答案由方程式确定关系式:Cr~3Na2S2O3,然后进行计算。
n(S2O2-3)=0.02 L×0.015 mol·L-1=3×10-4moln(Cr)=1×10-4molm(Cr)=1×10-4mol×52 g·mol-1=5.2×10-3g=5.2 mg废水中铬元素总浓度=5.2 mg0.025 L=208 mg·L-1微点聚焦二化学方程式计算中的巧思妙解——差量法“差量法”的实质是算出反应体系中某化学量从始态到终态的差量,以此作为解题的突破口。
按差量的性质来说,除了利用质量差、体积差之外,还可利用物质的量的差值、压强差值、溶液质量差值和溶解度差值进行有关计算。
从任何一个化学反应中,均可找到一个或多个有关量的差值,因此运用此法解题时,必须仔细分析题意,理清思路,选定好相关物理量的差值。
利用差量法解题可以简化许多化学计算,并能使学生更深刻地理解所发生反应的变化实质,对培养学生的抽象思维能力也有较好的作用。
解此类题的关键是根据题意确定“理论差量”,再根据题目提供的“实际差量”,列出比例式,然后求解。
[典题示例]【示例2】 用H 2还原x g CuO ,当大部分固体变红时停止加热,冷却后得残留固体y g ,共用去z g H 2,此时生成水的质量为( )A.89(x -y )g B .98(x -y )g C .9z g D .940z g 思维提示 本题根据固体质量差计算尤为简捷:H 2+CuO=====△ Cu + H 2O Δm80 g 64 g 18 g 16 g98(x -y )g x g -y g 说明:需要注意的是不可用z g H 2进行计算,因为用去的H 2并非全部参加了反应;不可只用x g 进行计算,因为CuO 未全部参加反应;不可只用y g 进行计算,因为y g 是CuO 和Cu 的质量和。
答案 B【解法模板】差量法解题思维流程1.计算依据:化学反应中反应物或生成物的量与差量成正比。
2.解题关键:一是明确产生差量的原因,并能根据化学方程式求出理论上的差值(理论差量)。
二是结合题中的条件求出或表示出实际的差值(实际差量)。
3.解题步骤:一是表示出理论差值及相应反应物、生成物对应的物理量,要注意不同物质的物理量及单位间的对应关系;二是表示出实际差量并写在相应位置(注意应将理论差值与实际差值写在化学方程式最右侧;三是根据比例关系建立方程式并求出结果。
[体验感悟]1.(2017·合肥质检)将a L NH 3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b L(气体体积均在同温同压下测定),该b L 气体中NH 3的体积分数是( )A.2a -b a B .b -a b C .2a -b bD .b -a a 解析 设参加反应的氨气为x ,则2NH 3 △N 2+3H 2 ΔV2 2x b -ax =(b -a ) L所以气体中NH 3的体积分数为a L -b -a L b L =2a -b b。
答案 C2.反应2A(g) x B(g)+2C(g),在恒温下达到平衡时,容器内的压强增加了30%,A 转化了20%,则x 值为( )A .1B .2C .3D .4 解析 容器内的压强增加了30%,即物质的量增加了30%,设原来有2 mol A ,则 2A(g) x B(g)+2C(g) Δn2 x 2 x2×20% mol 2×30% mol列式解得x =3。
答案 C微点聚焦三 简化过程 妙用守恒所谓“守恒”就是物质在发生“变化”或两物质在发生“相互作用”的过程中某些物理量的总量保持“不变”。
一切化学反应都遵循守恒定律,在化学变化中有各种各样的守恒,如质量守恒、元素原子守恒、得失电子守恒、电荷守恒、能量守恒等。
[典题示例]【示例3】 过氧化钙晶体(CaO 2·8H 2O)可用于改善地表水质、处理含重金属粒子废水、应急供氧等。
(1)已知:I 2+2S 2O 2-3===2I -+S 4O 2-6,测定制备的过氧化钙晶体中CaO 2的含量的实验步骤如下:第一步:准确称取a g 产品放入锥形瓶中,再加入过量的b g KI 晶体,加入适量蒸馏水溶解,再滴入少量2 mol·L -1的H 2SO 4溶液,充分反应。
