动力学-1-习题
化学反应动力学练习题1

化学反应动力学练习题一、计算题1.340K 时N 2O 5分解反应有如下实验数据求60s 内和120s 到240s 的平均速率。
2.某基元反应A(g)+2B(g)D(g)+E(g),某温度下,将一定量的A 和B通入一定体积的容器中。
(1)当A 和B 各消耗50%时反应速率为起始率的几倍?(2)在恒温下,将容器的体积减少一半时反应速率是起始速率的多少倍?3.一定温度下反应CO(g)+Cl 2(g)COCl 2有下列实验数据求(1)反应级数;(2)速率方程;(3)速率常数。
4.反应N2O 52NO 2+21O 2速率常数随温度变化的实验数据如下,求该反应的活化能。
5.反应CO(CH 2COOH)2CH 3COCH 3+2CO 2,在283K 时速率常数k 为6.48×10-3mol ·L -1·min -3,在333K 时速率常数k 为3.29mol ·L -1·min -1。
求303K时反应的速率常数。
6.密闭容器中进行的某基元反应A(g)+2B(g)2C(g)当反应物的起始浓度分别为cA =0.2mol·L-1,cB=0.3mol·L-1时的反应速率为0.72mol·L-1·s-1,若温度不变增大反应物浓度,使cA =1.2mol·L-1,cB=0.6mol·L-1,此时反应速率多大?为原来反应速率的多少倍?7.某温度下反应2NO(g)+O2(g)2NO2(g)的实验数据如下:(1)写出该反应的速率方程式并指出反应级数;(2)计算速率常数;(3)当c(NO)=0.15mol·L-1,c(O2)=0.080mol·L-1时反应速率是多少?8.反应C2H6→C2H4+H2,开始阶段反应级数近似为3/2级,910K时速率常数为1.13dm3/2·。
试计算C2H6(g)的压强为1.33×104Pa时的起始分解速率υ9.295K时,反应2NO+Cl2→2NOCl,反应物浓度与反应速率关系的数据如下:(2)写出反应的速率方程。
物理化学—动力学练习题及参考答案1

动力学1A 一、选择题 1. 连串反应 Ak 1Bk 2C 其中 k 1= 0.1 min -1, k 2= 0.2 min -1,假定反应开始时只有 A ,且浓度为 1 mol ·dm -3 ,则 B 浓度达最大的时间为: ( )(A) 0.3 min (B) 5.0 min (C) 6.93 min (D) ∞ 2. 平行反应 Ak 1B (1); Ak 2D (2),其反应 (1) 和(2) 的指前因子相同而活化能不同,E 1为 120 kJ ·mol -1,E 2为 80 kJ ·mol -1,则当在 1000K 进行时,两个反应速率常数的比是: ( )(A) k 1/k 2= 8.138×10-3 (B) k 1/k 2= 1.228×102(C) k 1/k 2= 1.55×10-5 (D) k 1/k 2= 6.47×104 3. 如果臭氧 (O 3) 分解反应 2O 3→ 3O 2的反应机理是: O 3→ O + O 2 (1) O + O 3→ 2O 2 (2) 请你指出这个反应对 O 3而言可能是: ( )(A) 0 级反应 (B) 1 级反应 (C) 2 级反应 (D) 1.5 级反应4. 化学反应速率常数的 Arrhenius 关系式能成立的范围是: ( ) (A) 对任何反应在任何温度范围内 (B) 对某些反应在任何温度范围内 (C) 对任何反应在一定温度范围内 (D) 对某些反应在一定温度范围内5. 如果反应 2A + B = 2D 的速率可表示为:r = -12d c A /d t = - d c B /d t = 12d c D /d t则其反应分子数为: ( )(A) 单分子 (B) 双分子 (C) 三分子 (D) 不能确定3 (A) kp H 23 p N 2 (B) kp H 22p N 2(C) kpH2pN2(D) kpH2pN227. 在反应 A k1Bk2C,Ak3D 中,活化能E1> E2> E3,C 是所需要的产物,从动力学角度考虑,为了提高 C 的产量,选择反应温度时,应选择: ( )(A) 较高反应温度 (B) 较低反应温度(C) 适中反应温度 (D) 任意反应温度8. [X]0 [Y][Z] 增加 0.0050 mol·dm-3所需的时间/ s0.10 mol·dm-3 0.10 mol·dm-3 720.20 mol·dm-3 0.10 mol·dm-3 180.20 mol·dm-3 0.05 mol·dm-3 36对于反应 X + 2Y → 3Z,[Z] 增加的初始速率为: ( )(A) 对 X 和 Y 均为一级 (B) 对 X 一级,对 Y 零级(C) 对 X 二级,对 Y 为一级 (D) 对 X 四级,对 Y 为二级9. 一级反应,反应物反应掉 1/n所需要的时间是: ( )(A) -0.6932/k (B) (2.303/k) lg[n/(n-1)](C) (2.303/k) lg n (D) (2.303/k) lg(1/n)10. 关于反应速率理论中概率因子P的有关描述,不正确的是: ( )(A) P与∆≠S m有关(B) P体现空间位置对反应速率的影响(C) P与反应物分子间相对碰撞能有关(D) P值大多数<1,但也有>1的二、填空题12. 60Co广泛用于癌症治疗, 其半衰期为5.26 a (年), 则其蜕变速率常数为:_________________, 某医院购得该同位素20 mg, 10 a后剩余 ______________mg。
动力学练习题word版

动⼒学练习题word版第⼗⼀章动⼒学练习题⼀、是⾮题(对的画√错的画×)1、反应速率系数k A 与反应物A 的浓度有关。
()2、反应级数不可能为负值。
()3、⼀级反应肯定是单分⼦反应。
()4、对⼆级反应来说,反应物转化为同⼀百分数时,若反应物的初始浓度越低,则所需时间越短。
()5、对同⼀反应,活化能⼀定,则反应的起始温度愈低,反应的速率系数对温度的变化愈敏感。
()6、阿累尼乌斯活化能的定义是dTkd RT Ea ln 2=。
() 7、对于元反应,反应速率系数部随温度的升⾼⽽增⼤。
() 8、若反应A →Y ,对A 为零级,则A 的半衰期 AA k C t 20,21=.。
()9、设对⾏反应正⽅向是放热的,并假定正逆都是元反应,则升⾼温度更利于增⼤正反应的速率系数。
()10、连串反应的速率由其中最慢的⼀步决定,因此速率控制步骤的级数就是总反应的级数。
() 11、鞍点是反应的最低能量途径上的最⾼点,但它不是势能⾯上的最⾼点,也不是势能⾯上的最低点。
()12、过渡态理论中的活化络合物就是⼀般反应历程中的活化分⼦。
() 13、催化剂只能加快反应速率,⽽不有改变化学反应的标准平衡常数。
()14、复杂反应是由若⼲个基元反应组成的,所以复杂反应的分⼦数是基元反应的分⼦数之和.。
()15、质量作⽤定律只适⽤于元反应。
() 16、某反应,若其反应速率⽅程式为A=Ac A 2c B ,则当c B,0>>c A,0时,反应速率⽅程可约化为假⼆级反应。
()17、若反应 A+B ?→?Y +Z 的速率⽅程为υ= kc A c B , 则该反应是⼆级反应,且肯定是双分⼦反应。
()18、对于反应 2NO + Cl 2 ?→? 2NOCl ,只有其速率⽅程为:υ=k {c (NO)}2c (Cl 2),该反应才有可能为元反应。
其他的任何形式,都表明该反应不是元反应。
()19、知道了反应物和产物可写出化学反应⽅程式, 但不能由配平的化学反应式直接写出反应级数和反应分⼦数。
地下水动力学习题1-1

高等学校教材地质出版社第一章渗流理论基础习题1-1一、填空题:1.地下水动力学是研究地下水_________、_________和_________中运动规律的科学,通常把____________称为多孔介质,而其中的岩石颗粒称为_________;多孔介质的特点是________、________、________和________。
2.地下水在多孔介质中存在的主要形式有_________、_________、_________和_________,而地下水动力学主要研究的_________的运动规律。
3.在多孔介质中,不连续的或一端封闭的孔隙对地下水运动来说是_________,但对贮存水来说却是________。
4.假想水流的_________、_________、_________以及_________都与真实水流相同,假想水流充满_________。
5.地下水过水断面包括_________和_________所占据的面积;渗透速度是_________上的平均速度,而实际流速是_________的平均速度。
6.在渗流中,水头一般是指_________,不同数值的等水头面(线)永远_________。
7.在渗流场中,把大小等于_________方向沿着_________的法线,并指向水头_________方向的矢量,称为水力坡度;水力坡度在空间直角坐标系中的三个分量分别为_________、_________和_________。
8.渗流运动要素包括_________、_________、_________和_________等等。
9.根据地下水速度_________与_________的关系,将地下水运动分为一维、二维和三维运动。
二、判断题:10.地下水在多孔介质中运动,因此可以说多孔介质就是含水层。
()11.地下水运动时的有效孔隙度等于排水(贮水)时的有效孔隙度。
()12.对含水层来说其压缩性主要表现在空隙和水的压缩上。
化学动力学习题

第5章化学动力学习题一、思考题1.化学反应速率是如何定义的?反应速率方程如何表达?2.影响反应速率的因素有哪些?3.如何加快均相和多相反应的反应速率?4.质量作用定律适用于什么样的反应?5.能否根据反应方程式直接写出反应速率方程式?为什么?6.速率常数受哪些因素的影响?浓度和压力会影响速率常数吗?7.什么是反应级数?零级反应和一级反应各有什么特征?8.一个反应的活化能为180 kJ·mol-1,另一个反应的活化能为48 kJ·mol-1。
在相似的条件下,这两个反应中哪一个进行较快些?为什么?9.为什么说使用催化剂不会改变体系的热力学性能?10.为什么不同的反应升高相同的温度,反应速率提高的程度不同?11.是不是对于所有的化学反应,增加任意一个反应物的浓度都会提高反应速率?为什么?12.碰撞理论和过渡态理论的基本要点是什么?两者有什么区别?13.何为反应机理?你认为要想了解反应机理,最关键是要怎么做?14.试解释浓度、压力、温度和催化剂加快反应的原因。
15.总压力与浓度的改变对反应速率以及平衡移动的影响有哪些相似之处?有哪些不同之处?举例说明。
16.比较“温度与平衡常数的关系式”同“温度与反应速率常数的关系式”,有哪些相似之处?有哪些不同之处?举例说明。
17.反应2NO(g)+2H2(g)=== N2(g)+2H2O(g)的速率方程是r = k c2(NO)c(H2)试讨论以下各种条件变化时对反应速率的影响(1) NO的浓度增加1倍;(2) 有催化剂参加;(3) 升高温度;(4) 反应容器的体积增大1倍18.对于下列平衡体系:C (s) + H2O (g) = CO (g) + H2(g),q为正值。
(1) 欲使平衡向右移动,可采取哪些措施?(2) 欲使(正)反应进行得较快(平衡向右移动)的适宜条件如何?这些措施对K及k(正)、k(逆)的影响各如何?二、是非题(对的在括号内填“√”号,错的填“×”号)1. 反应速率常数仅与温度有关,与浓度、催化剂等均无关系。
物理化学—动力学练习题及参考答案1

动力学1A 一、选择题 1. 连串反应 Ak 1Bk 2C 其中 k 1= 0.1 min -1, k 2= 0.2 min -1,假定反应开始时只有 A ,且浓度为 1 mol ·dm -3 ,则 B 浓度达最大的时间为: ( )(A) 0.3 min (B) 5.0 min (C) 6.93 min (D) ∞ 2. 平行反应 Ak 1B (1); Ak 2D (2),其反应 (1) 和(2) 的指前因子相同而活化能不同,E 1为 120 kJ ·mol -1,E 2为 80 kJ ·mol -1,则当在 1000K 进行时,两个反应速率常数的比是: ( )(A) k 1/k 2= 8.138×10-3 (B) k 1/k 2= 1.228×102(C) k 1/k 2= 1.55×10-5 (D) k 1/k 2= 6.47×104 3. 如果臭氧 (O 3) 分解反应 2O 3→ 3O 2的反应机理是: O 3→ O + O 2 (1) O + O 3→ 2O 2 (2) 请你指出这个反应对 O 3而言可能是: ( )(A) 0 级反应 (B) 1 级反应 (C) 2 级反应 (D) 1.5 级反应4. 化学反应速率常数的 Arrhenius 关系式能成立的范围是: ( ) (A) 对任何反应在任何温度范围内 (B) 对某些反应在任何温度范围内 (C) 对任何反应在一定温度范围内 (D) 对某些反应在一定温度范围内5. 如果反应 2A + B = 2D 的速率可表示为:r = -12d c A /d t = - d c B /d t = 12d c D /d t则其反应分子数为: ( )(A) 单分子 (B) 双分子 (C) 三分子 (D) 不能确定3 (A) kp H 23 p N 2 (B) kp H 22p N 2(C) kpH2pN2(D) kpH2pN227. 在反应 A k1Bk2C,Ak3D 中,活化能E1> E2> E3,C 是所需要的产物,从动力学角度考虑,为了提高 C 的产量,选择反应温度时,应选择: ( )(A) 较高反应温度 (B) 较低反应温度(C) 适中反应温度 (D) 任意反应温度8. [X]0 [Y][Z] 增加 0.0050 mol·dm-3所需的时间/ s0.10 mol·dm-3 0.10 mol·dm-3 720.20 mol·dm-3 0.10 mol·dm-3 180.20 mol·dm-3 0.05 mol·dm-3 36对于反应 X + 2Y → 3Z,[Z] 增加的初始速率为: ( )(A) 对 X 和 Y 均为一级 (B) 对 X 一级,对 Y 零级(C) 对 X 二级,对 Y 为一级 (D) 对 X 四级,对 Y 为二级9. 一级反应,反应物反应掉 1/n所需要的时间是: ( )(A) -0.6932/k (B) (2.303/k) lg[n/(n-1)](C) (2.303/k) lg n (D) (2.303/k) lg(1/n)10. 关于反应速率理论中概率因子P的有关描述,不正确的是: ( )(A) P与∆≠S m有关(B) P体现空间位置对反应速率的影响(C) P与反应物分子间相对碰撞能有关(D) P值大多数<1,但也有>1的二、填空题12. 60Co广泛用于癌症治疗, 其半衰期为5.26 a (年), 则其蜕变速率常数为:_________________, 某医院购得该同位素20 mg, 10 a后剩余 ______________mg。
理论力学课后答案-谢传峰、王琪-动力学部分
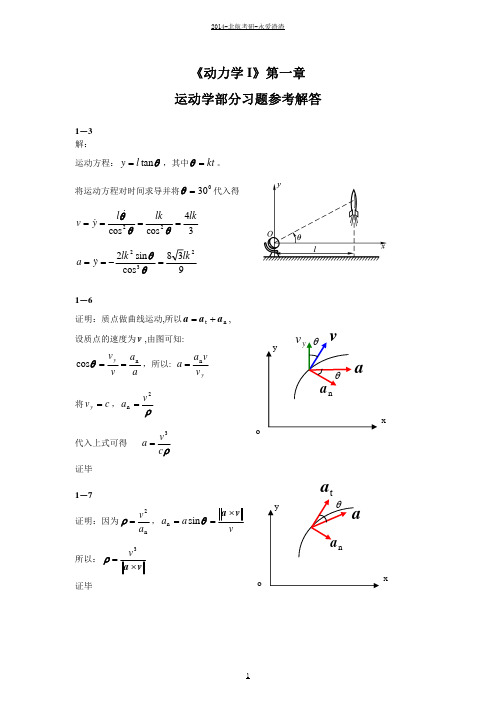
1-20 解:取小环为动点,OAB 杆为动系 运动分析 O 绝对运动:直线运动; 相对运动:直线运动; ve A 牵连运动:定轴转动。 由运动分析可知点的绝对速度、相对速度和牵连速度的方向如图所示, 其中: ve OM 根据速度合成定理: M
vr B
va
r 2 r cos 600
由此解得: x
vo
mg
(a)
sv 0 x
v0 s ,将该式对时间求导得: (a)式可写成: xx
2 x x 2 s v0 v0 x
(b)
2 2 v0 v 2l 2 x 0 3 (负号说明滑块 A 的加速度向上) x x
将(a)式代入(b)式可得: a x x
va2 v2 v 2 sin t n 因为 a ,所以根据上式可求出 aa aa tan 。 r r cos 2 r cos3
n a
根据矢量形式的质点运动微分方程有:
m(aat aan ) F FO mg
将该式分别在 x 轴上投影:
m(aat sin aan cos ) FO cos
取套筒 A 为研究对象,受力如图所示,根据质点矢量形式的运动微分方程有:
ma F FN mg
将该式在 x, y 轴上投影可得直角坐标形式的运动微分方程:
mg F cos m x F sin FN m y
其中: cos
x x2 l 2
, sin
ve
va
r
M vr
O
r aan
ar
aat
M
根据速度合成定理有 由此可求出: va
va ve v r
物理化学 练习题及答案

填空选择题化学动力学练习题一、判断题:1.在同一反应中各物质的变化速率相同。
2.若化学反应由一系列基元反应组成,则该反应的速率是各基元反应速率的代数和。
3.单分子反应一定是基元反应。
4.双分子反应一定是基元反应。
5.零级反应的反应速率不随反应物浓度变化而变化。
6.若一个化学反应是一级反应,则该反应的速率与反应物浓度的一次方成正比。
7.一个化学反应进行完全所需的时间是半衰期的2倍。
8.一个化学反应的级数越大,其反应速率也越大。
9.若反应A + B••Y + Z的速率方程为:r=kc A c B,则该反应是二级反应,且肯定不是双分子反应。
10.对于一般服从阿累尼乌斯方程的化学反应,温度越高,反应速率越快,因此升高温度有利于生成更多的产物。
11.若反应(1)的活化能为E1,反应(2)的活化能为E2,且E1 > E2,则在同一温度下k1一定小于k2。
12.若某化学反应的Δr U m < 0,则该化学反应的活化能小于零。
13.对平衡反应A••Y,在一定温度下反应达平衡时,正逆反应速率常数相等。
14.平行反应,k1/k2的比值不随温度的变化而变化。
15.复杂反应的速率取决于其中最慢的一步。
16.反应物分子的能量高于产物分子的能量,则此反应就不需要活化能。
17.温度升高。
正、逆反应速度都会增大,因此平衡常数也不随温度而改变。
二、单选题:1.反应3O2••2O3,其速率方程-d[O2]/dt = k[O3]2[O2] 或d[O3]/dt = k'[O3]2[O2],那么k与k'的关系是:(A) 2k = 3k' ;(B) k = k' ;(C) 3k = 2k' ;(D) ½k = •k' 。
2.有如下简单反应aA + bB••dD,已知a < b < d,则速率常数k A、k B、k D的关系为:(选项不全,自己写出答案)(A) ;(B) k A < k B < k D;(C) k A > kB > kD ;(D) 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
dc A ′ 2 − = k A c A c B = k A 2c A dt
dp A = kpA pB 。 5-1-8 已知气相反应 2A + B →2Y的速率方程为 − dt 将气体A和B按物质的量比2:1引入一抽空的反应器中,反应温
度保持400 K。反应经10min后测得系统压力为84 kPa,经很长时 间反应完了后系统压力为63 kPa。试求: (1)气体A的初始压力pA,0及反应经10 min后A的分压力pA; (2)反应速率系(常)数kA; (3)气体A的半衰期。
t1/2 =ln2 /kA =1.56×10−3 s 。
5-1-3 H2O2的催化分解反应为一级反应。水溶液中的H2O2浓度可 用KMnO4溶液滴定后确定。测得滴定所消耗的KMnO4溶液体积 V与时间t的关系如下: t /min 0 V/ml 46.1 5 10 37.1 20 29.8 30 50 5.0
= 20min
5-1-9 反应 2A + B→ Y由试验测的为二级反应,其反应 速率方程为:− dcA = k c c A A B
dt
70℃时,已知反应速率系(常)数kB = 0.400 dm3·mol−1·s−1, 若 cA,0 = 0.200 mol·dm−3, cB,0 = 0.100 mol·dm−3。试求反应 物A的转化率为90 %时,所需时间t = ?
dcA = k A cA cB 解:(1)− dt
因为 cA,0<< cB,0 ,所以 cB ≈ cB,0 = 常数,故有
dc A ′ − = k A cB,0cA = k A cA dt
1 1 ln 于是 t = ′ k A 1 − xA
1 1 解得 t = × ln = 22s −2 −1 3 −1 −3 1× 10 mol · · × 1.00mol dm dm s · 1 − 0.2
46.5 48.4 50.4 58.3
已知为一级反应,求反应速率系(常)数。
解:cA∝(V∞-Vt) cA,0 ∝ V∞
V∞ 1 cA , 0 1 k A = ln = ln t cA t V∞ − Vt
t / min 6 9 12 14 18 22 24 26 30
kA/10−2min−1 6.70 6.56 6.83 6.86 6.85 6.72 6.66 6.82 6.66
习题
• 若反应 2A → P 为二级反应,若[A]0为反 应物 A 的起始浓度,[A]为t时刻的浓度。 则关于其半衰期的说法,正确 正确的 正确 是:………………………( ) • (A) 与[A]0无关 (B) 与[A]0成正比 • (C) 与[A]0成反比 (D) 与[A]成反比
习题
• 某反应物的速率常数为0.099min-1,反应物 初始浓度为0.2mol·dm-3,则反应的半衰期 为( ) • (A). 7 min (B). 1.01 min (C). 4.04 min (D).50.5 min
<kA>=6.74×10-2 min−1
5-1-5 蔗糖的转化反应可用旋光仪进行研究,恒温下测得溶液 的旋光角α与时间t的关系如下: t / min 0 10 20 40 80 180 300 ∞
α
6.60 6.17 5.79
5.00 3.71
1.40 -0.24 -1.98
已知为一级反应,求反应速率系(常)数。
1 解:一级反应 kt = ln 1 − xA
设反应物初浓度为cA,0 二级反应 kt = 1 ( 1 − 1) cA,0 1 − xA (1)t1=t1/2/2
ln 2 1 = ln 一级: kt1 = 2 1 − xA
t1/2= ln2/k
t1/2=1/(kcA,0)
1-xA=0.707=70.7%
p/kPa 2.004 2.064 2.232 2.476
2.969 3.197
已知为一级反应,求反应速率系(常)数。已知t=0时,只有反应物。
解:p∞ =2p0 = 4.008 kPa
1 c A , 0 1 p∞ − p0 k A = ln = ln t cA t p∞ − pt
t /s 51 206 454 751 1132 1575 5.75 2215 5.79
19.6 12.3
试求H2O2分解反应的反应速率系(常)数。
1 cA , 0 1 V0 解: k = ln = ln A t cA t Vt
t / min 5 10 20 30 50 0.0440
kA / min−1
0.0434 0.0436 0.0428 0.0440
<kA> =0.0436 min−1
5-1-4 氯化重氮苯的反应如下: C6H5N2Cl(溶液) → C6H5Cl(溶液) + N2(g) 50℃时测得放出的N2体积(在一定温度和压力下)V与时间t 的关系如下: t / min 6 9 12 14 18 22 24 26 30 ∞
V/cm3 19.3 26.0 32.6 36.0 41.3 45.0
kt 二级: 2 =
5-1-7 在定温300K的密闭容器中,发生如下气相反应: A(g)+B(g)→Y(g)测知其速率方程为
dp A − = kpA pB dt 假定反应开始只有A(g)和B(g)(初始体积比为1:
1),初始总压力为200 kPa,设反应进行到10 min时, 测得总压力为150 kPa,则该反应在300 K时的反应速率 系(常)数为多少?再过10 min时容器内总压力为多少?
习题
• 反应A=2B在温度T时的速率方程为,则 此反应的半衰期 为:……………………………… ( ) • (A) ln2/kB (B) 21n2/kB • (C) kBln2 (D) 2kB ln2
习题
• 等容气相反应A→Y的速率系(常)数k与温度T 具有如下关系式: • ln (k / s −1 ) = 24.00 − 9622
1 cA , 0 1 α 0 − α ∞ = ln 解:k A = ln t cA t αt − α∞
t / min 10 20 40 80 180 300 5.32
kA/10−3min−1 5.14 4.96 5.16
<kA>=5.15×10−3min−1。
5.13 5.18
5-1-6 对于某一级反应和某二级反应,若反应物 初浓度相同且半衰期相等,求在下列情况下二 者未反应的百分数。 (1)t1=t1/2/2; 1 t /2 (2)t2=2t1/2 。
dc A − = k A cA c B dt
在25℃时,kA = 1 × 10−2 mol−1·dm3·s−1,求25℃时, A反应掉20 %所需时间。 (1)若cA,0 = 0.01 mol·dm−3,cB,0 = 1.00 mol·dm−3; (2)若cA,0 = 0.01 mol·dm−3,cB,0 = 0.02 mol·dm−3。
pA , 0 pB, 0
υ A pA 2 = = = υ B pB 1
dp A pA kA 2 − = k A pA = ( ) pA dt 2 2 2 1 1 ) =1.59×10−3 kPa−1·min−1 kA = ( − t pA pA , 0
(3)
t1/ 2 =
1 kA ( ) ⋅ pA, 0 2
解:
A(g) + B(g )→ Y(g) pA,0 pA pB,0 pB 0 pA,0- pA
t=0: t=t:
则时间t时的总压力为 pt = pA+ pB+ pA,0 - pA= pB+ pA,0 因为 则 故 pA,0= pB,0 符合化学计量系数比,所以 pA= pB pt = pA + pA,0 pA= pB= pt -pA,0
(2)t2=2t1/2
1 1 1 = ( − 1) 1-xA=0.667=66.7% 二级:kt1 = 2c A , 0 c A , 0 1 − x A
1 一级: kt2 = 2 ln 2 = ln 1− x
2 cA , 0 = 1 cA , 0 ( 1 − 1) 1 − xA
1-xA=0.25=25% 1-xA=0.333=33.3%
T /K
• ( 1 ) 计算此反应的活化能; • ( 2 ) 欲使A在10min内转化率达到90%,则反 应温度应控制在多少
5-1-1 反应ClCOOCl3(g)→2COCl2(g),在定温定容容器中进行, 测得总压力p与时间t的关系如下: t /s 0 51 206 454 751 2.710 1132 1575 2215 3.452
解:按cA,0 = 2cB,0,则反应过程中始终有 cA = 2cB,于是
dc A 1 1 2 ′ 2 − = k A c A cB = k A cA × c A = k A c A = k A cA dt 2 2
分离变量积分,得
1 t= ′ kA
或
t=
1 1 1 1 1 − − = c cA ,0 1 k cA cA,0 A A 2 xA
习题
• 用半衰期法求反应级数和速率常数在 780K及p0=101.325kPa时, • 某化合物的热分解反应的半衰期为2s, 若p0降为10.1325kPa时,半衰期为20s。 求该反应的级数和速率常数。
习题
• 某一级反应在300K时完成20% 需时间 3.60min ,而在250K时同样完成20% 需 时间18.4min ,求该反应的活化能。
试计算该反应在504℃的反应速率系(常)数及半衰期。
解:p∞ =3p0 =123.9 kPa
