动力学题库-机理推导题
动力学习题汇总-反应机理

2k1k 2 c(N2O5) = kc(N2O5)。 k 1 2k 2
8-4-5 反应 2NO + O2 2NO2 是三级反应, 且
反应速率随温度升高而下降。其反应机理为: k1 k-1
2NO
N2O2
k2
(快);
2NO2 (慢)
N2O2+O2
又已知 2NO N2O2 的rUm <0。试导出总反应的
dc(NO) =k2c(NO2)c(NO3)-k3 c(NO)c(NO3)=0 ; dt 以上两式相减,得
k1c(N2O5)=(k1+2k2) c(NO2)c(NO3) 。
dc(N 2O5 ) = k1c(N2O5)-k1c(NO2)c(NO3) dt
k1c(N 2 O 5 ) k1c( N 2 O5 ) k 1 k 1 2k 2
dc(CH 4 ) = k1c(CH3)c(H2)+k2 c(H)c(C2H6) dt
= 2k1c(CH3)c(H2) = 2k1K1/2[c(C2H6)]1/2 c(H2) 。
= k[c(C2H6)]1/2c(H2)
8-4-4 N2O5气相分解反应 N2O5 2NO2 +(1/2) O2 的反应机 理如下:
dc(N 2O 2 ) k1[c(NO)] 2 k1c(N 2O 2 ) k2c(O 2 )c(N 2O2 ) 0 dt
k1[c(NO)] 2 ; c( N 2 O 2 ) k 1 k 2 c(O 2 )
dc(NO 2 ) k1[c(NO)] 2 2k 2 c(O 2 )c(N 2 O 2 ) 2k 2 c(O 2 ) dt k 1 k 2 c(O 2 ) 2k1k 2 [c(NO)] 2 c(O 2 ) k 1 k 2 c(O 2 )
动力学题库-机理推导题

1 •求具有下列机理的某气相反应的速率方程:4 JU B B C k2 > DB 为活泼物质,可用稳态近似法。
证明此反应在高压下为一级。
[参考答案]稳态近似法的关键是认为活泼中间产物在反应过程中,其浓度不变,即其净速率为零。
设以产物D 的生成速率表示上述复合反应的速率,即de c ,k 2C B CC( 1)dt因B 的活泼物质,其净速率为 dc Bk i C A -k 」C B - k 2C g C cdt采用稳态近似法,贝U企 =0,亦即dtk i C A = k J C B ' k ?C B C ck i C A k i k 2C c将式(2)代入(1 )中,整理得de 。
_ k 2k i C A C c dt k 」k 2e c所谓高压下,亦即 C c , C A 浓度很大,致使k 2C c L kj ,于是k 4 k 2e c: k 2e c所以如二k i C A(—级反应)dt2.反应H 2 ■ Cl 2 r 2HCl 的机理为:Cl 2M 》2Cl M Cl H 2」》HCl HH Cl 2—J HCl Cl 2Cl M —k4 > Cl 2M 其中k i ,k 4分别为Cl 2的速率常数d Hci ,k 2[H 2][Cl] k 3[H][Cl 2] dt对H 和Cl 用稳态近似法(2)试证明:d[HCl] dti[H 2][Cl 2]2[参考答案]二 2k ?(4)有:d[H ^ 二 k 2[H 2][CI] —k 3[H ][CI 2] =0 dtd[CI]2及:2k 1[CI 2][M ] -k 2[H 2][CI] k 3[H][CI 2] -2KJCI ]2[M ] = 0dt由此二式可以得出:k 2【H 2][CI] =k3【H][CI 2] 2k 1[CI 2][M ] =2k 4[CI]2[M ]10 [cm k 4d [ HCI ]所以 ------- =k 2[H 2][CI] k 3[H ][CI 2]dt= 2k 2【H 2][CI]I N 2O 4 】将(2)代入(3)得r ]\ K i IHNO 2 2 \-N 2O 4 K 2; “N O 2 …H 2O I于是:[Cl ]二1怪 $ '[H k 43•若反应3HNO2T H 2O+2NO+H++NO 3一的机理如下,求以u _NO 31表示的速 率方程。
药物代谢动力学题库

药物代谢动力学题库
药物代谢动力学是药理学中的重要分支,它研究药物在体内的
吸收、分布、代谢和排泄等过程。
以下是一些与药物代谢动力学相
关的常见问题及其答案:
1. 什么是药物代谢动力学?
药物代谢动力学是研究药物在体内被代谢、转化和清除的过程
的科学。
它涉及到药物在体内的吸收、分布、代谢和排泄等过程,
以及这些过程的动力学特性。
2. 什么是药物的代谢?
药物代谢是指药物在体内经过化学反应转化为代谢产物的过程。
这些代谢产物通常具有不同的药理活性和生物学活性,对药物的药
效和毒性都有影响。
3. 药物代谢的主要部位有哪些?
药物代谢主要发生在肝脏、肠道、肾脏和肺部等组织器官中。
其中肝脏是最重要的药物代谢器官,大部分药物在体内经过肝脏的代谢转化。
4. 什么是药物的半衰期?
药物的半衰期是指药物在体内浓度下降到初始浓度的一半所需的时间。
它是衡量药物在体内代谢和排泄速度的重要指标,对于确定药物的给药方案和用药间隔具有重要意义。
5. 药物代谢动力学的影响因素有哪些?
药物代谢动力学受到许多因素的影响,包括个体的遗传因素、年龄、性别、肝功能、肾功能、饮食习惯、药物相互作用等。
这些因素都会对药物的代谢速率和代谢产物产生影响。
总的来说,药物代谢动力学是一个复杂而重要的领域,它对于药物的临床应用和药物研发具有重要意义。
希望以上回答能够满足你的需求,如果你有其他关于药物代谢动力学的问题,也欢迎继续提出。
化学反应机理练习题推导化学反应的反应机理

化学反应机理练习题推导化学反应的反应机理化学反应是物质之间发生的转化过程,而研究化学反应机理就是要理解反应发生的原因和过程。
推导化学反应的反应机理是化学研究的重要部分,也是化学工程和相关领域的基础。
本文将通过几个化学反应机理的练习题,来帮助读者更好地理解和掌握化学反应机理的推导过程。
【练习题一】醋酸酯的水解反应机理:醋酸酯可以通过水解反应转变为醋酸和醇。
推导醋酸酯的水解反应机理。
解题思路:水解反应是指一个物质与水反应形成另一组物质的过程。
在醋酸酯的水解反应中,醋酸酯首先与水分子中的氢离子发生酯键的断裂,形成醋酸根离子和醇。
接着,醋酸根离子和水分子再次发生质子转移反应,生成醋酸和醇。
推导过程:(1)机理步骤一:酯键的断裂CH3COOR + H2O → CH3COO- + R-OH(2)机理步骤二:质子转移反应CH3COO- + H2O → CH3COOH + OH-综上所述,醋酸酯的水解反应机理可以表示为:CH3COOR + H2O → CH3COOH + R-OH【练习题二】燃烧反应的反应机理:燃烧是许多化学反应中常见的反应类型之一。
请推导丙烷燃烧的反应机理。
解题思路:燃烧反应是指物质与氧气反应生成氧化产物和释放能量的过程。
丙烷燃烧是丙烷与氧气反应生成二氧化碳和水的过程。
在丙烷燃烧反应中,丙烷的碳-碳键首先被断裂,生成乙烯中间体,然后乙烯与氧气反应,在氧的作用下生成首先生成中间产物丙烯醛,再进一步发生加氢反应生成二氧化碳和水。
推导过程:(1)机理步骤一:丙烷的碳-碳键断裂C3H8 → CH2=CH2 + CH3•(2)机理步骤二:乙烯与氧气的反应CH2=CH2 + O2 → CH2=CH-CHO•(3)机理步骤三:丙烯醛的加氢反应CH2=CH-CHO• + H2 → CH3-CH2-OH + CO2综上所述,丙烷燃烧的反应机理可以表示为:C3H8 + 5O2 → 3CO2 + 4H2O【练习题三】还原反应的反应机理:还原反应是指物质接受或获取电子的过程,还原剂使其他物质发生电子转移,从而减少了氧化态。
物理化学-动力学练习题及参考答案

动力学1A一、选择题1. 连串反应A k1B k2 C 其中k1= 0.1 min-1,k2= 0.2 min-1,假定反应开始时只有A,且浓度为1 mol·dm-3,则B 浓度达最大的时间为:( )(A) 0.3 min (B) 5.0 min(C) 6.93 min (D) ∞2. 平行反应A k1 B (1);A k2 D (2),其反应(1)和(2)的指前因子相同而活化能不同,E1为120 kJ·mol-1,E2为80 kJ·mol-1,则当在1000K 进行时,两个反应速率常数的比是:( )(A) k1/k2= 8.138×10-3(B) k1/k2= 1.228×102(C) k1/k2= 1.55×10-5(D) k1/k2= 6.47×1043. 如果臭氧(O3) 分解反应2O3→3O2的反应机理是:O3→O + O2(1)O + O3→2O2(2)请你指出这个反应对O3而言可能是:( )(A) 0 级反应(B) 1 级反应(C) 2 级反应(D) 1.5 级反应4. 化学反应速率常数的Arrhenius 关系式能成立的范围是:( )(A) 对任何反应在任何温度范围内(B) 对某些反应在任何温度范围内(C) 对任何反应在一定温度范围内(D) 对某些反应在一定温度范围内5. 如果反应2A + B =2D 的速率可表示为:r = -12d c A /d t = - d c B /d t = 12d c D /d t 则其反应分子数为: ( )(A) 单分子 (B) 双分子(C) 三分子 (D) 不能确定6. 实验测得反应 3H 2+ N 2→ 2NH 3 的数据如下:由此可推知该反应的速率方程 d p (NH 3)/2d t 等于: ( )(A) kp H 23 p N 2(B) kp H 22p N 2 (C) kp H 2 p N 2 (D) kp H 2 p N 227. 在反应 A k 1B k 2C ,A k 3 D 中,活化能 E 1> E 2> E 3,C 是所需要的产物,从动力学角度考虑,为了提高 C 的产量,选择反应温度时,应选择: ( )(A) 较高反应温度(B) 较低反应温度 (C) 适中反应温度(D) 任意反应温度 8. [X]0 [Y]0 [Z] 增加 0.0050 mol ·dm -3 所需的时间/ s0.10 mol ·dm -3 0.10 mol ·dm -3 720.20 mol ·dm -3 0.10 mol ·dm -3 180.20 mol·dm-30.05 mol·dm-336对于反应X + 2Y →3Z,[Z] 增加的初始速率为:( )(A) 对X 和Y 均为一级(B) 对X 一级,对Y 零级(C) 对X 二级,对Y 为一级(D) 对X 四级,对Y 为二级9. 一级反应,反应物反应掉1/n所需要的时间是:( )(A) -0.6932/k(B) (2.303/k) lg[n/(n-1)](C) (2.303/k) lg n(D) (2.303/k) lg(1/n)10. 关于反应速率理论中概率因子P的有关描述,不正确的是:( )(A) P与≠S m有关(B) P体现空间位置对反应速率的影响(C) P与反应物分子间相对碰撞能有关(D) P值大多数<1,但也有>1的二、填空题12. 60Co广泛用于癌症治疗, 其半衰期为5.26 a (年), 则其蜕变速率常数为:_________________, 某医院购得该同位素20 mg, 10 a后剩余______________ mg。
化学反应动力学考题及问题详解
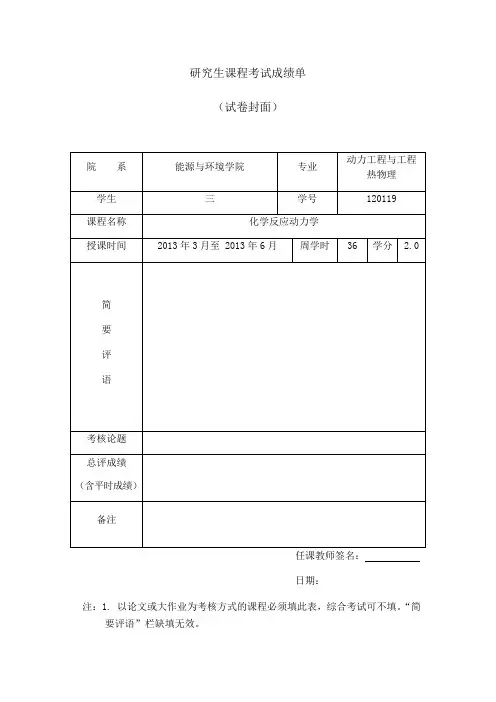
研究生课程考试成绩单(试卷封面)任课教师签名:日期:注:1. 以论文或大作业为考核方式的课程必须填此表,综合考试可不填。
“简要评语”栏缺填无效。
2. 任课教师填写后与试卷一起送院系研究生秘书处。
3. 学位课总评成绩以百分制计分。
第一部分1.简答题(1)简述化学反应动力学与化学反应热力学、化学反应工程的关系。
答:化学反应动力学与化学反应热力学是综合研究化学反应规律的两个不可缺少的重要组成部分。
由于二者各自的研究任务不同,研究的侧重而不同,因而化学反应动力学与化学反应热力学既有显著的区别又互有联系。
化学反应热力学特别是平衡态热力学是从静态的角度出发研究过程的始态和终态,利用状态函数探讨化学反应从始态到终态的可能性,即变化过程的方向和限度,而不涉及变化过程所经历的途径和中间步骤。
所以,化学反应热力学不考虑时间因素,不能回答反应的速率历程。
因此,即使一个反应在热力学上是有利的,但如果在动力学上是不利的,则此反应事实上是不能实现的。
因此,要开发一个新的化学过程,不仅要从热力学确认它的可能性,还要从动力学方面研究其反应速率和反应机理,二者缺一不可。
从研究程序来说,化学反应热力学研究是第一位的,热力学确认是不可能的反应,也就没有必要再进行动力学的研究。
显然只有对热力学判定是可能的过程,才有进行动力学研究的必要条件。
(2)简述速控步、似稳态浓度法、似平衡浓度法的适用条件及其应用。
答:速控步:连续反应的总反应的速率决定于反应速率常数最小的反应步骤——最难进行的反应,称此为决定速率的步骤。
此结论也适应于一系列连续进行的反应;而且要满足一个条件即反应必须进行了足够长的时间之后。
似稳态浓度法:是对于不稳定中间产物的浓度的一种近似处理方法,视之近似看作不随时间变化,不仅常用于连续反应,对于其他类似的反应只要中间物不稳定,也可适用。
似平衡浓度法:在一个包括有可逆反应的连续反应中,如果存在速控步,则可以认为其他各反应步骤的正向、逆向间的平衡关系可以继续保持而不受速控步影响,且总反应速率及表观速率常数仅取决于速控步及它以前的反应步骤,与速控步以后的各步反应无关。
物理化学动力学测试卷
,
得此结论的理由是 基元反应的反应级数等于反应分子数
。
2.对峙反应 A
B,其正反应的速率可表示为: r 正=k1[A]
;逆
反应的速率为: r 逆=k-1[B] ,该对峙反应的净速率可表示为: r= r 正-r 逆
=k1[A]- k-1[B] ;当反应达到平衡时,正、逆反应速率常数之间的关系可表示为
k1[A]- k-1[B] 或 k1/ k-1 = [B]/ [A] =K
1
《动力学部分》题库及题解
一、填空题:
1.何为具有简单级数的反应:反应速率只与浓度有关,且组分级数和反应总级数
为零或正整数 ,某反应 A+B=P 为基元反应,则该反应的反应级数为: 二级 ,
该反应的反应速率与反应物浓度的关系可表示为 r=k[A][B]
,得此关系
的理由是 基元反应遵守质量作用定律 ,该反应的分子数为: 二
反应是……( D)
A.一级反应
B.二级反应
C.零级反应
D.3/2 级反应
∵3/2 级反应的 t = 2/k([A]01/2-[A]1/2/[A]01/2[A]1/2) t1/t 2=2.22≈2
10、若某反应进行完全所需的时间是有限的,且等于 c0/k,则此反应为……(C )
A.一级反应
B.二级反应
是:测 不同温度下的速率常数 k ,作 lnk~1/T 关系图,通过斜率求
得活化能。
4.某气体反应 A+B—→3C 的速率方程为 r ==kCαACβB,为确定α、β值在常温 下进行实验,当初始压力为 PA,0=102Pa,PB,0=105Pa 时,作反应的 lnPA~t(时间) 图为一直线,当初始压力为 PA,0= PB,0=5×102Pa 时,仍作反应的 lnPA~t 图仍为一 直线,则α= 1 ,β= 0 。(lnc~t 成直线关系的是一级反应)
物理化学—动力学练习题及参考答案2
动力学2A 一、选择题1. 水溶液反应 Hg 22+ + Tl 3+ ─→ 2Hg 2+ + Tl + 的速率方程为r = k [Hg 22+][Tl 3+]/[Hg 2+]。
以下关于反应总级数 n 的意见哪个对? ( ) (A) n = 1 (B) n = 2 (C) n = 3 (D) 无 n 可言 2. 根据常识, 试确定238U 的半衰期近似为:(a 表示年) ( )(A) 0.3×10-6 s (B) 2.5 min (C) 5580 a (D) 4.5×109 a3. 某反应物反应掉 7/8 所需的时间恰好是它反应掉 1/2 所需时间的 3 倍,则该反应的级数是: ( )(A) 零级 (B) 一级反应 (C) 二级反应 (D) 三级反应 4. 1-1 级对峙反应由纯 A 开始反应,当进行到 A 和 B 浓度相等的时间为: (正、逆向反应速率常数分别为 k 1 ,k 2) ( ) (A) t = ln12k k (B) t =11221ln kk k k - (C) t =1121212ln k k k k k +- (D) 112121ln k t k k k k =+- 5. 一级反应完成 99.9% 所需时间是完成 50% 所需时间的: ( )(A) 2 倍 (B) 5 倍 (C) 10 倍 (D) 20 倍 6. 一个反应的活化能是33 kJ ·mol -1, 当 T = 300 K 时,温度每增加 1K ,反应速率常数增加的百分数约是: ( )(A) 4.5% (B) 90% (C) 11% (D) 50% 7. 均相反应 A + Bk 1C +D , A + Bk 2E +F 在反应过程中具有∆[C]/∆[E]= k 1/k 2的关系, ∆[C],∆[E] 为反应前后的浓差,k 1,k 2是反应 (1),(2)的速率常数。
下述哪个是其充要条件? ( )(A) (1),(2) 都符合质量作用定律 (B) 反应前 C ,E 浓度为零 (C) (1),(2) 的反应物同是 A ,B (D) (1),(2) 反应总级数相等8. 气相反应 A + 2B ─→ 2C ,A 和 B 的初始压力分别为 p A 和 p B ,反应开始时并无 C ,若 p 为体系的总压力,当时间为 t 时,A 的分压为: ( )(A) p A - p B (B) p - 2p A (C) p - p B (D) 2(p - p A ) - p B 9. 某二级反应,反应物消耗 1/3 需时间 10 min ,若再消耗 1/3 还需时间为: ( )(A) 10 min (B) 20 min (C) 30 min (D) 40 min 10. 某具有简单级数反应的速率常数的单位是 mol ·dm -3·s -1,该化学反应的级数为: ( )A B 2(A) 2 级 (B) 1 级 (C) 0 级 (D) 3 级 11. 反应速率的简单碰撞理论中引入了概率因子P ,可表示为反应截面与碰撞截面之比(σ r /σ AB ),于是 ( )(A) P >1 (B) P <1 (C) P =1 (D) 不一定二、填空题12. 某反应物的转化率分别达到 50%,75%,87.5% 所需时间分别为 t 12,2t 12,3t 12,则反应对此物质的级数为 _______ 。
机械原理试题库及答案
机械原理试题库及答案1. 问题:什么是机械原理?答案:机械原理是研究机械运动和力学性质的基本规律的科学。
它涉及到力学、材料学、电气学等多个学科的知识。
2. 问题:什么是力学?答案:力学是研究物体运动、力的作用和物体相互作用的科学。
它主要包括静力学、动力学和变形力学等分支。
3. 问题:什么是力?答案:力是使物体发生运动、改变速度或形状的作用。
它是一个矢量量,有大小和方向。
4. 问题:什么是力的平衡条件?答案:力的平衡条件是指在一个物体上作用的合力为零时,物体处于力的平衡状态。
它可以分为力的平衡和力的矩的平衡两个条件。
5. 问题:什么是摩擦力?答案:摩擦力是两个物体相互接触,并阻碍其相对运动的力。
它有静摩擦力和动摩擦力两种形式。
6. 问题:什么是杠杆原理?答案:杠杆原理是指在平衡条件下,杠杆两边所受到的力和力臂的乘积相等。
它描述了杠杆的力学性质。
7. 问题:什么是滑轮原理?答案:滑轮原理是指通过改变力的方向和大小来实现力的传递或减小的原理。
滑轮可以改变力的方向,同时根据滑轮的个数可以改变力的大小。
8. 问题:什么是齿轮原理?答案:齿轮原理是指通过两个或多个齿轮的啮合,实现力的传递和传动的原理。
齿轮可以改变力的方向、速度和扭矩。
9. 问题:什么是机械传动?答案:机械传动是指通过齿轮、皮带、链条等传动装置,将动力传递到机械系统中的过程。
它可以改变力的大小、方向和转速。
10. 问题:什么是弹簧原理?答案:弹簧原理是指在受到外力作用时,弹簧会发生弹性变形,并反向作用力的原理。
弹簧具有储存和释放能量的功能。
汽车动力学题库
汽车动力学题库(总10页) -本页仅作为预览文档封面,使用时请删除本页-1.简要按形成原因汽车空气阻力怎么分类简单概述各种阻力的形成。
(P82)汽车空气阻力分为形状阻力、干扰阻力、内循环阻力、诱导阻力以及摩擦阻力;1)形状阻力占压差阻力的大部分,主要与边界层流态和车身后的流体分离产生的尾涡有关;2)干扰阻力是由于车身表面凸起物、凹坑和车轮等局部的影响着气流的流动而引起的空气阻力;3)内循环阻力是流经车身内部的气流对通道的作用以及流动中的能量损耗产生的;4)诱导阻力是在侧面由下向上的气流形成的涡流的作用下,车顶上面的气流在后背向下偏转,产生的实际升力中一向后的水平分力;5)摩擦阻力是由于空气粘性使其在车身表面产生的切向力。
2.简述汽车的楔形造型在空气动力特性方面的特点。
1)前端低矮,进入底部的空气量少,底部产生的空气阻力小;2)发动机罩与前风窗交接处转折平缓,产生的空气阻力小;3)后端上缘的尖棱,使得诱导阻力较小;4)前低后高,‘翼形’迎角小,使空气升力小;5)侧视轮廓图前小后大,气压中心偏后,空气动力稳定性好。
3.假设某电动汽车的质心位置在前后轮轴中间位置,且前后车轮的侧片刚度相同,电池组放在中间质心位置,试问该车稳态转向特性类型属于哪一类在以下三种情况下,该车的稳态转向也行会如何变化1)将电池组移到前轴放置;2)将电池组移到后轴放置;3)将电池组分为两部分(质量相等),分别放在前后轴上。
根据稳定性因数公式该车稳态转向特性属于中性转向。
1)电池组移至前轴上放置,质心前移,变为不足转向;2)将电池组移到后轴上放置,质心后移,变为过多转向;3)质心位置不变,仍为中性转向。
4.什么是被动悬架、半主动悬架、主动悬架说明采用天棚阻尼的可控悬架属于哪一类悬架及其理由。
被动悬架是悬挂刚度和阻尼系数都不可调节的传统悬架;半主动悬架的阻尼系数可自动控制,无需力发生器,受减振器原理限制,不能实现最优力控制规律;主动悬架的悬架力可自动控制,需要增设力发生器,理论上可实现最优力控制规律。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.求具有下列机理的某气相反应的速率方程:
1
1k k A B - 2k B C D +−−→
B 为活泼物质,可用稳态近似法。
证明此反应在高压下为一级。
[参考答案]
稳态近似法的关键是认为活泼中间产物在反应过程中,其浓度不变,即其净速率为零。
设以产物D 的生成速率表示上述复合反应的速率,即
2D B C dc k c c dt
= (1) 因B 的活泼物质,其净速率为
112B A B B C dc k c k c k c c dt
-=-- 采用稳态近似法,则0B dc dt
=,亦即 112A B B C k c k c k c c -=+
112A B C
k c c k k c -=+ (2) 将式(2)代入(1)中,整理得
2112A C D C
k k c c dc dt k k c -=+ 所谓高压下,亦即C c ,A c 浓度很大,致使21C k c k -,于是
122C C k k c k c -+≈
所以 1D A dc k c dt
= (一级反应) 2.反应HCl Cl H 222→+的机理为:
M Cl M Cl k +−→−+212
H HCl H Cl k +−→−+22
Cl HCl Cl H k +−→−+32
M Cl M Cl k +−→−+242
其中14,k k 分别为Cl 2的速率常数 试证明:112
122224[]2[][]k d HCl k H Cl dt k ⎛⎫= ⎪⎝⎭ [参考答案]
[]]][[]][[2322Cl H k Cl H k dt
HCl d += 对H 和Cl 用稳态近似法
有:
0]][[]][[][2322=-=Cl H k Cl H k dt
H d 及:21222324[]2[][][][][][]2[][]0d Cl k Cl M k H Cl k H Cl k Cl M dt =-+-= 由此二式可以得出:
]][[]][[2322Cl H k Cl H k =
][][2]][[22421M Cl k M Cl k =
于是:2122
141][][Cl k k Cl ⎪⎪⎭
⎫ ⎝⎛= 所以 2232[][][][][]d HCl k H Cl k H Cl dt =+ ]][[222Cl H k =
21222
1412]][[2Cl H k k k ⎪⎪⎭
⎫ ⎝⎛= 3.若反应22332HNO H O NO H NO +-→+++ 的机理如下,求以-3NO υ⎡⎤⎣⎦表示的速率方程。
1K 2
222HNO NO+NO H O + (快速平衡) 2K 2242NO N O (快速平衡)
3k 24223N O H O HNO H NO +-+−−→++ (慢)
[参考答案]
[]-33242NO k N O H O υ⎡⎤⎡⎤=⎣⎦⎣⎦ (1)
因为前两个反应处于快速平衡,所以
[][][][]
22122NO NO H O K HNO = [][][][]21222K HNO NO NO H O =
(2) [][]
24222N O K NO = [][]22422N O K NO = (3)
将(2)代入(3)得
[][][][]2
21224222K HNO N O K NO H O ⎧⎫⎪⎪=⎨⎬⎪⎪⎩⎭ (4)
将(4)代入(1)得
[][][]
4
2-2332122HNO NO k K K NO H O υ⎡⎤=⎣⎦ 4.求具有下列机理的某气相反应的速率方程: 1
1k k A B - 2k B C D +−−→
B 为活泼物质,可用稳态近似法。
证明此反应在低压下为二级。
[参考答案]
稳态近似法的关键是认为活泼中间产物在反应过程中,其浓度不变,即其净速率为零。
设以产物D 的生成速率表示上述复合反应的速率,即
2D B C dc k c c dt
= (1) 因B 的活泼物质,其净速率为
112B A B B C dc k c k c k c c dt
-=-- 采用稳态近似法,则0B dc dt
=,亦即 112A B B C k c k c k c c -=+
112A B C
k c c k k c -=+ (2) 将式(2)代入(1)中,整理得
2112A C D C
k k c c dc dt k k c -=+ 在低压下,亦即21C k c k -,则
121C k k c k --+≈
所以 121
D C A C A dc k k c c kc c dt k -== (二级反应) 5.单分子气相分解反应A → P 的机理如下: 1
1*k k A A A A -++
2*k A P −−→
用稳态法推导生成物P 的速率方程,并证明该反应在高压下为一级,在低压下为二级. 解:
*2P p A dC k C dt
υ==
*2**1120A A A A A dC k C k C C k C dt
-=--= 2*121A A
A k C C k k C -=+ 所以: 2*12221P A p A A
dC k k C k C dt k k C υ-===+ (1) 高压时, A C 较大, 21A k k C -时, 211A A k k C k C --+≈,所以 21212211
P A p A A A dC k k C k k C kC dt k k C k υ--====+(121k k k k -=) 所以反应为一级
(2) 低压时, A C 较小, 21A k k C -时, 212A k k C k -+≈,所以
2212121P A p A A
dC k k C k C dt k k C υ-===+ 所以反应为二级。
