§1.1热力学的研究对象
什么是热力学

什么是热力学热力学是一门研究物质能量转化和传递的学科,主要研究热、功、能量和熵等宏观物理量的性质和相互关系。
热力学最早源于18世纪后期,由于当时工业革命的兴起,人们对热能的研究需求日益增加。
热力学的基本理论被奥地利科学家卡诺、英国物理学家开尔文、英国工程师瓦特等人提出,并逐渐发展成为一个独立的学科。
热力学的研究对象是宏观的物质系统,它的基本假设是系统的守恒性,即能量守恒和物质守恒。
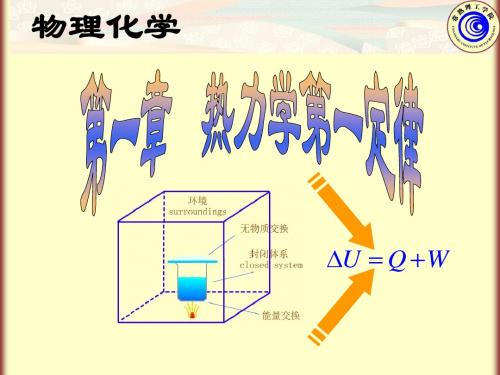
热力学系统分为封闭系统、开放系统和孤立系统。
封闭系统与外界的物质交换不发生,但能量交换允许;开放系统与外界的物质和能量交换都允许;孤立系统与外界的物质和能量交换都不允许。
热力学的基本物理量有热量、功、内能和熵。
热量是指由于温度差而传递的能量,通常用Q表示;功是指外力对系统做的可逆过程所做的功,通常用W表示;内能是指系统中所有微观粒子的能量总和,通常用U表示;熵是一个描述系统无序程度的物理量,通常用S表示。
根据能量守恒定律,可得到热力学第一定律:能量守恒定律,即能量不会凭空消失或产生,只会从一种形式转化为另一种形式。
热力学的第二定律是关于能量传递方向的定律,也是描述自然界过程发展方向的定律。
它包括热力学第二定律和熵增定律两个部分。
热力学第二定律规定了热量的反向传递是不可能的,热量只能从高温物体传递到低温物体。
熵增定律则表明孤立系统的熵是不断增加的,即系统的无序程度不断增加。
这是因为自然界中几乎所有过程都是不可逆的,无法回到初始状态。
热力学的应用非常广泛,几乎涉及到各个领域。
在物理学中,热力学用于研究物质的热力学性质、相变和热力学平衡等;在化学中,热力学用于研究化学反应的能量变化和反应的平衡等;在工程学中,热力学用于热能转化和能量利用的优化等。
热力学的应用也延伸到生物学、地球科学和环境科学等多个学科领域。
总之,热力学是研究物质能量转化和传递的科学,通过研究热、功、能量和熵等物理量之间的关系,揭示了自然界中各种宏观过程的规律。
第一章 热力学第一定律

1.1.3 热力学的方法和局限性
热力学方法: •研究对象是大数量分子的集合体,研究宏观性质,所得结论具 有统计意义。 •只考虑变化前后的净结果,不考虑物质的微观结构和反应机理。 •能判断变化能否发生以及进行到什么程度,但不考虑变化所需 要的时间。
总结
4
§1.1 热力学概论
热力学概论 热平衡 基本概念 第一定律 准静态过程 焓 热容 理想气体 焦耳-汤姆逊 热化学 温度影响
Physical Chemistry of Metallurgy
冶金物理化学
第一章 热力学第一定律
第一章 热力学第一定律
热力学概论 热平衡 基本概念 第一定律 准静态过程 焓 热容 理想气体 焦耳-汤姆逊 热化学 温度影响
主要内容
1. 热力学概论 7. 热容
2. 热平衡和热力学第零定律 8. 热力学第一定律对理
故
V V ( m ) ( m ) T p R p T 2 T p p p T
总结
17
§1.3 热力学基本概念
热力学概论 热平衡 基本概念 第一定律 准静态过程 焓 热容 理想气体 焦耳-汤姆逊 热化学 温度影响
1.3.2 系统的性质
用宏观可测性质来描述系统的热力学状态,故这些性质又称 为热力学变量。可分为两类: (1)广度性质(extensive properties) 又称为容量性质,它的数值与系统的物质的量成正比,如体 积、质量、熵等。这种性质有加和性,在数学上是一次齐函数。 (2)强度性质(intensive properties) 它的数值取决于系统自身的特点,与系统的数量无关,不 具有加和性,如温度、压力等。它在数学上是零次齐函数。指 定了物质的量的容量性质即成为强度性质,或两个容量性质相 除得强度性质。
第一章 热力学第一定律(物理化学-印永嘉)解析

焦耳(Joule)和迈耶(Mayer)自1840年起,历经20多年,用 各种实验求证热和功的转换关系,得到的结果是一致的。
即: 1 cal = 4.1840 J
这就是著名的热功当量,为能量守恒原理提供了科学的实 验证明。
对于热力学系统而言,能量守恒原理就是热力学第一定律
到1850年,科学界公认能量守恒定律是自然界的 普遍规律之一。能量守恒与转化定律可表述为:
力学平衡 又称机械平衡,体系各部的压力都相等,边界不再移动。 如有刚壁存在,虽双方压力不等,但也能保持力学平衡。 相平衡 在系统中多个相(包括g,l,s)的数量和组成不随温度 而变。上述平衡条件中任何一个的不能满足,则系统处于 非平衡态。
化学平衡 反应体系中各物的组成不再随时间而改变。
(二)热力学第一定律 §1.3 能量守恒——热力学第一定律
(2)状态和状态性质
状态是系统的物理性质和化学性质的综合表现。系统状态 的性质称为状态性质,或状态函数。当系统所有的状态性 质都不随时间变化时,则称系统处于“定态”。
容量性质 它的数值与体系的物质的量成正比,如体积、质量、熵等。 这种性质有加和性。
强度性质 它的数值取决于体系自身的特点,与体系的数量无关,不具 有加和性,如温度、压力等。往往两个容量性质之比成为系 统的强度性质。
(a)气体向真空膨胀
因为外压p外=0,所有在膨胀过程中系统没有 对环境做功,即
W=0
(b)气体在恒定外压的情况下膨胀
W
V2 V1
p外dV p外(V2
V1 )
(c)在整个膨胀过程中,始终保持外压比气体压力p只差 无限小的数值。
W
V2 V1
p外dV
V2 (p-dp)dV
第1章 热力学第一定律
§ 1.5 定容及定压下的热
U、H、U、 H、Qp、QV的区别与联系
1.哪个是状态函数? U、H 2.哪个能测量? ΔU、ΔH、Qp、QV 3.有何关系?W’=0时ΔU=Q ,ΔH=Q V p
§ 1.6 热容 1. 定容热。 δQ 注意:Wf=0,无相变、无 C= dT 化学变化的封闭系统。
2.可逆过程
可逆过程是一个极限的理想过程。
研究可逆过程的用处:
(1)确定提高实际过程的效率的可能性。
(2)求解重要热力学函数的变化值。
2.可逆过程
几种典型的可逆过程 可逆膨胀和可逆压缩:力平衡 可逆传热:热平衡 可逆相变:相平衡 可逆化学反应:A+B C
§ 1.4 体积功 3.可逆相变的体积功
§ 1.2 几个基本概念
1.系统和环境
在研究时被划分出来作为研究对象的 物体称为系统(System);系统以外与 系统有相互作用的周围部分称为环境 (Surroundings)。
1.系统和环境
系统分类
(1)敞开系统
(2)密闭(封闭)系统 (3)隔绝(孤立)系统
与环境的关系
物质交换 能量交换
√ × ×
1)三种不同过程的功相同么? 三种不同过程的内能变化相同么? 三种不同过程的热相同么? 2)哪种过程的功最大?
1.体积功 例: H2(1000Pa,3m3)
等温压缩 W=?
1molH2(3000Pa,1m3)
1)一次压缩? 2)等温可逆压缩?
1)一次膨胀:W=-2000 J 反向(一次压缩):W逆=(-3000)*(1-3)=6000 J 所以,在环境中留下了影响。 2)可逆膨胀:W=-3296 J 反向(可逆压缩):W逆=3296 J 所以,在环境中没有留下影响。
第一章 热力学第一定律
糖水
糖水 糖
均相系统
多(复、非均)相系统
化学平衡:系统内化学组成不变
物理化学 第一章 热力学第一定律 宁夏大学新华学院
Joule(焦耳)和 Mayer(迈耶尔)自1840年起,历经 20多年,用各种实验求证热和功的转换关系,得到的结 果是一致的。
即: 1 cal = 4.1840 J
状态函数:确定体系状态的物理量 (p,V,T)
特点: (1) 状态一定,状态函数一定。
(2) 状态变化,状态函数也随之而变,且状态函数
的变化值只与始态、终态有关,与变化途径无关。
物理化学
第一章 热力学第一定律
宁夏大学新华学院
§1.2 热力学基本概念及术语
容量(广度)性质:与物质的数量成正比,具有加和性 如:V、n、C 强度性质:与物质的数量无关,不具有加和性 如:P、T、Vm 、ρ T1 P1 V1 T2 P2 V2
(c)整个膨胀过程中,始终保持外压比气体压力p只差无限小数值
p外=p-dp
W p外dV ( p d p)dV pdV dpdV
V1 V1 V1 V1
V2
V2
V2
V2
物理化学
第一章 热力学第一定律
宁夏大学新华学院
§1.4 体积功
准静态过程:由无限多个极其接近平衡态(静态)的步骤组成
学能的变化 (能量守恒定律)
物理化学 第一章 热力学第一定律 宁夏大学新华学院
1.3 能量守恒----热力学第一定律
热和功的取号与热力学能变化的关系 系统吸热 Q>0 环境 U > 0 W>0 系统 系统放热 Q<0 U <0 W<0
U = Q + W
第一章 热力学第一定律

1.1.2.3 过程和途径
1.过程:当体系的状态发生变化时,状态变 化的经过,强调变化的方式 2.途径:完成变化的具体步骤,强调经由路 径的不同
注: 过程和途径不是严格区分的两个概念, 不强调方式和路径的时候可通用
几种常见的过程
• 等/定温过程:体系始态、终态及过程中的温度等于环境 温度且为常数。 T始=T终=T体=T环=常数 • 等/定压过程:体系始态、终态及过程中的压力等于环境 压力且为常数。 p始=p终=p体=p环=常数 • 等/定容过程:在变化过程中,体系的容积始终保持不变。 V体=常数
二次恒外压压缩
体系返回原状态,体系虽然恢复原 态,但环境失去功,得到热
等温可逆膨胀
V2 WⅣ nRT ln V1
W WⅣ WⅣ 0 , 又U Q W 0, 则Q 0
等温可逆压缩 V1 WⅣ nRT ln V2
体系循原过程返回,不仅体系恢复原态,而且未给 环境留下功热转化的痕迹,即环境也恢复原状态
1.1.3.1 能量守恒定律
1840年左 右,焦耳 发现了热 功当量
1.1.3.1 能量守恒定律
热功当量
升高相同的温度
状态1 加热 W=0 状态2 热 功 当 量
Q=0
Q=0
机械功 电功
1.1.3.1 能量守恒定律
电量热法
1.1.3.1 能量守恒定律
机械量热法
1.1.3.1 能量守恒定律
到1850年,科学界公认能量守恒定律是自然界的普 遍规律之一。
1.1.3.3 “热一”数学表达 式
Q
W
W
U1
Q
U2
U2-U1 = Q+W
1.1.3.3 “热一”数学表达式
第一章热力学第一定律
3.热力学研究的应用
解决热力学系统变化过程中的能量计算问题。 —重点解决化学反应热效应的计算问题。 解决系统变化过程中的可能性问题。 —重点解决化学反应自发方向和限度的问题。
4.热力学方法的特点:
只考虑变化前后的净结果,不考虑物质的微 观结构和反应机理。 能判断变化能否发生以及进行到什么程度, 但不考虑变化所需要的时间。 局限性: 第一、二定律是大量实验事实的总结,是公理, 不能用数学方法证明. 不知道反应的机理、速率和微观性质,只讲 可能性,不讲现实性。
θ
θ
三次膨胀
298K 4PӨ 1.0dm3
298K 3PӨ 4/3dm3
298K 2PӨ 2dm3
298K PӨ 4dm3
W3 = −3 p (4 / 3 − 1) − 2 p (2 − 4 / 3) − p (4 − 2) = −439 J
θ
θ
θ
•多次等外压膨胀 ' (a)克服外压为 p ,体积从 V1膨胀到 V ' ; (b)克服外压为 p ",体积从V ' 膨胀到 V " ; (c)克服外压为 p2,体积从V "膨胀到 V2 。
等温反抗外压 100kPa
等温反抗外压 50kPa
(2)过程的类型 等温过程( Tsys= Tamb= const) 等压过程( Psys= Pamb= const) 过程进行特定 条件分类 等容过程( Vsys= const) 绝热过程( Q= 0) 循环过程(始态=终态)
p= 150 kPa T= 273K 等压过程 P= 150 kPa T=373K
' 2
θ
θ三次Leabharlann 缩298K PӨ 4dm3
广延量和强度量
常见的一些实际温度值
温度到底是什么意思?!
• 用温度计测出来的东西?冷热?
• 把两个接触了足够长时间的物体(热平衡) 所共有的东西叫做温度 热平衡 温度 • 力学平衡定义了什么?力学平衡中什么是共 有的? 压强 • 扩散平衡定义了什么?扩散平衡中什么是共 有的? 化学势
2.4 广延量和强度量
广延量:与系统的量成正比:V、U 、S…
强度量:与系统的量无关:p、T … 注意:1、广延性的满足要求热力学极限 2、原子间的有效相互作用是短程的 长程力的能量不是广延量
3 热平衡定律和温度
3.1 热平衡
• 绝热壁及透热壁 绝热壁:两个物体通过器壁接触(无物质交换,不考虑 电磁作用),若两物体的状态可以完全独立改变,则器 壁称为绝热壁(无热量交换)。 透热壁:非绝热壁。
x y 1 0 y x z z
x y x 0 y z z x z y
证毕!
4.4 气体的状态方程
理想气体
pV nRT
推导使用右图所示过程,用到玻意 尔定律、阿伏伽德罗定律、理想气 体温标的定义。 阿 氏 定 律 :在相同温度和压强下,l mol的任何气体所占的体积都相同
对不同的假想体系具体考虑某一方面的性 质,就有了力学体系、电磁学体系、化学 体系,形成了物理学的不同分支,它们是 对实际的宏观系统进行不同的抽象,引进 不同的状态参量来描述。
1.2 状态参量 确定体系(或系统)状态的参量。
• 力学系统 力学参量:坐标,速度,加速度,角速度 • 电磁学体系 电磁学参量:电极化强度 P,电场 E (D), 磁化强度 M,磁场 H (B)
单元系:系统中只包含一种化学组分 多元系:系统中包含多种化学组分
热学-绪论
10×4.9×1017 = 4.9×1018个分子
分子的物质的量
4.9 1018 6.02 1023
8.1104
mol
即在137亿年中,分秒不间断地数,到目前数出万分之八点一摩尔。
4
1.热力学系统的分类
通常情况下,系统和外界之间总存在着某种形式的相互作用,包括 物质和能量的交换。根据相互作用形式,可将系统进行分类。
热力学方法的局限性
不能给出决定宏观热现象的微观实质。只能说明描述宏观热现 象物理量之间是怎样的关系,而不能说明为什么有这样的关系。
统计物理学能够深入热现象的本质,使热力学理论获得更深刻 的意义,给出宏观观测量的微观决定因素。
微观描述方法的局限性
它在数学计算遇到很大的困难,由此而作出简化假设(微观模型) 后所得的理论结果常与实验不能完全符合。
宏观描述——热力学方法
由观察和实验总结出来的热现象规律,构成热现象的宏观理论, 叫做热力学。
微观描述——统计物理学方法
从物质的微观结构出发,即从分子、原子的运动及它们之间的
相互作用出发,用统计的方法研究热现象的规律。这个理论叫做统
计物理学。
7
热力学对热现象给出普遍和可靠的结果,并可用以验证微观理论 的正确性。
mHale Waihona Puke 3洛施密特常量宇宙现今的年龄约为137亿年(1.6×1010年)
1年 =365×24×60×60秒≈3.1×107秒
宇宙年龄(秒):
1.37×1010×3.1×107秒≈4.9×1017秒
3
假如有一个“超人”,他从宇宙大爆炸那一刻起与宇宙同时诞生, 直到今天仍然健在,若他能够每秒钟数10个分子,则从他诞生时刻 数到现今,共数的分子数是
第一章_热力学第一定律
系统的各种性质,它们均随 状态确定而确定。 如:T, p, V,n 又如:一定量n的理想气体 V=nRT/P V= f(T,P) T, P是独立变量 推广 X=f (x, y) 其变化只与始末态有关,与 变化途径无关。
途径 2
状态2 (T2,p2)
途径 1
状态 1 (T1,p1)
图1.2 状态与途径
6 3 6
1.4.2.可逆过程与不可逆过程
某过程进行之后系统恢复原状的同时,环境也 恢复原状而未留下任何永久性的变化,则该过程 称为热力学可逆过程。
图1.5 恒外压膨胀
图1.6 可逆膨胀
热力学可逆过程有以下特征
(1)可逆过程进行时,系统始终接近于平衡态。 (2)可逆过程进行时,过程的推动力与阻力只相 差无穷小。 (3)系统进行可逆过程时,完成任一有限量变化 均需无限长时间。 (4)在定温可逆过程中,系统对环境所做之功为最 大功;环境对系统所做之功为最小功。
P16例题1 :在298K时2molH2的体积为15dm3 , 此时气体(1)在定温条件下,反抗外力为105Pa时 膨胀到体积为50dm3;(2)在定温下,可逆膨胀 到体积为50dm3。试计算两种膨胀过程的功。 解: (1)过程为不可逆过程 P外= P1= P2 = 105Pa
W p外 (V2 V1 ) [105 (50 15) 103 ]J 3500 J
p2 =-p1V1 (1- )=-V1 (P1 -P2 ) p1
=-10 10-3 m3 (106 -105 )Pa=-9.0 103 J
(3)外压比内压小一个无穷小的值,等温膨胀 过程是无限缓慢。
p1 p1 W pdV nRT ln p1V1 ln p2 p2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
定压下p ∅ , 400 o C
热力学 • 它研究在各种物理变化和化学变化中所发生的能 量效应。 • 研究在一定条件下,某种变化过程的方向性和限 度。
返回
2012-4-29
上一内容下一内容回来自目录教师:汪荣凯§1.1热力学的研究对象-page6 1.1热力学的研究对象 热力学的研究对象-
2.热力学是以热力学第一定律和热力学第二 定律为主要基础,是人类经验的总结,有着牢固 的实验基础和严密的逻辑推理方法,也是物理化 学中最基本的定律。
教师:汪荣凯
§1.1热力学的研究对象-page6 1.1热力学的研究对象 热力学的研究对象H 2 O(5mol ,25o C , p ∅ ) 定压下,加热 → H 2 O(5mol ,70o C , p ∅ )
3H 2 ( g ) + N 2 ( g ) → 2NH 3 ( g )
H 2 O(5mol ,25o C , p ∅ ) 定压下,加热 → H 2 O(5mol ,70o C , p ∅ )
3H 2 ( g ) + N 2 ( g ) → 2NH 3 ( g )
上一内容 下一内容 回主目录
定压下p ∅ , 400 o C
返回
2012-4-29
上一内容
下一内容
回主目录
返回
2012-4-29
教师:汪荣凯
§1.1热力学的研究对象-南大p63 1.1热力学的研究对象 南大p63 热力学的研究对象化学热力学的主要任务表现在: 化学热力学的主要任务表现在: • 根据热力学第一定律来计算变化中的热效应; • 根据热力学第二定律来解决变化的方向和限度 问题,以及相平衡和化学平衡中的有关问题; • 热力学第三定律是一个关于低温现象的定律, 主要是阐明了规定熵的数值。 • 热力学第零定律则是热平衡的互通性,并为温 度建立了严格的科学定义。
上一内容 下一内容 回主目录
返回
2012-4-29
教师:汪荣凯
§1.1热力学的研究对象-page7 1.1热力学的研究对象 热力学的研究对象热力学方法 • 在经验定律的基础上,通过演绎的方法,得出一 般性的规律。具有高度的普适性和可靠性。 • 研究是大量的宏观粒子系统,只考虑过程的初、 末态,不考虑过程的细节。(知其然,不知其所 以然) • 在热力学研究的物理量(变量)中,没有时间的 概念,不涉及过程进行的速率问题。
上一内容
下一内容
回主目录
返回
2012-4-29
教师:汪荣凯
§1.1热力学的研究对象-page6 1.1热力学的研究对象 热力学的研究对象3.化学热力学是把热力学的基本原理用来研 究化学现象以及和化学有关的物理现象的科学。 化学热力学的主要任务: • 研究化学过程及与化学过程密切相关的物理过程 中的能量效应; • 研究化学变化的方向性和限度。
上一内容 下一内容 回主目录
返回
2012-4-29
教师:汪荣凯
§1.1热力学的研究对象 1.1热力学的研究对象
上一内容
下一内容
回主目录
返回
2012-4-29
教师:汪荣凯
物理化学
上一内容
下一内容
回主目录
返回
2012-4-29
教师:汪荣凯
物理化学 第一章
上一内容
下一内容
回主目录
返回
2012-4-29
教师:汪荣凯
§1.1热力学的研究对象-page6 1.1热力学的研究对象 热力学的研究对象1.热力学是研究能量相互转换过程中所应遵 循的规律的科学。 研究宏观系统的热现象和其它形式能量之间 的转换关系,它包含当系统变化时所引起的这些 物理量的变化。
