最新范德华力及其物质性质
范德华力 氢键

氢键
已经与电负性很强的原子 形成共价键的氢原子与另 一分子中电负性很强的原 子之间的作用力 分子间或分子内氢原子与 电负性很强的N、O、F之间 较弱 溶解性、熔沸点
共价键
原子之间通 过共用电子 对形成的化
对物 熔沸点 质的 影响
0.00
水的 沸点 (℃)
100.00
水在0 ℃ 水在4 ℃ 水在20 水在100 时密度 时密度 ℃时密 ℃时密 (g/ml) (g/ml) 度(g/ml) 度(g/ml)
0.999841 1.000000 0.998203 0.958354
液态水中的氢键
范德华力、氢键和共价键的对比
范德华 力 概念 分子间 普遍存 在的作 用力 存在 分子之 范围 间
8.50
无
2、影响范德华力大小的因素
①结构相似的分子,相对分子质量 越大,范德华力越大。
②分子极性越强,范德华力越大
3、范德华力对物质性质的影响
化学键影响物质的化学性质(主)和 物理性质 范德华力影响物质的物理性质(熔、沸 点及溶解度等) 分子间范德华力越大,熔沸点越高
分子间 将干冰气化,破坏了CO2分子晶体的作用力 —————
氢键及其对物质性质的影响
3.氢键的存在
(1)分子间氢键
(2)分子内氢键
邻羟基苯甲醛(熔点:-7℃) 对羟基苯甲醛 (熔点:115-117℃)
4.氢键对物质性质的影响:
①对物质熔沸点的影响 分子间氢键使物质熔点升高
分子内氢键使物质熔点降低
②对物质的溶解性的影响
●●●
水的物理性质:
水的 熔点 (℃)
共价键 将CO2气体溶于水,破坏了CO2分子的————
练习:
分子间的力范德华力和氢键

分子间的力范德华力和氢键分子间的力:范德华力和氢键分子间的力是指分子之间相互作用的力,其中范德华力和氢键是两种常见的分子间力。
本文将对这两种力进行介绍和解析。
一、范德华力范德华力(van der Waals force)是一种相互吸引的力,起因于分子内部电荷分布的不均匀性。
它可以分为三种类型:弱的分散力(London力)、较强的取向力和最强的诱导力。
1. 分散力(London力)分散力是最弱的一种范德华力,主要存在于非极性分子之间。
分子内由于电子云的运动造成瞬时偶极矩的形成,进而引发相邻分子的极化作用,使它们之间发生吸引。
这种吸引力是瞬时性的,范德华力是由于瞬时偶极矩之间相互作用而形成的。
2. 取向力取向力是存在于极性分子之间的范德华力,是由于分子内的极性键引起的。
它是根据分子极性键的方向而产生的相互作用,类似于磁铁的N极和S极之间的吸引力。
3. 诱导力诱导力是范德华力中最强的一种类型,是由于一种分子的极化而诱发另一种分子的极化。
当一个非极性分子接近一个由极性键组成的分子时,它会被诱导成有临时极性,这样会引发两种分子之间的相互吸引。
总结:范德华力是一种微弱但广泛存在的分子间作用力,它对物质的性质和相互作用具有重要影响。
二、氢键氢键(hydrogen bond)是分子间的一种特殊强力相互作用,主要存在于带有氢原子的分子中。
氢键可以发生在分子中的氢与另一个带有电负性原子(如氮、氧和氟)之间的相互作用。
氢键的形成是通过氢原子与接受者原子形成一个氢和一个共价键,同时将电子密度极大地转移到接受者原子上。
氢键通常是可逆的,并且在分子之间形成临时的化学键,类似于范德华力的诱导力。
氢键的强度通常比较大,可以影响物质的性质和化学反应。
三、范德华力与氢键的区别范德华力和氢键虽然都属于分子间作用力,但是它们有一些明显的区别。
1. 强度不同:范德华力相对较弱,而氢键相对较强。
2. 形成条件不同:范德华力主要由于分子内电荷的不均匀性形成,而氢键则是通过氢原子和电负性原子之间的相互作用形成。
范德华力和氢键及其对物质性质的影响 PPT课件

H2O: O—H…O
NH3:
N—H…N
NH3和H2O: O—H…N
3.氢键的特点 (1).饱和性和方向性
a.由于 H 的体积小,1 个 H 只能形成一个氢键;
b.由于 H 的两侧电负性极大的两原子的负电排斥, 使(A — H ···B —)中A和B两个原子一般在H原子 两侧且呈直线排列。除非其它外力有较大影响时, 才改变方向。
Waals,1837~1923年)。荷兰科学家, 1910年获得诺贝尔物理奖。1837年6 月1日,生于莱顿。1873年,他获得 莱顿大学的博士学位,在论文中他 首次证明了分子体积以及分子间作 用力的存在。这种把分子聚集在一 起的作用力,叫做分子间作用力即
范德华力。
一、范德华力
1.使分子聚集在一起的作用力,其实质是电性引力。
范德华力和氢键及其对物 质性质的影响
夯实基础:
范德
华力 一、范德华力
和氢
键及
其对
物质
性质 的
二、氢键
影响
思考与交流
1、降温加压气体为什么会液化? 2、降温时液体为什么会凝固?
—— 分子间存在一种使其聚集在一起的 作用力!
这种把分子聚集在一起的作用力,叫做 分子间作用力也称为范德华力。
资 料
范德瓦尔斯(J.D.van der
有分子内氢键 沸点: 44 - 45 ℃
(2).溶解度
若溶质与溶剂之间能形成氢键,物质的溶解度 较大。例如:NH3极易溶于水。
(3).物质的硬度
若分子之间存在氢键,物质的硬度增大!
(4).物质的密度——使物质密度反常!
例如:水的固体(冰)密度小于液体!
Why:冰的密度小于水的密度?
高二化学范德华力与物质性质

我们知道:分子内部原子间存 在强的相互作用——化学键,形成 或破坏化学键都伴随着能量变化。
如水在通电情况下分解为氢气 和氧气,水分子中H-O键被破坏, 生成H-H、O-O键。
2H2O==2H2 + O2
通电
水的三态转变
固态水
液态水
气态水
物质三态之间的转化也伴随着能量 变化。这说明:分子间也存在着相互作 用力。
第四节 分子间的作用力与物质的性质
第一课时
【交流讨论】
(1)电解水的过程是一个 (填“物理”: 或 “化学”)过程,而冰与水的转化过程是一个 (填“物理”:或“化学” ) 过程。 (2)前者的实质是 而后者 (填“有”或“无”)破坏化学键。 (3)通过对两个过程的分析,你对冰与水之间 的转化有什么看法?(从化学键的破坏角度分析)
分子间作用力的种类
分子间作用力主要有两种:
范德华力
氢键
1.范德华力的实质是 ,一般地,范德华力存在于 粒之间 2.化学键作用能一般为 ,而分子间作用能一般为 3.完成表格 物质名称 熔点 沸点 熔化时破坏的作用力 氯化钠 不填 氯化氢
微
。
氯化钠熔点比氯化氢高的原因 。 4.通过对氯化钠氯化氢熔点的分析,你对分子间作用力 与化学键的区别的看法 。 5.从日常生活中,具体说明破坏范德华力的例子。
3. 范德华力对物质性质的影响
化学键影响物质的化学性质(主)和 物理性质 范德华力影响物质的物理性质(熔、沸 点及溶解度等) 分子间范德华力越大,熔沸点越高
范徳华力的应用
思考?夏天经常见到许多壁虎在墙壁或天花板上爬行, 却掉不下来,为什么? 壁虎为什么能在天花板土爬行自如?这曾是一个困扰 科学家一百多年的谜。用电子显微镜可观察到,壁虎 的四足覆盖着几十万条纤细的由角蛋白构成的纳米级 尺寸的毛。壁虎的足有多大吸力?实验证明,如果在一 个分币的面积上布满100万条壁虎足的细毛,可以吊起 20kg重的物体。近年来,有人用计算机模拟,证明壁 虎的足与墙体之间的作用力在本质上是它的细毛与墙 体之间的范德华力。
范德华力

分享到i贴吧 添加到搜藏 分享到新浪微博
合作编辑者:
rsw1987、百科ROBOT、§晴朗卣、月夜魔法师、忝潶ぎ請閉眼、sdoa6066921、9wop0更多如果您认为本词条还需进一步完善,百科欢迎您也来参与编辑词条 在开始编辑前,您还可以先学习如何编辑词条词条统计
浏览次数:约 29088 次
色散力存在于一切分子之间。色散力与分子的变形性有关,变形性越强越易被极化,色散力也越强。稀有气体分子间并不生成化学键,但当它们相互接近时,可以液化并放出能量,就是色散力存在的证明。
四.
由于各种分子均有瞬间偶极, 故色散力存在于极性分子-极性分子、极性分子-非极性分子及非极性分子-非极性分子之间. 色散力不仅存在广泛, 而且在分子间力中, 色散力经常是重要的. 观察下面数据:
又译:范德瓦耳斯力
[编辑本段]详细内容
一
范德华力是存在于分子间的一种吸引力,它比化学键弱得多。一般来说,某物质的范德华力越大,则它的熔点、沸点就越高。对于组成和结构相似的物质,范德华力一般随着相对分子质量的增大而增强。 氨气,氯气,二氧化碳等气体在降低温度、增大压强时能够凝结成液态或固 知道 MP3 图片 视频 百科 帮助设置
首页 自然 文化 地理 历史 生活 社会 艺术 人物 经济 科学 体育 编辑词条 范德华力
[编辑本段]基本信息
Van der Waa
ls force
极性分子可视作偶极子,其极性用偶极矩μ=qd来衡量,即正或负电荷电量(q)与电荷中心间距d的乘积。μ一般在10-30C·m数量级。μ=0的分子为非极性分子,μ越大,分子极性越大。测定分子偶极矩是确定分子结构的一种实验方法。德拜(P.J.W Debye,荷)因创立此方法而荣获1936年诺贝尔化学奖。
#化学:2.4.1《范德华力与物质性质》学案(鲁科版选修4)
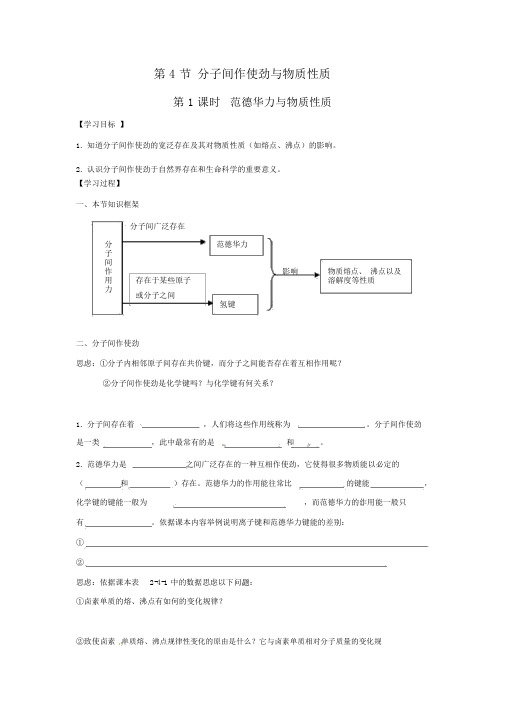
第 4 节分子间作使劲与物质性质第 1 课时范德华力与物质性质【学习目标】1.知道分子间作使劲的宽泛存在及其对物质性质(如熔点、沸点)的影响。
2.认识分子间作使劲于自然界存在和生命科学的重要意义。
【学习过程】一、本节知识框架分子间广泛存在分范德华力子间影响物质熔点、沸点以及作用存在于某些原子溶解度等性质力或分子之间氢键二、分子间作使劲思虑:①分子内相邻原子间存在共价键,而分子之间能否存在着互相作用呢?②分子间作使劲是化学键吗?与化学键有何关系?1.分子间存在着,人们将这些作用统称为。
分子间作使劲是一类,此中最常有的是和。
2.范德华力是之间广泛存在的一种互相作使劲,它使得很多物质能以必定的(和)存在。
范德华力的作用能往常比的键能,化学键的键能一般为,而范德华力的作用能一般只有。
依据课本内容举例说明离子键和范德华力键能的差别:①②思虑:依据课本表2-4-1 中的数据思虑以下问题:①卤素单质的熔、沸点有如何的变化规律?②致使卤素单质熔、沸点规律性变化的原由是什么?它与卤素单质相对分子质量的变化规律有如何的联系?范德华力主要影响物质的的性质。
其影响规律是:①②【典题解悟】)例1.以下相关范德华力的表达正确的选项是(A.范德华力的本质也是一种电性作用,因此范德华力是一种特别化学键B.范德华力与化学键的差别是作使劲的强弱问题C.罕有气体形成的晶体中原子之间不存在范德华力D.范德华力较弱,故损坏它需要的能量极少剖析:考察知识点是范德华力的定义和性质。
范德华力是分子与分子之间的一种互相作用,其本质与化学键近似,也是一种电性作用,但二者的差别是作使劲的强弱不一样,化学键一定是激烈的互相作用(120-800kJ ·mol -1),范德华力只有几到几十千焦每摩尔,故范德华力不是化学键;范德华力特别轻微,损坏它时耗费的能量较少;罕有气体形成的分子晶体中存在范德华力。
答案: BD例 2. 以下对于范德华力影响物质性质的表达中,正确的选项是()A. 范德华力是决定由分子构成物质熔、沸点高低的唯一要素B.范德华力与物质的性质没有必定的联系C.范德华力可以影响物质的化学性质和物理性质D.范德华力仅是影响物质部分物理性质的一种要素。
范德华力及其对物质性质的影响说课稿
范德华力及其对物质性质的影响说课稿大家好。
今天我说课的题目是《范德华力及其对物质性质的影响》,我将从教材、学情、教学方法、教学过程以及板书设计五个方面来进行我的说课一、说教材1、教材内容:本节课选自高中化学人教版,选修3《物质结构与性质》的第二章第三节第二课时“范德华力及其对物质性质的影响”。
2、教材所属地位:本节内容选自必修三《物质结构和性质》第二章《分子结构和性质》。
本节课主要是让学生理解分子间的作用力以及它对物质性质的影响,即是对物质性质的探究。
内容放置在分子的立体构型之后,有承上启下的作用,是联系正本书的关键所在。
通过学习分子间力,建立微观体系与宏观物质性质之间的关系,从而使学生建立起知识网络。
3、教学重点和难点:教学重点:理解范德华力的概念,强弱及其对物质性质的影响教学难点:范德华力对物质性质的影响4、教学目标根据教学大纲和本节教材的特点,我设立了以下教学目标1、知识和技能(1)理解范德华力及其对物质性质的影响(2)能举例说明化学键和范德华力的区别力的区别2、过程与方法(1)通过讲练结合,培养学生处理判断、归纳等解决问题的能力,熟悉掌握各知识点的共性和差异性。
(2)通过设置问题情境,提高学生分析和解决问题的能力3、情感、态度与价值观(1)培养学生认真、细致的学习态度。
(2)通过发现问题、解决问题的过程,培养学生思考能力,增强学生的求知欲和对学习化学的热情。
二、说学情:选修三《物质的结构和性质》物质的结构知识涉及微观世界,抽象,理论性强,学习难度大。
学习的理念方法都很欠缺;这部分知识的学习要求有很强的学习能力和理解能力等。
学生虽具有一定的理性思维能力,但抽象思维能力较弱,还是易于接受感性认识。
因此,本节课的教学起点低,并充分利用现代化教学手段,进行多媒体辅助教学,以求突出重点、突破难点。
三、说教法:那么,究竟应该怎样来完成本节课的任务呢?下面说一下本节课的教法1、范例、结合引导探索的方法,激发学生的学习兴趣。
范德华力(分子间作用力)
分子间作用力分子间作用力分子间作用力又被称为范德华力,按其实质来说是一种电性的吸引力,因此考察分子间作用力的起源就得研究物质分子的电性及分子结构。
分子间作用力分类分子间作用力可以分为以下三种力:取向力取向力发生在极性分子与极性分子之间。
由于极性分子的电性分布不均匀,一端带正电,一端带负电,形成偶极。
因此,当两个极性分子相互接近时,由于它们偶极的同极相斥,异极相吸,两个分子必将发生相对转动。
这种偶极子的互相转动,就使偶极子的相反的极相对,叫做“取向”。
这时由于相反的极相距较近,同极相距较远,结果引力大于斥力,两个分子靠近,当接近到一定距离之后,斥力与引力达到相对平衡。
这种由于极性分子的取向而产生的分子间的作用力,叫做取向力。
取向力的大小与偶极距的平方成正比。
极性分子的偶极矩越大,取向力越大;温度越高,取向力越小.对大多数极性分子,取向力仅占其范德华力构成中的很小分额,只有少数强极性分子例外。
诱导力在极性分子的固有偶极诱导下,临近它的分子会产生诱导偶极,分子间的诱导偶极与固有偶极之间的电性引力,称为诱导力。
在极性分子和非极性分子之间以及极性分子和极性分子之间都存在诱导力。
在极性分子和非极性分子之间,由于极性分子偶极所产生的电场对非极性分子发生影响,使非极性分子电子云变形(即电子云被吸向极性分子偶极的正电的一极),结果使非极性分子的电子云与原子核发生相对位移,本来非极性分子中的正、负电荷重心是重合的,相对位移后就不再重合,使非极性分子产生了偶极。
这种电荷重心的相对位移叫做“变形”,因变形而产生的偶极,叫做诱导偶极,以区别于极性分子中原有的固有偶极。
诱导偶极和固有偶极就相互吸引,这种由于诱导偶极而产生的作用力,叫做诱导力。
在极性分子和非极性分子之间,由于极性分子偶极所产生的电场对非极性分子发生影响,使非极性分子电子云变形(即电子云被吸向极性分子偶极的正电的一极),结果使非极性分子的电子云与原子核发生相对位移,本来非极性分子中的正、负电荷重心是重合的,相对位移后就不再重合,使非极性分子产生了偶极。
2-3-2范德华力、氢键及其对物质性质的影响与溶解性 59张 PPT课件
氢键。
第二章 分子结构与性质
3.氢键的表示方法
氢键通常用X—H……Y—表示,其中X、Y为N、O、F,
“—”表示共价键,“……”表示形成的氢键。例如,水中的 人
教
氢键表示为:O—H……O—。
版 化
学
第二章 分子结构与性质
说明:
①氢键中电负性强的原子可以是同种原子,也可以是
不同种原子。
人
教
② 氢 键 的 键 长 定 义 为 X—H…Y 的 长 度 , 而 不 定 义 为
2.范德华力的影响因素
影响范德华力的主要因素有分子的相对分子质量、分
子的极性等。
人
教
(1)组成和结构相似的物质,相对分子质量越大,范德
版 化
学
华力越大,如
分子 Ar
范德华
力 /kJ·mo
8.50
l-1
CO HI 8.75 26.00
HBr 23.11
HCl 21.14
第二章 分子结构与性质
(2)分子的极性越强,范德华力越大。 (3)温度升高,范德华力减小。
人 教 版 化 学
第二章 分子结构与性质
3.范德华力对物质性质的影响
(1)对物质熔、沸点的影响
一般来说,分子晶体中范德华力越大,物质的熔、沸 人
教
点越高。具体如下:
版 化
学
①组成和结构相似的物质,随着相对分子质量的增大,
分子间的范德华力逐渐增大,它们的熔、沸点逐渐升高。
如下图中的曲线所示:
第二章 分子结构与性质
版 化
学
第二章 分子结构与性质
若不断地升高温度,实现“雪花→水→水蒸气→氧气
和氢气”的变化。在变化的各阶段被破坏的粒子间的主要
范德华力和氢键对物质的物理性质的影响
经 验 交 流一、范德华力对物质物理性质的影响范德华力对物质物理性质的影响是多方面的。
液态物质范德华力越大,气化热就越大,沸点就越高;固态物质范德华力越大,熔化热就越大,熔点就越高。
一般来说,结构相似的同系列物质相对分子质量越大,分子变形性也越大,范德华力强,物质的熔点,沸点也就越高。
例如,稀有气体,卤素单质等,其沸点和熔点就是随着相对分子质量的增大而升高的。
相对分子质量相等或近似而体积大的分子,电子位移可能性大,有较大的变形性,此类物质有较高的沸点,熔点。
范德华力对液体的互溶度以及固态,气态非点解质在液体中的溶解度也有一定影响。
溶质或溶剂(指同系物)的极化率越大,分子变形性和范德华力越大,溶解度也越大。
另外,范德华力对分子型物质的硬度也有一定的影响。
分子极性小的聚乙烯,聚异丁烯等物质,范德华力较小,因而硬度不大;含有极性基因的有机玻璃等物质,范德华力较大,具有一定的硬度。
二、氢键对物质物理性质的影响氢键通常是物质在液态时形成的,但形成后有时也能继续存在于某些固态甚至气态物质之中。
例如:在气态,液态和固态的HF中都有氢键存在。
能够形成氢键的物质是很多的,如水,水合物,无机酸和某些有机化合物。
氢键的存在,影响到物质的某些性质。
如:1.熔点,沸点分子间含有氢键的物质溶化或气化时,除了要克服范德华力外,还必须提高温度,额外地供应一份能量来破坏分子间的氢键,所以这些物质的熔,沸点比同系列氢化物的熔点,沸点高。
分子内形成氢键,其熔点,沸点常降低。
例如,有分子内氢键的邻硝基苯酚熔点(45℃)比分子间氢键的间硝基苯酚的熔点(95℃)和对位硝基苯酚的熔点(114℃)都低。
2.溶解度在极性溶剂中,如果溶质分子与溶剂分子之间可以形成氢键,则溶质的溶解度增大。
HCl和NH3在水中的溶解度比较大,就是这个缘故。
3.黏度分子间有氢键的液体,一般黏度较大。
例如甘油,磷酸,浓硫酸等多羟基化合物,由于分子间可形成众多的氢键,这些物质通常为黏稠状液体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
思考题:
4.离子键、共价键、金属键、分子间
作用力都是微粒间的作用力,下列物
质中,只存在一种作用力的是( B )
A.干冰 B.NaCl C.NaOH
D.I2
D.H2SO4
作业:新坐标和导与学
实验四
血糖的测定及激素对血糖浓度的影响
一 实验目的
掌握GOD-POD法测定血糖的原理及方法。
观察胰岛素,肾上腺素对血糖浓度的影响。
范德华力的方向性和饱和性
只要分子周围空间准许,当气体分子凝 聚时,它总是尽可能的吸引其它分子, 范德华力一般没有方向性和饱和性,
小结:金属键--------没有 离子键--------没有 共价键--------有 范德华力------没有
【问题探究二】 范德华力大小的影响因素
物质
F2
Cl2
Br2
阅读相关资料
物质 沸点(℃) 熔点(℃)
N2 -196 -209.86
CO -191.4 -199
结论2:当相对分子质量相同时,极性越 大,范德华力越大,熔沸点越高, 如CO > N2
查表可知
物质 熔点(℃) 沸点(℃)
正丁烷 -138.4
-0.5
异丁烷 -159.6 -11.7
结论3:在同分异构体中,支链越多, 沸点越低,如正丁烷 > 异丁烷
范德华力
键能:化学键 100-600KJ/mol 范德华力 2-20 KJ/mol
化学键与范德华力的比较
化学键
范德华力
概念 相邻的原子间强 把分子聚集在 烈的相互作用 一起的作用力
存在范围 分子内相邻原子间 分子之间
作用力强 弱
较
强
与化学键相比 弱的多
影响的性 质
主要影响 化学性质
主要影响物理性 质(如熔沸点)
范德华力大小的比较方法
1.当相对分子质量不同时 一般情况下,组成和结构相似的分子, 相对分子量越大,范德华力越大,熔沸 点越高
2. 当相对分子质量相同时 (1)分子的极性越大,范德华力越大, 熔沸点越高,如CO > N2 (2)在同分异构体中,支链越多,沸点 越低,如正丁烷 > 异丁烷
课堂练习
比较下列物质的熔沸点的高低
2.下列叙述与分子间作用力无关的是 ( D) A.气体物质加压或者降温时能凝结或凝 固
B.干冰易升华 C.氟氯溴碘单质熔沸点依次升高 D.氯化钠的熔点较高
3.下列物质变化过程只是克服了范德华力 的是( C ) A.食盐的熔化 B.水的分解 C.干冰的升华 D. 金属钠的熔化
解析:由于范德华力比化学键弱的多,克服范德华力 的能量不足以破坏化学键,当干冰的状态发生改变时 ,仅仅是二氧化碳之间的作用力发生了改变,气内部 的碳氧双键依然不变
结论:碳的气态氢化物(化合物)中, 相对分子量越大,范德华力越大,熔沸 点越高
问:是不是物质的相对分子越大,熔沸 点就一定越高?
物质 沸点(℃) 熔点(℃)
H2O(l) 0
100
SO2 (g) -72.4 -10
熔沸点: H2O > SO2
总结1:一般情况下,组成和 结构相似的分子,相对分子量 越大,范德华力越大,熔沸点 越高
范德华力有什么特点? 范德华力大小的判断
范德华力的特点
1.广泛存在(由分子构成的物质) 2.作用力弱,无饱和性和方向性
3.主要影响物质的物理性质(熔沸点. 溶解度)
由分子构成的
物质名称 氯化钠
熔点
801℃
沸点
熔化时破坏的作用 力
离子键
二氧化硫 -72.4 -10
共价键
氯化氢 -112℃ -85 ℃
I2
相对分 38 子量
71 160
熔点 -219.6 -101 -7.2 (℃)
沸点 -188.1 -34.6 58.78 (℃)
熔沸点变 化趋势
熔沸点逐渐升高
254 113.5 184.4
卤族元素单质物理性质差异
结论:卤族元素单质(双原子分子)中, 相对分子量越大,范德华力越大,熔沸 点越高
物质
He
沸点(℃) -268
熔点(℃) -373
Ne -249 -249
Ar -185 -189
Kr 151 -157
结论:惰性气体(单原子分子)中,相 对分子量越大,范德华力越大,熔沸点 越高
物质
CH4 SiH4
沸点(℃) -161 -112
熔点(℃) -182.6 -185
GeH4 SnH4 -90 -52 -165 -150
(2) 显色原理 葡萄糖在葡萄糖氧化酶的催化下生成葡
萄糖酸,并产生过氧化氢,过氧化氢被过氧 化物酶(POD)催化释放初生态氧,氧又对 与色原性氧受体4-氨基安替比林偶联的酚氧 化,并与4-氨基安替比林结合生成红色醌类 化合物。
葡萄糖+O2+H2O GOD 葡萄糖酸+H2O2 4-氨基安替比林+酚+H2O2 POD 红色醌类 化合物 +4H2O
了解动物实验的基本知识和兔耳缘静脉取血 的方法。
二 原理
(2) 激素对血糖浓度的影响 葡萄糖在葡萄糖氧化酶的催化下生成葡
萄糖酸,并产生过氧化氢,过氧化氢被过氧 化物酶(POD)催化释放初生态氧,氧又对 与色原性氧受体4-氨基安替比林偶联的酚氧 化,并与4-氨基安替比林结合生成红色醌类 化合物。
二 原理
葡萄糖越多,生成的醌类物质就越多,颜 色就越深,通过所讲过的比色法,求出它的葡 萄糖含量,即血糖浓度。(标准管法)
三 操作
1.准备抗凝试管:首先放入试管一小勺抗凝剂 (草酸钠)。
2.分组。称重:Kg,共有四只兔子,两只注射 胰岛素,两只注射肾上腺素。兔子抓取方法: 一手抓取颈部皮肤,另一只手托臀部,把它放 在天平上称重。
CH4<_ CF4 <_ CCl4<_ CBr4 <_ CI4 H2O<_ H2S<_ H2Se<_ H2Te
联系生活实际?你能发现出什么矛盾吗?
1.下列关于范德华力影响物质性质 的叙述,正确的是( D )
A.范德华力是决定由分子构成物质熔、沸 点高低的唯一因素 B.范德华力与物质的性质没有必然的联系 C.范德华力能够影响物质的化学性质和物 理性质 D.范德华力仅是影响物质部分物理性质的 一种因素
范德华力及其物质性质
【联想.质疑】
(1)电解水的过程是一个化学(填“物 理”:或“化学”)过程,而冰与水的 转化过程是一个物理过程。
(2)前者的实质是有而后者无(填“有” 或“无”)破坏化学键。
(3)通过对两个过程的分析,你对冰与 水之间的转化有什么看法?(从化学键 的破坏角度分析)
【问题探究一】
