氧化钠和过氧化钠
氧化钠和过氧化钠有什么区别

氧化钠和过氧化钠都是化学品,它们的化学结构和性质存在明显的区别。
氧化钠,也称作氢氧化钠,化学式为NaOH,是一种强碱性化合物。
在水中溶解时可以产生一种含有氢氧根离子的碱性溶液,常被用于化学实验室、制皂、清洁和腐蚀性处理等方面。
氢氧化钠的化学性质稳定,不易挥发,但在接触金属或有机物质时可以发生剧烈的反应。
过氧化钠,化学式为Na2O2,是一种过氧化物,常被用作漂白剂和氧化剂。
过氧化钠在水中分解时会放出氧气,并产生氢氧根离子和过氧化氢根离子。
过氧化钠在接触到容易被氧化的物质时可以发生激烈的氧化反应,因为它本身是一种强氧化剂。
氢氧化钠和过氧化钠之间的最大区别在于它们的化学结构。
氢氧化钠是硷金属钠和氢氧根离子的化合物,而过氧化钠则是氧气和钠离子之间的过氧化物。
这两种化合物在实际应用中也有着不同的用途和化学反应,需要根据具体情况进行选择和使用。
氧化钠与过氧化钠

氧化钠与过氧化钠
碱—氢氧化钠与过氧化钠
1、氢氧化钠
氢氧化钠是一种习惯上把NaHCO3称作碳酸钠,是一种白色粉末状或实心结晶体,具有易溶于水,无色透明溶液的特性,还具有滴定性、水解性和抗风化作用等特点,常用于食品工业、除气液卤、处理和缓冲剂,以及科学仪器、电气工程和冶金等方面。
2、过氧化钠
过氧化钠是一种习惯上把Na2CO3称作碳酸氢钠,为白色固体,易溶于水,是最常用的氧化剂之一,具有可逆性、热稳定性、抗污染、氧化力强等特点,常用于非金属原料加速氧化铝,处理和控制发酵,缓冲介质和金属材料综合加工等工艺过程。
3、氢氧化钠与过氧化钠的区别
(1)氢氧化钠具有滴定性、水解性和抗风化作用等特点,而过氧化钠具有可逆性、热稳定性、抗污染、氧化力强等特点。
(2)对过氧化钠的滴定反应,不会产生CO2;而氢氧化钠滴定反应,
会产生CO2。
(3)氢氧化钠的分子量比过氧化钠的分子量小,且氢氧化钠滴定反应
之后,余下的氢氧化钠中含有残留氧化剂,而过氧化钠滴定反应之后,它没有余留氧化剂。
(4)氢氧化钠溶液是强中性,而过氧化钠溶液具有意外的强酸性,所以,氢氧化钠溶液可以用来缓冲发酵,而过氧化钠则不宜用来缓冲发酵。
(5)氢氧化钠的溶解度比过氧化钠的溶解度要高得多,而过氧化钠的
溶解度是氢氧化钠的一半。
综上所述,氢氧化钠与过氧化钠的主要区别就是具有不同的特性,以
及溶解度、滴定反应、氢氧化钠含有残留氧化剂等方面的不同。
氧化钠、过氧化钠和碳酸钠的物化性质

1.氧化钠Na2OO,白色固体(白色无定形片状或粉末)。
不燃,具腐氧化钠,分子式为Na2蚀性、强刺激性,可致人体灼伤。
对人体有强烈刺激性和腐蚀性。
对湿敏感。
在暗红炽热时熔融,到400℃以上时分解成过氧化钠和金属钠。
遇水起剧烈化合反应,形成氢氧化钠。
相对密度2.27。
用作脱氢剂,化学反应的聚合或缩合剂。
外观与性状:白色无定形片状或粉末。
熔点(℃): 1132沸点(℃):1275 (升华)相对密度(水=1): 2.27克每立方厘米闪点(℃):1036爆炸上限%(V/V):87%爆炸下限%(V/V):38%热力学函数(298.15K,100kPa):标准摩尔生成热ΔfHmθ(kJ·mol-1):-414.2标准摩尔生成吉布斯自由能Δf Gmθ(kJ·mol-1):-375.5标准熵Smθ(J·mol^-1·K^-1):75.1主要用途:用作聚合、缩合剂及脱氢剂。
与水的反应Na2O+H2O=2NaOH与二氧化碳反应Na2O+CO2=Na2CO3制氧化钠4Na+O2=2Na2O2.过氧化钠Na2O2过氧化钠,77.99。
工业品为淡黄粉末,加热则颜色变深,比重2.805,表观密度0.5-0.7g/cm3,熔点460℃(分解),分解温度657℃(分解),分解时放出氧气,极易吸湿,与水和含有水蒸汽的二氧化碳均发生放热反应,并放出氧气,与易燃有机物接触易发生燃烧,高温下有强烈腐蚀性。
工业级有效氧含量≥35.5%,氧化钙为3.5±0.5%。
和超氧化物组成混合药剂做为生氧剂,用于宇航、海底勘探、高原作业、矿山救援、消防救火、潜艇航行和医学卫生,过氧化钠还广泛用作漂白剂,氧化剂、去臭剂,杀菌剂及矿石分析。
过氧化钠不是碱性氧化物,但也可与水、二氧化碳,酸反应,反应过程中均有氧气放出,化学方程式分别为:2Na2O2+2H2O==4NaOH+O2↑2Na2O2+2CO2==2Na2CO3+O22Na2O2+4HCl==4NaCl+2H2O+O2↑3.碳酸钠(纯碱)Na2CO3【化学式】Na2CO3,106【俗名】块碱、纯碱、苏打(Soda) 、碱面、口碱(历史上,一般经张家口和古北口转运全国,因此又有“口碱”之说。
(完整)氧化钠和过氧化钠公开课

第二节 几种重要的金属化合物第一课时 钠的重要化合物——《氧化钠和过氧化钠》授课老师:杨秋玲一、教学目标1、知识与技能:了解氧化钠和过氧化钠的性质,掌握过氧化钠的性质。
2、过程与方法:通过观察实验现象,积累分析实验的方法。
3、情感态度和价值观:通过感受化学世界的奇妙,提高学习化学的兴趣. 二、教学重点:氧化钠和过氧化钠的性质 三、教学难点:过氧化钠的性质 四、教学过程 1、氧化钠(Na 2O )知识回顾:用化学方程式写出Na 2O 和Na 2O 2的形成,颜色,状态。
△ 学生板书:4Na+O 2=2Na 2O ; 2Na+O 2 ==== Na 2O 2钠暴露在空气中生成白色的固体氧化钠,在空气中加热剧烈燃烧,发出黄色火焰,生成淡黄色固体过氧化钠。
思考与交流:氧化钠的性质与氧化钙的相似,写出Na 2O 与H 2O 和CO 2反应的化学方程式。
学生板书:Na 2O + H 2O = 2NaOH ; Na 2O + CO 2 = Na 2CO 32、过氧化钠(Na 2O 2)Na 2O 2是否能类似于Na 2O 与H 2O 和CO 2反应呢? 实验——“滴水生火” 思考:为什么棉花会燃烧起来?引导:燃烧需要什么条件?可燃物、温度达到着火点、有助燃的物质原因:Na 2O 2和H 2O 反应放出大量的热,并且有氧气生成。
Na 2O 2和H 2O 反应是否还有其他产物?如何验证? 学生:还有NaOH 生成。
用酚酞溶液检验.实验3-5:将少量Na 2O 2置于试管中,加少量水后,将带火星的木条置于试管口,再向反应后的溶液滴加酚酞溶液,观察现象。
再振荡试管,溶液颜色又有什么变化?现象:加水后试管中有大量气体生成。
带火星木条复燃,试管外壁发热。
滴加酚酞,溶液变红;振荡后,溶液很快褪色。
结论:有O 2生成。
反应放热,有碱生成。
Na 2O 2具有漂白作用,作漂白剂。
请一个同学来写出Na 2O 2和H 2O 反应的化学方程式。
考点突破:钠的氧化物——氧化钠和过氧化钠
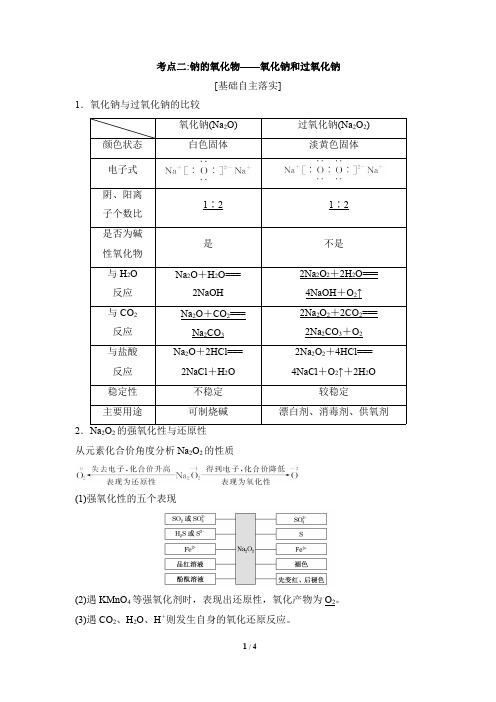
考点二:钠的氧化物——氧化钠和过氧化钠[基础自主落实]1.氧化钠与过氧化钠的比较氧化钠(Na 2O)过氧化钠(Na 2O 2)颜色状态白色固体淡黄色固体电子式阴、阳离子个数比1∶21∶2是否为碱性氧化物是不是与H 2O 反应Na 2O +H 2O===2NaOH 2Na 2O 2+2H 2O===4NaOH +O 2↑与CO 2反应Na 2O +CO 2===Na 2CO 32Na 2O 2+2CO 2===2Na 2CO 3+O 2与盐酸反应Na 2O +2HCl===2NaCl +H 2O 2Na 2O 2+4HCl===4NaCl +O 2↑+2H 2O稳定性不稳定较稳定主要用途可制烧碱漂白剂、消毒剂、供氧剂2.Na 2O 2的强氧化性与还原性从元素化合价角度分析Na 2O 2的性质(1)强氧化性的五个表现(2)遇KMnO 4等强氧化剂时,表现出还原性,氧化产物为O 2。
(3)遇CO 2、H 2O 、H +则发生自身的氧化还原反应。
小题热身1.判断正误(正确的打“√”,错误的打“×”)。
(1)氧化钠、过氧化钠均为碱性氧化物(×)(2)1mol Na2O2固体中含离子总数为4N A(×)(3)Na2O2溶于水产生O2的离子方程式为Na2O2+H2O===2Na++2OH-+O2↑(×)(4)Na2O2的电子式为(×)(5)1mol钠与氧气反应生成Na2O或Na2O2时,失去的电子数目均为N A(√)(6)Na2O2与H2O反应时,Na2O2既是还原剂又是氧化剂(√)(7)Na2O2在潮湿的空气中放置一段时间,最终产物是NaOH(×)(8)7.8g Na2O2与足量的CO2反应,转移电子的个数为0.2N A(×)2.如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。
钠及其氧化物的物质的量均为0.1mol,水的质量为100g。
氧化钠到过氧化钠的化学方程

氧化钠到过氧化钠的化学方程氧化钠(Na2O)到过氧化钠(Na2O2)的化学方程:2 Na2O + O2 → 2 Na2O2【引言】化学方程是描述化学反应中产生或消耗的物质的符号表示法。
在化学方程中,反应物写在箭头的左侧,生成物写在箭头的右侧。
在这篇文章中,我们将探讨从氧化钠到过氧化钠的化学反应,并分析该反应的深度和广度。
【正文】1. 氧化钠(Na2O)是一种由氧和钠元素组成的化合物。
它通常以白色粉末或晶体的形式存在,并具有强碱性。
氧化钠可以通过将纯碳酸钠(Na2CO3)加热至高温来制备。
在该反应中,碳酸钠分解为氧化钠和二氧化碳:Na2CO3 → Na2O + CO22. 过氧化钠(Na2O2)是一种由氧和钠元素组成的过氧化物。
它呈现为白色结晶,是一种强氧化剂和漂白剂。
氧化钠和空气中的氧气可以反应生成过氧化钠。
该反应可以用如下化学方程式表示:2 Na2O + O2 → 2 Na2O23. 分析这个化学方程,我们可以看到氧化钠中的钠元素的氧化状态从+1变为+2,而氧气中的氧元素的氧化状态则从0变为-1。
这说明氧化钠被氧化为过氧化钠,而氧气则被还原为过氧化钠中的氧。
这是一种氧化还原反应(redox)。
4. 氧化还原反应是许多化学变化中常见的一种类型。
它涉及到物质之间的电子转移。
在这个例子中,氧化钠中的钠原子失去了一个电子,被氧气中的氧原子接收。
这种电子转移反应可以通过化学键的形成和断裂来实现。
5. 过氧化钠的产生具有一定的实际意义和应用价值。
过氧化钠广泛用作漂白剂和消毒剂,在化学工业中扮演着重要的角色。
它也被用于环境保护和水处理领域,以及医药和食品工业中。
【总结】通过分析氧化钠到过氧化钠的化学反应,我们深入了解了氧化还原反应的机制和意义。
通过电子转移和化学键的形成和断裂,氧化钠中的钠元素被氧气中的氧元素氧化,生成过氧化钠。
我们还了解到过氧化钠在漂白剂、消毒剂和其他应用领域中的重要性。
【个人观点】氧化还原反应是化学中重要的反应类型之一。
钠的两种重要的氧化物——氧化钠和过氧化钠

钠的两种重要的氧化物——氧化钠和过氧化钠氧化钠和过氧化钠的比较难点提取Na2O2与CO2和H2O反应的五大关系1.物质的量的关系无论是CO2或H2O的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O与放出O2的物质的量之比均为2∶1。
2.气体体积关系若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量为原混合气体体积的12,即为生成氧气的量。
3.固体质量关系相当于固体Na2O2只吸收了CO2中的“CO”,H2O中的“H2”;可以看做发生相应的反应:Na2O2+CO===Na2CO3,Na2O2+H2===2NaOH(实际上两反应都不能发生)。
4.电子转移关系当Na2O2与CO2、H2O反应时,每产生1 mol O2转移2 mol e-。
5.先后顺序关系一定量的Na2O2与一定量的CO2和H2O(g)的混合物的反应,可看做Na2O2先与CO2反应,待CO2反应完全后,Na2O2再与H2O(g)发生反应。
【互动思考】1.判断正误,正确的划“√”,错误的划“×”(1)过氧化钠能与水反应,所以过氧化钠可以做气体的干燥剂()(2)过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂()(3)78 g Na2O2中含阴离子的个数是2 N A()(4)Na2O2与H2O反应制备O2的离子方程式:Na2O2+H2O===2Na++2OH-+O2↑()(5)Na2O、Na2O2组成元素相同,与CO2反应产物也相同()(6)Na2O2的电子式为()(7)1 mol钠与氧气反应生成Na2O或Na2O2时,失去的电子数目均为N A()(8)1 mol Na2O2与足量CO2反应时,转移2N A个电子()答案(1)×(2)√(3)×(4)×(5)×(6)×(7)√(8)×2.如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。
氧化钠和过氧化钠与二氧化碳反应

氧化钠和过氧化钠与二氧化碳反应
氧化钠(Na2O)和过氧化钠(Na2O2)与二氧化碳(CO2)可以
发生不同的化学反应。
首先,让我们讨论氧化钠和二氧化碳的反应。
氧化钠与二氧化碳反应会生成碳酸钠(Na2CO3)和释放出热量。
这
个反应可以用化学方程式表示为,Na2O + CO2 → Na2CO3。
接下来,让我们看看过氧化钠和二氧化碳的反应。
过氧化钠和
二氧化碳反应会生成碳酸钠和氧气。
这个反应可以用化学方程式表
示为,2Na2O2 + 2CO2 → 2Na2CO3 + O2。
这两种反应都是重要的化学反应,碳酸钠是一种常见的化合物,在工业生产和日常生活中都有广泛的用途。
这些反应也是化学实验
室中常见的实验内容,对于理解化学反应的特性和原理具有重要意义。
除了化学方程式之外,我们还可以从能量变化、物质的性质变
化等角度来分析这些反应。
例如,氧化钠和过氧化钠与二氧化碳反
应都涉及到能量的释放或吸收,这些能量变化对于工业生产和能源
利用具有重要意义。
此外,我们还可以探讨这些反应在环境保护和
资源利用方面的应用,以及它们在化工生产中的重要性。
总之,氧化钠和过氧化钠与二氧化碳的反应是化学领域中重要的反应之一,它们涉及到能量变化、物质转化等多个方面,对于我们理解化学原理和应用具有重要意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
②过氧化钠的化学性质
Ⅰ、与水反应 现象:产生大量气泡 带火星的木条复 气泡; 现象:产生大量气泡;带火星的木条复 试管外壁发热 滴加酚酞溶液先变 发热; 燃;试管外壁发热;滴加酚酞溶液 红后褪色
2Na2O2 + 2H2O = 4NaOH + O2↑
既是氧化剂又是还原剂, Na2O2既是氧化剂又是还原剂, O2 是 氧化产物,NaOH是还原产物 氧化产物,NaOH是还原产物
3、钠与酸反应 2Na + 2H+ = 2Na+ + H2 ↑
一、钠的重要化合物
1、氧化钠和过氧化钠
(1)物理性质
化学式 化合价 颜色 状态
Na2O Na2O
+1 -2
Na2O2 Na2O2
+1 -1
白色固体
淡黄色固体
(2) 化学性质
①氧化钠
思考:碱性氧化物有哪些重要的性质? 思考:碱性氧化物有哪些重要的性质? 有哪些重要的性质
第1课时
钠的重要化合物1 钠的重要化合物1
温故而知新
1、钠在空气中氧化,燃烧后分别得到什么物质? 钠在空气中氧化,燃烧后分别得到什么物质?
加热
4Na+O2=2Na2O 2Na+O2===Na2O2
2、钠与水反应
2Na + 2H2O = 2Na+ + 2OH- + H2 ↑
4、钠与盐溶液的反应 CuSO4 FeCl3溶液 2Na+2H2O+CuSO4=Na2SO4 +Cu(OH)2↓+H2 ↑ 6Na+6H2O+2FeCl3=6NaCl+2Fe(OH)3↓+3H2↑
+O2
0
化合价降低, 化合价降低,得2×e- ,被还原 降低 ×
Na2O2既是氧化剂又是还原剂 该反应是不是离子反应?为什么? 该反应是不是离子反应?为什么?
应用: 供氧剂。 应用:呼吸面具或潜艇中的供氧剂。
对该反应的几点思考
ⅰ、在CO2和水蒸气的混合气体中加入 Na2O2, Na2O2先跟谁反应
讨论: 讨论:
能否与水 与水、 Na2O2 能否与水、与CO2 、与稀盐酸反 若反应,则生成哪些物质? 应,若反应,则生成哪些物质?
思考: 是否能表现类似的性质? 思考:Na2O2是否能表现类似的性质? 请同学们设计一个实验来探索: 请同学们设计一个实验来探索:如何证 是否与水、 发生了反应? 明Na2O2是否与水、CO2发生了反应?
思考:过氧化钠是碱性氧化物吗? 思考:过氧化钠是碱性氧化物吗?
不是。因为过氧化钠与酸反应, 不是。因为过氧化钠与酸反应,除了
生成盐和水外,还生成氧气。 生成盐和水外,还生成氧气。
练习与思考
1.小军爱动脑筋,特别是在做计算题时,思维非常活跃, 1.小军爱动脑筋,特别是在做计算题时,思维非常活跃, 小军爱动脑筋 想出的方法又科学又简单。 想出的方法又科学又简单。老师在课堂上要求同学们做如 解析: :在100g水中分别加入下列物质①2.3g0.1mol 解析: 水中加入的物质的物质的量都是 钠 下一道题:100g水中加入的物质的物质的量都是0.1mol, 100g水中分别加入下列物质 2.3g钠 水中分别加入下列物质① 下一道题向100g水中加入的物质的物质的量都是0.1mol, 比较① 6.2g氧化钠③7.8g过氧化钠④4 g氢氧化钠,完全溶解后 氧化钠③7.8g过氧化钠 过氧化钠④ g氢氧化钠 完全溶解后, 氢氧化钠, ②比较①和④可知,加入的溶质的物质的量相同,而①中 , 6.2g氧化钠可知,加入的溶质的物质的量相同, 发生反应2Na+2H ↑,总质量 总质量① 发生反应2Na+2H2O=2NaOH+H2↑,总质量①<④,故 比较各溶液的溶质质量分数的大小, 比较各溶液的溶质质量分数的大小, 质量分数① 比较② 分析反应2Na 质量分数①>④,比较②和③,分析反应2Na2O2+2H2O 不到2分钟,小军就得出了正确结果, 不到2分钟,小军就得出了正确结果,你知道是怎么做出来 向溶液中加入1mol 1mol的 就会以O =4NaOH+O2↑,向溶液中加入1mol ) 的吗?请你也试一试,结果是( 的吗?请你也试一试,结果是( 的Na2O2就会以O2 的形式跑出去1mol的氧原子 >②>③>④ 0.1mol A.③>②>④>1mol的氧原子,即加入0.1mol的 B.① A.的形式跑出去1mol的氧原子,即加入0.1mol的Na2O2 ③ ① B.① 相当于加入0.1mol 故质量分数② C.②=③>①0.1mol的 D.③ C.相当于加入0.1mol的Na2O,故质量分数②=③,由于 ② >④ D.③=②>①=④ 溶质的物质的量是0.2mol 显然质量分数关系为② 0.2mol, 溶质的物质的量是0.2mol,显然质量分数关系为②=③ >①>④。
Na2O2是强氧化剂
化合价升高, 化合价升高,失2×e-,被氧化
2Na2O2+2H2O = 4NaOH+O2↑
化合价降低, 化合价降低,得2×e-,被还 = 2NaOH+H2O2
Ⅱ、与二氧化碳反应
化合价升高, 化合价升高,失2×e-,被氧化 升高
-1 -2 2Na2O2+2CO2=2Na2CO3
Ⅰ、与水反应生成碱 (较活泼的); 较活泼的)
Ⅱ、与酸性氧化物反应生成相应的盐(较 酸性氧化物反应生成相应的盐( 反应生成相应的盐 活泼的) 活泼的) Ⅲ、与酸反应只生成相应的盐和水 反应只
请大家写出Na 与水、 请大家写出Na2O与水、与CO2 、与稀盐酸 反应的化学方程式
Na2O+H2O=2NaOH Na2O+CO2=Na2CO3 Na2O+2HCl=2NaCl+H2O
只与潮湿的CO ⅱ、Na2O2只与潮湿的CO2反应 反应的本质是什么, ⅲ、Na2O2与CO2反应的本质是什么, 与水反应的本质又如何? 与水反应的本质又如何?
反应, ⅳ、Na2O2与CO2 、H2O反应,量的关 系怎样? 系怎样?
呼吸面具
3、过氧化钠与盐酸反应 2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑
【答案】C
2、有两包淡黄色的粉末,分别是硫粉和过 氧化钠,请设计简单的实验区分他们
方法一: 方法一:分别取少量样品置于两支试管 加入少量水, 中,加入少量水,有气泡冒出的是过氧 化钠, 化钠,另一包则为硫粉 方法二:分别取少量固体, 方法二:分别取少量固体,在空气中点燃 产生淡蓝色火焰并有刺激性气味气体产生 的是硫粉,另一种则为过氧化钠。 的是硫粉,另一种则为过氧化钠。
提示: 提示:
