高中化学选修四第四章-电解池资料
人教化学选修4第四章第三节 电解池(共17张PPT)

1、与电源正极相连的碳棒上有气
实验 现象
泡产生,且气体有刺激性气味,能
使湿润的KI-淀粉试纸变蓝。 2、与电源负极相连的碳棒上有红
色的固体析出。
结论 通电后发生了化学变化,生成了铜
和氯气。
2020/6/11
--
--
3
一、电解原理 1、电解:
2、电解池(: 把又电称能电转解化槽为)化学能的装置。
c
其结果如何呢?试写出电极反
应。
阳极 :2Cl -- 2e-=Cl2↑
阴极
:2H+
+2e-=
电解
H2
↑
总反应:2HCl Cl2↑ + H2↑
HCCuCl溶l2溶液液
2020/6/11
10
【探究活动4】
2、在电解氯化铜溶液的装置中,
若把电极材料换成锌,其结果 ZCn
ZCn
又如何呢?试写出电极反应式。
Ag+>Hg2+ > Fe3+ >Cu2+>H+>Pb2+>Sn2+> Fe2+>Zn2+ > ……
②阳极: 阴离子放电,失电子能力强先放电。
S2->I->Br->Cl- >OH->含氧酸根 (SO42- 等)>F-
2020/6/11
9
【探究活动4】
1、在电解氯化铜溶液的装置
中,若把电解质换成氯化氢, c
A.H2和Cl2 C.H2和O2
B.Cu 和Cl2 D. Cu和 O2
分析:阳离子: Cu2+、Na+ 、H+
放电顺序: Cu2+ > H+ >Na+
人教版化学《电解池》ppt课件

3.电解:
电流通过电解质溶液而在阴阳两极上发生氧化还 原反应的过程。
电解池 把电能转化为化学能的装置。
形成条件: (1)有直流电源 (2)与电源相连的两个电极 (3)电解质溶液(或熔融的电解质) (4)形成闭合回路
电极判断
①由电解池中的电极与电源的(+)(-) 极的连接情况直接判断。与负极连接的为电 解池的阴极,与正极连接的为电解池的阳极。
阴极:2H+ + 2e- = H2↑
总反应:2HCl
电解
===
H2↑+Cl2↑
电解CuCl2
阳极:2Cl-- 2e- = Cl2 ↑ 阴极:Cu2++2e- = Cu
电解总过反程应中:溶Cu液C的l2 =浓电=解度= C和uP+HC值l2↑如何变化?
无氧酸-----增大 溶液浓度减小,PH值 CuCl2-----减小
> Al3+>Mg2+>Na+>Ca+>K+
(2)阳极: 还原性越强,越易放电 (阳极本身或溶液中阴离 子失电子) ----与电极材料有关.若阳极为活性电极,则阳 极本身失电子溶解.若阳极为惰性电极,则溶液中阴离子 失电子.
活性电极>S 2->I ->Br ->Cl ->OH ->含氧酸根
人教版化学选修四第四章第三节--电 解池(共 22张PP T)
人教版化学选修四第四章第三节--电 解池(共 22张PP T)
1、电解含氧酸(如:H2SO4﹑HNO3﹑H3PO4等) 活泼金属含氧酸盐(如:Na2SO4﹑KNO3等) ﹑强 碱(如:NaOH﹑KOH﹑Ca(OH)2﹑Ba(OH)2等) 实 质上是电解水.阳极产生O2,阴极产生H2
选修4-电解池

6、电解过程中的两极区及整个溶液PH的变化 和使电解后溶液恢复原状态所采取的措施: 两极区PH看电极反应式,整个溶液PH的变化 看总反应式。 1、H+放电而OH-不放电 PH↑
PH分析 2、H+不放电而OH-放电 PH↓ ↓ PH 原酸 + 3、H 放电、OH 也放电 , 原碱 PH↑ 实际是电解水 , 具体分析。 原中性 PH —
电极的判断 (1)根据外接电源判断: 与正极相连的为阳极,与负极相连的是阴极 (2)根据氧化还原反应类型判断: 发生氧化反应的一极为阳极,还原反应的一 极为阴极。 (3)根据阴阳离子运动的方向判断: 阳离子移向的一极是阴极,阴离子移向的一 极是阳极。 (4)根据电子运动的方向判断: 电子流出的一极是阳极极,电子流入的一极 是阴极。
阴极: Cu2+ +2e-=Cu
学习目标: 1、掌握电解原理的几种重要的应用 (1)、掌握氯碱工业(电解食盐水)的原理 (2)、掌握形成电镀的条件 (3)、掌握铜的电解精炼条件 (4) 、掌握几种金属电冶炼原理(钠、镁、铝)。
学习小组问题:
4、粗铜中有哪些杂质?粗铜中的杂质都以单质的形式沉 积到池底吗?电解精炼铜中粗铜中的杂质如何变化? 5、为什么参考书中提到“粗铜精炼时,溶液中铜离子浓 度减小,而电镀时浓度不变?”精炼铜和电镀铜本质上有 何区别?精炼铜是不是相当于把铜电镀到纯铜上?
3、粗铜的电解精炼 粗铜 纯铜 阳极 Zn Zn→ Zn2++2eFe Fe → Fe2++2eNi Ni → Ni2++2eCu Cu→ Cu2++2eAg CuSO4溶液 阳极泥 Au 阳极:Cu-2e-=Cu2+
-
+
相对活波的金属只溶解 阴极: Cu2+ +2e-=Cu 不析出,相对不活泼的 问 : 电解完后 ,CuSO 溶 4 金属以单质的形式沉积 在电解槽底,形成阳极泥 液的浓度有何变化?
选修四第四章第三节电解池(52张)

四、电解电极反应式的书写
电解溶质型
HCl溶液
阳极:2Cl- - 2e- = Cl2↑
阴极:2H++2e- = H2↑
总反应:2HCl
通电
===
H2
↑
+Cl2
↑
通电
2H++2Cl- === H2 ↑ +Cl2 ↑
电解水型 阳极:4OH- - 4e- = 2H2O + O2 ↑
阴极:4H+ + 4e- = 2H2 ↑
电解溶质和水 放氧生酸型
阳极:4OH- - 4e- = 2H2O + O2 ↑ 阴极: Cu 2++ 2e -= Cu
总反应:
通电
CuSO4溶液
22CCuuS2+O+24+H22HO2O=通=电====4H2+H+O2 2S↑O+42+COu2 ↑+2Cu
电解质溶液用惰性电极电解的示例:
电解
举例
2.原理 (1)通电前: Cu2+、Cl-、H+、OH-自由移动 通电后: 定向移动
(2)电极上的反应
阴极: Cu2+ + 2e- = Cu (还原反应)
阳极: 2Cl--2e- =Cl2↑(氧化反应)
总反应: Cu2+ + 2Cl-电解
电解
Cu
+Cl2↑
CuCl2 Cu +Cl2↑
放电
粒子在电极上失去或获得电子发生氧化还原反应的过程。
类型 物质类别 实例
电极反应
溶液pH 溶液复 变化 原方法
含氧酸
仅溶剂 强碱 水电解
选修4第四章第三节电解池

想一想、做一做
[例]以石墨棒为电极,请写出分别电解下列溶液时,在 阴、阳两极上发生的电极反应式及总的化学方程式。 (1)NaCl溶液: 阳极:2Cl--2e-=Cl2↑ 阴极:2H++2e-=H2↑ (2H2O 总反应:2Cl-+2H
2H++2OH-)
O = Cl2↑+H2↑+2OH2
电解
(2)CuSO4溶液: OH-在哪一极产生? 阳极:4OH--4e-=2H2O+O2↑ (4H2O 4H++4OH-) 2+ +4e-=2Cu 阴极:2Cu
2、电解无氧酸溶液(氢氟酸除外)、不活泼金属的 无氧酸盐溶液,如电解盐酸、CuCl2溶液等 电解盐酸 阳极: 2Cl -- 2e-=Cl2↑ 阴极: 2H+ +2e-= H2 ↑
总反应:2HCl = Cl2↑ + H2↑ 类型:电解电解质型 实质:电解质本身被电解 电解后溶液中溶质的质量分数 减小 ,若要恢复 原来的组成和浓度,需加入一定量的 溶质 (通入一 定量的HCl气体)
活性金属 > S2->I->Br->Cl->OH->含氧酸根>F-
除Pt、Au
电极反应:
阳极: 2Cl- - 2e- = Cl2↑
(氧化反应)
阴极
Cu -
-- + e +
阳极
eoooo oooo oooo oooo oooo oooooooooooo ooooooooooo
阴极: Cu2+ + 2e- = Cu
4、根据金属活动顺序表,Cu不能发生如下反应:
Cu + 2H2O=Cu(OH)2↓+ H2↑。但选择恰当电极材料
人教版高中化学选修四原电池与电解池
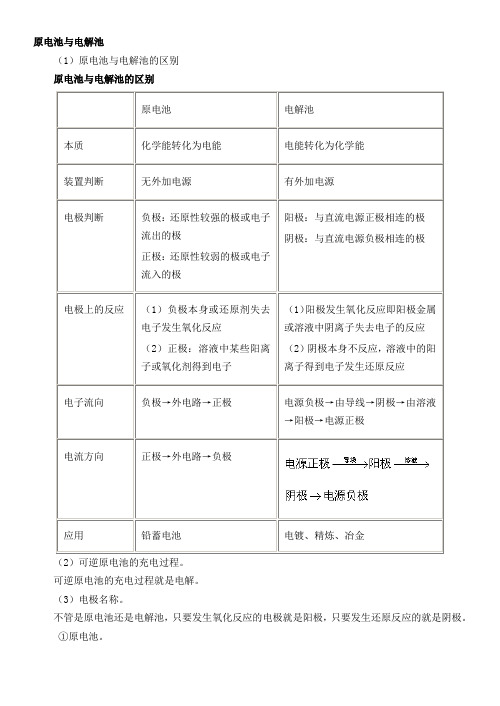
原电池与电解池(1)原电池与电解池的区别原电池与电解池的区别原电池电解池本质化学能转化为电能电能转化为化学能装置判断无外加电源有外加电源电极判断负极:还原性较强的极或电子流出的极正极:还原性较弱的极或电子流入的极阳极:与直流电源正极相连的极阴极:与直流电源负极相连的极电极上的反应(1)负极本身或还原剂失去电子发生氧化反应(2)正极:溶液中某些阳离子或氧化剂得到电子(1)阳极发生氧化反应即阳极金属或溶液中阴离子失去电子的反应(2)阴极本身不反应,溶液中的阳离子得到电子发生还原反应电子流向负极→外电路→正极电源负极→由导线→阴极→由溶液→阳极→电源正极电流方向正极→外电路→负极应用铅蓄电池电镀、精炼、冶金(2)可逆原电池的充电过程。
可逆原电池的充电过程就是电解。
(3)电极名称。
不管是原电池还是电解池,只要发生氧化反应的电极就是阳极,只要发生还原反应的就是阴极。
①原电池。
A.根据组成原电池两极的材料来判断电极。
两极材料为活泼性不同的金属时,则活泼性相对较强的一极为负极,另一极为正极。
由一种金属和另一种非金属(除氢外)作电极时,金属为负极,非金属为正极。
B.根据原电池内两极上发生的反应类型或现象来判定电极。
原电池的负极一般为金属,并且负极总是发生氧化反应:,故负极表现为渐渐溶解,质量减小。
由此可判定,凡在原电池工作过程中发生氧化反应或质量减少的一极为负极;凡发生还原反应或有物质析出的一极为正极。
注意:原电池的电极有两套称谓:负极又可称为阳极,正极又可称为阴极(不要把负极称为阴极;正极称为阳极)。
其中正负极一套称谓是对外电路而言,在物理中常用,阴阳极一套称谓是对内电路而言。
原电池也是作为电源向用电器提供电能的,所以一般都用外电路的电极名称,称为正负极而不称为阴阳极。
②电解池。
A.电解池是在外电源作用下工作的装置。
电解池中与电源负极相连的一极为阴极,阳离子在该极接受电子被还原;与电源正极相连的一极为阳极,阴离子或电极本身(对电镀而言)在该极失去电子被氧化。
人教版高二化学选修4教学课件:第四章4.3 电解池(共50张PPT)

第2课时 电解原理的 2 应用
• 1. 氯碱工业
• (1)概念 • 用电解饱和食盐水的方法来制取Cl2、NaOH、H2,并
以它们为原料生产一系列化工产品的工业,称为氯碱工业。
• 1. 氯碱工业
• (2)原理
• ①通电前,NaCl溶液中含有的离子是___________。
• 通电时,移向阴极的离子是______,移向Na阳+极C的l− 离H+子O是H−
Fe2+>Zn2+>H+(水)>
•
Al3+、Mg2+、Na+、Ca2+、K+
• 2. 电解产物的判断 • (3)电极产物的判断
离子 S2− 产物 S
SO32− SO42−
I− Br− Cl− OH−
I2
Br2 Cl2 O2
离子 Ag+ Hg2+ Fe3+ Cu2+ H+ 产物 Ag Hg Fe2+ Cu H2
借助于电流,反应进行是 不自发的氧化还原反应。
• 2. 构成条件
直流电源 两个电极 电解质溶液(或熔融电解质) 闭合回路
阴极
阳极
• 3. 工作原理
e-
e-
二、电解原理
• 1. 电解
• 使(直流)电流通过电解质溶液(或熔融电解质)而在阴、 阳两极引起氧化还原反应的过程叫做电解。
电离与电解的比较
合金的方法。 • (2)电解槽构成 • 阴极——待镀金属 • 阳极——镀层金属 • 电镀液——含有镀层金属离子 • (3)特点 • ①阳极参与电极反应 • ②电镀液浓度保持不变
• 3. 电解精炼铜
• (1)电解槽构成 • 阳极:粗铜 (含Zn、Fe、Ni、Au、Ag等杂质) • 阴极:纯铜 • 电解液:CuSO4溶液
高中化学选修4电解池课件_人教版

CuCl2
电解
Cu +Cl2↑
2
1、电解原理
在外加直流电源的作用下,电解质的阴阳 离子在阴阳两极发生氧化还原反应的过程, 叫电解。
明 确
⑴ 电流是发生氧化—还原反应的根源、
动力。
⑵
阴阳离子在做定向运动导电的同时, 也就在两极发生了氧化还原反应, 生成了新物质;而金属导电是由自 由电子的定向运动形成,无反应发 生,无新物质生成,两者有本质区 别。
①若为金属(非惰性)电极,电极失电子
7
②若为惰性电极,电解质溶液中阴离子“争”失电子
要判断电极反应的产物,必须掌握 离子的放电顺序。
阳极:
①活性材料作电极时:金属在阳 极失电子被氧化成阳离子进人溶液, 阴离子不容易在电极上放电。 ②用惰性电极(Pt、Au、石墨、 钛等)时:溶液中阴离子的放电顺序 (由难到易)是:
注:当离子浓度相差较大时,放电顺序要发 生变化,相同时按H+,不同时按(H+)
9
想一想: 若以铜电极反应式、电解方程式的书写:
练习:完成下列溶液的电极反应。 (以石墨为电极电解) 硫酸溶液: 盐酸: NaOH溶液: CuBr2溶液: KCl溶液: CuSO4溶液: Na2SO4溶液:
3
2、 定义:把电能转化为化学能的装置。 电 组成: 两个电极、 电解质溶液、 直流电源 解 与外电源正极相连的电极,出电子,氧化反应。 池 电极 阳极:
惰性电极: C、Pt、Au等,不论做阴极、阳极,
电极材料 本身都不反应。
阴极: 与外电源负极相连的电极,进电子,还原反应。
活泼电极: Fe、Cu、Ag等,做阴极本身不反应,
11
S 2->SO32->I ->Br ->Cl ->OH ->NO3 ->SO42-(等含氧酸根离 8 子)>F
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学选修四第四章-电解池资料
4、电解池中的:
阴极:与直流电源的负极相连,发生还原 反应;
阳极:与直流电源的正极相连,发生氧化 反应。
工作原理:通电时,电子从电源的负极沿导线流
入电解池的阴极,经过阴、阳离子定向运动形成的内 电路,再从电解池的阳极流出,并沿导线流回电源的 正极。
阳极
阴极
氧 气
铜
实例
电极反应
浓 PH 复原 度值
阴极(Cu2+ H+): 2Cu2++ 4e-=2Cu
CuSO4 阳极(SO42- OH-) :4OH-- 4e- = 2H2O+O2 ↑
减 减 加适量 小 小 CuO
电解2CuSOຫໍສະໝຸດ +2H2O2Cu +O2↑+2H2SO4
固体
高中化学选修四第四章-电解池资料
金属(除Pt、Au) > S2->I->Br->Cl->OH->含氧酸>F-
金属阳极先放电,离子后放电。
阴阳离子在电极上得放电顺序不要绝对化。此与离子性质、溶液浓度、电流密度、电极材料均有关。
高中化学选修四第四章-电解池资料
练习:以碳棒为电极,电解下列溶液, 写出电极反应式 1、 CuCl2 HI 2、 Na2SO4、 H2SO4 、NaOH 3、 NaCl, 4、 AgNO3、
浓度
减小
PH 复原 值
增 加适量 大 CuCl2
晶体
第一组:电解HI溶液
阳极
阴极
碘
氢气
实例
HI
电极反应
浓度 PH 值
阴极( H+):2H++ 2e-= H2↑ 阳极:(I- ,OH-) : 2I--2 e- =I2
2HI 电解 I2 + H2 ↑
减小 增 大
高中化学选修四第四章-电解池资料
复原
通入 适量 HI
第二组:电解Na2SO4
阳极
阴极
氧
氢
气
气
实例
电极反应
浓度 PH 复原 值
Na2SO4
阴极(H+ Na+) :4H ++ 4e- = 2H2 ↑ 阳极(OH- SO42-): 4OH-- 4e- = 2H2O+O2 ↑ 变大
通电 2H2O == 2H2 ↑+O2 ↑
高中化学选修四第四章-电解池资料
不加 变 H2O
第二组:电解H2SO4
阳极
阴极
氧
氢
气
气
实例
电极反应
浓度 PH 值
H2SO4
阴极(H+ ) :4H ++ 4e- = 2H2 ↑
变
阳极(OH- SO42-): 4OH-- 4e- = 2H2O+O2 ↑ 通电
大
变 小
2H2O == 2H2 ↑+O2 ↑
高中化学选修四第四章-电解池资料
复原
加 H2O
第二组:电解NaOH
结论: CuCl2溶液在电流的作用下发生了 化学变化,分解生成了Cu和Cl2
高中化学选修四第四章-电解池资料
一、电解原理
1、电解的概念:使电流通过电解质溶液(或熔融态)而在 阴、阳两极引起氧化还原反应的过程叫做电解。
2、电解池的概念:借助于电流引起氧化还原反应的装置,也就 是把电能转变为化学能的装置,又称电解槽。
电
解 质
不活泼金属的 无氧酸盐
CuCl2
阳极:2Cl—-2e—=Cl2↑ 阴极:Cu2++2e—=Cu
溶质 和水 同时 电解
活泼金属的 无氧酸盐
不活泼金属的 含氧酸盐
NaCl CuSO4
阳极:2Cl—-2e—=Cl2↑ 阴极:2H++2e—=H2↑
电解质溶液的导电过程,就是电解质溶液的电解过程。
高中化学选修四第四章-电解池资料
5、电解池的分析
电解质先电离后电解; 导电过程就是电解过程。 阴极不参与电解反应; 活性阳极先于阴离子放电。
阳离子得电子,放电 e-
氧化性强的先得电子
H+
阴极
Cu2+ + 2e- = Cu (还原反应)
阴离子失电子,放电 e- 还原性强的先失电子
阳极
阴极
氧
氢
气
气
实例
电极反应
浓 PH 复原 度值
阴极(H+ Na+) :4H ++ 4e- = 2H2 ↑
NaOH 阳极(OH- ): 4OH-- 4e- = 2H2O+O2↑
通电
变 大
2H2O == 2H2 ↑+O2 ↑
高中化学选修四第四章-电解池资料
变加 大 H2O
第三组:电解NaCl
阳极
阴极
8、电解质溶液用惰性电极电解的规律
高中化学选修四第四章-电解池资料
电解 类型
举例
物质类别
实例
电极反应
电 解 水
含氧酸
强碱
活泼金属的 含氧酸盐
H2SO4 NaOH
Na2SO4
阳极:4OH—-4e— =O2↑+2H2O
阴极:4H++4e— =2H2↑
电 解
无氧酸
HCl
阳极:2Cl—-2e—=Cl2↑ 阴极:2H++2e—=H2↑
实例
电极反应
浓度 pH 复原
高中化学选修四第四章-电解池资料
第一组:电解CuCl2
阳极
阴极
氯 气
铜
实例
CuCl2
电极反应
阴极(Cu2+ H+):Cu2++ 2e-=Cu
阳极:(Cl- OH-) : 2Cl--2 e- =Cl2 ↑ CuCl2 电解 Cu+Cl2 ↑
高中化学选修四第四章-电解池资料
OH-
阳极
2 Cl- - 2e- = Cl2↑ (氧化反应)
总反应:
电解
CuCl2
惰性电极:石墨、金、铂
Cu +Cl2↑
活性电极:石墨、金、铂 以外的金属
高中化学选修四第四章-电解池资料
6、电极反应式的书写: 关键是准确判断离子放电顺序。
阴阳两极反应式相加,即得电解的总 反应方程式。(注意电荷守恒)
氯
氢
气
气
实例
电极反应
NaCl
阴极(Na+ H+):2H ++ 2e- = H2 ↑
阳极(Cl- OH-): 2Cl-- 2e- = Cl 2 ↑
电解
2NaCl+2H2O
2NaOH+H2 ↑+Cl2 ↑
高中化学选修四第四章-电解池资料
浓度 PH 值
减增 小大
复原
通入 适量 HCl
第四组:电解CuSO4
第四章 电化学基础
第三节 电解池
高中化学选修四第四章-电解池资料
原电池是把化学能转化为电能的 装置, 而电解池则相反,是由电能转 化为化学能的装置。
高中化学选修四第四章-电解池资料
[实验4-2]:P79
现象:
(1)阴极石墨棒上逐渐覆盖了一 层红色的铜。 (2)阳极石墨棒上有使湿润的碘 化钾淀粉试纸变蓝。
高中化学选修四第四章-电解池资料
7、放电顺序:
阴极:氧化性强的阳离子先得电子
Ag+>Hg2+>Fe3+>Cu2+>H+(酸) >Pb2+ > Sn2+ +>Fe2+>Zn2+ >H+(水) > Al3+>Mg2+>Na+>Ca2+>K+ 金属越不活泼,对应阳离子氧化性越强,越容易得电子。
阳极:还原性强的阴离子先失电子
