分析化学综合实验讲义
《实验讲义》课件

实验所涉及的公式和计算 方法
实验所涉及的仪器和试剂 的作用和使用方法
实验步骤
实验前的准备
包括实验所需仪器、试剂的准备 ,实验场地的安排等
实验总结与讨论
对实验结果进行总结和讨论,分 析实验中存在的问题和改进方向
实验操作过程
按照实验步骤逐一进行实验操作 ,包括仪器的使用、试剂的添加 、数据的记录等
实验数据处理
《实验讲义》ppt课 件
• 实验概述 • 实验材料与设备 • 实验操作过程 • 实验数据分析 • 实验结论与展望 • 参考文献
目录
Part
01
实验概述
实验目的
1
掌握实验的基本原理和方 法
4
培养科学素养和实验精神
2
培养实验操作技能和实验
数据处理能力
3
培养观察、分析和解决问
题的能力
实验原理
实验所涉及的基本概念和 原理
对实验数据进行处理和分析,得 出实验结果
Part
02
实验材料与设备
实验材料
实验材料的选择
实验材料的储存
选择适当的实验材料是实验成功的关 键,需要考虑材料的性质、纯度、来 源和稳定性等因素。
不同材料需要不同的储存条件,正确 储存材料可以保证其质量和稳定性, 避免实验误差。
实验材料的准备
实验前需对实验材料进行充分的准备 ,包括材料的预处理、称量、配置等 步骤,以确保实验的顺利进行。
改进措施
针对实验不足,提出了具体的改进措施和方法, 以提高实验的准确性和可靠性。
未来展望
对未来实验的发展方向和潜在应用进行了展望, 为后续研究提供参考和借鉴。
Part
06
参考文献
参考文献引用格式
分析化学实验讲义

分析化学实验讲义实验一滴定分析仪器基本操作(滴定管、容量瓶、移液管)1. 滴定管滴定管是滴定时可以准确测量滴定剂消耗体积的玻璃仪器,它是一根具有精密刻度,内径均匀的细长玻璃管,可连续的根据需要放出不同体积的液体,并能够准确读出液体体积。
常量分析用的滴定管容量为50mL 和25mL,最小刻度为0.1 mL,读数可估计到0.01 mL。
滴定管分为具塞和无塞两种,也就是习惯上所说的酸式滴定管和碱式滴定管。
酸式滴定管又称具塞滴定管,它的下端有玻璃旋塞开关,用来装酸性、中性与氧化性溶液,不能装碱性溶液如NaOH等。
碱性滴定管又称无塞滴定管,它的下端有一根橡皮管,中间有一个玻璃珠,用来控制溶液的流速,它用来装碱性溶液与无氧化性溶液。
滴定管的使用:(1)使用前的准备①洗涤:自来水→洗液→自来水→蒸馏水②涂凡士林:活塞的大头表面和活塞槽小头的内壁③检漏:将滴定管内装水至最高标线,夹在滴定管夹上放置2min◆酸式滴定管用滤纸检查活塞两端和管夹是否有水渗出,然后将活塞旋转180℃,再检查一次◆碱式滴定管,放置2min,如果漏水应更换橡皮管或大小合适的玻璃珠④润洗:为保证滴定管内的标准溶液不被稀释,应先用标准溶液洗涤滴定管3次,每次5~10mL⑤装液:左手拿滴定管,使滴定管倾斜,右手拿试剂瓶往滴定管中倒溶液,直至充满零刻线以上⑥排气泡:酸式滴定管尖嘴处有气泡时,右手拿滴定管上部无刻度处,左手打开活塞,使溶液迅速冲走气泡。
碱式滴定管有气泡时,将橡皮塞向上弯曲,两手指挤压玻璃珠,使溶液从管尖喷出,排除气泡。
⑦调零点:调整液面与零刻度线相平,初读数为“0.00mL”⑧读数:a.读数时滴定管应竖直放置b.注入或放出溶液时,应静置1~2min后再读数c.初读数最好为0.00mLd.无色或浅色溶液读弯月面最低点,视线应与弯月面水平相切e.深色溶液应读取液面上缘最高点f.读取时要估读一位(2)滴定操作:将滴定管夹在右边①酸式滴定管:活塞柄向右,左手从滴定管后向右伸出,拇指在滴定管前,食指及中指在管后,三指平行的轻轻拿住活塞柄。
化学实验讲义

化学实验讲义实验⼆黄连中⼩檗碱的提取和鉴定(设计性实验)⼀、⽬的与要求1.通过对黄连中⼩檗碱的提取,掌握天然产物的提取技术。
2.通过对⼩檗碱的鉴定,掌握⼀般⽣物碱的鉴别⽅法。
3.通过查阅资料并结合所学知识,初步了解并完成实验⽅案的设计。
⼆、基本原理黄连主含⼩檗碱,含量为5.20%-7.69%,还含黄连碱,甲基黄连碱、掌叶防⼰碱等,由于它们有相似结构,常统称为黄连⽣物碱。
⼩檗碱异名为黄连素,在⽔或稀⼄醇中结晶所得⼩檗碱为黄⾊针状结晶。
游离⼩檗碱微溶于冷⽔,易溶于热⽔,⼏乎不溶于冷⼄醇、氯仿和⼄醚。
⼩檗碱和⼤分⼦有机酸⽣成的盐在⽔中的溶解度都很⼩。
⼩檗碱有季铵式、醛式、醇式,3种能互变的结构式,以季铵式最稳定。
⼩檗碱的盐都是季铵盐,于硫酸⼩檗碱的⽔溶液中加⼊计算量的氢氧化钡,⽣成棕红⾊强碱性游离⼩檗碱,易溶于⽔,难溶于⼄醚,称为季铵式⼩檗碱。
如果于⽔溶性的季铵式⼩檗碱⽔溶液中加⼊过量的碱,则⽣成游离⼩檗碱的沉淀,称为醇式⼩檗碱。
如果⽤过量的氢氧化钠处理⼩檗碱盐类则能⽣成溶于⼄醚的游离⼩檗碱,能与羟胺反应⽣成衍⽣物,说明分⼦中有活性醛基,称为醛式⼩檗碱。
⼩檗碱的提取⽅法主要有溶剂法(包括⽔或⽔-有机溶剂法、醇-酸⽔-有机溶剂法、碱化有机溶剂法)、离⼦交换树脂法、沉淀法等,通过⽣物碱特有的沉淀反应和显⾊反应对其进⾏鉴别.ON+OCH3OCH3⼩檗碱的结构式三、仪器和试剂1.仪器与材料100mL园底烧瓶、冷凝管、50mL、100mL烧杯各1只,10mL、25mL量筒各1个,铁架台1个、漏⽃1个、滤纸若⼲、滴管1个、蒸发⽫、⼩试管三⽀等。
2. 试剂与原料黄连粉2.0g,体积分数为95%的⼄醇15mL,浓HCl10mL、蒸馏⽔、碘化铋钾试液、碘碘化钾试液、硅钨酸试液等。
四、实验步骤1.⼩檗碱的提取2.⼩檗碱的鉴定实验⼗⾹⾖素-3-羧酸的制备(综合性实验)⼀、实验⽬的1.学习利⽤Knoevenagel反应制备⾹⾖素的原理和实验⽅法。
(精)基础化学综合实验讲义

基础化学综合实验讲义实验预习、记录和实验报告实验预习有机化学实验课是一门带有综合性的理论联系实际的课程,也是培养学生独立工作能力的重要实践环节。
因此,要达到实验的预期效果,必须在实验前认真地预习好有关实验内容,做好实验前的准备工作。
看:仔细地阅读与本次实验有关的全部内容,不能有丝毫的马虎和遗漏。
查:通过查问手册和有关资料来了解实验中要用到或可能出现的化合物的性能和物理常数。
写:在看和查的基础上认真地写好预习笔记。
每个学生都应准备一本实验预习和记录本。
预习笔记的具体要求是:(1)实验目的和要求,实验原理和反应式(主反应、主要副反应)。
需用的仪器和装置的名称及性能、溶液浓度或配制方法,主要试剂或产物的物理常数,主要试剂的规格用量(g,ml,mol)都要写在预习笔记本上。
(2)阅读实验内容后,根据实验内容用自己的语言正确地写出简明的实验步骤(不是照抄!),关键之处应加注明。
步骤中的文字可用符号简化。
例如,化合物只写分子式;克用“g”,毫升“mL”,热用“△”,加“+”,沉淀“↓”,气体逸出用“↑”,仪器以示性图代之。
这样在实验前己形成了一个工作提纲,实验时按此提纲进行。
(3)合成实验,应列出租产物纯化过程及原理。
(4)对于将要做的实验中可能出现的问题(包括安全和实验结果)要写出防范措施和解决办法。
实验记录实验时应认真操作,仔细观察,积极思考,并且应不断地将观察到的实验现象及测得的各种数据及时如实地记录在记录本上。
实验完毕后,将实验记录交教师审阅。
实验记录是实验过程的原始记录,必须以严肃认真的态度对待。
做好实验记录应注意以下几点:(1)使用记录本,编写页数。
(2)完整记录实验内容展求记录准确,实事求是,不准弄虚作假。
记录内容包括:实验的全过程、试剂用量、仪器装置、反应温度、反应时间、反应现象、产量、产率等。
(3)实验记录必须做到简明、扼要,字迹整洁,不仅要自己明白,还要别人能看懂,作为原始记录不得随便涂改。
分析化学综合实训教学设计

分析化学综合实训教学设计一、引言分析化学是化学的一个重要分支,研究物质的组成、结构以及它们之间的相互作用。
综合实训是一种以实践为基础的教学方法,能够帮助学生将理论与实际应用相结合,提高他们的分析能力和解决问题的能力。
本文旨在设计一种分析化学综合实训教学方案,以帮助学生更好地理解和掌握分析化学的基本理论和实验技术。
二、教学目标1. 理解分析化学的基本原理和方法;2. 掌握常用的分析化学仪器和设备的操作技术;3. 培养学生的实验技能和数据处理能力;4. 培养学生的创新思维和解决问题的能力。
三、教学内容本教学设计主要包括以下几个方面的内容:1. 分析化学基本原理的讲解:介绍分析化学的基本概念、原理和方法,包括定性分析、定量分析和分析仪器的原理等。
2. 分析化学仪器的使用:带领学生熟悉常用的分析化学仪器和设备,如分光光度计、原子吸收光谱仪、气相色谱仪等,并教授其操作技巧。
3. 实验技术和数据处理:引导学生进行一系列的分析化学实验,如酸碱滴定、重金属离子分析等,培养他们的实验技能和数据处理能力。
4. 实践应用与解决问题:设置综合实训项目,让学生应用所学分析化学知识和实验技术,解决实际问题,培养他们的创新思维和解决问题的能力。
四、教学方法1. 结合理论与实践:通过讲解理论知识和进行实验操作相结合,帮助学生更好地理解分析化学的原理和方法。
2. 贴近实际应用:将实验内容与实际应用场景相结合,让学生感受到分析化学在实际中的重要性和应用价值。
3. 引导探究学习:鼓励学生主动学习和独立思考,通过探究问题和解决问题的过程,加深对知识的理解和掌握。
4. 小组合作学习:以小组为单位进行实验和项目的设计与实施,培养学生的团队合作和协作能力。
五、教学评价在教学过程中,我们可以通过以下几种方式对学生的学习情况进行评价:1. 实验报告:要求学生根据实验结果撰写实验报告,评价其实验设计、实验操作和数据处理能力。
2. 项目展示:让学生进行综合实训项目的展示,评价其创新思维、解决问题的能力和团队合作能力。
【精品】综合与设计性大学化学实验

综合与设计性实验讲义目录模块一实验一茶叶中提取咖啡因(综合性化学实验)1实验二黄连中小檗碱的提取和鉴定(设计性化学实验)5实验三烟叶中烟碱的提取与定性分析测定(综合性化学实验)6实验四玉米须中黄酮和多糖的提取、鉴别与含量测定(设计性化学实验)10模块二实验五高锰酸钾法测定蛋壳中CaO的含量(设计性化学实验)12实验六维生素C药片中抗坏血酸含量的测定(综合性化学实验)13实验七葡萄糖酸锌的制备和分析(综合性化学实验)15模块三实验八1,2,4—三唑的制备(设计性化学实验)18实验九聚乙烯醛缩甲醛胶水的制备(综合性化学实验)19实验十香豆素-3-羧酸的制备20实验十一三草酸合铁(Ⅲ)酸钾的制备、性质和组成分析(设计性化学实验)22实验十二固体酒精的制备及燃烧热的测定(综合性化学实验)24说明:本实验课程要求学生从三个模块(见附表)中选出四个实验题目,即从模块一、模块二中各择一个实验题目,从模块三中选择二个。
四个实验题目中设计性实验不得少于一个.设计性实验要提供设计方案,列举可行的方案。
实验前要交给指导老师批阅。
例如:模块一中选择烟叶中烟碱的提取与定性分析测定(综合性化学实验),模块二中选择高锰酸钾法测定蛋壳中CaO的含量(设计性化学实验),模块三中选择聚乙烯醛缩甲醛胶水的制备(综合性化学实验),环保颜料氧化铁黄的制备定(综合性化学实验)模块一实验一茶叶中的咖啡因的提取及其红外光谱的测定A茶叶中的咖啡因的提取一、实验目的(1)通过从茶叶中提取咖啡因学习固-液萃取的原理及方法。
(2)掌握索氏提取器的原理及作用。
(3)掌握升华原理及操作.二、实验原理茶叶中含有多种黄嘌呤衍生物的生物碱,其主要成分为含量约占1%~5%的咖啡因(Caffeine,又名咖啡碱),并含有少量茶碱和可可豆碱,以及11%~12%的丹宁酸(又称鞣酸),还有约0。
6%的色素、纤维素和蛋白质等。
咖啡因的化学名为1,3,7-三甲基-2,6—二氧嘌呤,其结构为:ONH3CNOCH3NNCH3NNHNN纯咖啡因为白色针状结晶体,无臭,味苦,置于空气中有风化性。
无机及分析化学实验讲义

实验一 水中碱度的测定一、实验目的学习分析天平的使用和样品的称量;学习标准溶液的配制和标定;学习和掌握滴定分析的基本操作;掌握酸碱滴定法测水中碱度的原理和方法。
二、实验原理1. 盐酸溶液的标定首先配制约0.1mol/L 的盐酸溶液,以甲基橙为指示剂,用已知准确浓度的Na 2CO 3标准溶液来标定盐酸的准确浓度,溶液由黄色变至橙红色即为滴定终点。
反应式:Na 2CO 3+2HCl =2NaCl+H 2O+CO 22. 水中碱度的测定碱度是指水中含有能与强酸发生中和作用的物质的总量,是衡量水体变化的重要指标,是水的综合性特征指标。
碱度主要来自水样中存在的碳酸盐、重碳酸盐及氢氧化物。
1) 酚酞碱度酚酞作指示剂,用盐酸标准溶液滴定至溶液颜色由红色恰好变为无色为止,盐酸滴定体积为V 1 mL 。
反应式: NaOH + HCl = H 2O + NaCl Na2CO 3 + HCl = NaHCO 3 + NaCl()水样=酚酞碱度V V •C L /mol 1HCl , ()1000×V V •C L /mg CaO 1HCl 水样=计,以酚酞碱度 2) 总碱度再加甲基橙指示剂,用盐酸标准溶液继续滴定至溶液由黄色变为橙红色为止,盐酸滴定体积为V 2 mL 。
反应式:NaHCO 3 + HCl =NaCl + H 2O+CO 2()水样+=总碱度V )V V (•C L /mol 21HCl ; ()1000×V )V V (•C L /mg CaO 21HCl 水样+=计,以总碱度 3) 氢氧化物、碳酸盐和重碳酸盐由V 1和V 2可以判断水中碱度的组成,并计算出氢氧化物、碳酸盐和重碳酸盐的含量。
三、主要仪器及试剂主要仪器:电子天平(0.0001g ),称量瓶,烧杯,玻璃棒,250mL 容量瓶,锥形瓶,酸式滴定管(50mL ),25mL 移液管,100mL 移液管,吸耳球主要试剂:无水碳酸钠,12mol/L 浓盐酸,0.1%甲基橙指示剂,0.1%酚酞指示剂,无二氧化碳水四、实验步骤1. 洗净所有玻璃器皿,并试漏;2. Na 2CO 3标准溶液的配制采用差减法准确称取预先干燥过的无水Na 2CO 3固体1.2~1.4g (精确到0.0001g )于小烧杯中;加约50mL 蒸馏水,用玻璃棒搅拌溶解后,转移至250mL 容量瓶中,用少量蒸馏水润洗烧杯3~4次,全部转移至容量瓶中,定容。
化学工程与工艺专业分析化学实验讲义
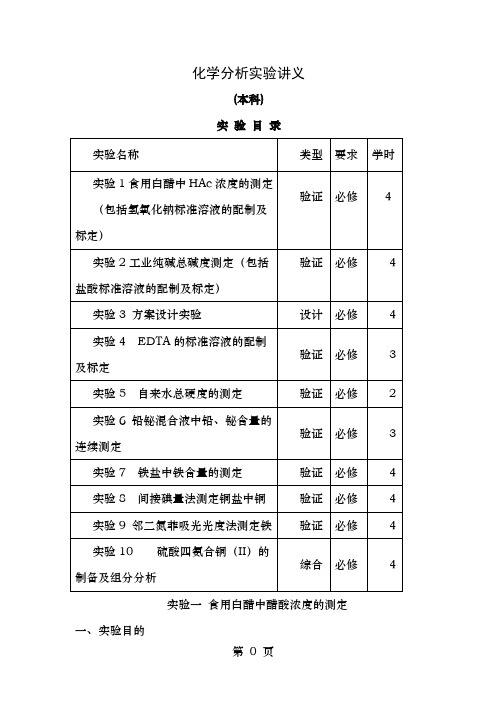
化学分析实验讲义(本科)实验目录实验一食用白醋中醋酸浓度的测定一、实验目的1.了解基准物质邻苯二甲酸氢钾的性质及其应用。
2.掌握NaOH 标准溶液的配制、标定的操作。
3.掌握强碱滴定弱酸的反应原理及指示剂的选择。
4.巩固分析天平操作,熟悉滴定操作方法,学习移液管与容量瓶等量器的正确使用。
二、实验原理1.食用白醋中的主要成份为醋酸,醋酸的Ka=1.8×10-5,可用标准NaOH 溶液直接滴定,滴定终点产物是醋酸钠,滴定突跃在碱性范围内,pHsp≈ 8.7,选用酚酞作指示剂。
从而测得其中醋酸的含量。
HAc+NaOH=NaAc+H 2O2. NaOH 标准溶液采用标定法,这是因为NaOH 固体易吸收空气中的CO 2与水蒸汽,故只能选用标定法来配制。
常用来标定碱标准溶液的基准物质有邻苯二甲酸氢钾、草酸等。
本实验用基准物质邻苯二甲酸氢钾标定,滴定产物为邻苯二甲酸钠钾,滴定突跃在碱性范围内,pHsp≈9,用酚酞作指示剂。
反应式如下:三、仪器台秤、半(全)自动电光分析天平、称量瓶、量筒(10mL)、烧杯、试剂瓶、碱式滴定管(50 mL)、锥形瓶(250mL)、移液管(25 mL )、容量瓶(250 mL )、电炉。
四、试剂NaOH(s)(A.R.)、酚酞指示剂(0.2%乙醇溶液)、食用白醋(市售)。
CO CO+ N a CO + H 2 O CO邻苯二甲酸氢钾(KHC8H4O4)基准物质(烘干温度100-1250C)。
五、实验步骤1.0.1mol/LNaOH标准溶液的配制用台秤称取4.0g NaOH固体于1000mL烧杯中,加去离子水溶解,然后转移至试剂瓶(聚乙烯)中,用去离子水稀释至1000mL,充分摇匀,贴上标签(溶液名称,姓名,配制日期),备用。
2.0.1mol/L NaOH溶液的标定准确称取邻苯二甲酸氢钾0.4~0.8g三份,分别置于250mL锥形瓶中,各加入约40mL热水溶解,冷却后,加入3滴酚酞指示剂,用NaOH溶液滴定至溶液刚好由无色变为微红色且30s内不褪,停止滴定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4. Dark scan (1) 将 port reducer 装在取样口,拧紧螺丝; (2) 将 light trap 罩在取样口上。 (3) 点击软件上的―dark scan‖。 5. Reference scan (1) 将 Spectralon Reference Standard(参比) 放置在样品口 (2)点击―Reference Scan‖。 6. Sample scan
实验一:紫外-可见漫反射光谱法定量判别颜色的 CMYK 参数 一.实验目的 通过对不同深浅程度彩色印刷品的紫外-可见漫反射光谱测量, 掌握紫外- 可见漫反射原理, 熟悉 InstantSpec BWS003 的使用, 并了解印刷工业中的不同颜 色模式。 二.实验原理 1) 紫外-可见漫反射光谱: 紫外-可见漫反射光谱与 UV 吸收光谱相比,所测样品的局限性要小很多。 UV 吸收光谱符合朗伯-比尔定律,只有在稀溶液中浓度和吸光度才有线性关系, 否则将无法完成定量工作。 而紫外-可见漫反射光谱则可以测试浑浊溶液、悬浊 溶液及固体和固体粉末等样品,试样产生的漫反射符合 Kublka—Munk 方程式
光谱检测条件为:物镜:50X;光谱扫描范围:100 - 4000 cm-1;激光功率: 20mW;激光曝光时间:10s;光谱扫描次数:1 次。 四. 实验步骤 1. 打开主机和计算机电源,同时打开激光器后面的总电源开关,将仪器预热20 分钟左右。 2. 自检. 静态取谱(Static),中心520 Raman Shift cm-1, Advanced -> Pinhole 设为 in。 使用硅片,用50 倍物镜,1 秒曝光时间,100%激光功率取谱。使用曲线拟合 (Curve fit)命令检查峰位,检验仪器状态。 3.样品拉曼光谱的测定 将KNO3溶液放置在2ml玻璃试剂瓶中, 保证瓶中没有气泡。 将玻璃试剂瓶放 置在载玻片上,并置于显微镜的载物台上,调节显微镜载物台的高度使得显微镜 焦点聚焦于溶液中(上2,下1)。选择Measurement->New->Spectral acquisition 进行实验条件设置,再将白光照明光路切换到激光照明光路(上1,下2),即选 择激光照射,选择Measurement->Run运行实验,等待实验运行,直到窗口中出现 红色的光谱曲线,采集光谱结束,保存扫描结果。 依次测定各浓度的KNO3溶液的拉曼光谱,并采用Origin软件对其进行处理, 拟合计算出a常数,以获得标准曲线。 测定未知浓度的KNO3溶液,计算其浓度。 五.数据处理 用Origin软件绘制不同浓度的拉曼光谱。纵坐标是散射强度,可用任何单位 表示,横坐标是拉曼位移,通常用相对于瑞利线的位移表示其数值,单位为波数 cm-1。
三.实验仪器和试剂 1. InstantSpec BWS003 紫外可见漫反射光谱仪; 2. 标准浓度的色带; 3. 待测浓度的色带; 4. 其他样品; 四.实验步骤 1. 双击打开软件,从菜单栏中选择―Option‖-―Enable Reference Material File‖-―Set‖。 2. 3. 设置―Integration Time‖为 800。 点击―Open FlashLight‖。
2) 印刷品的颜色模式: 在印刷工业中常用的颜色模式有 RGB 模式、CMYK 模式、HSB 模式、Lab 颜色模式、位图模式、灰度模式、索引颜色模式、双色调模式和多通道模式,其 中 RGB 模式和 CMYK 模式最为常用。 RGB 模式基于最基础的光学三原色的三个色彩通道:红(R:red)、绿(G: green)、蓝(B:blue),进行不同比例的混合叠加,来得到各式各样的色彩,每种 原色的比例参数设置从 0-255,所以共有 16,777,216 种颜色,被认为是接近了自 然界中所有的颜色,是色彩最全的一种颜色模式,故又称为真彩色。 CMYK 模式是印刷工业中使用最为广泛的一种颜色模式。与 RGB 相类似,
图 2.
KNO3 溶液的 WSR 与浓度之间的关系(点:实验数据;线:拟合曲线)
将该a常数代入式(1) ,即为KNO3溶液浓度测定的标准曲线。测定未知浓 度的KNO3溶液,并计算其浓度。
六. 讨论与思考: 1. 比较不同的实验条件下同一浓度的溶液的拉曼光谱有何异同(重点观察无机 盐特征峰和水峰有何变化)? 2.为什么不能采用无机盐溶液的拉曼特征峰强度定量计算溶液浓度? 3.对比本实验与《仪器分析实验》课程中的“激光拉曼光谱”实验,谈谈自己 的感想和收获。
表一 不同浓度 KNO3 溶液的 WSR 值 浓度(mol/L) WSR 0.1 0.2 0.3 0.4 0.5 1.3 溶液的 WSR 关于浓度作图,如图 2 所示。然后采用 Origin 软件的非线性拟合方法对该曲线进行反比例函数拟合,获得 a 常数。
六.注意 1.不要抄袭本讲义中的原理部分,请根据个人情况概括,提交电子版实验报 告; 2.实验报告中需要有工作曲线或模式识别的相关建模内容; 3.分析结果时,需要对测量结果进行可靠性分析,提供相应指标参数; 4.附 100 字以内中文摘要; 七.讨论与思考 1.同种颜色的深浅与同一波长处的 R%高低有什么联系? 2.观察不同颜色的物质反射率最高处的峰值有何不同,为什么? 3.应当用什么来执行 Reference Scan?为什么?
(1) 取下参比,将样品放置在取样口,点击―Acquire one Spectrum‖; (2) 选择―%T/R‖得到漫反射光谱曲线。 (3) 换另一个样品, 点击―Acquire Overlay‖得到该样品的漫反射光谱曲线。 五.数据处理 以已知浓度梯度的某种颜色浓度(程度)为自变量,选取适当波长的 R%为 因变量(可以对 R%进行合理的数学变换,比如取负对数等) ,建立工作曲线或 回归模型(提供数学公式和相关系数) ,并以此为标准,预报待测样品中指定颜 色的浓度(程度) 。
A n V WSR H O ∝ H O n KNO Av NO n KNO
2 2 1 3 3 3
n H2O
C H 2O C KNO3
a C KNO3
……………….(式 1)
V
将实验所测的不同浓度的溶液的 WSR 关于浓度作图,此图应近似为反比例 函数曲线;采用 origin 软件对该曲线进行非线性拟合(y = a/x) ,可获得该溶液 的 a 常数。将 a 值代入式(1) ,即可获得该溶液浓度测定的标准曲线方程。因此, 通过检测未知浓度溶液的拉曼光谱,可得 WSR,将该 WSR 带入标准曲线方程, 即可获知该溶液的浓度。
实验二拉曼光谱定量检测无机盐溶液浓度
一. 实验目的 1、熟练掌握显微共焦激光拉曼光谱仪的使用方法。 2、能使用 Origin 等软件对测得的拉曼光谱进行数据处理。 3、通过对不同浓度无机盐溶液的定量检测,深刻理解拉曼光谱的基本原理。
二. 实验原理 在无机盐溶液的拉曼光谱中,其水峰及无机盐的特征峰是由溶液中的水及无 机盐分别贡献,且其检测条件完全相同。因此,其水峰及无机盐特征峰的面积比 (简称为 WSR)将正比于溶液中水和溶质的分子数之比,即溶液中水与溶质的 浓度比。由于在盐溶液中,水分子是大量存在的,当溶液浓度变化时,水的浓度 可近似为不变(溶液越稀,该假设越成立) ,即为一常数,本实验中用常数 a 表 示。因此,可推测出 WSR 与溶液的浓度成反比例关系,如式 1 所示。
(1 R )2 / 2 R K / S
式中 K -吸收系数 S -为散射系数 R∞ 表示无限厚样品的反射系数 R 的极限值,其数值为一个常数。 实际上,反射系数 R 通常是采用与已知高反射系数的标准物质(本实验采 用 PTFE,其反射系数在紫外可见光区>98%)比较来测量,测定 R∞(样品)/ R∞ (标准物质)比值,用 R%表示(仪器软件用 T%表示) ,将此比值对波长作图, 构成一定波长范围内该物质的漫反射光谱。
3) 仪器结构: 紫外-可见漫反射光谱仪主要分为以下几个部分:光源系统、积分球反射体 系、反射光检测系统、数据收集处理系统。
积分球是漫反射测量中的常用附件之一。 其内表面的漫反射物质反射系数高 达 98%,使得光在积分球内部的损失接近零。漫反射光是指从光源发出的光进 入样品内部, 经过多次反射、 折射、 散射及吸收后返回样品表面的反射光。 最后, 反射光射出积分球打到检测器上,完成光谱检测。再将数据信号传输给数据收集 处理系统,产生光谱图。 不同颜色反射强度不同, 不同的颜色的特征反射波长也不同。可以根据这些 特点建立一个印刷材料颜色漫反射光谱的标准模型,并进行主成分分析,解析出 待测样品的基色混合比例,实现颜色校正。上述都是基于 CMYK 模式来讲的。 而在建模过程中, 漫反射光谱类似于吸收光谱是严重重叠的,所以可以选取一部 分具有特征反射的光谱,回归建模,完成对应颜色浓度预报。
它由人为规定的四中色彩通道按照比例参数混合叠加来表征颜色, 四个通道分别 是:青色(C:cyan) 、洋红(M:magenta) 、黄色(Y:yellow) 、黑色(K:black, 不用 B 是为了避免与 blue 混淆) ,在印刷中代表四种颜色的油墨。每种基色的参 数比例范围是 0%-100%。 CMYK 模式在本质上与 RGB 模式没有太大区别, 只是 产生色彩的原理不同,在 RGB 模式中由光源发出的色光混合生成颜色,而在 CMYK 模式中由光线照到有不同比例 C、M、Y、K 油墨的纸上,部分光被吸收 后,反射到人眼的光产生颜色。由于 C、M、Y、K 在混合成色时,随着 C、M、 Y、K 四种成分的增多,反射到人眼的光会越来越少,光线的亮度会越来越低, 所以 CMYK 模式产生颜色的方法又被称为色光减色法。 一般的印刷机都是采用 CMYK 模式印刷,而用计算机的显示系统以及制作 广告材料时使用的是 RGB 模式 (可以调整颜色模式) 。 所以在交付印刷时印刷厂 会把工程文件从 RGB 转换成 CMYK,这就会导致由于色域变化而产生的色差。 一般来说,转换后,印刷成品较工程文件颜色总体偏青。 当然任何模式都存在缺陷。 由于生产工艺有限, 现在还无法制备出很纯的四 种基色的墨晶。从理论上讲,同 RGB 类似,CMY 三种颜色已经足够所有颜色, 黑色可由其混合产生。 但实际混合的结果是一种很深的暗红色。如果对印刷品要 求较高时,就需要使用黑色的墨晶,且在印刷中黑色使用的频率最高,故添加了 黑色墨晶,变成了四基色体系。而对于一些特殊的颜色比如金、银或比较亮的颜 色是需要专色的,即预先混合好的颜色墨晶,导致成本变高。原因就是四种墨晶 并不纯。而 RGB 模式要求使用非常纯的红、黄、蓝墨晶,价格昂贵,故多使用 CMYK 模式。 而往往我们关注和头疼的,就是出现这种色差的问题。比如在 RGB 模式中 设置的一个颜色,在 CMYK 模式中会产生偏差,那么偏差有多少?如何测量? 换句话说,就是如何检验印刷品的质量?如何定量分析颜色偏差?对于这些问 题,我们可以使用紫外-可见漫反射光谱仪来解决。
