无机化学第五章习题参考答案
张祖德《无机化学习题》及答案第五章

第五章答案1. (1) 3.8×10−17 mol·dm−3(2) 3.58×10−2 mol·dm−3(3) 3.3×10−3 mol·dm−32. 2.90×10−703. (1) 1.34×10−4 mol·dm−3(2) 1.8×10−7 mol·dm−3(3) 1.8×10−5 mol·dm−34. FeS能溶于1.00 mol·dm−3的盐酸中,HgS则不溶。
5. 1.19×10−46. [Ag+]=[Cl−]=1.3×10−5 mol·dm−3[Ba2+]=[SO42−]=1.3×10−5 mol·dm−37. 4.9×10−108. 无CaSO4沉淀产生,有BaSO4沉淀产生。
9. (1) 3.8×10−4 mol·dm−3(2) 不相等。
因为F-离子的存在,大大减少了Sr2+的存在,增加了CO32-的存在。
10. 平衡时无PbBr2固体存在。
11. 7.3×10−412. 无ZnS沉淀,有CuS沉淀。
[H+]=0.32 mol·dm−3[Zn2+]=0.01 mol·dm−3[Cu2+]=3.74×10−15 mol·dm−313. (1) 52.7 mg/100 cm3(2) 7.0×10−4 mol·dm−314. (1) 无CdS沉淀,(2) 有CdS沉淀。
15. (1) pH=1.08(2) 有CaC2O4沉淀,第一种沉淀后不会有BaC2O4沉淀。
16. (1) 有Mg(OH)2沉淀。
(2) 加入12.8 g NH4Cl(s)。
17. (1) 1.84×10−14 mol·dm−3(2) 5.8×10−11 mol·dm−318. [Ag+]=2.4×10−5 mol·dm−3[MoO42−]=4.6×10−2 mol·dm−319. 111 mL20. (1) [SO42−]=1.8×10−5 mol·dm−3(2) 18%(3) 2.16×10−3 mol 21. [Sr2+]=8.7×10−4 mol·dm−3[Ba2+]=1.7×10−6 mol·dm−3[SO42−]=8.7×10−4 mol·dm−322. (1) AgCl先沉淀(2) [Cl−]=4.03×10−5 mol·dm−3(3) 7.15×10−4 g23. 95.6 %24. (1) 3.67 (2) 6.3925. 无BaF2沉淀产生26. 无AgAc沉淀产生27.28. −1.37 < pH ≤ 1.3329. 1.06 g30. [Br−]=3.0×10−5 mol·dm−3[I−]=4.8×10−9 mol·dm−331. 1.0×10−5 mol·dm−332. 3.0×10−1033. 1.7 g34. [Ag+]=1.0×10−8 mol·dm−3[Cl−]=0.017 mol·dm−3[Br−]=5.0×10−5 mol·dm−3[Na+]=0.067 mol·dm−3[NO3−]=0.05 mol·dm−335. [Ag+]=0.0053 mol·dm−3[Cl−]=3.2×10−8 mol·dm−3[Ba2+]=5.6×10−7 mol·dm−3[SO42−]=0.0027 mol·dm−336. 有ZnS和NiS沉淀37. 0.35 g·dm−338. 无FeS沉淀产生39. [Ba2+]=1.4×10−8 mol·dm−3[SO42−]=1.3×10−4 mol·dm−3[Sr2+]=6.0×10−3 mol·dm−3[CrO42−]=6.0×10−3 mol·dm−340. [Ag+]=1.3×10−11 mol·dm−3[Cl−]=1.4×10−2 mol·dm−3[I−]=6.4×10−6 mol·dm−3[Tl+]=1.4×10−2 mol·dm−341. [I−]=1.0×10−8 mol·dm−342. [Ag+]=4.3×10−10 mol·dm−3[NO2−]=1.1×10−4 mol·dm−343. (1) K=5.88×10−3(2) K=1.18×104对于同种类型的难溶电解质,在某种离子浓度相近时,K sp大的沉淀可以转化成K sp小的沉淀。
兰叶青无机化学课后习题答案5

第五章 分析化学概论5-7解:55.84520.06%20.09%278.0120.06%20.09%0.03%0.03%0.001520.09%T T r T x x E x x E E x ===∴=-=-=--===- =-1.5‰ 5-8解:1234514.5,13.814.013.614.214.00.350.350.02514.0r x x x x x x S S S x ===========25‰ 5-9解:1.53 1.54 1.61 1.831.8390%4520.761.831.63,0.14090%4511.63 1.630.16D P n Q Q Q x S P n t x μ===-=<∴====-∴=±==±表表排序得:,,,可疑值x 当置信度,时,查表得,应保留当置信度,时,查表得=2.35平均值的置信区间为:5-10 解:35.65、35.69、35.72、35.60()()14,35.66,0.052295%,451 3.1835.6635.660.0899%,451 5.8435.6635.660.15n x S P n t x P n t x μμ=====-==±==±==-==±==±当时,查表得当时,查表得5-11 解:90.00%89.60%0.4%95%,1151 2.2389.60%89.60%0.27%90.00%T x x S P n t x μ=====-==±==±∴当时,查表得不在此范围内,此产品不符合规定要求。
5-12 解:M (NaCl)=55.845, m (NaCl)=35.8+4.5162=40.3-1(NaCl)40.3(NaCl)58.443(NaCl)0.690(mol L )1.000m M c V ∴===⋅5-13 解:甲合理。
无机化学第五章习题参考答案
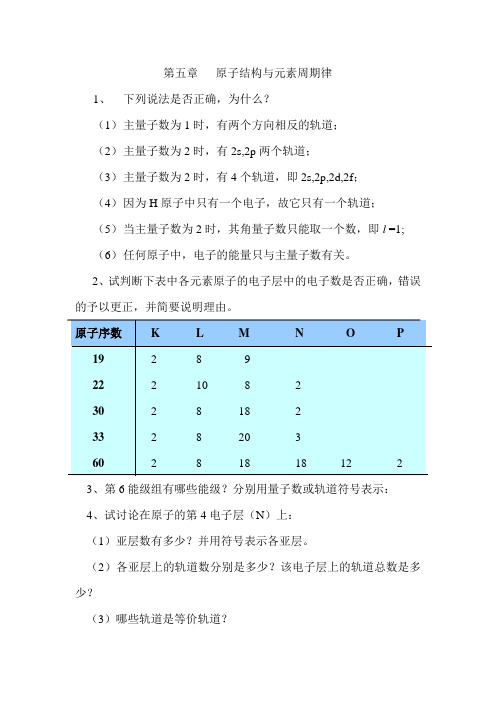
第五章原子结构与元素周期律1、下列说法是否正确,为什么?(1)主量子数为1时,有两个方向相反的轨道;(2)主量子数为2时,有2s,2p两个轨道;(3)主量子数为2时,有4个轨道,即2s,2p,2d,2f;(4)因为H原子中只有一个电子,故它只有一个轨道;(5)当主量子数为2时,其角量子数只能取一个数,即l =1;(6)任何原子中,电子的能量只与主量子数有关。
2、试判断下表中各元素原子的电子层中的电子数是否正确,错误的予以更正,并简要说明理由。
3、第6能级组有哪些能级?分别用量子数或轨道符号表示:4、试讨论在原子的第4电子层(N)上:(1)亚层数有多少?并用符号表示各亚层。
(2)各亚层上的轨道数分别是多少?该电子层上的轨道总数是多少?(3)哪些轨道是等价轨道?5、写出与下列量子数相应的各类轨道符号,并写出其在近似能级图中的前后能级所对应的符号:(1)n=2, l=1(2) n=3, l =2(3) n=4, l =0(4) n=4, l =36、在下列各项中,填入合适的量子数:(1)n=?, l=2, m=0, m s=±1/2(2)n=2, l=?, m=-1, m s=±1/2(3)n=4, l=?, m=+2, m s=±1/2(4)n=3, l=0, m=?, m s=±1/27、指出下列假设的电子运动状态(依次为n,l,m, m s),哪几种不可能存在?为什么?(1)3,2,+2,+1/2 (2)2, 2, -2, +1/2(3)2, 0, +1, -1/2 (4) 2, -1, 0, +1/2(5) 4, 3, -1, 18、原子吸收能量由基态变成激发态时,通常是最外层电子向更高的能级跃迁。
试指出下列原子的电子排布中,哪些属于基态或激发态,哪些是错误的。
(1)1s2 2s2 2p1(2)1s2 2s2 2p62d1(3) 1s22s22p43s1(4) 1s2 2s4 2p29、写出原子序数为45,52,79各元素的原子核外电子排布式及其价层电子构型。
北师大《无机化学》第四版习题答案5

北师大《无机化学》第四版习题答案5第五章化学热力学基础5-1 从手册中查出常用试剂浓硫酸、浓盐酸、浓硝酸、浓氨水的密度和质量分数计算它们的(体积)物质的量浓度和质量摩尔浓度。
解:经查阅: p(HCl)=1.19g/ml w(HCl)=37.23%p(H2SO4)=1.83g/ml w(H2SO4)=98%p(HNO3)=1.42g/ml w(HNO3)=69.80%p(NH3.H2O)=0.9g/ml w(NH3.H2O)=26%由公式c=pw/M可得:c(HCl)=12 mol·L–1c(H2SO4)=18.3mol·L–1c(HNO3)=15.7 mol·L–1 c (NH3.H2O)=13.8 mol·L–1设1㎏水中含溶质n mol,则由w=m/(m+1000)(m为溶质质量)可得:m (HCl)=16.2 mol/㎏m(H2SO4)=500 mol/㎏m(HNO3)=36.69 mol/㎏m (NH3.H2O)= 20.67 mol/㎏5-2 从手册查出常温下的饱和水蒸气压,计算当时相对湿度为40%时,水蒸气压多大。
解:在298K下,P(饱和水蒸气压)=3.167Kpa,P(不饱和)/P(饱和)=40%,则P(不饱和)/P(饱和)=40%×P(饱和)=0.4×3.167=1.2668 Kpa答:水蒸气压为1.2668 Kpa.5-3化学实验中经常用蒸馏水冲洗已用自来水洗净的烧杯。
设洗净烧杯残留“水”为1mL,试计算,用30mL蒸馏水洗1次和2次,烧杯中残留的“自来水的浓度”分别多大?解:再用自来水洗之后,烧杯中自来水为1ml之后,加入30ml 蒸馏水,一共为31ml 水,自来水占1/31,倒掉后又倒1ml,故自来水浓度为1/31。
若第一次加入的蒸馏水倒掉之后,1ml中含1/31ml的自来水;再加入30ml蒸馏水,一共为31ml水,自来水占1/312=1/963 所以倒掉后自来水占1/312=1/9635-4 计算15℃,97kPa下15g氯气的体积。
中山大学无机化学(上册)第5章习题答案汇总

第5章 溶液与电离平衡习题答案原子量取四位有效数字,计算过程采用“四舍六入五成双”取舍,热力学数据除题目给出外均引用自书后附录以及兰氏手册。
1. 实验室某些常用的试剂百分浓度及密度分别是:(1)浓盐酸:含HCl 37.0%,密度1.19 g ⋅cm -3;加至3位有效数字 (2)浓硫酸:含H 2SO 4 98.0%,密度1.98 g ⋅cm -3; (3)浓硝酸:含HNO 3 70.0%,密度1.42 g ⋅cm -3; (4)浓氨水:含NH 3 28.0%,密度0.900 g ⋅cm -3。
试分别计算它们的物质的量浓度。
解:(1) -33-3-131.19g cm 1000cm 37.0%12.0mol dm 36.5g mol 1.0dmn c V ⋅⨯⨯===⋅⋅⨯ (2)19.8 mol·dm -3(3)15.8 mol·dm -3 (4)14.8 mol·dm -3 2. 是非题(1) 0.10 mol .dm -3 HAc 溶液中c (H +) = 1.3⨯10-3 mol .dm -3,故0.050 mol .dm -3 HAc 溶液中c (H +) = 0.65⨯10-3 mol .dm -3;(2)向浓度均为0.10 mol .dm -3的NH 3⋅ H 2O- NH 4Cl 的缓冲溶液中,加入HCl 使c (HCl) = 0.099 mol .dm -3,则由于溶液的缓冲作用,pH 不变;(3)Na 2CO 3溶液中通入适量CO 2气体,便可得到一种缓冲溶液; (4)多元弱酸盐的水解(如Na 3PO 4),以第一步水解为主;(5)将浓度均为0.10 mol .dm -3的HAc 和NaAc 混合溶液冲稀至浓度均为0.05 mol .dm -3,则由于HAc 电离度增大,混合溶液的酸度降低; (6)在一定的温度下,改变溶液的pH ,水的离子积不变; (7)弱电解质的电离度随弱电解质浓度降低而增大;(8)NH 4Ac 为一元弱酸碱盐,水解程度很大,故其水溶液的酸碱性很大。
无机及分析化学课后习题第五章答案

一、选择题1.氢气与下列物质反应中,氢气不作为还原剂的是( )A. 单质硫单质硫B. 金属锂金属锂C. 四氯化钛四氯化钛D. 乙烯乙烯解:选B 。
氢原子与碱金属结合生成金属氢化物,氢原子能得到电子,是作为氧化剂参与反应。
应。
2.下列各组物质可共存于同一溶液中的是( )A. NH 4+ , H 2PO 4-, K + , Cl -, PO 43- B. Pb 2+ , NO 3-, Na + , SO 42- C. Al(OH) 3, Cl -, NH 4+, NH 3·H 2O D. Sn 2+ , H + , Cr 2O 72- , K +, Cl -解:选A 。
选项B 中Pb 2+,SO 42-能够生成沉淀PbSO 4; 选项C 中,强电解质的存在,会促进Al(OH) 3的凝聚。
选项D 中Sn2+ 与Cr 2O 72-在H +下会发生氧化还原反应。
只有A 中各离子不会发生反应,能够稳定存在。
子不会发生反应,能够稳定存在。
3.下列叙述正确的是(.下列叙述正确的是( )A. 22O H 分子构型为直线形分子构型为直线形B. 22O H 既有氧化性又有还原性既有氧化性又有还原性C. 22O H 的水溶液很稳定的水溶液很稳定D. 22O H 与722O Cr K 的酸性溶液反应生成稳定的5CrO解:选B 。
22O H 分子中存在过氧链—O —O —,过氧链在相当于书本的书脊位置上,而两个氢原子在半展开的两页纸面位置上,所以22O H 分子构型不是直线形。
22O H 的水溶液不稳定,遇杂质易分解。
22O H 与722O Cr K 的酸性溶液反应生成3Cr +。
22O H 中O 的氧化态居中,所以既22O H 既有氧化性又有还原性。
既有氧化性又有还原性。
4.地方性甲状腺肿大引起的原因是(.地方性甲状腺肿大引起的原因是( )A. 氟过多氟过多B. 碘过多碘过多C. 碘不足碘不足D. 维生素不足维生素不足解:选C 。
无机化学各章节第五章答案(新)
第五章 习题5-2用质子理论判断下列物质哪些是酸?并写出它的共轭碱。
哪些是碱?也写出它的共轭酸。
其中哪些既是酸又是碱?H 2PO 4-,CO 32-,NH 3,NO 3-,H 2O ,HSO 4-,HS -,HCl解:酸HCl ,HSO 4- 碱CO 32-,NO 3-, 既是酸又是碱NH 3,H 2PO 4-,H 2O ,HS -, 5-3氨水是一弱碱,当氨水浓度为0.200 mol .L -1时,NH 3H 2O 的离解度α为0.946%,问当浓度为0.100 mol .L -1时NH 3H 2O 时电离度α为多少?解:222211ααθc c K a == %423.010.0%)946.0(02.0222112=⨯==c c αα 5-4 0.01 mol ⋅L -1 HAc 溶液的解离度为4.2%,求同一温度下,HAc 的解离常数和溶液的pH值。
解:5221076.1%)2.4(01.0-⨯=⨯==αθc K a∵{θc c /}﹒)(HAc K a θ=0.01×1.76×10-5>61.1210-,{θc c /}/)(HAc K a θ=0.01/1.76×10-5>81.210∴θc H c /)(+=θθc c K a /=01.01076.15⨯⨯-=4.2×10-3 pH=2.385-5水溶液中,强酸与强碱反应的离子反应式为 H + + OH -= H 2O , 反应的标准平衡常数Kθ=θwK 1; 强酸与弱一元碱反应的离子反应式为 B -+ H + = HB , 反应的标准平衡常数K θ=θ)(1HB a K , 弱一元酸与强碱反应的离子反应式为 HB +OH -= B -+ H 2O , 反应的标准平衡常数K θ=θθwHB a K K )( ; 弱一元酸与弱一元碱反应的离子反应式为HA + B - = A -+HB , 反应的标准平衡常数K θ=θθ)()(HB a HA a K K 。
无机化学习题解答第五章
第五章氧化-还原反应无机化学习题解答(5)思考题1.什么是氧化数如何计算分子或离子中元素的氧化数氧化数是某一原子真实或模拟的带电数。
若某一原子并非真实得到若失去电子而带电荷,可以认为得到与之键合的电负性小于它的原子的电子或给予与之键合的电负性大于它的原子电子,然后计算出来的带电情况叫氧化数。
已知其他原子的氧化数,求某一原子的氧化数时可用代数和的方法,中性分子总带电数为零;离子总带电数为离子的电荷。
2.指出下列分子、化学式或离子中划线元素的氧化数:As2O3 KO2 NH4+ Cr2O72- Na2S2O3 Na2O2 CrO5 Na2PtCl6 N2H2 Na2S52.As2O3 +3,KO2 +1,NH4+ -3,Cr2O72-+3,Na2S2O3 +2,Na2O2 -1,CrO5 +10,Na2PtCl6 +4,N2H2 -1,Na2S5 -2/5,3.举例说明下列概念的区别和联系:⑴氧化和氧化产物⑵还原和还原产物⑶电极反应和原电池反应⑷电极电势和电动势3.⑴氧化是失去电子氧化数升高,所得氧化态较高产物即为氧化产物。
⑵还原是得到电子氧化数降低,所得氧化态较较产物即为还原产物。
⑶在某个电极上发生的反应为电极反应,分为正极的还原反应和负极的氧化反应,总反应为原电池反应。
⑷固体电极材料与所接触的溶液间的电势差即为该原电池的电极电势。
两电极构成原电池时两电极间的电势差为该原电池的电动势。
4.指出下列反应中何者为氧化剂,它的还原产物是什么何者为还原剂,它的氧化产物是什么⑴2FeCl3+Cu→FeCl2+CuCl2⑵Cu+CuCl2+4HCl→2H2[CuCl3]⑶Cu2O+H2SO4→Cu+CuSO4+H2O4.⑴氧化剂:FeCl3,还原产物:FeCl2,还原剂:Cu,氧化产物:CuCl2。
⑵氧化剂:CuCl2,还原产物:2H2[CuCl3],还原剂:Cu,氧化产物:2H2[CuCl3]。
⑶氧化剂:Cu2O,还原产物:Cu,还原剂:Cu2O,氧化产物:CuSO4。
高等无机化学课后习题答案第5章
第五章1.解释过渡金属的有机金属化合物的结构与金属d电子组态的关系:d6组态的有机金属化合物常采取六配位八面体结构;d8组态的采取五配位四方锥或三角双锥结构;d10组态的采取四配位四面体结构,并举出一些实例。
(提示:根据18电子规则)(P191)答:过渡金属有机金属化合物满足有效原子序数规则,即金属的全部电子数与所有配体提供的σ 电子的总和恰好等于金属所在周期中稀有气体的原子序数。
如果只考虑价层电子,那么金属价电子数加上配体σ 电子数的总和等于18 的分子是稳定的,即18 电子规则。
这一规则反映了过渡金属原子用它的5 个nd 轨道,一个(n+1)s 轨道和3个(n+1)p 轨道总共9个价轨道最大程度地成键,在每个价轨道中可容纳一对自旋相反的电子,共计18个电子形成稳定结构。
对于d6组态,其配位数为(18-6)/2 = 6 ,所以多采取六配位八面体结构,如[V(CO)6]-和Cr(CO)6等;对于d8组态,其配位数为(18-8)/2 = 5 ,所以采取五配位四方锥或三角双锥结构,如Fe(CO)5等;对于d10组态,其配位数为(18-10)/2= 4 ,所以采取四配位四面体结构,如Ni(CO)4等。
2.解释以下羰基伸缩振动频率的变化:[V(CO)6]-Cr(CO)5[Mn(CO)6]+cm-l1860 2000 2090答:配位化合物离子所带的电荷对νCO有影响,如上边的等电子系列中,负电荷增加,反馈作用增强,C≡O键削弱,使νCO 下降;反之正电荷阻止电173子从金属移向CO 的空轨道,反馈作用减弱,造成νCO 增加。
4.根据下列红外光谱图判断羰基的类型。
答:CO的不同配位方式可以通过红外光谱鉴定,已知中性分子中M-CO端基的CO伸缩振动频率在1900~2150cm-1范围内,而与正常双键性质相应的“酮式”CO,即μ2-桥基CO 的伸缩振动频率降低到1750~1850cm -1范围内,叁桥的μ3-CO 具有更低的伸缩振动频率。
大学无机化学第五章试题及解答
⼤学⽆机化学第五章试题及解答第五章原⼦结构和元素周期表本章总⽬标:1:了解核外电⼦运动的特殊性,会看波函数和电⼦云的图形2:能够运⽤轨道填充顺序图,按照核外电⼦排布原理,写出若⼲元素的电⼦构型。
3:掌握各类元素电⼦构型的特征4:了解电离势,电负性等概念的意义和它们与原⼦结构的关系。
各⼩节⽬标:第⼀节:近代原⼦结构理论的确⽴学会讨论氢原⼦的玻尔⾏星模型213.6E eV n =。
第⼆节:微观粒⼦运动的特殊性1:掌握微观粒⼦具有波粒⼆象性(h h P mv λ==)。
2:学习运⽤不确定原理(2h x P mπ≥)。
第三节:核外电⼦运动状态的描述1:初步理解量⼦⼒学对核外电⼦运动状态的描述⽅法——处于定态的核外电⼦在核外空间的概率密度分布(即电⼦云)。
2:掌握描述核外电⼦的运动状态——能层、能级、轨道和⾃旋以及4个量⼦数。
3:掌握核外电⼦可能状态数的推算。
第四节:核外电⼦的排布1:了解影响轨道能量的因素及多电⼦原⼦的能级图。
2;掌握核外电⼦排布的三个原则:○1能量最低原则——多电⼦原⼦在基态时,核外电⼦尽可能分布到能量最低的院⼦轨道。
○2Pauli 原则——在同⼀原⼦中没有四个量⼦数完全相同的电⼦,或者说是在同⼀个原⼦中没有运动状态完全相同的电⼦。
○3Hund 原则——电⼦分布到能量简并的原⼦轨道时,优先以⾃旋相同的⽅式分别占据不同的轨道。
3:学会利⽤电⼦排布的三原则进⾏第五节:元素周期表认识元素的周期、元素的族和元素的分区,会看元素周期表。
第六节:元素基本性质的周期性掌握元素基本性质的四个概念及周期性变化1:原⼦半径——○1从左向右,随着核电荷的增加,原⼦核对外层电⼦的吸引⼒也增加,使原⼦半径逐渐减⼩;○2随着核外电⼦数的增加,电⼦间的相互斥⼒也增强,使得原⼦半径增加。
但是,由于增加的电⼦不⾜以完全屏蔽增加的核电荷,因此从左向右有效核电荷逐渐增加,原⼦半径逐渐减⼩。
2:电离能——从左向右随着核电荷数的增多和原⼦半径的减⼩,原⼦核对外层电⼦的引⼒增⼤,电离能呈递增趋势。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第五章原子结构与元素周期律
1、下列说法是否正确,为什么?
(1)主量子数为1时,有两个方向相反的轨道;
(2)主量子数为2时,有2s,2p两个轨道;
(3)主量子数为2时,有4个轨道,即2s,2p,2d,2f;
(4)因为H原子中只有一个电子,故它只有一个轨道;
(5)当主量子数为2时,其角量子数只能取一个数,即l =1;
(6)任何原子中,电子的能量只与主量子数有关。
2、试判断下表中各元素原子的电子层中的电子数是否正确,错误的予以更正,并简要说明理由。
3、第6能级组有哪些能级?分别用量子数或轨道符号表示:
4、试讨论在原子的第4电子层(N)上:
(1)亚层数有多少?并用符号表示各亚层。
(2)各亚层上的轨道数分别是多少?该电子层上的轨道总数是多少?
(3)哪些轨道是等价轨道?
5、写出与下列量子数相应的各类轨道符号,并写出其在近似能级图中的前后能级所对应的符号:
(1)n=2, l=1
(2) n=3, l =2
(3) n=4, l =0
(4) n=4, l =3
6、在下列各项中,填入合适的量子数:
(1)n=?, l=2, m=0, m s=±1/2
(2)n=2, l=?, m=-1, m s=±1/2
(3)n=4, l=?, m=+2, m s=±1/2
(4)n=3, l=0, m=?, m s=±1/2
7、指出下列假设的电子运动状态(依次为n,l,m, m s),哪几种不可能存在?为什么?
(1)3,2,+2,+1/2 (2)2, 2, -2, +1/2
(3)2, 0, +1, -1/2 (4) 2, -1, 0, +1/2
(5) 4, 3, -1, 1
8、原子吸收能量由基态变成激发态时,通常是最外层电子向更高的能级跃迁。
试指出下列原子的电子排布中,哪些属于基态或激发态,哪些是错误的。
(1)1s2 2s2 2p1(2)1s2 2s2 2p62d1
(3) 1s22s22p43s1(4) 1s2 2s4 2p2
9、写出原子序数为45,52,79各元素的原子核外电子排布式及
其价层电子构型。
10、指出下列各原子中的未成对电子数:
(1)As (2) Sn (3) Mn (4) Ba
11、填充下表:
12、写出Ti,V,Cr原子的电子排布式,指出其电子在d轨道的排布情况。
如果各失去2个,成为Ti2+,V2+和Cr2+,其离子的电子排布式又如何?这种结果说明什么问题?
13、某元素的原子序数为35,试回答:
(1)其原子中的电子数是多少?有几个未成对电子?
(2)其原子中填有电子的电子层、能级组、能级、轨道各为多少?价电子数有几个?
(3)该元素属于第几周期、第几族?是金属还是非金属?最高氧化值是多少?
14、完成下表(不看周期表):
15、完成下表(不看周期表):
16、写出下列元素的名称,符号和核外电子排布式,并指出它们在周期表中的位置:
(1)第一种副族元素(2)第一种p区元素
(3)第一种ds区元素(4)第4周期的第6种元素
(5)最外层为5s1,次外层d轨道半充满的元素
(6)4p半充满的元素(7)第一种f区元素
(8)电负性最大的元素(9)原子半径最大的元素
(10)3d轨道全充满,4s轨道上有1个电子的元素
17、第4周期的某两元素,其原子失去3个电子后,在角量子数为2的轨道上的电子:(1)恰好填满(2)恰好半充满。
试推断对应两元素的原子序数和元素符号。
18、某元素原子的最外层上仅有1个电子,此电子的量子数是n=4,l=0,m=0,m s=+1/2(或-1/2)。
问:
(1)符合上述条件的元素可以有几种?原子序数各为多少?(2)写出相应元素的元素符号和电子排布式,并指出其价层电子结构及在周期表中的区和族。
19、不看周期表,试推断下列每组原子中哪一个原子具有较大的电负性值:
(1)17和19 (2)37和55 (3)8和14
20、有A,B,C,D四种元素,其价层电子数依次为1,2,6,7,其电子层数依次减少一层,已知D-的电子层结构与Ar原子相同,A和B的次外层各只有8个电子,C次外层有18个电子。
试判断这四种元素:
(1)原子半径由小到大的顺序;
(2)电负性由小到大的顺序;
(3)金属性由弱到强的顺序。
21、试讨论并解释:
(1)原子半径在短周期主族元素、d区元素和f区元素从左到右的变化特点;
(2)原子半径在主族各族和副族左半部分(即ⅢB~ⅦB)自上而下的变化特点。
22、写出周期表各族元素的价层电子构型通式,并简述其与各族元素最高氧化值的一般关系。
