酶学与酶工程复习资料
酶学与酶工程

Lecture1 酶学与酶工程1、酶的概念,命名、酶的活性中心1)酶是由活细胞产生的,具有催化活性和高度转移性的特殊蛋白质,是一类生物催化剂。
酶工程:将酶学理论与化工技术相结合,研究酶的产生和应用的一门新的技术性学科,包括了酶制剂的制备、酶的固定化、酶的修饰与改造及酶反应器等方面。
主要:酶的生产、酶的分离纯化、酶的固定化和酶生物反应器。
化学酶工程:用化学手段修饰、改造、模拟天然酶,使其更适合人们的需要,主要包括天然酶、化学修饰酶、固定化酶以及化学人工合成酶的研究与应用。
生物酶工程:用生物学的方法,特别是基因工程、蛋白质工程和组合库筛选法改造天然酶,创造性能优异的新酶,主要是抗体酶、杂合酶、进化酶和核酸酶的研究与应用。
2)命名:系统命名法!!催化下列反应酶的命名:ATP+D—葡萄糖→ADP+D—葡萄糖-6-磷酸该酶的正式系统命名是:ATP:葡萄糖磷酸转移酶,表示该酶催化从ATP中转移一个磷酸到葡萄糖分子上的反应。
它的分类数字是:E.C.2.7.1.1E.C代表按国际酶学委员会规定的命名第1个数字(2)代表酶的分类名称(转移酶类)第2个数字(7)代表亚类(磷酸转移酶类)第3个数字(1)代表亚亚类(以羟基作为受体的磷酸转移酶类)第4个数字(1)代表该酶在亚-亚类中的排号(D葡萄糖作为磷酸基的受体)3)活性中心必需基团:酶分子中氨基酸残基侧链的化学基团中,一些与酶活性密切相关的基因酶的活性中心:必需基团在空间结构上彼此靠近,组成具有特定空间结构的区域,能与底物特异结合并将底物转化为产物。
2、酶的分类、组成、结构特点和作用机制分类:按酶促反应的性质分类(六大类):氧化还原酶、转移酶、水解酶、裂解酶类、异构酶类、合成酶类全酶=酶蛋白+辅因子辅因子包括:有机辅因子(辅酶非共价结合/辅基非共价结合或共价结合)和金属辅因子(金属酶/金属激活酶)酶蛋白的分类:3、酶作为催化剂的显著特点强大的催化能力:可以加快至1017倍;没有副反应,酶在较温和的条件下催化反应的进行;高度的专一性,各种酶都有专一性但是专一程度的严格性上有所差别;可调节性,包括了抑制剂和激活剂的调节、反馈抑制调节、共价修饰调节和变构调节等;易变性,大多数的酶是蛋白质,在极端环境中会受到破坏。
(完整版)酶学与酶工程总结
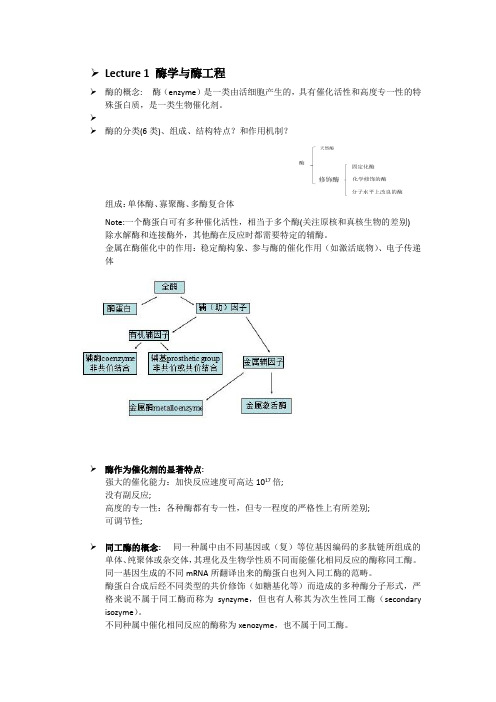
➢Lecture 1 酶学与酶工程➢酶的概念:酶(enzyme)是一类由活细胞产生的,具有催化活性和高度专一性的特殊蛋白质,是一类生物催化剂。
➢➢酶的分类(6类)、组成、结构特点?和作用机制?组成:单体酶、寡聚酶、多酶复合体Note:一个酶蛋白可有多种催化活性,相当于多个酶(关注原核和真核生物的差别) 除水解酶和连接酶外,其他酶在反应时都需要特定的辅酶。
金属在酶催化中的作用:稳定酶构象、参与酶的催化作用(如激活底物)、电子传递体➢酶作为催化剂的显著特点:强大的催化能力:加快反应速度可高达1017倍;没有副反应;高度的专一性:各种酶都有专一性,但专一程度的严格性上有所差别;可调节性;➢同工酶的概念:同一种属中由不同基因或(复)等位基因编码的多肽链所组成的单体、纯聚体或杂交体,其理化及生物学性质不同而能催化相同反应的酶称同工酶。
同一基因生成的不同mRNA所翻译出来的酶蛋白也列入同工酶的范畴。
酶蛋白合成后经不同类型的共价修饰(如糖基化等)而造成的多种酶分子形式,严格来说不属于同工酶而称为synzyme,但也有人称其为次生性同工酶(secondary isozyme)。
不同种属中催化相同反应的酶称为xenozyme,也不属于同工酶。
➢酶的活性中心指必需基团在空间结构上彼此靠近,组成具有特定空间结构的区域,能与底物特异结合并将底物转化为产物必需基团(essential group):酶分子中氨基酸残基侧链的化学基团中,一些与酶活性密切相关的基团。
活性中心内的必需基团:结合基团(与底物相结合)和催化基团(催化底物转变成产物)活性中心外的必需基团:维持酶活性中心应有的空间构象所必需;构成酶活性中心的常见基团:His的咪唑基、Ser的-OH、Cys的-SH、Glu的γ-COOH。
➢酶的作用机制➢酶活力的调节➢酶的应用食品加工方面:生物技术在食品工业中应用的代表就是酶的应用,目前已经有几十种酶成功用于食品工业。
如葡萄糖、饴糖、果葡糖浆的生产、蛋白质制品加工、果蔬加工、食品保鲜以及改善食品品质与风味等。
酶与酶工程考试复习资料

试述酶生物合成的基本过程。
RNA的生物合成——转录:(1)转录的起始(2)RNA链的延伸(3)RNA链合成的终止(4)RNA前体的加工蛋白质生物合成——翻译:(1)氨基酸活化生成氨酰—tRNA(2)肽链合成的起始(3)肽链的延伸(4)肽链合成的终止(5)蛋白质前体的加工酶的生物合成有那几种模式:同步合成型:同步合成型是酶的生物合成与细胞生长同步进行的一种酶生物合成模式。
该类型酶的生物合成速度与细胞生长速度紧密联系,又称为生长偶联型延续合成型:延续合成型是酶的生物合成在细胞的生长阶段开始,在细胞生长进入平衡期后酶还可以延续合成一段较长时间的酶生物合成模式。
属于该类型的酶可以是组成酶也可以是诱导酶。
中期合成型:中期合成型酶在细胞生长一段时间以后才开始,而在细胞生长进入平衡期以后,酶的生物合成也随之停止。
滞后合成型:滞后合成型酶是在细胞生长一段时间或者进入平衡期以后才开始其生物合成并大量积累,又称为非生长偶联型。
如何控制微生物发酵产酶的工艺条件:1、细胞活化与扩大培养;选育得到的优良的产酶微生物必须采取妥善的方法进行保藏。
常用的保藏方法有斜面保藏法、沙土管保藏法、真空冷冻干燥保藏法、低温保藏发法、石蜡油保藏法等,可以根据需要和可能进行选择,以尽可能保持细胞的生长、繁殖和产酶特性2、培养基的配置;在设计和配制培养基时,首先要根据不同细胞和不同用途的不同要求,确定各种组分的种类和含量,并要调节至所需的PH,以满足细胞生长、繁殖和新陈代谢的需要。
3、PH的调节控制;培养基的PH与细胞的生长繁殖以及发酵产酶关系密切,在发酵过程中必须进行必要的调节控制。
4、温度的调节控制;细胞的生长、繁殖和发酵产酶需要一定的温度条件。
在一定的温度范围内,细胞才能正常生长、繁殖和维持正常的新陈代谢。
5、溶解氧的调节控制;细胞的生长、繁殖和酶的生物合成过程需要大量的能量。
为了获得足够多的能量,细胞必须获得充足的氧气,使从培养基中获得的能源物质(一般是指各种碳源)经过有氧降解而生成大量的A TP。
酶学与酶工程重点总结

酶学与酶⼯程重点总结第⼆章酶学基础⼀、酶的活性中⼼(active center,active site)(⼀)活性中⼼和必需基团1、与酶活性显⽰有关的,具有结合和催化底物形成产物的空间区域,叫酶的活性中⼼,⼜叫活性部位。
2、活性中⼼可分为结合部位和催化部位。
3、结合部位决定酶的专⼀性,催化部位决定酶所催化反应的性质。
4、酶结构概述(1)活性中⼼是⼀个三维实体。
(2)是有⼀些⼀级结构上可能相距较远的氨基酸侧链基团组成,有的还包含辅酶或辅基的某⼀部分基团。
(3)在酶分⼦表⾯呈裂缝状。
(4)酶活性中⼼的催化位点和结合位点可以不⽌⼀个。
(5)酶活性中⼼的基团都是必需基团,但必需基团还包括活性中⼼以外的基团。
5、酶分⼦中的氨基酸残基或其侧链基团可以分为四类1.接触残基2.辅助残基3.结构残基4.⾮贡献残基(⼆)酶活性中⼼中的化学基团的鉴别1.⾮特异性共价修饰:某些化学试剂能使蛋⽩质中氨基酸残基的侧链基团反应引起共价结合、氧化或还原修饰反应,使基团结构和性质发⽣变化。
如果某基团修饰后不引起酶活⼒的变化,就可初步认为此基团可能是⾮必需基团;反之,如修饰后引起酶活⼒的降低或丧失,则此基团可能是酶的必需基团。
2.亲和标记共价修饰剂是底物的类似物,可专⼀性地引⼊酶的活性中⼼,并具有活泼的化学基团(如卤素),可与活性中⼼的基团形成稳定的共价键。
因其作⽤机制是利⽤酶对底物类似物的亲和性⽽将酶共价标记的,故称为亲和标记。
3.差别标记在过量底物或可逆抑制剂遮蔽活性中⼼的情况下,加⼊共价修饰剂,使后者只修饰活性中⼼以外的有关基团;然后去除底物或可逆抑制剂,暴露活性中⼼,再⽤同位素标记的向⼀修饰剂作⽤于活性中⼼的同类基团;将酶⽔解后分离带有同位素的氯基酸,即可确定该氨基酸参与活性中⼼。
4.蛋⽩质⼯程这是研究酶必需基闭和活性中⼼的最先进⽅法,即将酶蛋⽩相应的互补DNA(cDNA)定点突变,此突变的cDNA表达出只有⼀个或⼏个氨基酸被置换的酶蛋⽩,再测定其活性,可以知道被置换的氨基酸是否为活⼒所必需。
酶工程复习资料一

酶工程复习资料一酶工程(Enzyme Engineering)是研究和应用酶的性质、结构和功能,以及改造和设计酶的方法和技术的学科。
它是生物工程的重要分支之一,与生物技术、食品工程、医药工程等领域密切相关。
本篇文档将为读者提供关于酶工程的基本概念、酶的结构与功能、酶的改造和设计等内容的复习资料。
一、酶工程的基本概念酶是生物体内的催化剂,能够在相对较低的温度和压力下加速化学反应速率。
酶工程是指利用化学和生物学的原理和方法,对酶进行改造和优化,使其在特定条件下具有更高的催化活性和稳定性。
酶工程的研究内容主要包括酶的筛选与鉴定、酶的改造与优化、酶的应用与产业化等方面。
二、酶的结构与功能酶是由蛋白质组成的,具有特定的空间结构和功能部位。
酶的空间结构由其氨基酸序列决定,而功能部位则与其所催化的反应类型相关。
酶通过与底物结合形成酶底物复合物,从而降低反应的活化能,加速反应的进行。
酶的催化活性受到pH、温度、离子浓度等环境因素的影响,最适条件下表现出最高的催化效率。
三、酶的改造与优化为了使酶具有更好的催化性能和稳定性,科学家们通过酶的改造与优化来实现这一目标。
常用的方法包括基因工程技术、蛋白工程技术、酶体外修饰等。
基因工程技术可以通过改变酶的基因序列来改变其氨基酸组成,进而改变酶的结构和功能。
蛋白工程技术则可以通过局部改变酶的氨基酸序列来提高酶的催化活性和稳定性。
酶体外修饰则是指在酶的外部添加辅助因子或改变环境条件来改善酶的催化效果。
四、酶的应用与产业化酶在生物技术、医药、食品、农业等领域具有广泛的应用前景。
在生物技术领域,酶被广泛应用于基因工程、蛋白质表达、酶联免疫法等技术中。
在医药领域,酶被应用于药物合成、药物代谢等方面。
在食品和农业领域,酶被应用于食品加工、酿酒、饲料添加等。
酶学与酶工程复习资料

酶学与酶工程复习资料上一届考试试题一、名字解释1、酶的活性中性:酶分子中直接与底物结合,并和酶催化作用直接有关的区域叫酶的活性中心,参与构成酶的活性中心和维持酶的特定构象所必需的基团为酶的必需基团。
2、米式方程及各字母的意义:米氏方程表示一个酶促反应的起始速度v与底物浓度S关系的速度方程,v=V max·S/(K m+S).其中 K m值称为米氏常数,V max是酶被底物饱和时的反应速度,[S]为底物浓度。
由此可见K m值的物理意义为反应速度(v)达到1/2V max时的底物浓度(即K m=[S]),单位一般为mol/L,只由酶的性质决定,而与酶的浓度无关.3、别构效应:一个蛋白质与其配体(或其他蛋白质)结合后,蛋白质的空间结构发生改变,使它适用于功能的需要,这一类变化称为别构效应或变构效应。
4、遗传密码:遗传密码决定蛋白质中氨基酸顺序的核苷酸顺序,由3个连续的核苷酸组成的密码子所构成.5、盐析:增加中性盐浓度使蛋白质、气体、未带电分子溶解度降低的现象。
是蛋白质分离纯化中经常使用的方法,最常用的中性盐有硫酸铵、硫酸钠和氯化钠等。
6、内囊性包埋法:系利用天然的或合成的高分子材料(统称为囊材)作为囊膜壁壳,将固态或液态药物包裹成为的药库型微型胶囊。
7、固定化酶:水溶性酶经物理或化学方法处理后,成为不溶于水的但仍具有酶活性的一种酶的衍生物。
在催化反应中以固相状态作用于底物。
8、必需水:维持酶分子完整的空间构象所必需的最低水量.二、问答题1、温度对酶促反应的影响及原因。
答:温度对酶促反应的影响包括两方面:一方面是当温度升高时,反应速度也加快,这与一般化学反应相同。
另一方面,随温度升高而使酶逐步变性,即通过减少有活性的酶而降低酶的反应速度。
在低于最适温度时,前一种效应为主,在高于最适温度时,则后一种效应为主,因而酶活性丧失,反应速度下降。
2、操纵子的定义及组成。
答:操纵子:指启动基因、操纵基因和一系列紧密连锁的结构基因的总称,基因表达的协同单位,转录的功能单位。
酶工程 复习资料

第一章绪论1.何谓酶工程,试述其主要内容和任务。
酶的生产、改性与应用的技术过程称为酶工程。
酶工程的主要内容包括:微生物细胞发酵产酶,动植物细胞培养产酶,酶的提取与分离纯化,酶分子修饰,酶、细胞、原生质体固定化,酶非水相催化,酶定向进化,酶反应器和酶的应用等。
酶工程的主要任务是经过预先设计,通过人工操作获得人们所需的酶,并通过各种方法使酶的催化特性得以改进,充分发挥其催化功能。
2.酶有哪些显著的催化特性?酶是生物催化剂,与非酶催化剂相比,具有专一性强、催化效率高和作用条件温和等显著特点。
3.简述影响酶催化作用的主要因素。
酶的催化作用受到底物浓度、酶浓度、温度、pH、激活剂浓度、抑制剂浓度等诸多因素的影响。
5.简述酶活力单位的概念和酶活力的测定方法。
酶活力单位:在特定条件下(温度可采用25℃,pH等条件均采用最适条件),每1min催化1μmol的底物转化为产物的酶量定义为1个酶活力单位,这个单位称为国际单位(IU)。
在特定条件下,每秒催化1mol底物转化为产物的酶量定义为1卡特(kat)酶活力的测定方法:振荡测定法,酶柱测定法,连续测定法,固定化酶的比活力测定,酶结合效率与酶活力回收率的测定,相对酶活力的测定。
或者测定方法:化学测定法、光学测定法、气体测定法其它.酶的发展历史:4000多年前的夏禹时代——酿酒技术。
3000多年前的周朝——制造饴糖、食酱等食品。
1833年——佩恩和帕索兹从麦芽的水抽提物中得到淀粉酶。
19世纪中叶——巴斯德对酵母的乙醇发酵进行研究。
1913年——米彻利斯和曼吞根据中间产物学说,推导出米氏方程。
1926年——萨姆纳得到脲酶结晶,并证明它具有蛋白质的性质。
1960年——雅各和莫诺德提出操纵子学说。
1982年——切克发现核酸类酶。
1983年——阿尔特曼发现核糖核酸酶P的RNA 部分M1RNA具有核糖核酸酶P的催化活性。
酶的专一性分为绝对专一性和相对专一性。
相对专一性又可分为键专一性和基团专一性米氏方程:酶的可逆性抑制作用可以分为竞争性抑制、非竞争性抑制和反竞争性抑制。
酶工程期末复习资料

酶⼯程期末复习资料酶⼯程期末复习资料名词解释:1.酶⼯程:⼜称为酶技术,是指酶的⽣产与应⽤的技术过程。
2.酶的⽣产:通过各种⽅法获得⼈们所需的酶的技术过程。
3.酶的改性:是通过各种⽅法改进酶的催化特性的技术过程。
4.酶的应⽤:是在特定的条件下通过酶的催化作⽤,获得⼈们所需的产物、除去不良物质或获得所需信息的技术过程。
5.酶⼯程的主要任务:经过预先设计,通过⼈⼯操作,获得⼈们所需的酶,并通过各种⽅法使酶充分发挥其催化功能。
6.酶活⼒:指在⼀定条件下,酶所催化的反应初速度。
7.酶活⼒单位:在特定条件下(温度可采⽤25℃,pH等条件均采⽤最适条件),每1 min 催化1 µmol 的底物转化为产物的酶量定义为1 个酶活⼒单位。
或在特定条件下,每秒催化1 mol底物转化为产物的酶量定义为1卡特(Kat)。
1 Kat =6×107 IU8.酶的⽐活⼒:是酶纯度的⼀个指标,是指在特定条件下,单位重量(mg)蛋⽩质或RNA所具有的酶活⼒单位数。
9.酶的转换数:Kp,⼜称为摩尔催化活性,是指每个酶分⼦每分钟催化底物转化的分⼦数。
即是每摩尔酶每分钟催化底物转化为产物的摩尔数。
10.酶的催化周期: 转换数的倒数称为酶的催化周期。
催化周期是指酶进⾏⼀次催化所需的时间。
11.固定化酶: 固定在载体上并在⼀定空间范围内进⾏催化反应的酶。
12.酶的结合效率:⼜称为酶的固定化率,是指酶与载体结合的百分率。
13.酶活⼒回收率:是指固定化酶的总活⼒与⽤于固定化的总游离酶活⼒的百分率。
14.相对酶活⼒:具有相同酶蛋⽩(或酶RNA)量的固定化酶活⼒与游离酶活⼒的⽐值称为相对酶活⼒。
15.酶的定向进化技术:模拟⾃然进化过程(随机突变和⾃然选择)在体外进⾏酶基因的⼈⼯随机突变,建⽴突变基因⽂库,在⼈⼯控制条件的特殊环境下,定向选择得到具有优良催化特性的酶的突变体的技术过程。
16.酶的提取分离法⽣产:是采⽤各种技术从动物、植物、微⽣物细胞或者其它含酶原料中将酶提取出来,再与所含杂质进⾏分离的技术过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酶学与酶工程复习资料
上一届考试试题
一、名字解释
1、酶的活性中性:酶分子中直接与底物结合,并和酶催化作用直接有关的区域叫酶的活性中心,参与构成酶的活性中心和维持酶的特定构象所必需的基团为酶的必需基团。
2、米式方程及各字母的意义:米氏方程表示一个酶促反应的起始速度v与底物浓度S关系的速度方程,v=V max·S/(K m+S)。
其中 K m值称为米氏常数,V max是酶被底物饱和时的反应速度,[S]为底物浓度。
由此可见K m值的物理意义为反应速度(v)达到1/2V max时的底物浓度(即K m=[S]),单位一般为mol/L,只由酶的性质决定,而与酶的浓度无关。
3、别构效应:一个蛋白质与其配体(或其他蛋白质)结合后,蛋白质的空间结构发生改变,使它适用于功能的需要,这一类变化称为别构效应或变构效应。
4、遗传密码:遗传密码决定蛋白质中氨基酸顺序的核苷酸顺序,由3个连续的核苷酸组成的密码子所构成。
5、盐析:增加中性盐浓度使蛋白质、气体、未带电分子溶解度降低的现象。
是蛋白质分离纯化中经常使用的方法,最常用的中性盐有硫酸铵、硫酸钠和氯化钠等。
6、内囊性包埋法:系利用天然的或合成的高分子材料(统称为囊材)作为囊膜壁壳,将固态或液态药物包裹成为的药库型微型胶囊。
7、固定化酶:水溶性酶经物理或化学方法处理后,成为不溶于水的但仍具有酶活性的一种酶的衍生物。
在催化反应中以固相状态作用于底物。
8、必需水:维持酶分子完整的空间构象所必需的最低水量。
二、问答题
1、温度对酶促反应的影响及原因。
答:温度对酶促反应的影响包括两方面:一方面是当温度升高时,反应速度也加快,这与一般化学反应相同。
另一方面,随温度升高而使酶逐步变性,即通过减少有活性的酶而降低酶的反应速度。
在低于最适温度时,前一种效应为主,在高于最适温度时,则后一种效应为主,因而酶活性丧失,反应速度下降。
2、操纵子的定义及组成。
答:操纵子:指启动基因、操纵基因和一系列紧密连锁的结构基因的总称,基因表达的协同单位,转录的功能单位。
很多功能上相关的基因前后相连成串,由一个共同的控制区进行转录的控制,包括结构基因以及调节基因的整个DNA 序列。
操纵子通常由2个以上的编码序列与启动序列、操纵序列以及其他调节序列在基因组中成簇串联组成。
3、蛋白质合成过程当中的主要物质。
答:主要为mRNA、tRNA、氨基酸、核糖核蛋白体以及有关的酶和辅助因子。
蛋白质合成是以mRNA为模板,以氨基酸为底物,在核糖体上通过各种tRNA、酶和辅助因子的作用,合成多肽链的过程。
4、酶生物合成模式有哪几种及其特点?简述其接近理想模式的方法?
答:1、同步合成型:酶的生物合成与细胞生长同步进行的一种酶生物合成模式。
该类型酶的
生物合成速度与细胞生长速度紧密联系,又称为生长偶联型。
2、延续合成型:酶的生物合成在细胞的生长阶段开始,在细胞生长进入平衡期后,酶还可以延续合成一段较长时间。
3、中期合成型:酶在细胞生长一段时间以后才开始,而在细胞生长进入平衡期以后,酶的生物合成也随着停止。
4、滞后合成型:酶是在细胞生长一段时间或者进入平衡期以后才开始其生物合成并大量积累,又称为非生长偶联型,许多水解酶的生物合成都属于这一类型。
在酶的发酵生产中,为了提高产酶率和缩短发酵周期,最理想的合成模式应是延续合成型。
属于延续合成型的酶,在发酵过程中没有生长期和产酶期的明显差别。
细胞一开始生长就有酶产生,直至细胞生长进入平衡期以后,酶还可以继续合成一段较长的时间。
对于其他合成模式的酶,可以通过基因工程\细胞工程等先进技术,选育得到优良的菌株, 并通过工艺条件的优化控制, 使他们的生物合成模式更加接近于延续合成型。
其中对于同步合成型的酶,要尽量提高其对应的mRNA的稳定性,为此适当降低发酵温度是可取的措施;对于滞后合成型的酶,要设法降低培养基中阻遏物的浓度,尽量减少甚至解除产物阻遏或分解代谢物阻遏作用,使酶的生物合成提早开始;而对于中期合成型的酶,则要在提高mRNA的稳定性以及解除阻遏两方面考虑,使其生物合成的开始时间提前,并尽量延迟其生物合成停止的时间。
5、举例说明生物酶制剂生产工艺流程。
答:一、植物细胞培养的工艺流程:外植体→细胞的获取→细胞培养→分离纯化→产物。
植物细胞培养产酶的工艺过程——大蒜细胞培养生产超氧化物歧化酶(SOD):1、大蒜愈伤组织的诱导:打破休眠的大蒜蒜瓣,去除外皮消毒在无菌条件下,将蒜瓣切成0.5cm3左右的小块,植入培养基中,25℃、600lux、12h/d光照的条件下培养18d,诱导得到愈
伤组织。
2、大蒜细胞悬浮培养:愈伤组织在无菌条件下转入培养基中,加入灭菌玻璃珠,25℃、600lux、12h/d的光照条件下震荡培养10~12d,使愈伤组织分散成为小细胞团或单细胞筛网将小细胞团或单细胞转入新培养基中,光照培养。
3、超氧化物歧化酶的分离纯化:收集细胞,经过细胞破碎,用pH7.8 的磷酸缓冲液提取、有机溶剂沉淀等,分离得到超氧化物歧化酶。
二、动物细胞培养产酶的工艺过程——人黑色素瘤细胞培养生产组织纤溶酶原活化剂:1、人黑色素瘤细胞培养基。
2、人黑色素瘤细胞培养:(1)细胞的种子细胞用胰蛋白酶消化处理:细胞分散、洗涤、记数、稀释成细胞悬浮液。
(2)接种浓度为(1~3 )×103个细胞/mL,于37 ℃的CO2培养箱中,通入含5%CO2的无菌空气,培养至长成单层致密细胞。
(3)倾去培养液,用pH7.4 的磷酸缓冲液洗涤细胞2~3次。
(4)换入一定量的无血清Eagle培养液,继续培养。
(5)每隔3~4d,取出培养液进行tPA的分离纯化。
(6)再向反应器中加入新鲜的无血清Eagle培养液,继续培养,以获得大量tPA。
3、组织纤溶酶原活化剂的分离纯化:在获得培养液中加入一定量的蛋白酶抑制剂和表面活性剂,过滤去沉淀,适当稀释后,采用亲和层析技术进行分离(以tPA抗体为配基,以溴化氰活化的琼脂糖凝胶为母体制成亲和层析剂,上柱、洗涤后用3mol/L KSCN溶液洗脱,分部收集),得到tPA溶液。
经过浓缩、葡聚糖G-150凝胶层析、冷冻干燥,得到精制tPA干粉。
6、简述各种层析方法及其原理。
答:。
