酸碱性和pH、溶液的酸碱性与生活的关系
有机化学基础知识酸碱性和pH值的概念

有机化学基础知识酸碱性和pH值的概念有机化学基础知识:酸碱性和pH值的概念在有机化学中,酸碱性和pH值是非常重要的概念。
它们不仅与化学反应的进行密切相关,还对生物体的正常功能和环境的维持发挥着重要作用。
本文将介绍有机化学中酸碱性和pH值的基本概念、测定方法以及相关应用。
一、酸碱性的基本概念在有机化学中,酸碱性是指物质在溶液中释放或捕获氢离子的能力。
酸是指能够释放氢离子(H+)的物质,而碱是指能够接受或捕获氢离子的物质。
酸和碱之间的反应被称为酸碱反应,产生的产物称为盐和水。
酸碱性可以用酸度(acidicity)和碱度(basicity)来描述。
酸度表示酸的强弱,越强的酸酸度越高;碱度表示碱的强弱,越强的碱碱度越高。
酸度和碱度之和常常为0,即酸碱中和。
二、pH值的概念pH值是描述溶液酸碱性强弱的负对数指标。
它用来表示溶液中氢离子的浓度,也反映了溶液的酸碱性。
pH值的定义如下:pH = -log10[H+],其中[H+]表示溶液中氢离子的浓度。
pH值通常在0到14之间,其中7被认为是中性的,小于7的溶液被认为是酸性的,大于7的溶液被认为是碱性的。
pH值越低,溶液越酸性;pH值越高,溶液越碱性。
三、酸碱性的测定方法1. 酸碱指示剂法:酸碱指示剂是一种可以根据其颜色变化来判断溶液酸碱性质的物质。
常见的酸碱指示剂有酚酞、甲基橙等。
通过加入酸碱指示剂,溶液的颜色变化可以帮助我们判断溶液的酸碱性。
2. pH试纸法:pH试纸是一种可以根据其颜色变化来快速测定溶液pH值的方法。
将pH试纸浸入溶液中,根据试纸变色可以判断溶液的pH值范围。
3. pH计测定法:pH计是一种通过测量溶液中电离氢离子浓度来确定pH值的仪器。
通过电极与溶液接触,测量溶液中的电位差,然后根据之前的校准曲线可以确定溶液的pH值。
四、酸碱性的应用酸碱性在有机化学中有着广泛的应用。
以下是几个常见的应用:1. 酸催化反应:许多有机化学反应需要在酸性条件下进行。
初三化学第三章溶液的酸碱性B
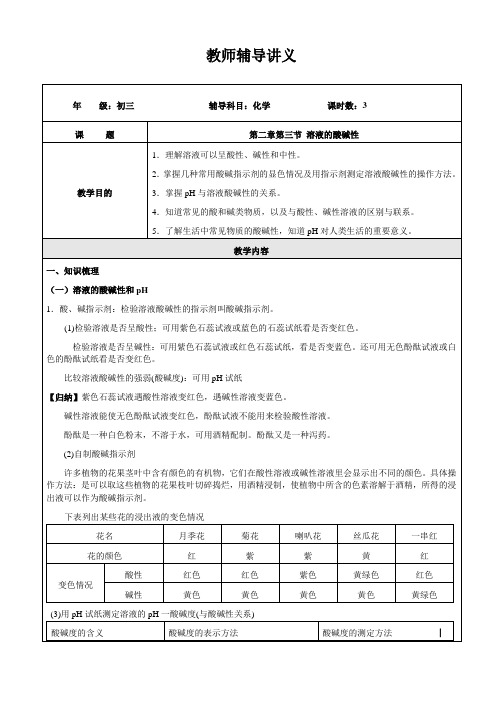
教师辅导讲义15.某溶液的pH=5,要使溶液的pH增大到8,可向此溶液中加入( )A.KNO3溶液B.KOH溶液C.H2SO4溶液D.蒸馏水16.向滴有酚酞的NaOH溶液中,逐渐滴入稀硫酸至过量,下面叙述正确的是( )A.溶液由红色变为无色,pH逐渐增大B.溶液由无色变为红色,pH逐渐减小C.溶液由红色变为无色,pH逐渐减小D.溶液颜色不变,pH逐渐增大17.一些食物的近似pH为:①苹果2.9~3.3;②葡萄3.5~4.5;③番茄4.0~4.4;④鸡蛋清7.6~8.0这些食物中,胃酸过多的病人不宜多食的是( )A.仅④B.仅①②C.仅①②③D.①②③④18.现要测定某溶液的pH,使用pH试纸,若事先用水把试纸润湿再测pH,则实际测得值与真实值比较( )A.变大B.变小C.不变D.无法确定19.下列实验室中溶液的pH随加入试剂体积而变化的关系与图中相符的是( )A.稀硫酸中不断滴人氢氧化钠溶液B.碳酸钠溶液不断滴入盐酸C.稀硫酸中不断滴入蒸馏水D.氢氧化钠溶液中不断滴人蒸馏水20.下列说法中正确的是( )①酸溶液一定显酸性②酸性溶液一定是酸溶液③碱溶液一定显碱性④碱性溶液一定是碱溶液A.①②B.①③C.②④D.③④21.溶液的酸碱度常用________来表示,其范围通常在________之间,当________时,溶液显碱性;________越大,碱性越________ (填“强”或“弱”)并能使紫色石蕊试液变________色,无色酚酞试液变________色,举二例:________、________。
22.将生石灰,氯化氢、氯化钠、二氧化碳,氨气分别溶于水,再滴入几滴石蕊试液,pH>7的溶液是________,石蕊试液呈________色;pH<7的溶液是________,石蕊试液呈________色;pH=7的溶液________,石蕊试液呈________色。
23.自然界的水,经测定其pH略小于7,说明略显________性。
初三化学酸碱盐知识点(最全整理版)

初三化学酸碱盐知识点(最全整理版)一、酸性溶液和碱性溶液结论:〔1〕但凡能使紫色石蕊试液变红的溶液都是酸性溶液,并且该溶液不能使无色酚酞试液变色;〔2〕但凡能使紫色石蕊试液变蓝的溶液都是碱性溶液,并且该溶液能使无色酚酞试液变红;〔3〕不能使紫色石蕊试液变色,也不能使无色酚酞试液变色的溶液,我们称为中性溶液。
〔4〕如紫色石蕊试液及无色酚酞等能检验溶液酸碱性的试液,称为酸碱指示剂。
注意:①我们有时候还用蓝色或红色石蕊试纸来检验溶液的酸碱性;②酸性溶液能使蓝色石蕊试纸变红,碱性溶液能使红色石蕊试纸变蓝;③只有可溶性的酸性、碱性物质才能使指示剂变色,变色的是指示剂,而不是该物质。
2.日常生活中常见的酸性物质与碱性物质〔1〕酸性物质:山楂、柠檬、柑橘、西红柿等;〔2〕碱性物质:茶叶碱、烟碱等。
3.区分酸溶液和酸性溶液、碱溶液和碱性溶液注意:酸溶液是指酸的水溶液,酸性溶液是指能使紫色石蕊试液变红的溶液,因此酸溶液一定是酸性溶液,而酸性溶液不一定是酸溶液;同样,碱性溶液不一定是碱溶液,碱溶液一定是碱性溶液。
例如:硫酸铜、氯化铵的水溶液显酸性,而不是酸;纯碱、肥皂的水溶液显碱性,但不是碱。
4.补充知识:酸、碱、盐的概念〔1〕酸:电离时生成的阳离子全部是氢离子的化合物。
如:HCl、HNO3、H2SO4、H2CO3等。
HCl==H++Cl-;H2SO4==2H++SO42-;〔2〕碱:电离时生成的阴离子全部是氢氧根离子的化合物。
如:NaOH、Ca(OH)2等。
NaOH==Na++OH-;Ca(OH)2==Ca2++2OH-;〔3〕盐:电离时生成金属离子〔或铵根离子〕和酸根离子的化合物。
如:NaCl、NH4NO3等。
NaCl==Na++Cl-;NH4NO3==NH4++NO3-;二、溶液的酸碱性的强弱1.酸碱度:用来表示溶液的酸性或碱性的强弱程度。
2.pH试纸用来定量的测定溶液的酸碱度。
溶液的pH值与酸碱性关系:pH=7,溶液呈中性;pH7,溶液呈碱性,且pH越大,碱性越强。
化学物质的酸碱酸度

化学物质的酸碱酸度化学物质的酸碱性质在很多领域都有重要的应用。
酸碱性是指物质在溶液中的离子化程度和氢离子(H+)或氢氧根离子(OH-)的浓度。
本文将介绍化学物质的酸碱度以及它们在生活和工业中的应用。
一、酸碱度的定义酸碱度是指溶液中酸性或碱性的强弱程度,它可以通过pH值来表示。
pH值的定义为负对数,即pH = -log[H+]。
当溶液中的[H+]浓度较高时,pH值较低,说明溶液更酸性;反之,当溶液中的[H+]浓度较低时,pH值较高,说明溶液更碱性。
二、物质的酸碱性质酸性物质具有以下特征:酸性物质在溶液中能够释放出氢离子(H+),从而降低溶液的pH值。
常见的酸性物质包括硫酸、盐酸和硝酸等。
酸性物质可以与碱性物质发生中和反应,生成盐和水。
碱性物质具有以下特征:碱性物质在溶液中能够释放出氢氧根离子(OH-),从而增加溶液的pH值。
常见的碱性物质包括氢氧化钠、氢氧化钙和氨水等。
碱性物质可以与酸性物质发生中和反应,生成盐和水。
中性物质的pH值在7附近,既不酸性也不碱性。
水是最常见的中性物质,其pH值为7。
三、酸碱度的测量方法酸碱度可以通过使用酸碱指示剂或pH计来测量。
酸碱指示剂是一种能够根据酸碱溶液的性质改变颜色的化学物质,比如酚酞指示剂、甲基橙指示剂等。
根据溶液的颜色变化,可以确定溶液的酸碱性质。
pH计则可以直接测量溶液中的pH值,通过电极测量氢离子浓度从而得到pH值。
四、酸碱度的应用1. 生活中的应用酸碱性在生活中有许多应用。
例如,我们常用酸性清洁剂来去除油垢和细菌,因为酸性物质可以有效地破坏细菌的细胞结构。
另外,在烹饪中,我们使用柠檬汁和醋来调味或处理食材,这些食品都属于酸性物质。
2. 工业中的应用酸碱性在工业中也有广泛的应用。
例如,电池中常用的酸性电解液可以产生电能。
另外,纺织业使用酸性染料来着色纤维,而水处理厂使用碱性物质去除水中的杂质。
此外,制药业、化工业和金属加工业等也都离不开对酸碱性的控制,以确保产品质量。
pH与生活课件生活中物质的酸碱性

1、你知道生活中我们吃的和用的一些物质哪 些是酸性的?哪些是碱性的? 2、有什么方法可以既简单又方便地测定物质 的酸碱性? 3、在生活、生产和科学研究中,有时仅知道 溶液是酸性还是碱性是不够的,经常还需要 知道溶液的酸碱强弱程度,那么怎样表示和 测定溶液的酸碱度呢?
pH与生活
学习目标:
1、物质的酸碱性强弱可用pH的高低来 表示。
2、会用pH试纸和标准比色卡测定物质 酸碱性的强弱。
3、酸碱性的强弱程度的, 简称酸碱度。
1、 pH的范围是0-14
2、 酸性溶液的pH<7; 中性溶液的pH=7; 碱性溶液的pH>7。
3、 酸性溶液的pH值越小酸性越强,反 之PH值越大酸性越弱。
pH与人体健康
人体体液的PH值是7.35~7.45时正常; 人体体液的PH值<7.35时,处于亚健康状况; 人体体液的PH值=6.9时,变成植物人; 人体体液的PH值是6.85~6.45时死亡。
pH值
如何测定溶液的pH值
测定不同浓度的酸或碱的pH值
结论:
①酸越浓,pH值越小;酸越稀,pH值 越大; ②碱越浓,pH越大;碱越稀,pH值越 小。
测定生活中常见物质的pH值:
将可食用与非食用物质的pH值比较,有 何结论?
(酸性或碱性太强的物质即pH值太大或太 小的均不可食用,它们有强烈的腐蚀性)
碱性溶液的pH值越大碱性越强,反 之PH值越小碱性越弱。
; 微信红包群 / 微信红包群
;
被人为的光明撕裂得丢了魂魄。其实黑暗是洁净的,那灯红酒绿、夜夜笙歌的繁华,亵渎了圣洁的黑暗。上帝给了我们黑暗,不就是送给了我们梦想的温床吗?如果我们放弃梦想,不断地制造糜烂的光明来驱赶黑暗,纵情声色,那么我们面对的,很可能就是单色调的世界了。 ?
pH值与酸碱强弱的关系

pH值与酸碱强弱的关系在化学领域中,pH值是一种用来衡量溶液酸碱性质的指标。
它是通过测量溶液中氢离子(H+)的浓度来确定的。
pH值的范围从0到14,其中7被定义为中性。
小于7的pH值表示酸性,而大于7的pH值表示碱性。
酸碱性越强,pH值就越低或越高。
本文将探讨pH值与酸碱强弱之间的关系。
1. pH值与酸碱强弱酸性溶液具有较高的氢离子浓度,因此其pH值低于7。
强酸(如盐酸)具有极低的pH值,接近于0,表明其酸性非常强烈。
相对而言,弱酸(如乙酸)的pH值会稍微高一些,但仍然低于7。
碱性溶液则相反,其氢离子浓度较低,因此其pH值高于7。
强碱(如氢氧化钠)的pH值接近于14,表示其碱性十分强烈。
而弱碱(如氢氧化铵)的pH值会稍微低一些,但仍然高于7。
2. pH值的测量与指示剂pH值的测量可以通过使用酸碱指示剂或pH计来完成。
酸碱指示剂是一种能够根据溶液的pH值而发生颜色变化的物质。
最常见的指示剂是酚酞、酚酞红和甲基橙等。
通过观察溶液颜色的变化,我们可以粗略地确定其pH值。
而pH计是一种更为精确的测量仪器,它可以直接测量溶液中的氢离子浓度,并将其转化为相应的pH值。
pH计广泛应用于实验室和工业生产中,能够提供更准确和可靠的测量结果。
3. pH值与酸碱反应酸和碱之间的反应产生盐和水,这种反应被称为酸碱中和反应。
在中和过程中,溶液的pH值会接近7,表明中和后的溶液呈中性。
强酸与强碱之间的中和反应非常剧烈,这也是为什么我们在实验室中使用盐酸和氢氧化钠进行酸碱中和实验的原因。
弱酸和弱碱中和反应相对较慢,需要更长的时间才能达到中性。
4. pH值与生活应用pH值的概念在日常生活中有许多应用。
例如,我们可以使用pH试纸来检测家庭水源的水质是否酸性或碱性。
此外,pH值还对许多工业和农业过程至关重要。
在工业生产中,pH值的控制可以影响许多化学反应的进程和产物。
一些工业过程需要酸性条件,而另一些则需要碱性条件。
通过合理控制pH值,可以提高生产过程的效率和产物的质量。
九年级酸碱盐知识点ph

九年级酸碱盐知识点phpH是酸碱溶液酸碱性强弱的一个常用指标。
它是以氢离子浓度为基础,采用对数表示的。
pH的取值范围是0-14,数值越小表示酸性越强,数值越大表示碱性越强,数值为7表示中性。
1. pH的计算方法pH的计算公式为:pH = -log[H+],其中[H+]代表溶液中氢离子的浓度。
在酸性溶液中,氢离子浓度高;而在碱性溶液中,氢离子浓度低,计算pH可以帮助我们了解溶液的酸碱性质。
2. 酸性和碱性溶液的pH范围当溶液的pH小于7时,表示溶液为酸性。
例如,盐酸、硫酸等酸性物质具有较低的pH值。
而当溶液的pH大于7时,表示溶液为碱性。
例如,氢氧化钠、氨水等碱性物质具有较高的pH值。
当溶液的pH值等于7时,表示溶液为中性。
例如,纯水的pH值为7。
3. pH对物质性质的影响pH值对物质的性质有很大的影响。
在酸性溶液中,金属会被腐蚀,蓝色石蕊试纸会变红;在碱性溶液中,酸性物质可以被中和,红色石蕊试纸会变蓝。
pH值还可以影响化学反应的进行,因为许多酸碱反应只在特定的pH范围内才能进行。
4. pH的应用pH值在生活和工业中有许多应用。
例如,在食品加工中,通过控制pH值可以使食品保质期延长;在水处理中,通过调节水的pH值可以改善水的质量;在医学中,通过测量体液的pH值可以帮助判断人体内部的酸碱平衡等等。
总结:酸碱盐知识点ph是九年级化学教育中的重要内容。
了解pH值的计算方法和酸碱性质对物质的影响,有助于我们更好地理解化学反应和应用于实际生活中。
掌握了这些知识点,我们可以更好地理解和应用化学知识。
酸碱性的基础概念与定义

酸碱性的基础概念与定义酸碱性是化学中的一个基本概念,涉及许多与物质性质和反应相关的重要问题。
本文将介绍酸碱性的基础概念与定义,并探讨其在化学以及生活中的应用。
一、酸碱性的定义酸碱性是指溶液中氢离子(H+)或氢氧根离子(OH-)的相对浓度。
根据溶液中氢离子和氢氧根离子的浓度,我们可以将溶液分为酸性溶液、中性溶液和碱性溶液三种类型。
1. 酸性溶液:酸性溶液指的是含有较高浓度的氢离子(H+)的溶液。
在酸性溶液中,氢离子的浓度高于氢氧根离子的浓度,通常用pH值来表示酸性溶液的酸碱程度。
pH值小于7的溶液被认为是酸性溶液,pH值越小,酸性越强。
2. 中性溶液:中性溶液指的是含有相等浓度的氢离子(H+)和氢氧根离子(OH-)的溶液,其pH值为7。
纯水就是一种典型的中性溶液,其中的氢离子和氢氧根离子的浓度相等。
3. 碱性溶液:碱性溶液指的是含有较高浓度的氢氧根离子(OH-)的溶液。
在碱性溶液中,氢离子的浓度低于氢氧根离子的浓度,同样用pH值来表示碱性溶液的碱性程度。
pH值大于7的溶液被认为是碱性溶液,pH值越大,碱性越强。
二、酸碱反应酸碱性的概念与酸碱反应密切相关。
酸碱反应是指酸与碱之间发生的化学反应,其中酸质子(H+)的传递是反应的核心。
1. 酸的特性与反应:酸是一种能够释放质子(H+)的化合物。
在水溶液中,酸质子会与水分子结合形成氢离子(H3O+),从而使溶液呈酸性。
酸具有以下特性:- 可腐蚀性:酸可以腐蚀金属、使有机物变色等;- 反应性:酸与碱或金属氧化物反应生成盐和水;- 酸味:某些酸具有酸味,如柠檬汁和醋。
2. 碱的特性与反应:碱是一种能够接受质子(H+)或释放氢氧根离子(OH-)的化合物。
在水溶液中,碱能够与水分子反应生成氢氧根离子,从而使溶液呈碱性。
碱具有以下特性:- 碱性气味:如氨气具有刺激性的氨味;- 溶解性:碱可以溶解在水中,生成碱性溶液;- 反应性:碱与酸反应生成盐和水。
三、酸碱性在化学中的应用1. pH值的测定:pH值作为测量溶液酸碱性的重要指标,广泛应用于化学实验、环境监测、食品检测等领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
下列用pH值表示溶液酸性最强的( A )
A、pH=0 B、pH=1
C、pH=7
D、无法判断
医生提醒胃酸过多的病人应少吃苹果,那么
苹果的pH值( B )
A、大于7 B、小于7
C、等于7
D、无法判断
以下物质溶于水形成 的溶液中,
pH值大于7的是( C )
A、二氧化碳 B、二氧化硫
C、氧化钙
D、氯化钠
识别酸性溶液和碱性溶液: 除了酸碱指示剂之外还有石蕊试纸
红色石蕊试纸(用来检验碱性溶液):
——遇到碱性溶液变成蓝色 ——遇到酸性溶液变成红色
蓝色石蕊试纸(用来检验酸性溶液):
溶液酸碱性的测定方法:
取待测液少许于试管中,滴入2-3滴 若溶液颜色 ,证明原溶液显
待测液 加入无色酚 酞试液后溶 液颜色 待测液 1 待测液2 酸性溶液
C
12. 往稀盐酸中滴加氢氧化钠溶液至 完全中和时为止,溶液的pH变化的图 象正确的是( B )
小资料 饮用水的PH值与人体健康并无必然联系
世界卫生组织的研究报告表明,水的PH值
与人体健康的关系目前并没有得到证明。 最近一些厂商为推销产品强化“碱性水” 等说法是缺乏科学根据的。人体胃酸的PH 值通常在3左右,由于人体自身有强大的 酸碱调节功能,喝下PH值为5-8的水后, 其实几乎是没有差异的。对普通人来说, 没有必要去专门喝弱碱性水;长期喝碱性 水,会中和胃酸,影响食物消化;过量饮 用弱碱性水反而会一定程度破坏体内的酸 碱平衡。
常用的酸碱指示剂。
盐酸
紫色石蕊试液 变红色 的颜色 溶液的酸碱性 酸性
澄清石灰水 蒸馏水
变蓝色 碱性 不变色 中性
结论: 紫色石蕊在酸性溶液变红色,
紫色石蕊在碱性溶液变蓝色,
中性不变色 (酸红碱蓝)
动动手
氯化铵 碳酸钠 氯化钠 变蓝色 不变色 碱性 中性
紫色石蕊试液 的颜色 溶液的酸碱性
变红色 酸性
2、练习册3.3。
11.某学生在研工业废水的利用中,把一
瓶含氢氧化钠的废水的pH值调至小于7, 所采取的下列方法中一定正确的是 ( ) A.往废水中滴加石蕊试液,再加入 适量的蒸馏水稀释至无色 B.往废水中滴加石蕊和盐酸,至溶 液显紫色 C. 往废水中滴加石蕊和盐酸,至溶 液显红色 D. 往废水中滴加石蕊和盐酸,至溶 液显蓝色
写字的溶液
方 法 一
显字的溶液 石灰水(或其
原理
酚酞试液
石灰水(或其
他碱性溶液)
方 法 二
他碱性溶液)
方 法 三
酚酞 试液
无色酚 酞试液 遇碱溶 液变成 红色
紫色石蕊试 液遇碱溶液 变蓝色
石灰水(或其 他碱性溶液)
石蕊试液
作业: 1、 搜集各种花瓣、蔬菜等,按 “自制酸碱指示剂”的方法试一试, 并检验家中常见溶液的酸碱性。
盐酸 氯化铵 蒸馏水 氢氧化钠 碳酸钠 酚酞试液 的颜色 无色 溶液酸碱 性 酸性 无色 酸性 无色 中性 红色 碱性 红色 碱性
结论:酚酞在酸性和中性溶液中不变色 酚酞在碱性溶液中变红色
强调 酸性溶液不一定是酸,如NH4Cl溶液 碱性溶液不一定是碱,如Na2CO3溶液
寻找科学家的足迹
(发现酸碱指示剂)
一天清晨,波义耳偶然将盐酸溅到 了紫罗兰花瓣儿上。喜爱鲜花的他急 忙用水把花冲洗了一下。过了一会儿 ,他惊奇的发现紫罗兰花瓣儿颜色变红了!波义耳没有 放弃这一奇怪的现象,提出了许多猜想和假设并做了大 量的实验来验证猜想,由此他发现大部分花草受酸性或 碱性物质作用,都能改变颜色。其中一种叫做石蕊地衣 的植物效果最明显,它的紫色浸液遇酸溶液变红,遇碱 溶液变蓝。这就是最早使用的紫色石蕊试液。
A
课堂练习:
2.常温时测得鸡蛋清的近似
PH为7.6 ~ 8.0,对它酸碱性 的判断正确的是( B ) A.呈酸性 B.呈碱性 C.呈中性 D.无法判断
3.保健医生提示: 胃酸过多的病人,应少 食苹果!那么,苹果汁 的pH( C ) A、大于7 B、等于7 C、小于7 D、无法判断
4.下列物质溶于水,所得溶
溶液酸碱性与生活的关系
人体某些体液的正常pH范围 血液
pH
7.35~7.45
唾液
6.6~7.1
胃液
0.8~1.5
胆汁
6.8~6.74
尿液
5.0~7.0
几种作物生长最适宜的pH范围
西瓜6.0~7.0
苹果树6.0~8.0
小麦6.0~7.0
酸雨: pH<5.6的雨水 正常雨水pH约为5.6 CO2+H2O=H2CO3
想一想
如何用化学方法鉴别白醋、澄清石灰水、食盐水?
实验步骤
取样,分别滴加 少量的紫色石蕊 试液
实验现象
一样品变红色; 一样品变蓝色; 一样品不变色, 仍为紫色
结论
变红色的原样品 为盐酸;不变色 的原样品为食盐 水;变成蓝色的 原样品为白醋
我的收获
石蕊 试液
酚酞 试液
蓝色石 红色石 蕊试纸 蕊试纸
pH值
表示溶液的酸碱性强弱 即溶液酸碱度
pH值的测定---pH试纸
用洁净干燥的玻璃棒蘸取被测溶液滴在pH 试纸上,然后把试纸显示的颜色与标准比色卡对照, 颜色最为接近的值即为pH值 。
动动手
用pH试纸测定下列溶液的pH值
盐酸 pH值 氯化铵 蒸馏水 碳酸钠 氢氧化钠
(1)不能直接把pH试纸浸入待测溶液中,以免 带入杂质,同时这种操作可能泡掉pH试纸上一部 分指示剂,以致比色发生较大的误差; (2)不能先用水将pH试纸润湿,再进行测试, 因为水润湿后的pH试纸将测定的是稀释后溶液的 pH。 (3)我们实验室一样使用的pH试纸是广泛pH试 纸,测出的pH值是1-14的整数 (4)为了比较精确的测定溶液的pH,我们可以 用精密pH试纸和酸度计(pH计)来测量。
溶液酸碱性和pH值
柠檬
山楂 “尝起来酸酸的”
酸桔子
“摸起来滑滑的”
强调 通常禁止对实验室中的化 学试剂采用“尝味试验法” 了解其味道 ;禁止用手接 触药品。
想一想
现在实验室中有一瓶溶 液,该如何去了解它是否有 酸味或是否显酸性呢?
能检验溶液酸、碱性的指示剂, 称为酸碱指示剂
紫色石蕊和无色酚酞是两种
如何利用家中材料来测试雨水pH值?
洗发剂和护发剂 日常生活中,洗发时一般先用 护发 _____ 剂,后用 剂。 洗发 查阅资料:一些碱性物质能去油除 垢;弱酸性有益于头发的健康。 猜想:洗发剂显 碱 性,护发剂 弱酸 显 _____ 性。可用 来验证 我的猜想。
在蔬菜生长过程中,常喷洒农药防治病虫害。 据有关专家介绍,用碱性溶液或清水浸泡,可使 残留在蔬菜上的农药的毒性降低。因此,买来的 蔬菜在食用前最好用稀碱水或清水浸泡一段时间。 浸泡蔬菜时可加入适量 ( ) A A.纯碱 B.食盐 C.白糖 D.食醋
试液, 性。
待测液 3 待测液4 待测液 5 待测液6 中性溶液 碱性溶液
无色
无色
无色
无色
红色
红色
加入紫色石 蕊试液后溶 红色 液颜色
红色
紫色
紫色
蓝色
蓝色
土壤的酸碱性直接影响植物的生长 发育。例如浙江的“龙井茶”就只能产 于微酸性的土壤中。如果酸性太强就无 法正常生长。用酸碱指示剂能否区分土 壤酸性的强弱呢?
牛奶6.3~6.6;鸡蛋清7.6~8.0。 则下列说法中,不正确的是( ) D A.胃酸过多的人应少饮葡萄汁 B.苹果汁能使石蕊试液变红 C.鸡蛋清为碱性食品 D.牛奶比苹果汁的酸性强
酸碱度有什么意义呢?
了解溶液的酸碱度的意义
(1)化工生产中许多反应必须在 一定的____ PH溶液 _____里才能进行; (2)农业生产中家作物一般适宜在 pH为_______ 7 或者_______ 接近7 的土壤中生长; (3)测定雨水的pH(酸雨的PH小于5.6), 可以了解空气的__________ 情况; 污染 (4)测定人体内或排出的液体的pH, 可以了解人体的________ 健康 状况.
5.下列溶液酸性最强的是( B ) A、pH=6 B、pH=1 C、pH=7 D、pH=14
6.在使用pH试纸测定某种酸溶液
的pH时,若事先用蒸馏水把试纸 润湿后再测pH,则实际测得值与 真实值比较( A )。 A.变大 B.变小 C.不变 D.可能变大、变小或不变
7.一些食物的近似pH如下: 葡萄汁3.5~4.5;苹果汁2.9~3.3;
pH
酸性 溶液 红色 无色 红色 中性 紫色 溶液 无色
<7 pH越小 酸性越----
强
=7
碱性 蓝色 溶液
红色
蓝色
>7
pH越大 碱性越----
强
世界真奇妙
革命先烈方志敏在国民党反动派的监狱中,为 了将情报送给党组织,用米汤在白纸上写字,别人 看不见,但当用碘酒涂在信纸上后,字便会显示出 来,这是因为米汤含有淀粉,碘酒含有碘,而无色 的淀粉溶液遇到碘会变蓝色。小明同学在听了这一 故事以后, 也想写一封“密信”,但他又不想再 用上面的方法。同学们,运用你所学的化学知识帮 帮小明, 告诉他,用 写字,用 显字, 其原理是 。
液的PH小于7的是( D ) A、CaO B、NaCl C、KOH D、CO2
2、pH值与溶液酸、碱度的关系:
pH值越大,碱性越强;
pH值越小,酸性越强;
溶液酸碱度-------pH值
0 1 2 3 4 5 6
7
8 9 10 11 12 13 14
酸性增强
中性
碱性增强
pH<7,呈酸性,pH越小,酸性越强 pH=7,呈中性 pH>7,呈碱性,pH越大,碱性越强
(2)实验结论:
