对WesternBlot进行灰度分析
(整理)实验步骤-westernbloting实验流程-5临床医.

Western blotting实验流程实验流程共分为6步:1 待测蛋白的准备;2 蛋白电泳;3 转膜;4 抗体结合;5 曝光;6 灰度值统计分析。
一、待测蛋白的准备1.细胞蛋白的提取:(1)拿出六孔培养板,去培养液,PBS洗细胞两遍,根据细胞密度每孔加50~100µl细胞裂解液(含1%的蛋白酶抑制剂PMSF,现用现配),冰上放置10分钟裂解。
(2)将培养板置于冰上,用细胞刮挂下细胞,每孔刮一分钟左右(刮不同孔细胞需用PBS 或水冲洗细胞刮,洗后甩干),收集裂解液于1.5ml EP管中,置于冰上裂解20分钟,期间需用振荡器振荡混匀3次,每次15秒左右(3)12000rpm,4℃冷冻离心5min左右,收集上清置于新EP管,存于-80℃。
2. BCA法蛋白溶液浓度测定(具体步骤按试剂盒说明书)(1)配制BCA工作液:打开37℃恒温箱预热加温,取出BCA标准品与蛋白样品解冻,配BCA工作液,A:B=50:1,A液总量=(8个标准蛋白+待测蛋白数量)*200µl,B液总量=(8个标准蛋白+待测蛋白数量)*4µl,配好后混匀。
(2)配制BCA标准品与标准曲线:用PBS稀释好标准品,按说明书将标准品加入到96孔板中,再补加PBS到一样体积。
(3)配制蛋白样品:每孔加入5µl蛋白原液,补加PBS稀释(稀释可节省蛋白,记住稀释倍数,蛋白较多时也可不稀释直接加蛋白原液测;蛋白孔可做2~3个平行孔,测量时取平均值较准)(4)加入BCA工作液:每孔各加200µl已配好的工作液,盖上板盖混匀30秒,37℃孵育30min,放好蛋白样品。
(5)测蛋白浓度:打开酶标仪预热10分钟以上,孵育完后取出96孔板冷却到室温,用移液枪去除小气泡,用纸巾擦干96孔板板度水珠,调节酶标仪波长,放入打印纸,打开96孔板板盖,在570nm波长下读取数值,空白孔可设可不设。
(具体按酶标仪操作说明,可以测几次选取)(6)计算浓度:用EXCELL表格制作标准直线方程,计算待测蛋白浓度(若稀释测量的记住要乘以稀释倍数才是最终蛋白浓度),然后以每个条带最低浓度那组蛋白为标准计算各组蛋白上样体积与细胞裂解液RIPA的补加体积。
10分钟Get!大牛教你用imageJ对Westernblot条带进行灰度分析!
10分钟Get!大牛教你用imageJ对Westernblot条带进行
灰度分析!
科研人员做的western blot实验一般需要对其结果扫描后进行灰度分析,一般使用的软件为Image 。
采用Image J 软件对蛋白质印迹实验结果(Western Blot)进行灰度半定量分析,是分子生物学实验中比较常用的方法,可实现对WB实验结果进行准确、简单和快速的分析。
ImageJ分析Westernblot条带图
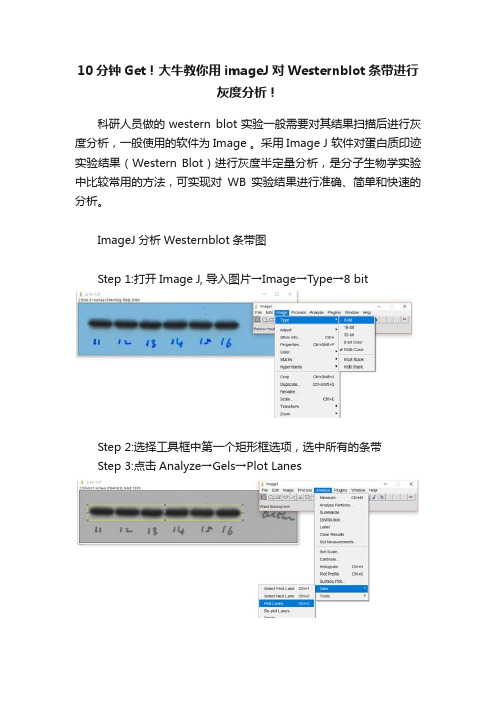
Step 1:打开Image J, 导入图片→Image→Type→8 bit
Step 2:选择工具框中第一个矩形框选项,选中所有的条带
Step 3:点击Analyze→Gels→Plot Lanes
Step 4:选用工具框中的直线工具,将开口波峰封闭
Step 5:选用工具框中的魔棒工具,点击相应的波峰,相应area值
ImageJ分析Westernblot条带图
Step 1:打开Image J, 导入图片。
Image→Type→8 bit
Step 2:扣除背景P→rocess→Subtract Background→选择50 pixels和Lightbackground
Step 3:设定参数→Analyze→Set Measures→按照下图勾选参数
Step 4:设定参数→Analyze→Set scale→unit of length选项改为pixels
Step 5:图像分割→Edit→Invert→选用椭圆或自定义工具选中条带
Step 6:Analyze→Measure→得到 IntDen值Step 7:重复Step5、6,得到所有条带的IntDen值
以上实用干货来源于课程
30分钟精通Image J图片处理。
WB灰度值测定

Image J测到了WB条带灰度值关于用Image J量化westernblot条带灰度值,在网上一直盛传着两种操作方法,然鹅~小伙伴们却一直不确定到底哪种才是正确的测量灰度方法,甚至将灰度与光密度弄混淆。
今天咱们一起就这个机会学习下,请先看看你是用以下那种方法测量灰度值?以下是两种方法的具体操作。
方法一:1、打开Image J软件→左上角file→Open 选择自己的条带图片(事先把条带摆正)2、把图片转化成灰度图片:Image→type→8—bit3、第一个矩形工具→选上所有条带4、analyze→Gels→select first lane→Gels→plot lanes(在这第四步也可以分开选取,如:框选第一个条带→analyze→Gels→select firstlane→将第一个框拖移到余下条带→Gels→select nextlane)5、选中直线工具,将开口波峰关闭6、选中魔棒工具(正数第七个),点击波峰,就得出所有area值。
方法二1、打开Image J软件→左上角file→Open 选择自己的条带图片(事先条带弄正)2、把图片转化成灰度图片:Image→type→8—bit3、扣除背景:Process→Subtract Background→50pixels 并勾选Light Background5、设定参数:Analyze→set measurement→勾选Area、Mean gray value、Min & max gray value、Integrated density6、Analyze→set scale→unit of length选项里改为pixels,确定6、图像分割。
Edit→Invert→选中椭圆圈(手残党首选)/不规则圆圈(心灵手巧党义无反顾),手动圈上单个条带7、Analyze→Measurement即得到Intden,重复6、7步就得到所有Intden值小伙伴们,你们是哪种方法呢?首先先把结论说出来,其实两者得出的area和Intden严格来说都不是灰度值,前者是面积而后者是光密度值,但用来量化WB条带都是OK的。
干货▎ImageJ分析WesternBlot蛋白条带灰度值

干货▎ImageJ分析WesternBlot蛋白条带灰度值聊点学术,一键关注“你已经是个成熟的条带了,要学会自己分析!”“连Western blot都没学好,又让我学Image J,我......”This is the dividing line.Image J分析蛋白条带灰度值首先解释一下,为什么要分析灰度值?灰度的概念是使用黑色调表示物体,即用黑色为基准色,不同的饱和度的黑色来显示图像。
采用ECL发光时,蛋白条带发出的荧光会曝光在胶片上,留下的黑色条带。
然而胶片扫描后为蓝色背景、黑色条带,这并不是单纯的黑灰白颜色。
因此,我们首先得在Photoshop 中将整张图片去色,使彩色图片变成黑白图片,形成近灰色背景、黑色条带的图片类型。
此时,条带的深浅和面积综合代表着蛋白的量。
灰度值分析自然就成为我们的首选。
延伸说一下,免疫组织化学染色(IHC)结果本身为近白色背景、棕黄色阳性表达,这时我们就不能直接用灰度反映阳性表达强弱了,而是积分吸光度,也就是咱们常说的平均光密度(IOD)。
如果你真的想用灰度计算IHC结果,显然你需要将图片转为灰度图再计算。
此处不表。
分析图文步骤如下:Image J软件界面↓1. 图片转换为黑白图:首先使用Photoshop打开胶片扫描图片,点击“图像>调整>去色”,将彩色图片转化为黑白图片,并使用裁剪工具将目标条带裁剪至合适大小后另存图片。
2.打开Image J软件:2.1.打开图片文件:File>Open;将图片转化为8bit类型:Image>Type>8-bit。
(此步骤的目的是为了将图片的每个像素用8bit表示,这样的话,整个图片的灰度将分为256个级别,即黑、灰、白的像素模式;若保留原始的16bit格式或RGB格式,图片灰度级别会呈指数增长,并有其它颜色混入,造成计算误差。
)2.2.将整张图片背景灰度均一化,消除图片背景影响:Process>Subtract Background,默认数值为50即可。
用ImageJ对Western DNA和Blot图片灰度分析

用ImageJ对W estern Blot图片灰度分析教程收集于互联网来源中生网The good news is that even if you don't have access t o a photo editing program such as Photoshop, you can now do all the same analyses using free programs. My favorite option is the freely available ImageJ from the National Institut es of Health.The homepage for ImageJ is here: /ij/index.html wherein you can find links t o the download, document ation, additional plugins and so on.Once ImageJ is inst alled, open it up and open your scanned film file. We'll start the ImageJ section by duplicating the method outlined above for Phot oshop.1. Open your file.2. Under Image>Type click on 8-bit t o convert the image to grayscale.3. Go to the menu Process>Subt ract Background. Try a rolling ball radius of 50. This removes some of the background coloration from your image.4. Go to Analyze>Set Measurements, and click the boxes for Area, Mean Gray Value, and Int egrated D ensit y.5. Go to Analyze>Set Scale, and ent er "pixels" in the box next t o Unit of length.6. Go to Edit>Invert (or hit Ct rl+Shift+I) t o invert the colors on the image. Now the dark areas are light, and the light areas are dark. As outlined above, this has the benefit of making the measured values for bands increase with increasing prot ein expression.7. Choose the F reehand Selection tool from the t ool palette.8. Draw a line around the boundary of your first band. As above, you need to use your own judgement aboutwhere t he edges of the band are, and what is simply background noise.9. Hit the m key to take a measurement of the enclose area that you select ed. The Result s window should pop up, and each of the measurements you select ed in step 4 should appear. Not e that the Integrated Density column is simply the Area and Mean Gray Value columns multiplied together.10. Use the Freehand Selection tool to select the next band, and press m to take the measurement. Repeat this for each of you bands, including the st andard.11. When you are finished, you can go to the Edit menu in the Results window, and choose Copy All. You can then paste the results into a spreadsheet for lat er use.教你使用ImageJ分析电泳条带灰度比-ImageJ使用教程ImageJ这套软件可以自动帮你你计算细胞数,也可以定量分析DNA电泳或是Western blot条带。
ImageJ对WesternBlot进行灰度分析

ImageJ对WesternBlot进行灰度分析Western Blotting是生物学领域常用的分析蛋白质的实验技术,它可以提供蛋白质定量和免疫印迹图像。
Western Blot的数据分析需要使用图像处理软件,ImageJ是一款免费的开源软件,是生物医学图像处理分析领域的标准工具之一。
本文将介绍ImageJ如何对Western Blot图像进行灰度分析。
背景Western Blotting技术是分析蛋白质表达及功能的一种常用方法,它可以检测蛋白质的存在、分子量、相对表达量、修饰等信息。
通常利用免疫学方法检测Western Blot膜上的蛋白质,检测后得到的结果是一张黑白图像。
这个图像需要进行处理和分析,以得到蛋白质的数量和变化。
ImageJ是一个开源的图像处理和分析软件,它可以用于各种各样的生物医学图像分析,包括Western Blotting图像分析。
ImageJ提供了灰度分析的功能,可以实现对Western Blotting图像的结果定量分析。
灰度分析可以测量Western Blotting图像的灰度值,这个值可以代表蛋白质的含量,从而实现对蛋白质表达量的分析。
安装ImageJ和导入图像在使用ImageJ进行Western Blotting图像分析前,需要先安装并打开ImageJ。
安装完成后,可以通过以下步骤导入Western Blotting图像:1.打开ImageJ并选择“File”菜单中的“Open”选项。
2.找到Western Blotting图像并选择打开。
3.如果需要对导入的图像进行调整,可以使用ImageJ提供的功能或插件进行操作。
灰度分析灰度分析是Western Blotting图像分析的一个重要步骤,旨在定量分析蛋白质的含量。
以下是使用ImageJ进行灰度分析的步骤:1.进入“Analyze”菜单并选择“Gels”选项。
2.在“Gels”菜单中,选择“Lane Profile”选项。
ImageJ和Graphpad如何对WesternBlot条带灰度分析【干货】每日生物评论

ImageJ和Graphpad如何对WesternBlot条带灰度分析【干货】每日生物评论摘要手把手教你利用Image J和Graphpad软件对Western Blot条带进行灰度分析和柱状图构建,看艾美捷干货分享。
WB是研究蛋白表达的一个经典方法。
对于一些时间点或者是不同组织蛋白表达量的分析就涉及到量的变化。
一些凝胶成像软件带有此分析工具,比如Quantity One,Bandscan,Gel-Pro Analyzer等成像系统专用软件。
除了这些软件,还有一个比较简单的综合性质图像处理软件Image J可以很方便的进行灰度分析。
而且Image J是开源性质的免费软件,可以在其官网直接下载使用。
对Western Blot条带进行数值化有两种方法——灰度分析和光密度分析。
灰度是计算机图像分析仪根据图像颜色深浅分为256个级别。
灰度值越小物体颜色越深。
光密度是指光线通过溶液或某一物质前的入射光强度IO与该光线通过溶液或物质后的透射光强度Ib比值的对数OD=log(IO/Ib);图像分析中,入射光和透射光强度分别被切片上最亮区域的平均灰度值和待测目标平均灰度值取代,则图像分析系统的光密度值=log(切片标本最亮区域的平均灰度值(g0)/待测目标的平均灰度值(g))。
光密度值越大,物体颜色越深,阳性物质相对含量越大。
对于灰度值来说,切片标本制作时染色时间长短,以及测量时显微镜照明光源电压的大小对其影响很大。
而光密度是一个比值。
是通过计算一张切片标本最亮区域的平均灰度值与该切片标本中待测目标的平均灰度值的比值,再根据数学公式计算而来的,所以受切片标本染色时间长短及照明光源电压关系很小。
然而有研究实践显示,灰度值与光密度值二者之间存在着线性关系,都可以用来进行WB定量分析。
同样,Image J软件进行WB条带定量分析时也存在两种方法,此处只列举一种方法,具体步骤如下。
1、下载安装,并打开Image J软件。
Westen blot 灰度测定方法

WB灰度计算image j
1.载入图片:File----open---选中文件
2.图片处理:
(1)改变类型:RGB转化为8-bit(灰度图)
(2)去除背景:(灰背景影响计算)process---subtract background---默认50.0 light background---OK(CTRL加加号放大,加减号缩小)
3.分析方法一:
(1)选择分析范围:矩形工具框选分析泳道
(3)analyze---gels---select first lane---yes
(4)绘图:analyze---plot lanes(几个条带对应几个峰值)
(5)计算每一个峰值的面积:峰的根部分隔开,用直线工具画竖的知县分割成闭合区域
(6)计算面积:魔棒工具,分别点击每一个峰值的区域,得到面积数据(面积对应灰度值,蛋白质量越多则灰度面积越大)
蛋白质跑之前内参调齐肉眼即可判断趋势。
4.分析方法二:
矩形工具单独框选后命名(除了第一个ctrl+1以外都ctrl+2,最后一个ctrl+3可以挪到旁边,框框大小必须一样)
nalyze---plot lanes绘图后,得到单独分割的峰图,直接选择魔棒工具(更加精确也可以直线封闭),选择面积计算即可
#一般需要与目的蛋白的分子量相差5kd以上。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Image J 对Western blot 条带进行灰度分析
Image J软件:Windows 版本
第一步:软件安装
1.下载地址:/ij/download.html
2.下载windows 32位带Java版本,双击软件安装。
第二步:界面介绍
1.软件界面
第三步:图片分析
1.下图为样板图片
2.导入图片:File> Open> Sample1.jpg
图片导入后,Sample1.jpg在新的窗口中打开
3.图片类型设置:Image> Type> 8 bit
4.去除图片背景:Process> Subtract Background> …
4.1Subtract Background 窗口:Rolling ball radius 设为50 pixels,
勾选light background,可选preview,点击“OK”确定
5.工具栏:选择“矩形选框”
6.最大化“Sample1.jpg”窗口,便于矩形选择,矩形选择第一个泳道
7.标记“矩形选框”为1:矩形选择后,调整矩形至合适大小,按下数字键
“1”,或者Analyze> Gels> Select Fist Lane。
8.选择“泳道2”:拖动“1”的矩形框,会出现两个矩形选框,拖动矩形框
至泳道2,调整位置,并按下数字键“2”,Image J 会自动调整大小使“矩形框2”与“矩形框1”保持同一水平。
9.继续拖动,会出项新的“矩形选框”,调增至泳道3,并按下数字键“2”
(注意:是按下数字键“2”),重复9至6个泳道全部选择。
10.所有泳道选择后,按下数字键“3”,出现分析图谱。
11.“直线”封闭峰:工具栏选择“直线”,从起峰处至落峰处。
果出现在新的窗口中。
计算结果:
12.其他泳道,以此类推,本文原创,如有疑问或建议,欢迎Email
biowhb@。
