引物设计软件使用
引物设计的原则以及常见引物设计软件的使用

450-500 P.E.
# range. ——p70,oligo7 manual
三 常用软件使用方法
4.Beacon Designer8
与primer premier6界面类似,增加了设计引物的种类,可用于设
计各种实时定量的引物和探针,分子信标等。
三 常用软件使用方法
4.Beacon Designer8
一 前言
如何设ቤተ መጻሕፍቲ ባይዱ引物?
遵循引物设计的原则 设定引物的一些参数 利用引物设计软件搜索,评价引物
Back to contents
二 引物设计原则
1.引物的长度
引物的长度一般选择在18-27个碱基之间,过长和过短都会降 低引物结合效率。
2.引物的Tm值
引物的Tm值一般选择在55-65℃之间,上下游引物之间Tm相差 不宜超过4℃。 Tm值:两段互补的碱基序列解链50%时的温度 估算Tm=4*(G+C)num+2*(A+T)num
此外,Beacon Designer增加了标记外显子的选项,使得方便设计跨外 显子的引物,提高实时定量引物的特异性。 Locate exon + Junction Primer serach
三 常用软件使用方法
4.Beacon Designer8
导出引物信息为表格文件-Export Results
引物设计的原则以及
常见引物设计软件的使用
伏东科 20150618
目录
一 前言 二 引物设计原则 三 常用软件使用方法
四 常见问题
一 前言
什么是引物?
引物(primer),又称引子,是一小段单链DNA或RNA,用来作 为DNA复制的起始点(终点)。
引物设计软件使用

一、引物设计step by step1、在NCBI上搜索到目的基因,找到该基因的mRNA,在CDS选项中,找到编码区所在位置,在下面的origin中,Copy该编码序列作为软件查询序列的候选对象。
2、用Primer Premier5搜索引物①打开Primer Premier5,点击File-New-DNA sequence, 出现输入序列窗口,Copy目的序列在输入框内(选择As),此窗口内,序列也可以直接翻译成蛋白。
点击Primer,进入引物窗口。
②此窗口可以链接到“引物搜索”、“引物编辑”以及“搜索结果”选项,点击Search按钮,进入引物搜索框,选择“PCR primers”,“Pairs”,设定搜索区域和引物长度和产物长度。
在Search Parameters里面,可以设定相应参数。
一般若无特殊需要,参数选择默认即可,但产物长度可以适当变化,因为100~200b p的产物电泳跑得较散,所以可以选择300~500bp.③点击OK,软件即开始自动搜索引物,搜索完成后,会自动跳出结果窗口,搜索结果默认按照评分(Rating)排序,点击其中任一个搜索结果,可以在“引物窗口”中,显示出该引物的综合情况,包括上游引物和下游引物的序列和位置,引物的各种信息等。
④对于引物的序列,可以简单查看一下,避免出现下列情况:3’不要出现连续的3个碱基相连的情况,比如GGG或CCC,否则容易引起错配。
此窗口中需要着重查看的包括:T m应该在55~70度之间,GC%应该在45%~55%间,上游引物和下游引物的T m值最好不要相差太多,大概在2度以下较好。
该窗口的最下面列出了两条引物的二级结构信息,包括,发卡,二聚体,引物间交叉二聚体和错误引发位置。
若按钮显示为红色,表示存在该二级结构,点击该红色按钮,即可看到相应二级结构位置图示。
最理想的引物,应该都不存在这些二级结构,即这几个按钮都显示为“None”为好。
但有时很难找到各个条件都满足的引物,所以要求可以适当放宽,比如引物存在错配的话,可以就具体情况考察该错配的效率如何,是否会明显影响产物。
NCBI使用教程--qPCR引物设计

NCBI使⽤教程--qPCR引物设计NCBI设计qPCR引物主要⽤到Primer designing tool⼀/打开基因序列页⾯⼆/点击Pick Primers,跳转到到Primer designing tool的页⾯到Primer designing tool的页⾯。
*如果已经有了基因的序列,可以不通过基因查找页⾯,直接进⼊Primer designing tool。
具体的⼊⼝是NCBI——BLAST——Primer-Blast。
三/根据公式对将设计出的引物进⾏参数设计① PCR Template通过查找序列转到Primer designing tool的,那么在PCR Template栏中则会⾃动出现您的基因的编号,⽐如对于human β-actin来讲,其mRNA的页⾯点击Pick Primer之后,PCR Template 栏中会出现其对应编号:NM_001101.3。
如果是直接进⼊Primer designing tool界⾯,则需要将⽬的基因的编号或者序列粘贴进该框中。
在右侧的Range栏中,可以设定正反向引物的结合范围。
② Primer Parameters引物参数栏中,前两⾏是引物的序列栏,⽤于对已有的引物进⾏特异性分析,在设计引物的过程中并不会⽤到,因此留空即可。
在PCR product size⼀⾏中,可以设定PCR引物的扩增产物长度范围,对于qPCR来讲,范围设为50~250时结果⽐较精确,可以先设定⼀个较⼩的范围,如80~150,如果该范围内没有设计出⽐较好的引物,则可以返回扩⼤产物⼤⼩范围。
# of primers to return是指软件设计引物的数量(如果有的话),默认为10对。
引物的Tm值⼀⾏中,可以设定引物的最⼤、最⼩和最佳Tm值,以及正反向引物Tm的最⼤差值。
对于qPCR来讲,默认的即为最佳Tm值60°C,不需做任何修改。
③ Exon/intron selection在抽提RNA的过程中,样本中的基因组DNA污染会显著影响最终的结果,虽然可以使⽤DNase I进⾏处理将RNA样本中的中DNA降解掉,但是很难保证DNA降解完全。
引物设计软件(Primer Primer 5.0)安装流程
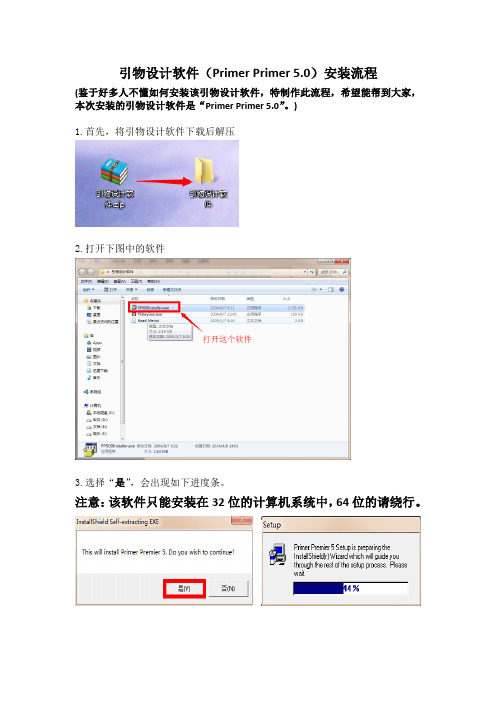
引物设计软件(Primer Primer 5.0)安装流程
(鉴于好多人不懂如何安装该引物设计软件,特制作此流程,希望能帮到大家,本次安装的引物设计软件是“Primer Primer 5.0”。
)
1.首先,将引物设计软件下载后解压
2.打开下图中的软件
3.选择“是”,会出现如下进度条。
注意:该软件只能安装在32位的计算机系统中,64位的请绕行。
4.进度条集满后,会出现如下授权窗口,选择“Yes”
5.该软件默认安装在C盘,你也可以点击“Browse”自定义安装位置,选择好安装位置后,点击Next进入下一步
6.进入安装界面,安装完成后,会出现如下窗口,如果你想阅读README文件,就选择复选框,之后点击Finish按钮,完成安装。
7.接下来需要激活该软件,方可使用,打开已安装好的程序(在之前选择的安装路径下寻找),打开下图中框内的程序,同时你也可以创建快捷方式到桌面,以方便后续使用时打开。
8.再打开安装包中的PSKeyGen.exe,如下图所示。
9.点击引物设计软件中的“Active Product”按钮。
会出现如下图窗口,记住窗口中的Machine ID。
10.打开PSKeyGen.exe,选择“Primer Primer 5.0”,将Machine ID号输入到下面的文本框中,点击“Generate it!”。
记住出现的激活码
11.将激活码输入到引物设计软件中的激活窗口,如下图。
再点击“OK”完成激活。
这样该软件就可以使用了。
制作人:王名利
2014年6月2日。
Oligo6.0软件使用说明

Oligo使用方法介绍作为目前最好、最专业的引物设计软件,Oligo的功能很强,在这里我们介绍它的一些主要功能:如:普通引物对的搜索、测序引物的设计、杂交探针的设计以及评估引物对质量等等。
在正式进行引物设计前,我们首先面临的一个任务就是向Oligo程序导入模板序列,根据不同的实验情况,导入模板有三种方法:1,直接用键盘输入:a,点击file菜单中的New Sequence 浮动命令,或直接点击工具栏中的New Sequence命令,进入序列展示窗口;b,此时即可键入DNA序列;c,如果需要的话,Oligo提供碱基回放功能,在边键入时边读出碱基,防止输入错误。
点击Edit菜单中的“Readback on”即可。
2,利用复制和粘贴:当我们序列已经作为TXT文件存在或其它oligo不能直接open的文件格式,如word 文件.html格式,这个功能就显得很有用了。
在相应文件中复制序列后在序列展示窗口粘贴,oligo会自动去除非碱基字符。
当序列输入或粘贴完成后,点击Accept/Discard菜单中的Accept浮动命令,即可进入引物设计模式。
3,如果序列已经保存为Seq格式或者FASTA,GenBank格式时,oligo就可以直接打开序列文件。
点击File菜单中的“Open”浮动命令,找到所需文件,打开即可。
进入引物设计模式后,oligo一般会弹出三个窗口,分别是6-碱基频率窗口,碱基退火温度窗口以及序列内部碱基稳定性窗口,其中的退火温度窗口是我们引物设计的主窗口,其它的两个窗口则在设计过程中起辅助作用,比如6-碱基频率窗口可以使我们很直观地看到所设计引物在相应物种基因组中的出现频率,如果我们的模板是基因组DNA或混合DNA时,该信息就显得有用了,而内部稳定性窗口则可以显示引物的5’端稳定性是否稍高于3’端等。
一,普通引物对的搜索:以Mouse 4E(cDNA序列)为例。
我们的目的是以Mouse 4E(2361 bp)为模板,设计一对引物来扩增出600-800bp长的PCR产物。
引物设计软件Oligo使用方法介绍荧光定量PCR仪

引物设计软件Oligo使用方法介绍荧光定量PCR仪|荧光定量PCR基因扩增仪作为目前最好、最专业的引物设计软件,Oligo的功能很强,在这里我们介绍它的一些主要功能,如:普通引物对的搜索、测序引物的设计、杂交探针的设计以及评估引物对质量等等。
在正式进行引物设计前,我们首先面临的一个任务就是向Oligo程序导入模板序列,根据不同的实验情况,导入模板有三种方法:1、直接用键盘输入:a、点击file菜单中的New Sequence 浮动命令,或直接点击工具栏中的New Sequence命令,进入序列展示窗口;b、此时即可键入DNA序列;c、如果需要的话,Oligo提供碱基回放功能,在边键入时边读出碱基,防止输入错误。
点击Edit菜单中的“Readback on”即可。
2、利用复制和粘贴:当我们序列已经作为TXT文件存在或其它oligo不能直接open的文件格式,如word文件。
html 格式,这个功能就显得很有用了。
在相应文件中复制序列后在序列展示窗口粘贴,oligo会自动去除非碱基字符。
当序列输入或粘贴完成后,点击Accept/Discard菜单中的Accept浮动命令,即可进入引物设计模式。
3、如果序列已经保存为Seq格式或者FASTA,GenBank格式时,oligo就可以直接打开序列文件。
点击File菜单中的“Open”浮动命令,找到所需文件,打开即可。
进入引物设计模式后,oligo一般会弹出三个窗口,分别是6-碱基频率窗口,碱基退火温度窗口以及序列内部碱基稳定性窗口,其中的退火温度窗口是我们引物设计的主窗口,其它的两个窗口则在设计过程中起辅助作用,比如6-碱基频率窗口可以使我们很直观地看到所设计引物在相应物种基因组中的出现频率,如果我们的模板是基因组DNA或混合DNA 时,该信息就显得有用了,而内部稳定性窗口则可以显示引物的5‘端稳定性是否稍高于3’端等。
一、普通引物对的搜索:以Mouse 4E(cDNA序列)为例。
PCR引物设计及Primer_Premier_5.0使用介绍

Use these two button to translate the DNA seq to a protein seq or a protein seq to a DAN seq 8种密码子偏好
引物设计界面 First you can design the primer
manually
Sense strand or anti-sense strand
引物设计的原则
2.引物GC含量在40%~60%之间,Tm值最 好接近72℃。 GC含量(composition)过高或过低都 不利于引发反应。上下游引物的GC含量 不能相差太大。若按公式Tm=4(G+C) +2(A+T)估计引物的Tm值,则有效引 物的Tm为55~80℃,其Tm值最好接近 72℃以使复性条件最佳。
引物设计的原则
3.引物3′端要避开密码子的第3位。 如扩增编码区域,引物3′端不要终止于 密码子的第3位,因密码子的第3位易发 生简并,会影响扩增的特异性与效率。
引物设计的原则
4.引物3′端不能选择A,最好选择T。 引物3′端错配时,不同碱基引发效率存 在着很大的差异,当末位的碱基为A时, 即使在错配的情况下,也能有引发链的合 成,而当末位链为T时,错配的引发效率 大大降低,G、C错配的引发效率介于A、T 之间,所以3′端最好选择T。
PCR引物设计及相关软件使用
主要内容
• • • • • PCR介绍 引物设计原理 引物设计原则 Primer Premier 5.0 介绍 举例说明引物的设计
1、什么是PCR 聚合酶链反应(Polymerase Chain Reaction ,PCR)是80年代中期发展起来的 体外核酸扩增技术。它具有特异、敏感、 产率高、快速、简便、重复性好、易自动 化等突出优点;能在一个试管内将所要研 究的目的基因或某一DNA片段于数小时内扩 增至十万乃至百万倍;可从一根毛发、一滴 血、甚至一个细胞中扩增出足量的DNA供分 析研究和检测鉴定。
oligo7中文说明

Oligo使用方法介绍作为目前最好、最专业的引物设计软件,Oligo的功能很强,在这里我们介绍它的一些主要功能:如:普通引物对的搜索、测序引物的设计、杂交探针的设计以及评估引物对质量等等。
在正式进行引物设计前,我们首先面临的一个任务就是向Oligo程序导入模板序列,根据不同的实验情况,导入模板有三种方法:1,直接用键盘输入:a,点击file菜单中的New Sequence 浮动命令,或直接点击工具栏中的New Sequence命令,进入序列展示窗口;b,此时即可键入DNA序列;c,如果需要的话,Oligo提供碱基回放功能,在边键入时边读出碱基,防止输入错误。
点击Edit菜单中的“Readback on”即可。
2,利用复制和粘贴:当我们序列已经作为TXT文件存在或其它oligo不能直接open的文件格式,如word文件.html格式,这个功能就显得很有用了。
在相应文件中复制序列后在序列展示窗口粘贴,oligo会自动去除非碱基字符。
当序列输入或粘贴完成后,点击Accept/Discard菜单中的Accept浮动命令,即可进入引物设计模式。
3,如果序列已经保存为Seq格式或者FASTA,GenBank格式时,oligo就可以直接打开序列文件。
点击File菜单中的“Open”浮动命令,找到所需文件,打开即可。
进入引物设计模式后,oligo一般会弹出三个窗口,分别是6-碱基频率窗口,碱基退火温度窗口以及序列内部碱基稳定性窗口,其中的退火温度窗口是我们引物设计的主窗口,其它的两个窗口则在设计过程中起辅助作用,比如6-碱基频率窗口可以使我们很直观地看到所设计引物在相应物种基因组中的出现频率,如果我们的模板是基因组DNA或混合DNA时,该信息就显得有用了,而内部稳定性窗口则可以显示引物的5’端稳定性是否稍高于3’端等。
一,普通引物对的搜索:以Mouse 4E(cDNA序列)为例。
我们的目的是以Mouse 4E(2361 bp)为模板,设计一对引物来扩增出600-800bp长的PCR产物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、引物设计step by step1、在NCBI上搜索到目的基因,找到该基因的mRNA,在CDS选项中,找到编码区所在位置,在下面的origin中,Copy该编码序列作为软件查询序列的候选对象。
2、用Primer Premier5搜索引物①打开Primer Premier5,点击File-New-DNA sequence, 出现输入序列窗口,Copy目的序列在输入框内(选择As),此窗口内,序列也可以直接翻译成蛋白。
点击Primer,进入引物窗口。
②此窗口可以链接到“引物搜索”、“引物编辑”以及“搜索结果”选项,点击Search按钮,进入引物搜索框,选择“PCR primers”,“Pairs”,设定搜索区域和引物长度和产物长度。
在Search Parameters里面,可以设定相应参数。
一般若无特殊需要,参数选择默认即可,但产物长度可以适当变化,因为100~200b p的产物电泳跑得较散,所以可以选择300~500bp.③点击OK,软件即开始自动搜索引物,搜索完成后,会自动跳出结果窗口,搜索结果默认按照评分(Rating)排序,点击其中任一个搜索结果,可以在“引物窗口”中,显示出该引物的综合情况,包括上游引物和下游引物的序列和位置,引物的各种信息等。
④对于引物的序列,可以简单查看一下,避免出现下列情况:3’不要出现连续的3个碱基相连的情况,比如GGG或CCC,否则容易引起错配。
此窗口中需要着重查看的包括:T m应该在55~70度之间,GC%应该在45%~55%间,上游引物和下游引物的T m值最好不要相差太多,大概在2度以下较好。
该窗口的最下面列出了两条引物的二级结构信息,包括,发卡,二聚体,引物间交叉二聚体和错误引发位置。
若按钮显示为红色,表示存在该二级结构,点击该红色按钮,即可看到相应二级结构位置图示。
最理想的引物,应该都不存在这些二级结构,即这几个按钮都显示为“None”为好。
但有时很难找到各个条件都满足的引物,所以要求可以适当放宽,比如引物存在错配的话,可以就具体情况考察该错配的效率如何,是否会明显影响产物。
对于引物具体详细的评价需要借助于Oligo来完成,Oligo自身虽然带有引物搜索功能,但其搜索出的引物质量感觉不如Primer5.⑤在Primer5窗口中,若觉得某一对引物合适,可以在搜索结果窗口中,点击该引物,然后在菜单栏,选择File-Print-Current pair,使用PDF虚拟打印机,即可转换为Pdf文档,里面有该引物的详细信息。
3、用Oligo验证评估引物①在Oligo软件界面,File菜单下,选择Open,定位到目的cDNA序列(在primer中,该序列已经被保存为Seq文件),会跳出来两个窗口,分别为Internal Stability(Delta G)窗口和Tm窗口。
在Tm 窗口中,点击最左下角的按钮,会出来引物定位对话框,输入候选的上游引物序列位置(Primer5已经给出)即可,而引物长度可以通过点击Change-Current oligo length来改变。
定位后,点击Tm窗口的Upper按钮,确定上游引物,同样方法定位下游引物位置,点击Lower按钮,确定下游引物。
引物确定后,即可以充分利用Analyze菜单中各种强大的引物分析功能了。
②Analyze中,第一项为Key info,点击Selected primers,会给出两条引物的概括性信息,其中包括引物的T m值,此值Oligo是采用nearest neighbor method计算,会比Primer5中引物的Tm值略高,此窗口中还给出引物的Delta G和3’端的Delta G.3’端的Delta G过高,会在错配位点形成双链结构并引起DNA聚合反应,因此此项绝对值应该小一些,最好不要超过9。
③Analyze中第二项为Duplex Formation,即二聚体形成分析,可以选择上游引物或下游引物,分析上游引物间二聚体形成情况和下游引物间的二聚体情况,还可以选择Upper/Lower ,即上下游引物之间的二聚体形成情况。
引物二聚体是影响PCR反应异常的重要因素,因此应该避免设计的引物存在二聚体,至少也要使设计的引物形成的二聚体是不稳定的,即其Delta G值应该偏低,一般不要使其超过4.5kcal/ mol,结合碱基对不要超过3个。
Oligo此项的分析窗口中分别给出了3’端和整个引物的二聚体图示和Del ta G值。
④Analyze中第三项为Hairpin Formation,即发夹结构分析。
可以选择上游或者下游引物,同样,D elta G值不要超过4.5kcal/mol,碱基对不要超过3个。
Analyze中第四项为Composition and T m,会给出上游引物、下游引物和产物的各个碱基的组成比例和Tm值。
上下游引物的GC%需要控制在40%~60%,而且上下游引物之间的GC%不要相差太大。
Tm值共有3个,分别采用三种方法计算出来,包括nearest neighbor method、%GC method和2(A+T)+4(G+C)method,最后一种应该是Primer5所采用的方法,T m值可以控制在50~70度之间。
第五项为False Priming Sites,即错误引发位点,在Primer5中虽然也有False priming分析,但不如oligo详细,并且oligo会给我正确引发效率和错误引发效率,一般的原则要使误引发效率在100以下,当然有时候正确位点的引发效率很高的话,比如达到400~500,错误引发效率超过100幅度若不大的话,也可以接受。
⑤Analyze中,有参考价值的最后一项是“PCR”,在此窗口中,是基于此对引物的PCR反应Summa ry,并且给出了此反应的最佳退火温度,另外,提供了对于此对引物的简短评价。
若该引物有不利于PCR 反应的二级结构存在,并且Delta G值偏大的话,Oligo在最后的评价中会注明,若没有注明此项,表明二级结构能值较小,基本可以接受。
⑥引物评价完毕后,可以选择File-Print,打印为PDF文件保存,文件中将会包括所有Oligo软件中已经打开的窗口所包括的信息,多达数页。
因此,打印前最好关掉Tm窗口和Delta G窗口,可以保留引物信息窗口、二级结构分析窗口(若存在可疑的异常的话)和PCR窗口。
4、引物确定后,对于上游和下游引物分别进行Blast分析,一般来说,多少都会找到一些其他基因的同源序列,此时,可以对上游引物和下游引物的blast结果进行对比分析,只要没有交叉的其他基因的同源序列就可以。
二、引物设计过程中的心得1、Primer 5.0搜索引物①Primer Length我常设置在18-30bp,短了特异性不好,长了没有必要。
当然有特殊要求的除外,如加个酶切位点什么的。
②PCR Product size最好是100-500bp之间,小于100bp的PCR产物琼脂糖凝胶电泳出来,条带很模糊,不好看。
至于上限倒也不必要求苛刻。
③Search parameters还是选Manual吧,Search stringency应选High,GC含量一般是40-60%。
其它参数默认就可以了。
④搜索出来的引物,按Rating排序,逐个送Oligo软件里评估。
当然,搜索出的引物,其扩增产物很短,你可以不选择它,或是引物3端≥2个A或T,或引物内部连续的G或C太多,或引物3端≥2个G 或C,这样的引物应作为次选,没得选了就选它。
对于这样的引物,如果其它各项指标还可以,我喜欢在引物末端去掉一个不满意的或加上一个碱基,看看引物的评估参数有没有变好点。
2、Oligo 6.0评估引物①在analyze里,Duplex Formation不管是上游引物、下游引物还是上下游引物之间,The most s table 3’-Dimer绝对值应小于4.5kcal/mol, The most stable Dimer overall绝对值一般应小于多少kcal/ mol跟PCR退火温度有关,我几次实验感觉在PCR退火温度在65°的时候,The most stable Dimer ov erall 6.7kcal/mol没有问题。
②Hairpin Formation根据黄金法则③False priming sites: Primer的priming efficiency应该是错配地方的4倍左右,更多当然更好。
④在PCR栏,设计者感觉其所显示的optimal annealing temperature数值值得参考。
在PCR摸索条件的时候,退火温度为其数值加减2的范围就可以了。
⑤Internal stability很重要:我们希望引物的内部稳定性是中间高、两边低的弧形,最起码保证3端不要过于稳定。
下图引物3端过于稳定,很容易导致不适当扩增。
△G参照黄金法则,这其实很好理解:把一滴水放到大海里,这滴水就会不停的扩散分布,扩散的越厉害越稳定,所以△G绝对值越大结构越稳定。
3、其他①两个评价系统不一样,丁香园战友感觉oligo评价引物好点,primer出来的引物,一般按效率排序,再结合退火温度和引物长度,选择引物到oligo测试。
这是初步的选择,其实引物到了oligo里,退火温度也不一样。
②3端的二聚体应该避免,这个要看退火温度决定,一个50°的退火温度肯定和65°对二聚体的影响不一样了,一般来讲尽量控制在-4.5kcal/mol以下(丁香园战友观点,很多东西真得还是需要自己摸索)。
③我们感觉3端有A无A影响不大,3端有T是不是一定不行,不见得。
软件是评估,法则也不是没有例外,不是1+1=2那么确定。
④错配和二聚体谁轻谁重,丁香园战友觉得“到致命的程度”谁都重要,在设计的时候,尽量两个都不得罪。
⑤GC含量并非不重要,它直接影响引物各端稳定性,3端来两个G或C,稳定性就上去了,粘在模板上很牢。
所以设计引物的时候,会尽量避免这样的情况出现。
自从1985年美国PE—Cetus公司的人类遗传研究室Mullis等发明了具有划时代意义的聚合酶链反应(P CP0 以来,PCR已经成为了分子生物学领域最基本也是最重要的技术手段之-[ I。
然而能否找到一对合适的核苷酸片段作为引物,使其有效地扩增模板DNA序列,无疑决定着PCR的成败。
现在动物遗传育种早已进入了分子时代,在基因水平寻求影响动物遗传表型的新基因突显重要,因此引物设计无疑又成为了寻找新基因的重中之重。
1 引物的设计以及初步筛选引物的设计与初步筛选基本上通过一些分子生物学软件和相关网站来完成的,目前运用软件Primer Pre mier 5 或美国whitehead 生物医学研究所基因组研究中心在因特网上提供的一款免费在线PCR引物设计程序Primer 3来设计引物,再用软件Oligo 6进行引物评估,就可以初步获得一组比较满意的引物。
