吸附等温线
3-吸附等温线

混合吸附的Langmuir方程
设有两种物质A和B 在表面同时吸附且都 不发生解离,用A 和 B分别代表A和B的 覆盖度,则用以上方 法推导出:
Brunaauer-Emmett-Teller 吸 附等温式-BET方程(两个假定)
BET方程是建立在Langmuir吸附理论基础上 的,但同时还认为:1,物理吸附为分子间力, 被吸附的分子与气相分子之间仍有此种力,故 可发生多层吸附,多层吸附与气体的凝聚相似。 2,吸附达到平衡时,每个吸附层上的蒸发速 度等于凝聚速度,故能对每层写出相应的吸附 平衡式,经过一定的数学运算得到BET方程。
反应物的扩散过程
催化剂的颗粒具有使反应物分子可以进 入的内孔。反应物的扩散过程是分以下 两步进行的:
在催化剂周围的介质中的外扩散DE 催化剂孔中的内扩散Di
催化剂周围的介质中的外扩散
在工作状态时,催化剂的颗粒被一个 固定的分子(反应物、产物或介质)滞 流层所包围,反应物、产物分子通过 这个层向催化剂颗粒的外表面的扩散 或向其反方向的扩散,称为外扩散。
III型等温线
在整个压力范围内凸向下,曲线没有拐 点B,此种吸附甚为少见。
曲线下凸表明此种吸附所凭借的作用力 相当弱。吸附质对固体不浸润时的吸附, 如水在石墨上的吸附即属此例。
IV型等温线
开始部分即低P/Po区,与II型等温线类 似凸向上。
在较高P/Po区,吸附明显增加,这可能 是发生了毛细管凝聚的结果。 由于毛细管凝聚,在这个区内,有可能 观察到滞后现象、即在脱附时得到的等 温线与吸附时得到的等温线不重合。
吸附等温线
当吸附与脱附速度相等时,催化剂表面 上吸附的气体量维持不变,这种状态即 为吸附平衡。 吸附平衡与压力、温度、吸附剂的性质 等因素有关。一般地,物理吸附达到平 衡时很快,而化学吸附则很慢。 对于给定的物系,在温度恒定和达到平 衡的条件下,吸附质与压力的关系称为 吸附等温式或称吸附平衡式,绘制的曲 线称为吸附等温线。
讨论吸附等温线的特征和相应的吸附条件

讨论吸附等温线的特征和相应的吸附条件吸附等温线是描述吸附剂与吸附物之间吸附平衡关系的一种图形表示方法。
它是指在一定温度下,吸附剂与吸附物之间的吸附量与吸附剂中吸附物的浓度之间的关系。
吸附等温线的特征和相应的吸附条件对于研究吸附过程和优化吸附工艺具有重要意义。
吸附等温线的形状和特征取决于吸附剂和吸附物之间的相互作用力、温度、压力等因素。
一般来说,吸附等温线可以分为以下几种类型:1. Langmuir型吸附等温线Langmuir型吸附等温线是一种典型的单层吸附等温线,它的特点是吸附量随着吸附物浓度的增加而增加,但是当吸附物浓度达到一定值时,吸附量趋于饱和,不再增加。
这种吸附等温线的形状呈现出一个S形,其数学表达式为:q = qmKc/(1+Kc)其中,q表示吸附量,qm表示最大吸附量,K表示Langmuir常数,c表示吸附物浓度。
2. Freundlich型吸附等温线Freundlich型吸附等温线是一种多层吸附等温线,它的特点是吸附量随着吸附物浓度的增加而增加,但是吸附量的增加速度逐渐减缓。
这种吸附等温线的形状呈现出一个弯曲的曲线,其数学表达式为:q = Kc^n其中,q表示吸附量,K和n分别为Freundlich常数。
3. BET型吸附等温线BET型吸附等温线是一种多层吸附等温线,它的特点是吸附量随着吸附物浓度的增加而增加,但是吸附量的增加速度逐渐减缓,最终趋于饱和。
这种吸附等温线的形状呈现出一个S形,其数学表达式为:q = qmBc/(1-Bc)其中,q表示吸附量,qm表示最大吸附量,B表示BET常数,c表示吸附物浓度。
吸附等温线的相应吸附条件吸附等温线的形状和特征与吸附条件密切相关。
以下是吸附等温线的相应吸附条件:1. Langmuir型吸附等温线的吸附条件Langmuir型吸附等温线适用于单层吸附,吸附剂和吸附物之间的相互作用力较强,吸附物分子在吸附剂表面形成单层吸附。
此时,吸附剂表面的吸附位点数目有限,当吸附物浓度达到一定值时,吸附位点已经全部被占据,吸附量趋于饱和。
吸附等温线及动力学

运用数学和统计方法对数据进行分 析,包括等温线模型的拟合、动力 学参数的计算等,以揭示吸附过程 的本质和规律。
结果展示和讨论要点
结果展示
将实验数据和分析结果以图表、表格和文字等形式进行展示,使得结果更加直观和易于理解。
讨论要点
对实验结果进行讨论和解释,包括吸附等温线的形状、吸附量和吸附强度等参数的变化规律及其影响因素,以及 动力学模型对实验结果的预测和解释能力等。同时,还可以探讨实验结果在实际应用中的意义和价值,以及未来 研究的方向和展望。
展的重要趋势。
复杂体系吸附研究
针对复杂体系的吸附行为研究将成为未来 发展的重要方向,包括多组分竞争吸附、 动态吸附等方面的研究。
跨学科交叉融合
随着计算机科学、人工智能等领域的快速 发展,未来有望通过跨学科交叉融合为吸 附领域的研究和应用带来新的突破。
THANKS
感谢观看
活化能计算
通过实验数据拟合得到活化能值,可用于评估 吸附过程的难易程度。
影响因素
温度、吸附剂性质、表面结构等均可影响活化能的大小。
03
吸附等温线实验方法与数 据处理
实验方法设计原则和实施步骤
设计原则
确保实验条件的一致性和可重复 性,选择合适的吸附剂和被吸附 物质,以及确定合适的温度、压 力和浓度范围。
影响因素
温度、压力(或浓度)、吸附剂性质(如比表面积、孔径分布等)、吸附质性 质(如分子量、极性等)以及共存物质等都会影响吸附等温线的形状和位置。
实验条件选择
为了获得准确可靠的吸附等温线数据,需要选择合适的实验条件,如温度范围、 压力(或浓度)范围、吸附剂和吸附质的用量、接触时间以及分析方法等。同 时,还需要进行多次重复实验以减小误差。
介孔材料的吸附等温线

介孔材料的吸附等温线介孔材料的吸附等温线是指在一定温度下,介孔材料吸附物质的吸附量与其平衡浓度之间的关系。
介孔材料通常具有较大的比表面积、孔径和孔容,因此可以有效地吸附各种分子和离子。
在吸附等温线中,通常采用Langmuir等温线、Freundlich等温线和Bet等温线模型描述介孔材料的吸附特性。
Langmuir等温线是介孔材料最常用的吸附等温线模型之一,该模型假定吸附分子只能吸附在介孔表面上的等价吸附位点上,并且吸附分子之间不发生相互作用。
因此,Langmuir等温线可以用以下方程式表示:q = QmKc/(1 + Kc)其中,q是吸附量,Qm是最大吸附量,Kc是平衡常数,它反映了吸附分子与吸附位点之间的亲和力。
Langmuir等温线通常用于描述单分子层吸附。
Freundlich等温线是另一种常见的介孔材料吸附等温线模型,它描述的是介孔材料的多层吸附特性,即吸附分子在吸附位点上的互相作用。
Freundlich等温线可以用以下方程式表示:q = KfCn其中,q是吸附量,C是平衡浓度,Kf是Freundlich常数,n是吸附等温线的斜率。
当n=1时,Freundlich等温线化为线性等温线,类似于Langmuir等温线。
Bet等温线是另一种较为复杂的介孔材料吸附等温线模型,它考虑了吸附分子在介孔材料表面不同层次上的吸附特性。
Bet 等温线可以用以下方程式表示:q = Q1(KpC)/(1 + KpC) + Q2(KpC)^2/(1 + KpC)^2其中,Q1和Q2是吸附能力系数,Kp是Bet常数。
Bet等温线一般用于描述在介孔材料孔径较大时,吸附分子以多层方式吸附的情况。
吸附等温线

吸附等温线包伟吸附相平衡是吸附分离科学技术的重要基础之一,是表述吸附剂对吸附质分子的最大吸附容量以及吸附选择性。
吸附等温线是吸附相平衡的具体描述,是吸附分离装置设计所必需的参数。
通过对一系列吸附等温线的分类,人们可以更好地理解各种吸附机理并建立相应的理论模型。
同时这一系列吸附等温线的分类还有利于将理论模型更好地应用到实际中去,例如用BET 或Langmuir 的方法测量出样品的比表面积。
IUPAC [International Union of Pure and Applied Chemistry,国际理论与应用化学协会]手册上就有说明:对于吸附过程的研究,第一步就是“确定吸附等温线的类型,然后再确定吸附过程的本质[1,2]”。
对于吸附等温线的分类,主要有以下3种分类方法:1.早期的BDDT 的5 类吸附等温线1940年,在前人大量的研究和报道以及从实验测得的很多吸附体系的吸附等温线基础上,Brunauer S.,Deming L. S.,Deming W. E.和Teller E.等人对各种吸附等温线进行分类,将吸附等温线分为5类(如图1所示),称为BDDT分类,也常被简称为Brunauer吸附等温线分类。
(如上图所示)类型I 是向上凸的Langmuir 型曲线,表示吸附剂毛细孔的孔径比吸附质分子尺寸略大时的单层分子吸附或在微孔吸附剂中的多层吸附或毛细凝聚。
该类吸附等温线,沿吸附量坐标方向,向上凸的吸附等温线被称为优惠的吸附等温线。
在气相中吸附质浓度很低的情况下,仍有相当高的平衡吸附量,具有这种类型等温线的吸附剂能够将气相中的吸附质脱除至痕量的浓度,如氧在-183℃下吸附于炭黑上和氮在-195℃下吸附于活性炭上,以及78K时N2在活性炭上的吸附及水和苯蒸汽在分子筛上的吸附。
类型II 为形状呈反S 型的吸附等温线,在吸附的前半段发生了类型I 吸附,而在吸附的后半段出现了多分子层吸附或毛细凝聚,例如在20℃下,炭黑吸附水蒸气和-195℃下硅胶吸附氮气。
常见吸附等温曲线的类型及其理论分析

contents
目录
• 吸附等温线的基本概念 • 常见吸附等温曲线类型 • 吸附等温曲线理论分析 • 吸附等温曲线在实践中的应用 • 吸附等温曲线的发展趋势与展望
01
吸附等温线的基本概念
定义与分类
定义
吸附等温线是指在一定的温度下,吸 附剂对气体分子的吸附量与气体压力 之间的关系曲线。
吸附等温曲线的调控和优化。
吸附等温曲线理论模型的改进与发展
1 2 3
多分子层吸附模型
在传统的单分子层吸附模型基础上,发展多分子 层吸附模型,能够更准确地描述复杂吸附等温曲 线。
统计热力学模型
结合统计热力学理论,建立更为精确的吸附等温 曲线理论模型,以解释实验数据并预测新体系的 吸附行为。
机理导向模型
气体分子性质
气体分子的性质如分子大小、 极性、扩散系数等也会影响吸
附等温线的形状和位置。
02
常见吸附等温曲线类型
Ⅰ型吸附等温线
总结词
表示单层饱和吸附,吸附量随相对压力的增加而增加,直至接近饱和压力。
详细描述
Ⅰ型吸附等温线是典型的物理吸附等温线,表示吸附剂表面完全被吸附质覆盖, 形成单分子层吸附。在相对压力较低时,吸附量随相对压力的增加迅速增加, 当接近饱和压力时,吸附量增长速度减缓。
VS
详细描述
D-R理论假设气体分子在固体表面形成单 分子层吸附,同时考虑了气体分子在固体 表面和孔内的吸附。该理论可以用来计算 孔径分布和孔体积等参数。
04
吸附等温曲线在实践中 的应用
在气体分离中的应用
分离空气中的氧气和氮气
利用吸附等温曲线,可以找到最佳的吸附剂和操作条件,将空气中的氧气和氮气进行有 效分离。
等温吸附平衡――吸附等温线
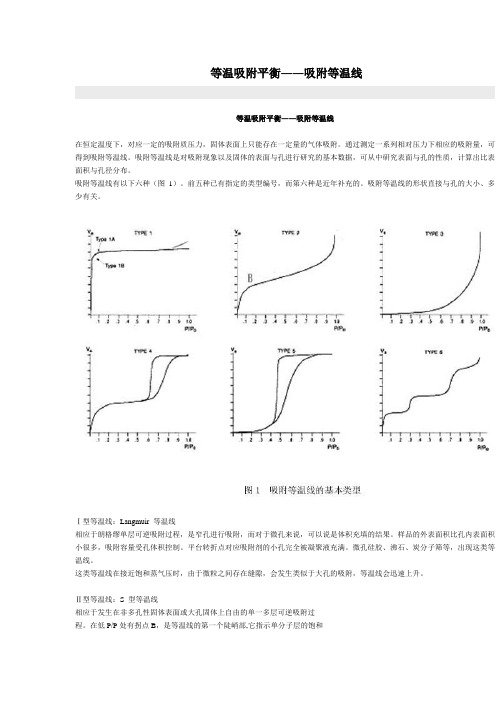
等温吸附平衡――吸附等温线等温吸附平衡――吸附等温线在恒定温度下,对应一定的吸附质压力,固体表面上只能存在一定量的气体吸附。
通过测定一系列相对压力下相应的吸附量,可得到吸附等温线。
吸附等温线是对吸附现象以及固体的表面与孔进行研究的基本数据,可从中研究表面与孔的性质,计算出比表面积与孔径分布。
吸附等温线有以下六种(图1)。
前五种已有指定的类型编号,而第六种是近年补充的。
吸附等温线的形状直接与孔的大小、多少有关。
Ⅰ型等温线:Langmuir 等温线相应于朗格缪单层可逆吸附过程,是窄孔进行吸附,而对于微孔来说,可以说是体积充填的结果。
样品的外表面积比孔内表面积小很多,吸附容量受孔体积控制。
平台转折点对应吸附剂的小孔完全被凝聚液充满。
微孔硅胶、沸石、炭分子筛等,出现这类等温线。
这类等温线在接近饱和蒸气压时,由于微粒之间存在缝隙,会发生类似于大孔的吸附,等温线会迅速上升。
Ⅱ型等温线:S 型等温线相应于发生在非多孔性固体表面或大孔固体上自由的单一多层可逆吸附过程。
在低P/P处有拐点B,是等温线的第一个陡峭部,它指示单分子层的饱和吸附量,相当于单分子层吸附的完成。
随着相对压力的增加,开始形成第二层,在饱和蒸气压时,吸附层数无限大。
这种类型的等温线,在吸附剂孔径大于20nm时常遇到。
它的固体孔径尺寸无上限。
在低P/P区,曲线凸向上或凸向下,反映了吸附质与吸附剂相互作用的强或弱。
Ⅲ型等温线:在整个压力范围内凸向下,曲线没有拐点 B在憎液性表面发生多分子层,或固体和吸附质的吸附相互作用小于吸附质之间的相互作用时,呈现这种类型。
例如水蒸气在石墨表面上吸附或在进行过憎水处理的非多孔性金属氧化物上的吸附。
在低压区的吸附量少,且不出现 B 点,表明吸附剂和吸附质之间的作用力相当弱。
相对压力越高,吸附量越多,表现出有孔充填。
有一些物系(例如氮在各种聚合物上的吸附)出现逐渐弯曲的等温线,没有可识别的B点.在这种情况下吸附剂和吸附质的相互作用是比较弱的。
吸附等温线__概述说明以及解释

吸附等温线概述说明以及解释1. 引言1.1 概述吸附等温线是研究吸附过程中底物与吸附剂之间相互作用的重要工具。
它描述了在一定温度下,单位质量或单位表面积的吸附剂上所吸附的底物的数量随压力或浓度的变化关系。
通过实验和数据分析,可以得到不同条件下的吸附等温线曲线图。
该曲线对于理解和预测吸附过程至关重要。
1.2 文章结构本文将首先介绍吸附等温线的定义和背景,包括其基本概念和研究背景。
接着,将详细说明实验方法和数据分析技术,揭示获得吸附等温线实验数据的方法。
然后,我们将探讨吸附等温线的解释,包括理论模型概述以及分子间相互作用力和温度对吸附能力的影响。
最后,我们将探讨吸附等温线在工业应用领域、环境保护与净化领域以及材料科学与能源研究领域的应用和意义。
文章最后将给出结论,总结文章的要点和重要发现,并展望未来研究方向和挑战。
1.3 目的本文的目的是全面概述吸附等温线的研究进展和应用领域。
通过介绍吸附等温线的定义、实验方法和数据分析,我们希望读者可以了解如何获得吸附等温线实验数据和如何分析这些数据。
同时,我们将阐述吸附等温线的解释,从理论模型出发探讨分子间相互作用力和温度对吸附能力的影响。
最后,通过介绍吸附等温线在工业应用、环境保护与净化以及材料科学与能源研究中的应用与意义,我们希望展示吸附等温线在实际领域中所具有的价值并提供未来研究方向。
2. 吸附等温线:2.1 定义和背景:吸附等温线是描述物质在给定条件下吸附过程的图形表示。
它描述了固体表面与气体或液体相接触时发生的吸附量与平衡压力(或浓度)之间的关系。
吸附等温线通常由实验测得的数据绘制而成,并通过拟合曲线得到更具体的数学模型以解释吸附行为。
2.2 实验方法:实验测量吸附等温线可以使用多种方法,其中最常见的是静态方法和动态方法。
静态方法一般涉及将气体或液体与固体材料放置在封闭容器中,经过一段时间达到平衡后,通过测量样品前后组分或浓度变化来确定吸附量。
动态方法则通过将气体或液体在固定速率下通过固定床层进行流动,实时监测进出口组分或浓度变化来推导吸附等温线。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
/mN m-1
10.7 35.0 25.66 375. 357.
水 – 正己烷 水 – 正辛烷 水 – 氯仿 水 – 四氯化碳 水 – 正辛醇
表面吉布斯自由能
温度、压力和组成恒定时,可逆使表面积增加dA
所需要对系统作的非体积功,称为表面功。用公式表
示为:
W dAs
'
式中 为比例系数,它在数值上等于当T,p 及
/ mN m-1
18.4 21.8 22.3 26.43 72.75 113.8 137.8 250 582 700 878.5 1300 1800
正己烷 正辛醇 乙醇 乙醚 H2O NaCl LiCl Na2SiO3(水玻璃) FeO Al2O3 Ag Cu Pt
固体分子间的相互作用力远远大于液体的,所以固体物质 要比液体物质具有更高的表面张力。
比表面(specific surface area)
单位质量的固体所具有的表面积;或单位体积固 体所具有的表面积。即:
As A0 m
或
As A0 V
式中,m 和 V 分别为固体的质量和体积,As为其 表面积。
分散度与比表面
把物质分散成细小微粒的程度称为分散度。
例如,把边长为1 cm的立方体1 cm3 ,逐渐分
割成小立方体时,比表面将以几何级数增长。 分散程度越高,比表面越大,表面能也越高。
§13.1 表面张力及表面Gibbs自由能
表面张力 表面热力学的基本公式 界面张力与温度的关系 溶液的表面张力与溶液浓度的关系
一、表面张力(surface tension)
2 l 2 l 2 l 2 l 2 l 2 l 2 l 2 l 2 l 2 l 2 l 2 l 2 l 2 l 2 l 2 l
在两相(特别是气-液)界面上,处处存在着一种
张力,这种力垂直于表面的边界,指向液体方向并
与表面相切。 把作用于单位边界线上的这种力称为表面张 力,用 或 表示。 表面张力的单位是:
Nm
1
表10.1.1 某些液态物质的表面张力
物 质 t / °C
20 20 20 25 20 803 614 1000 1427 2080 1100 1083 1773.5
组成恒定的条件下,增加单位表面积时所必须对系
统做的可逆非膨胀功。
表面自由能 (surface free energy)
狭义的表面自由能定义: 广义的表面自由能定义:
G ( )T , p ,nB As
H U A ) S , p ,nB ( )T ,V ,n ( ) S ,V ,nB ( B As As As G ( )T , p ,nB As
这个经验规律称为 Antonoff 规则。
三、表面热力学的基本公式
根据多组分热力学的基本公式
dU TdS pdV BdnB
B
U U S ,V , nB
对需要考虑表面层的系统,由于多了一个表 面相,在体积功之外,还要增加表面功,则基本
公式为:
dU TdS pdV dAs BdnB
表10.1.2 一些固态物质的表面张力 物 质 气 氛
Cu蒸气 真空 真空 真空
t /°C
1050 750 215 5.5 0. 25 1850 20 -196
/mNm-1
1670 1140 685 527 12010 1000 905 4500 1030
Cu Ag Sn 苯 冰 氧化镁 氧化铝 云母石英
(1010晶面)
两种互不混溶的液体形成液-液界面时,界面层分子所处 力场取决于两种液体。所以不同液-液对界面张力不同。
表10.1.3 20°C 某些液-液界面张力(两液体已相互达到饱和) 界 面
/mN m-1
51.1 50.8 32.8 45 8.5
界 面
水 – 乙醚 水–苯 水 – 硝基苯 水–汞 苯–汞
物理化学电子教案——第十三章
表面物理化学
第十三章
§13.1 §13.2 §13.3 §13.4 §13.5 §13.6 §13.7 §13.8 §13.9
表面物理化学
表面张力及表面Gibbs自由能 弯曲表面上的附加压力和蒸气压 溶液的表面吸附 液-液界面的性质 膜 液-固界面—润湿作用 表面活性剂及其作用 固体表面的吸附 气-固相表面催化反应
又可称为表面Gibbs自由能
2
Jm 表面自由能的单位:
表面张力
纯物质的表面张力与分子的性质有关,通常是
(金属键)>
(离子键)>
(极性共价键)> (非极性共价键)
水因为有氢键,所以表面张力也比较大。
Antonoff 发现,两种液体之间的界面张力是两
种液体互相饱和时的表面张力之差,即
1,2 1 2
F =(W1 W2 ) g = 2 l
2 l 2 l 2 l 2 l 2 l 2 l 2 l 2 l 2 lW 2 2 l l 1
这时
W 2 W 2 W 2 W 2 W 2 W 2 W 2 W 2 W 2 W W 2 W2
2
F 2 l
表面张力
表面和界面 (surface and interface)
界面是指两相接触的约几个分子厚度的过渡区, 若其中一相为气体,这种界面通常称为表面。 常见的界面有:气-液界面,气-固界面,液-液 界面,液-固界面,固-固界面。
1.气-液界面
空气 气-液 界面
CuSO 4 溶液
2.气-固界面
气-固界面
U U S ,V , As , nB
B
表面热力学的基本公式
所以考虑了表面功的热力学基本公式为
dU TdS pdV dAs BdnB dH TdS Vdp dAs BdnB
B B B
3.液-液界面
H2 O
Hg
液 -液 界面
4.液-固界面
Hg
液-固界面
H2 O
玻璃板
5.固-固界面
Cr镀层 铁管
固-固界面
界面现象的本质
例 :
直径为 1cm的 球型小水滴
分成 1018个
直 径 10nm 的 圆球形小液滴
表面积: 3.1416cm
2
表面积相 差 106倍
总表面积 314.16m2
