Western blot详细操作过程
Western Blot技术详细操作步骤

Western Blot技术详细步骤蛋白质印记(Western Blot)是一种常用的生物技术,用于检测特定蛋白质在细胞提取物中的存在。
Western Blot基本步骤如下:1. 准备样品和设备:收集细胞或组织样品,然后使用适当的细胞裂解缓冲液将细胞破碎。
前处理样本并测定蛋白质浓度。
准备凝胶电泳设备,包括聚丙烯酰胺凝胶和Tris-glycine SDS运行缓冲液。
2. 凝胶电泳:将处理好的样品与样品缓冲液混合并加热,然后将其加载到凝胶孔中。
接着将预染蛋白质分子量标记也加载至凝胶中。
开始分子量依赖的电泳,使蛋白质在凝胶中分离。
3. 转印:将蛋白质从凝胶转移到结构更加稳定的膜载体,如聚偏氟乙烯 (PVDF)或者硝酸纤维素膜。
使用电转印或半干转印设备进行转移。
4. 封闭:为防止非特异性结合,使用5%无脂奶粉或BSA溶于TBST (Tris-缓冲的盐水加Tween 20)在膜上进行封闭。
一般封闭时间约为1小时,根据实验需求可调整。
5. 第一抗体孵育:将特异性的一抗稀释 (通常为多克隆或单克隆抗体),然后在封闭液中孵育膜。
根据抗体浓度与孵育时间进行相应优化。
6. 清洗:使用TBST清洗膜,以去除未结合的一抗。
通常需要清洗3次,每次5-10分钟不等,避免一抗非特异性结合。
7. 第二抗体孵育:将标记有荧光或酶的二抗稀释后,再次孵育膜。
封闭液中的二抗通常是与一抗长在不同宿主动物中的特异性抗体。
孵育时间需要优化。
8. 清洗:再次清洗膜,以去除未结合的二抗。
重复步骤6的清洗方法。
9. 检测:将膜放入检测设备中,如化学发光仪、荧光扫描仪等。
等待信号产生并记录结果。
测定蛋白质相对表达量的强度并进行定量分析。
10.数据分析:使用图像处理软件进行定量分析,如ImageJ等软件,并进行归一化处理,一般以内参蛋白(如β-actin, GAPDH等)数据为基准。
以上就是蛋白印记的基本操作步骤,具体细节及操作条件可能因实验室环境和试剂不同而有所差异。
western blot实验流程(自己整理)
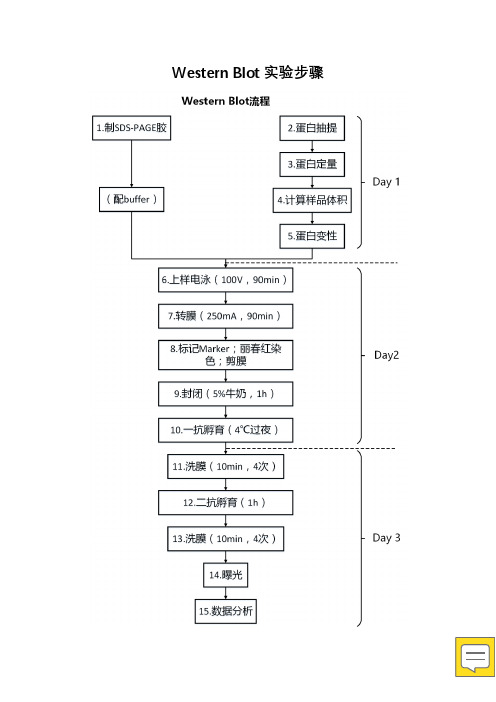
Western Blot实验步骤1.制胶2.细胞蛋白抽提步骤1.提前预冷离心机,溶解lysis buffer;2.将细胞沉淀置于冰上;1ml PBS重悬,4℃离心5min,(除去样中微量血清);3.每107cells加裂解工作液100ul,轻轻重悬细胞沉淀;4.置冰上10min,其间振荡2-3次;5.13000rpm离心10min,4℃;6.将上清转到小离心管中;7.取出1ul,用于Bradford测定蛋白浓度(ug/ul)=(样本OD值的平均值-对照OD值平均值)*斜率100℃,5min;提前预热。
中间打开盖子1~2次。
6.上样电泳(100V,90min)向电泳槽中加入电泳缓冲液,使两块玻璃内侧电泳液高于上样孔,外侧电泳槽内电泳液浸没凝胶底部。
玻璃板内侧液面高于外侧。
然后开始上样,保证每孔总蛋白量在30-50ug,总上样量小于30ul,注意上样时间尽量短,避免样品扩散。
上样完毕,盖好电泳槽的盖子,注意正负极,并选择适当的电压进行电泳。
通常在不连续的系统中,上层浓缩胶的电泳电压(建议70-80V)要低于分离胶电泳电压(建议90-110V),以达到更好的浓缩效果,使样品进入分离胶时被压缩在同一水平线上。
电泳直至溴酚蓝染料前沿下至凝胶末端处停止电泳,电泳时间约2-3 小时。
电泳时间根据具体情况定。
7.转膜(250mA,1h 30min)转膜顺序:阴极碳板+海绵+三滤+胶+膜+三滤+海绵+阳极碳板湿式电转膜1. 电泳结束后取出凝胶,在转膜缓冲液中漂洗数秒。
按“三明治”模式,打开电转印夹,每侧垫上一块专用的用转膜液浸泡透的海绵垫,再各放一块转膜液浸透的快速高效蛋白转移垫(定性滤纸),将凝胶平放在阴极侧滤纸上,最后将转膜液浸透博士德硝酸纤维素NC 膜平放在凝胶上,去除气泡,夹好电转印夹,注意NC 膜与胶,NC 膜与滤纸,滤纸与胶之间不可有气泡。
2. 转印槽加满转膜缓冲液,插入电转印夹,将转印槽放入冰箱内(-20℃),确保NC 膜最靠近正极,带负电的氨基酸和蛋白质向正极迁移。
WesternBlot操作流程

WesternBlot操作流程Western Blot操作流程本⼈将⾃⼰做WB实验时的具体操作流程,做了详细的记录并整理。
因为每个实验室的条件不⼀样,所以本流程仅供参考,具体适合⾃⼰的实验操作需要⼤家摸索。
由于知识量有限,有些描述⽤词并不专业,请⼤家谅解。
⼀、流程图制胶→→电泳跑胶(1.5-2.5h)→→转膜(3h)→→(可使⽤⽴春红检测是否蛋⽩是否成功转移)TBST清洗(10min)→→封闭(2h)→→TBST清洗(10min)→→附Ⅰ抗(内参:⼩⿏抗β-Actin,先摇床轻摇30min,再放冰箱4度过夜)→→TBST 清洗三次(10min/次)→→附Ⅱ抗(内参:⼭⽺抗⼩⿏,轻摇1.5h)→→TBST清洗三次(10min/次)→→显影⼆、物料及配制1、电泳液:⼀包电泳粉+1000ml双蒸⽔(可回收使⽤)2、10%过硫酸铵:1g过硫酸铵+10ml双蒸⽔3、转膜液:⼀包转膜粉+800ml双蒸⽔+200ml甲醇(可回收使⽤)4、TBST溶液:50ml 20*TBS+950ml双蒸⽔+1ml吐温20。
(⽆需回收)5、封闭液:购买6、Ⅰ抗(内参):将⼩⿏抗β-Actin:Ⅰ稀释液按1:500稀释待⽤,4度保存。
Ⅰ抗(⽬的蛋⽩58kDa):将smad2:Ⅰ稀释液按1:1000稀释待⽤,4度保存。
7、Ⅱ抗(内参):将⼭⽺抗⼩⿏:Ⅱ抗稀释液按1:5000稀释代⽤,4度保存。
Ⅱ抗(⽬的蛋⽩58kDa):将⼭⽺抗兔:Ⅱ抗稀释液按1:5000稀释待⽤,4度保存。
7、显影液:按说明书配制,避光可长期回收使⽤8、定影液:按说明书配制,可长期回收使⽤9、发光液:超敏发光液A液:B液=1:1三、步骤(⼀)制胶1、Tris-⽢氨酸SDS-PAGE聚丙烯酰胺凝胶电泳分离胶溶液的配制2、Tris-⽢氨酸SDS-PAGE聚丙烯酰胺凝胶电泳5%积层胶所⽤溶液3、1)将规格1.0mm或其它规格的玻璃板固定好。
2)依次将所需试剂加⼊烧杯中,加⼊TEMED之后,混匀,⽤1000ml的移液枪沿玻璃板缝左右两边的⾓交替加⼊分离胶溶液,也可从左到右连续加⼊(⽬的:两种⽅法都可以使液⾯快速达到⽔平状态)。
Western blot详细操作过程

Western BlotWestern Blot 采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。
经过PAGE 分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄(NC )膜或聚偏二氟乙烯(PVDF )膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。
以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色以检测电泳分离的特异性目的基因表达的蛋白成分。
该技术广泛应用于检测蛋白水平的表达。
流程:蛋白样品的提取→蛋白样品定量与变性→PAGE 凝胶电泳→转膜→丽春红染色→封闭→抗体孵育→底物显色。
实验器材和试剂:一. 蛋白提取试剂1.10% SDS 裂解液:称取10g SDS 粉末加入双蒸水至90mL ,充分溶解,定容至100ml 室温保存。
2.RIPA 裂解液1ml 裂解液工作液配方: 10ul 100mmol/L PMSF (1mM) 0.2ul 10mg/ml Aprotinin (2ug/ml) 5.0ul 1mg/ml Leupeptin (5ug/ml)0.9848ml 裂解液0.5ml 裂解液工作液配方: 5ul 100mmol/L PMSF (1mM) 0.1ul 10mg/ml Aprotinin (2ug/ml) 2.5ul 1mg/ml Leupeptin (5ug/ml)0.4924ml 裂解液 PMSF 必须摇匀至无结晶时才可与裂解液混合3.蛋白酶抑制剂:100mmol/L PMSF :17.4mg PMSF 粉末溶于1ml 异丙醇(AR),分装250ul 每管后-20℃保存。
使用终浓度为1 mmol/L 。
【PMSF :在溶液中不稳定,应在临用前从储存液中现加于裂解液中。
PMSF 剧毒,严重损害呼吸道粘膜、眼睛及皮肤,吸入、吞进或通过皮肤吸收后有致命危险一旦眼睛或皮肤接触了PMSF ,应立即用大量的水冲洗。
Westernblot实验操作详细步骤

Westernblot实验操作详细步骤1.样本制备:a.收集细胞或组织样本并加入提取缓冲液,破碎细胞或组织以释放蛋白质。
b.用超声波破碎机或搅拌器处理样本,使其彻底破碎。
c.避免加入蛋白酶抑制剂和磷酸酶抑制剂以防止蛋白质的降解。
2.蛋白质分离:a.将样本加入离心管中,并用高速离心分离细胞碎片和细胞核。
b.收集上清液,其中包含溶解的蛋白质。
3.蛋白质浓度测定:a. 使用BCA或Bradford等方法测定提取的蛋白质浓度。
b.根据需要调整蛋白质浓度,以确保每个样本使用相同的蛋白质量。
4.准备SDS-凝胶:a.准备解聚凝胶和浓缩凝胶以进行垂直电泳。
b.根据需要选择合适的胶百分比和凝胶组装器。
c.制备足够的凝胶和凝胶缓冲液。
5.蛋白质电泳:a.将蛋白质样本加入加载缓冲液,并在煮沸过程中使其变性。
b.将蛋白质样本加载至凝胶槽中。
c.根据需要在凝胶中加入预定分子量标记物,以便于蛋白质分子量的确定。
d.以恒定电流进行电泳,直到预定分子量标记物到达所需位置。
6.蛋白质转膜:a.选择合适的膜材料(例如聚偏氟乙烯或硝酸纤维素)。
b.用蛋白质转膜装置将凝胶上的蛋白质转移到膜上。
c.确保膜与凝胶完全贴合,并尽量避免气泡的产生。
7.阻塞和抗体孵育:a.将膜放入含有5%非脂奶粉或1%牛血清蛋白的TBST缓冲液中进行阻塞。
b.在蛋白质靶向抗体中稀释贮存液,并使用适当的稀释倍数进行孵育。
c.将膜和抗体一起放入摇床或孵育箱中,在适当的温度下进行孵育。
8.洗涤:a.用TBST缓冲液洗涤膜以去除未结合的抗体。
b.进行3至5次洗涤,每次洗涤持续5到10分钟。
9.二次抗体孵育:a.将膜放入稀释过的二抗溶液中进行孵育。
b.孵育时间和温度根据抗体种类和需求进行调整。
10.再洗涤:a.用TBST缓冲液进行大约3至5次洗涤。
b.确保彻底洗涤以去除未结合的二抗。
11.信号检测:a.使用化学发光或荧光探针对膜上的蛋白质进行检测。
b.按照探针供应商的说明进行操作。
western-blot实验操作步骤

western-blot实验操作步骤Western,也称Western blot、Western blotting、Western印迹,是用抗体检测蛋白的重要方法之一。
可按照以下步骤操作。
1.收集蛋白样品(Protein sample preparation)使用细胞裂解液,对贴壁细胞、悬浮细胞或组织样品进行裂解。
然后测定每个蛋白样品的蛋白浓度。
2. 电泳(Electrophoresis)(1) SDS-PAGE凝胶配制SDS-PAGE凝胶(分离胶及浓缩胶)可以参考一些文献资料进行配制(2) 样品处理在收集的蛋白样品中加入适量浓缩的SDS-PAGE蛋白上样缓冲液。
例如2X或5X的SDS-PAGE蛋白上样缓冲液。
使用5X的SDS-PAGE 蛋白上样缓冲液可以减小上样体积,在相同体积的上样孔内可以上样更多的蛋白样品。
5X的SDS-PAGE蛋白上样缓冲液可以参考相关文献资料配制, 100℃或沸水浴加热3-5分钟,以充分变性蛋白。
(3) 上样与电泳(1)冷却到室温后,把蛋白样品直接上样到SDS-PAGE胶加样孔内即可。
为了便于观察电泳效果和转膜效果,以及判断蛋白分子量大小,最好使用预染蛋白质分子量标准。
(2)电泳时通常推荐在上层胶时使用低电压恒压电泳,而在溴酚蓝进入下层胶时使用高电压恒压电泳。
对于Bio-Rad的标准电泳装置或类似电泳装置,低电压可以设置在80-100V,高电压可以设置在120V左右。
(3)为了电泳方便起见,也可以采用整个SDS-PAGE过程恒压的方式,通常把电压设置在100V,然后设定定时时间为90-120分钟。
设置定时可以避免经常发生的电泳过头。
通常电泳时溴酚蓝到达胶的底端处附近即可停止电泳,或者可以根据预染蛋白质分子量标准的电泳情况,预计目的蛋白已经被适当分离后即可停止电泳。
3. 转膜(Transfer)(1)我们推荐在Western实验中选用PVDF膜。
硝酸纤维素膜(NC膜)也可以使用,但硝酸纤维素膜比较脆,在操作过程中特别是用镊子夹取等过程中容易裂开。
Western blot(蛋白印迹法)详细步骤

Western blot(蛋白印迹法)详细步骤一、组织的研磨准备:研钵、研磨棒、EP管、药匙、液氮、液氮匙、自封袋、一次性手套、棉手套步骤:①用研磨棒将装有冻存组织的EP管敲碎,取出组织,在研钵中盛满液氮,用力敲碎组织,研磨。
②研磨过程中一旦液氮干了,立即加入液氮,保持研磨在液氮中进行,直至组织呈干粉状。
③用在液氮中浸泡过的药匙将研磨好的粉末盛入新的EP管中。
④装有组织粉末的EP管现在液氮中保存,待所有组织都研磨结束后装入自封袋,于-80℃保存。
注意:1.研钵使用前要用锡纸包口、研磨棒用锡纸包头,在烘箱中烘烤180℃至少3h 以上。
2.组织研磨成粉末后待液氮全部挥发后再将组织粉末装管。
3.每种样品都最好留有副管,备用。
二、裂解提蛋白准备:裂解液配制比例RIPA:PMSF=1000:10=100:1若需要加入蛋白酶抑制剂,则比例一般为1:1000(即1ml裂解液加1μl蛋白酶抑制剂)步骤:①将RIPA和PMSF按比例混匀,加入到装有组织粉末的EP管中,一般加入300~500μl左右(浓度尽量高点)。
②盖好盖子,在冰上裂解30~40min.③到时间后于4℃,12000rpm离心10min,取上清液转移到新的离心管中,于-20℃保存。
注意:1.裂解液加入后用手指弹一下混匀,当加入量很少时,成粘稠状,有必要时应用枪头混匀。
三、BCA法测定蛋白浓度(BCA试剂盒)准备:BCA试剂盒(BCA试剂A、BCA试剂B、蛋白标准液)、酶标板、酶标仪、摇床步骤:①按1:15或1:30稀释待测样品,即取1μl样品+14μl水。
③按50体积BCA试剂A加1体积BCA试剂B(50:1)根据样品数量配制BCA工作液。
④每个标准品孔加入200μl BCA工作液,样品孔加入待测样品10μl和200μlBCA工作液,充分混匀,在摇床上震荡30s,37℃放置30min,于492nm下测定OD值。
⑤标准曲线以蛋白含量(μg)为横坐标,吸光度为纵坐标,根据样品的吸光度可以在标准曲线上查得相应的蛋白含量。
Western Blot实验详细步骤

Western Blot实验技术一、制胶SDS-PAGE分离胶配方表1、检查制胶器是否漏水,吸干玻璃中水分2、配置分离胶,加入玻璃板中(注意:不能有气泡和杂物),距离玻璃上口1.5mL 停止加胶。
3、再加ddH2O或异丁醇水封除去气泡,凝胶后倒掉水,吸干水到浓缩胶插梳。
二、上样1、先在内槽加满电泳液才可以拔梳子。
2、拔梳子时垂直向上拔出,不可左右摇晃梳子。
3、拔完梳子后观察梳子孔,是否有缺口和歪,用针头拨正。
4、上样时从左到右依次上样。
5、若上样组不多时,左右第一孔不加样。
6、要预留Marker的上样孔。
三、电泳四、转膜PVDF膜即聚偏二氟乙烯膜(polyvinylidene fluoride)是蛋白质印迹法中常用的一种固相支持物。
PVDF膜是疏水性的,膜孔径有大有小,随着膜孔径的不断减小,膜对低分子量的蛋白结合就越牢固。
(转膜缓冲液:需4度预冷,现配现用,不能放太久。
)1、转印滤纸:全胶长8.5cm,宽5.5cm,需剪裁成7层滤纸,压平后约3mm。
需在转膜缓冲液中平衡浸泡备用。
2、海绵垫:在转膜液中平衡浸泡备用。
3、PVDF膜:剪裁8.5cm*5.5cm ,需在甲醇中浸润2min(活化膜上正电基团),然后在转膜缓冲液中平衡浸泡备用。
4、凝胶:凝胶也需要在预冷的转膜转膜缓冲液中平衡浸泡3-5分钟。
否则在转膜过程中会出现皱缩,导致出现转移的条带变形。
三明治夹心法:负极(黑)-海绵垫-滤纸-胶-PVDF膜-滤纸-海绵垫-正极(白)转膜时间:通电恒流,60V,一个槽100mA左右,1h(注意:在操作过程中用玻棒赶走气泡。
装置转膜仪时注意黑对黑(负对负),白对红(正对正)。
装置运行时需冰浴。
)五、封闭在进行抗体杂交之前,需要先对转印膜进行封闭,以防止抗体对非转印蛋白区域的非特异性吸附。
封闭一般采用异源性蛋白质或去污剂,本实验室常用的有5%BSA,10%脱脂奶等,至于选择哪一类封闭液,首先应考虑与检测目的相适应(做l酪氨酸磷酸化时不推荐non-fat milk 封闭)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Western BlotWestern Blot 采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。
经过PAGE 分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄(NC )膜或聚偏二氟乙烯(PVDF )膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。
以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色以检测电泳分离的特异性目的基因表达的蛋白成分。
该技术广泛应用于检测蛋白水平的表达。
流程:蛋白样品的提取→蛋白样品定量与变性→PAGE 凝胶电泳→转膜→丽春红染色→封闭→抗体孵育→底物显色。
实验器材和试剂:一. 蛋白提取试剂1.10% SDS 裂解液:称取10g SDS 粉末加入双蒸水至90mL ,充分溶解,定容至100ml 室温保存。
2.RIPA 裂解液1ml 裂解液工作液配方: 10ul 100mmol/L PMSF (1mM) 0.2ul 10mg/ml Aprotinin (2ug/ml) 5.0ul 1mg/ml Leupeptin (5ug/ml)0.9848ml 裂解液0.5ml 裂解液工作液配方: 5ul 100mmol/L PMSF (1mM) 0.1ul 10mg/ml Aprotinin (2ug/ml) 2.5ul 1mg/ml Leupeptin (5ug/ml)0.4924ml 裂解液 PMSF 必须摇匀至无结晶时才可与裂解液混合3.蛋白酶抑制剂:100mmol/L PMSF :17.4mg PMSF 粉末溶于1ml 异丙醇(AR),分装250ul 每管后-20℃保存。
使用终浓度为1 mmol/L 。
【PMSF :在溶液中不稳定,应在临用前从储存液中现加于裂解液中。
PMSF 剧毒,严重损害呼吸道粘膜、眼睛及皮肤,吸入、吞进或通过皮肤吸收后有致命危险一旦眼睛或皮肤接触了PMSF ,应立即用大量的水冲洗。
凡被PMSF 污染的衣物应予丢弃。
】二. 蛋白定量试剂: 1. BCA 蛋白定量试剂盒2. 10ml 0.9%的生理盐水(90mg NaCl 溶于10ml 去离子水中) 三. 上样用试剂: 6×SDS 上样缓冲液:取一个离心管,秤取2.0g SDS 粉末,6mg 溴酚蓝(BromopHenolblue;Albutest)粉末,然后用枪头加入5mL 1.5mol/L Tris-HCl (pH 6.8),用移液管加入10mL Glycerol(甘油,丙三醇),枪头加入2mL β-mercapteethanol (β-巯基乙醇)充分混匀,加双蒸水定容至20ml ,涡旋溶解。
4℃避光保存。
四.电泳工作液:1.1.5mol/L Tris-HCl缓冲液:(三(羟甲基)氨基甲烷)称取18.171g Tris粉末,加入60mL 双蒸水中,加盐酸调节pH至6.8或8.8,定容至100mL。
4℃保存。
可致癌,不要直接接触皮肤。
2.1.0mol/L Tris-HCl缓冲液:称取12.114g Tris粉末,加入60mL 双蒸水中,加盐酸调节pH至6.8或8.8,定容至100mL。
4℃保存。
可致癌,不要直接接触皮肤。
3.0.5mol/L Tris-HCl缓冲液:称取6.057g Tris粉末,加入60mL 双蒸水中,加盐酸调节pH至6.8或8.8,定容至100mL。
4℃保存。
可致癌,不要直接接触皮肤。
4.10% APS:(一周内使用,最好新鲜配置)称取0.5g APS粉末,加入双蒸水至5 mL,充分溶解,4℃保存。
5.10% SDS:秤取10g SDS粉末溶于100ml双蒸水中,可50℃水浴下溶解,室温保存。
如在长期保存中出现沉淀,水浴溶化后,仍可使用混匀后在室温下静置15min,然后加入5ul TEMED即为分离胶,即可灌胶。
6. 4%浓缩胶(上层胶):0.7mL 30% Acr/Bis;1.5mL 0.5mol/L Tris-HCl (pH 6.8);60μL 10% SDS;3.6mL双蒸水混匀后加入50μL 10% APS和5μL TEMED(灌胶时再加)。
7.1×电泳液缓冲液(使用液)(PH=8.3):3.04 g Tris粉末,14.4g甘氨酸(Glycine)粉末,1g SDS粉末溶于800ml双蒸O定容至1000ml,室温保存。
可重复使用3-5次。
水中,调PH=8.3,用ddH210×电泳液缓冲液(储存液)(PH=8.3):30.4 g Tris粉末,144g甘氨酸(Glycine)粉末,10g SDS粉末溶于800ml双蒸O定容至1000ml,室温保存。
水中,调PH=8.3(浓HCl调),用ddH2五.转膜工作液:1×转膜液缓冲液(使用液)(PH=8.3):3.0 g Tris粉末,14.1g甘氨酸(Glycine)粉末,1.25g SDS粉末溶于800ml双蒸水中,用ddHO定容至1000ml,溶解后室温保存,使用时再加250mL甲醇(AR)可重复2使用3-5次。
10×转膜液缓冲液(储存液)(PH=8.3):30.0 g Tris粉末,141g甘氨酸(Gl ycine)粉末,12.5g SDS粉末溶于800ml双蒸O定容至1000ml,溶解后室温保存。
使用时稀释10倍,加入20%甲醇。
水中,用ddH2可取10×溶液100ml, ddH2O 900ml,甲醇250ml。
(重复利用再重新加入甲醇50ml)六.封闭液1g脱脂奶粉于20mL 1X TBST混匀,4℃保存。
保存时间不能太久,有味道就不能用了。
七.抗体孵育用液1X TBST缓冲液(使用液):O 24.2g Tris粉末,87.6g NaCl,10mL Tween20(AR)溶于800ml双蒸水中,用ddH2定容至1000ml调节pH至7.4。
室温保存。
10X TBST缓冲液(储存液):O 24.2g Tris粉末,87.6g NaCl,10mL Tween20(AR)溶于800ml双蒸水中,用ddH2定容至1000ml调节pH至7.4。
室温保存。
八.丽春红染液(可回收利用)九.显影液Western Lightning ECL Pro十.STRIP膜再生试剂 100ml 5ml 8ml 12ml 14ml10% SDS 20ml 1ml 1.6ml 2.4ml 2.8ml0.5M Tris HCl (pH6.8) 12.5ml 0.625ml 1ml 1.5ml 1.75ml0 67.5ml 3.375ml 5.4ml 8.1ml 9.45mlddH2β- mercaptoethanol 0.8ml 40ul 64ul 96ul 112ul操作步骤:(一)蛋白样品制备(1)待测蛋白细胞收集1.准备冰盒,提前准备好需要的试剂和器材,EP管:标记好相关信息(细胞名称,蛋白提取,转染信息,时间);离心管,滴管,含血清的培养液,胰蛋白酶,PBS。
4℃离心机提前预冷;2.弃掉皿内的无血清培养液(含血清的培养液,可直接收到相应的离心管),用1.0ml的PBS清洗,将PBS收到相应的离心管内,再用1.0ml的PBS清洗,收集PBS,每皿加1ml的胰蛋白酶进行消化,37℃,5min。
3.消化后将皿放在冰盒上,冰上操作。
用培养液(可以用离心管内带血清的培养液)吹打细胞,收入离心管(可再冲洗一次,冲洗干净),将离心管配平后放1500r/5min离心。
4.取出离心管,吸掉上清(注意不要碰到蛋白固体),管底留少量液体,用手弹离心管底部,震荡离心管,加入1ml的PBS吹打几次后移入相应的EP管,在离心管再加入0.5ml的PBS清洗加入EP管。
EP管配平后4℃,1500r/5min。
5.取出EP管,轻轻吸掉上清,留少许液体在底部,弹几下EP管进行震荡,加入1.5ml的PBS涡旋3-5次,配平后4℃,1500r/5min。
6.取出EP管,轻轻吸掉上清,留少许液体在底部,配平状态在4℃离心机进行离心,转速为最高转速14800转,达到此速度立刻停止,取出EP管,小心吸掉所有的液体。
7.将EP管放在-80℃冰箱内保存。
(2)细胞总蛋白的提取:1.准备相应的试剂和器材,按照配方配置裂解液和 PMSF溶液,4℃离心机提前开机预冷,准备冰盒。
2.取出收集好的蛋白样品置于冰上。
3.按照配方配置裂解工作液,(根据试剂盒实际要求)摇匀置于冰上。
(PMSF要摇匀至无结晶时才可与裂解液混合),取40-50ul(细胞多用50ul)裂解工作液加入细胞EP管中,吹打均匀,涡旋几次,冰上裂解30min,(裂解期间每10min涡旋一次),裂解完成后再涡旋一次然后转移至4℃离心机14800r/20min(提前开离心机预冷)。
取出离心后的EP管吸取上清,置于新的EP管中。
4. 将轻微离心后的上清可分装后放于-20℃保存。
(二)蛋白含量的测定1.配置10ml 0.9%的生理盐水(90mg NaCl溶于10ml去离子水中),用于配置相应的BSA梯度溶液。
2.将标准样品和蛋白样品按下表稀释和加样检测范围=(20-2000ug/ml)工作液最后加,加工作业速度要快,且在冰上操作。
样品:工作液=1:8(25ul:200ul)3.BCA A:BCA B=50:1,每孔需要200ul工作液。
根据需要的数量配置工作液,所需工作液的总体积为:(标准品的个数 + 待测蛋白质样品的个数)×( 实验重复次数)×(用于每个样品的工作液的体积) =所需的工作液(当试剂 B 加入到试剂 A 中时,开始可观察到有浑浊产生,经搅拌后浑浊会迅速消失,得到绿色澄清工作液。
工作液储存于密闭容器中,在室温下可稳定保存数天)注:如果样品有限,则可取标准品和待测未知样品10ul(样品与工作液的比例为1:20)。
然而,在这种情况下,定量分析的检测范围将被限制在125-2000g/mL。
A B C D E F G H I4. 将微孔板密封,在 37℃恒温箱30转中孵育30分钟。
(孵育时盖报纸避光)5. 将微孔板冷却到室温。
使用微孔板读数仪,测量样品在 562nm 或该波长附近的吸光值。
打开酶标仪“Gen5 CHS 2.04”图标→新建记录→检测,吸收光→波长562→打开96孔板盖子放入机器开始检测,将结果复制到Excel 中拷贝。
该方法在波长 540-590nm 范围内均可成功得到结果。
由于微孔板酶标仪的光路长度比使用比色皿的分光光度计短,因此微孔板方案要求样品与工作液的比例更高,才能获得与试管标准方案相同的灵敏度。
如果想要得到较高的562nm 处的吸光值,则需将孵育时间增加到2 小时。
