第25章 芳环上的取代反应
芳环的取代反应
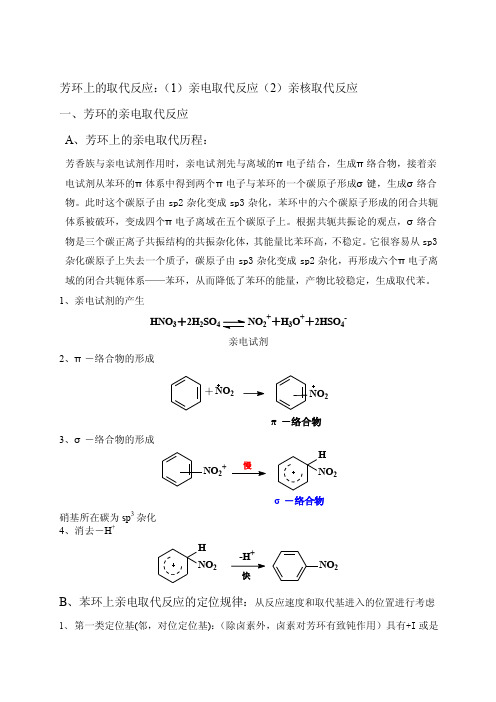
芳环上的取代反应:(1)亲电取代反应(2)亲核取代反应 一、芳环的亲电取代反应 A 、芳环上的亲电取代历程:芳香族与亲电试剂作用时,亲电试剂先与离域的π电子结合,生成π络合物,接着亲电试剂从苯环的π体系中得到两个π电子与苯环的一个碳原子形成σ键,生成σ络合物。
此时这个碳原子由sp2杂化变成sp3杂化,苯环中的六个碳原子形成的闭合共轭体系被破环,变成四个π电子离域在五个碳原子上。
根据共轭共振论的观点,σ络合物是三个碳正离子共振结构的共振杂化体,其能量比苯环高,不稳定。
它很容易从sp3杂化碳原子上失去一个质子,碳原子由sp3杂化变成sp2杂化,再形成六个π电子离域的闭合共轭体系——苯环,从而降低了苯环的能量,产物比较稳定,生成取代苯。
1、亲电试剂的产生HNO 3+2H 2SO4NO 2++H 3O ++2HSO 4-亲电试剂2、π-络合物的形成+NO 2π-络合物23、σ-络合物的形成NO 2+HNO2σ-络合物硝基所在碳为sp 3杂化 4、消去-H ++NO 2H NO 2快B 、苯环上亲电取代反应的定位规律:从反应速度和取代基进入的位置进行考虑1、 第一类定位基(邻,对位定位基):(除卤素外,卤素对芳环有致钝作用)具有+I 或是+C 效应,其作用是增大芳环的电子云密度。
致活基NH 2NHR2OHORNHCROPhR致钝基F Cl BrI2、 第二类定位基(间位定位基):具有-I 或-C 效应,使芳环上的电子云密度降低,均为致钝基NO 2NR 3COOHCOORSO 3HCNCHOCROCCl 3C 、影响亲电取代的因素:(1)芳环上取代基对于E +进入芳环位置的影响第一类定位基-邻对位定位基第二类定位基-间位定位基共振式越多, 正电荷分散程度越大,芳正离子越稳定。
(2) 动力学控制与热力学控制: α位取代-动力学控制产物; β位取代-热力学控制产物。
(3) 邻位和对位定向比:a 亲电试剂的活性越高,选择性越低。
胡宏纹《有机化学》第3版下册配套题库名校考研真题及详解(芳环上的取代反应)【圣才出品】

胡宏纹《有机化学》第3版下册配套题库名校考研真题及详解
第25章芳环上的取代反应
一、选择题
1.下列化合物,与HBr起S N l反应的速率最慢的是()。
[清华大学2006研]
【答案】(D)
2.反应的产物是()。
[武汉大学2002研]
【答案】(A)
【解析】喹啉的亲核取代反应主要发生在C2上。
二、填空题
1.比较下列各组化合物亲电取代反应活性。
[浙江大学2004研]
【答案】亲电取代反应活性:(A)>(C)>(B)
【解析】吡咯分子中环内每个碳原子提供1个p电子、氮原子提供2个p电子,组成大π键,氮原子的给电子共轭效应大于吸电子诱导效应,故吡咯中电子云密度比苯高;而吡啶分子中氮原子上的孤对电子没有参与大π键,氮原子的吸电子诱导效应大于给电子的共轭效应,故吡啶环内的电子云密度比苯低。
2.排出下列各化合物在亲电取代反应中的活性大小次序:。
[清华大学1999研、大连理工大学2003研]
【答案】亲电取代反应活性:(C)>(B)>(A)>D)
【解析】呋喃、噻吩电子云密度比苯高,相对而言,氧的给电子共轭效应比硫强,故呋喃的电子云密度比噻吩高,更易发生亲电取代反应,而吡啶中由于氮的电负性比碳强,故吡啶环上的电子云密度比苯低,其亲电取代反应活性不如苯。
芳环的亲电取代亲核取代反应芳环取代基的反应

二、取代基对芳环亲电取代反应的影响
4. 定位效应与定位规律的分析与解释 从实验事实提出的问题:
—— 为什么致活基都是邻对位取代基? —— 为什么大多数致钝基都是间位定位基? —— 为什么卤素既是弱的致钝基,又是邻对位定位基?
以下从三个方面进行分析讨论: —— 电子效应对苯环上电子云密度分布的影响 —— 苯环上电子云密度分布的理论计算结果 —— 反应中活泼中间体的结构与稳定性
CH3和烷基:弱致活基,邻对位定位基。
ortho-
CH 3 E H
CH 3 E H
CH 3 E H
parameta-
particularly stable CH 3
SO3
2 中等强度亲电试剂,能取代致活、不能取代致钝 的芳环:
—— R+ (obtained by R-Cl + AlCl3)
—— RC+=O (obtained by RCOCl + AlCl3)
———R2C=O+H(obtained by R2C=O + H+)
3 弱亲电试剂,只能取代高活化的芳环:
一、芳环的亲电取代反应及机制
(1) Halogenation
一、芳环的亲电取代反应及机制
(1) Halogenation
一、芳环的亲电取代反应及机制
(2) Nitration
一、芳环的亲电取代反应及机制
(3) Sulfonation —— reversible reaction
磺化反应是可逆的,存在动力学和热力学控制的竞争
二、取代基对芳环亲电取代反应的影响
1. Experimental Facts:
CH 3 HNO 3
CH 3 NO 2
芳环亲核取代反应

③、按SN1机理进行的亲核取代反应
当环上有吸电子基团内时, 重氮盐的分解速率减慢;
当环上有供电基团时: 若取代基处于间位,提高反应速率; 若取代基处于对位,降低反应速率。
2、 离去基团对活性的影响
离去基团离去能力的大致次序是
F > N O 2 > O T s > S O C 6 H 5 > C l,B r,I, > N 3 > N R 3 > O R ,O A r,S R ,S O 2 R ,N H 2
Note: 在芳香亲核取代反应中离去能力是 F > Cl , Br , I , 这不同于脂肪族亲核取代反应SN1和SN2 的取代顺序。
原因:芳香取代反应机理常常是第一步是决定速率的, 在该步中,强的 -I 基团有利于反应的进行, 这也解释了F和NO2是那样容易离去的原因。
离去基团离去的难易,不仅和基团离去后生成的 负离子的稳定性有关,还与亲核试剂的性质有关
NO2 H+
OH NO2
O2N
NO2
NO2
NO2
Cl
ONa
OH
NO2Na2 CO3O2N 35℃
NO2 H+O2N
NO2
NO2
N O2
N O2
B.芳基重氮离子的单分子亲核取代(SNAr1)
在芳环上按照SN1机理进行的反应很少,重氮盐的重氮基 被取代的反应认为是按SN1机理进行的。
NN slow fast
+
NH2
50%
50%
B r
N aN H 2.液 液氮 氨
C H 3 - 35℃ N H 2
C H 3+
N H 2
CH3O
57%
芳环上的取代卤化

5
3.2.2 卤化反应动力学
C6H6 + Cl2 k1 C6H5Cl + HCl C6H5Cl + Cl2 k2 C6H4Cl2 + HCl C6H4Cl2 + Cl2 k3 C6H4Cl3 + HCl
表 苯在氯化、磺化和硝化反应中k1/k2的比较
反应类 型
氯化
磺化
硝化
k1/k2
8.5
103~104 105~107
6
图 苯在间歇氯化时的产物组成变化
每摩尔纯苯所消耗的氯气的量(摩尔) 叫做氯化深度。
7
3.2.3 氯化重要实例
氯化反应的主要影响因素 氯苯的制备 2,6-二氯苯酚的制备 2,6-二氯苯胺的制备
8
3.2.3.1氯化反应的主要影响因素
原料纯度 (1)水份:<0.04%
Cl Cl
Cl
Cl
SO2NH2
20
二苯脲法 O
NH2
NH2
C NH
O
NH2
C NH
O
NH2
C NH
Cl
Cl Cl
Cl
SO3H
SO3H
NH2
Cl
Cl
NH2
Cl
Cl
SO3H
SO3H
SO3H
21
环己酮氯化、胺化、热解脱氯化氢法
O
H
H
O
Cl
Cl
H H
H H
Cl H
Cl H
H H
HH
H H
HH
NH
Cl
Cl
Cl H
Cl2, AlCl3
CCl4 氯化
HO
Cl
Cl
C(CH3)3
HO
第五章 芳环上的取代反应

E H
反应进程
硝化反应:
HNO3
2H2SO4 HNO3
+ NO2
H2SO4
+
NO2
2HSO4
H3O
NO2+
NO2 H
卤代反应:
R + Br2 FeBr3 Br R
机理:
Br2 + FeBr3
Br Br
δ
δ
FeBr3
OH NO2
2)H3O+
Cl
o NO2 1)Na2CO3,H2O,100 C
OH NO2
2)H3O+ NO2 NO2
反应活性:
Cl O2N NO2 NO2
Cl NO2 + NH3
Cl
Cl NO2
Cl
>
Cl ≈ NO2
>
>
>
NO2
NO2
NH2 NO2
NO2
NO2
(二) 消除-加成反应机理 (苯炔机理) OCH3 Br OCH3 NaNH2 NH2 OCH3 NH 2
NH2 Cl HBr, H2O, NaNO2 10oC
CH3
+ N2Br Cl CuBr, HBr
CH3
Br Cl
Sandmeyer反应
NH2 HCl,H2O,NaNO2 0~5oC
N2Cl KI
+
-
I
Schiemann反应:
NH2 HBF4, NaNO2 CH3
NH2 HCl, H2O, NaNO2
Chapter 5
芳环上的取代反应

+ N2
,
CuBr HBr
N CuCl
+ N2
①历程
N2
+ N
+ CuCl
Cl-
+ CuCl2 +N2
Cl
+ CuCl2
N2Cl-
+ CuCl
②举例
CuCN KCN
CN
+ N2
2. Gattermann(加特曼反应)
N2ClCl
N2Br-
Br
Cu HCl
Cu HBr
注:Cu代替CuCl或CuBr
N2ClNO2
+E+ +H+
中间体碳正离子 σ-络 合 物
2.典型亲电取代反应历程举例: 硝化反应:
HNO3+2H2SO4
H
每摩尔 HNO3在浓 H2SO4中 形成四个质点 (冰点降低实验证实)
H3O+2HSO4+NO2
NO2
H NO2
拉曼光谱中 NO2在 1400cm-1 处有吸收带
NO2
+ NO2
慢
+HSO4 -
COOH C H C C
N2+ COOH
Cu -N2
H COOH
-H
△ 菲
三.苯炔历程(消除-加成历程) Cl 1. 反应历程: NH
2
Cl
-Cl-
NH2
H NH2
NH2
NH3
+ NH2
苯炔历程证明: ①红外光谱证明
(8 K时可观察到它的光谱)
②碘苯与NaNH2反应时,加入1,3-环己二烯或呋喃可生成D-A产物。
N2Cl
芳香族化合物的取代反应

(D)H (D)H NO2 H(D) HNO3/H2SO4 H(D) H(D) kH/kD = 1.05 (D)H (D)H NO2 H(D) NO2 H(D)
容易观察到较小的同位素效应 (kH/kD = 1-3,而非正常的6-7): 第一步具有可逆性及由此引起 的分配效应所产生的。
:
:
:
:OMe
+
H
E
H
E :
H
E : :OMe H E
H
E
:OMe
+
:
:OMe
+
H E
H E
+
化学
-I > +C ,钝化苯环:X
Cl
Cl E H H E
B间位定位基 的定位能力次序大致为(从强到弱) 2.
-NR3, -NO2, -CF3, -CCl3, -CN, -SO3H, -CHO, -COR,-COOH, -CONH2。
反 应 进 程
化学
2. 同位素效应 当一个反应进行时,在决定反应速率的步骤中发生 了反应物分子的同位素键的断裂,将显示初级动力 学同位素效应。最常见的是,反应物分子中的氢被 氘取代后,反应时有速率上的不同,这种变化称为 氘同位素效应,用kH/kD表示。 例如下列反应有 动力学同位素效 应,说明质子是 在决速步的失去 的:
CH2CH3 H
CH3CH2 + [AlCl3Br]
CH2CH3
H+
+
HBr AlCl3
化学
特点: 1°常用的催化剂是无水AlCl3,此外 FeCl3、BF3、 无水HF、SnCl4、ZnCl2、H3PO4、H2SO4等都有催 化作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
T
kH / kT<1~2
T
T
T
NO2
T
实用文档 T
Me3 C
C Me3 Br2
C Me3
H Br
Me3 C
C Me3
+
-H
k2
C Me3
Me3 C
Br C Me3
C Me3
kH/ kD=3.6
位阻决定反应速率.
实用文档
吸电子基 给电子基
N +R 3 N O 2 C O O HX... O - C O O - C H 3C H 3C H 2...
取代基效应: 分子中某个原子或原子团对整个分子或
分子中其它部分产生的影响. 实用文档
取代基效应
电子效应 场效应
诱导效应 (σ, π) 共轭效应 ( π-π, p-π) 超共轭效应 (σ- π,σ- p)
空间传递
电子效应
空间效应 (位阻效应)
因取代基而导致共用电子对沿σ键转移的结果。
O
O
O 2NC H 2COH >C H 3COH
sp2 + E +
E +
sp3
H -H +
+E
sp2 E
-络合物寿命很短
实用文档
4、动力学同位数效应 P593
OMe
OMe
OMe
D
D
D
D
D
Br2
+
Br kH / kD=1
D
D
D
D
D
D
D
Br
D
NO2
NO2
D
D
D
D
HNO3/H2SO4
D
D
D
kH / kD=1.O5
NO2
D
D
NO2
NO2
T
T
T
HNO3/H2SO4
δ δδ δ
Y CHCHCHCH 2
共轭效应不受传递距离的影响
结构特征: 单、重键交替
δ
O C δ C δ Cδ HHCN NCC C C OH
H 共轭体系中所有原子共平面
实用文档
OH
P-π共轭。
δδ δ
结果: -OH的O、P-位碳原子上 带有部分的负电荷。
O
O
RCO H RCO+H
传递方式:π电子转移(用弧形箭头表示)
2. 定位效应
G E+
G E
+
G
G
+
理论上:
E
o mp=2 2 1
E
o+p=40%+20%=60% m=40%
实用文档
5、定位规律
G E+
G E
+
G
G
+
E E
实用文档
H
H
G = -CF3
C F3 E H
+
C F3 E H
+
CF3
CF3
+E H
+E H
CF3 + HE
CF3 +
E H
实用文档
H
C F3
规则:
1. 同周期的原子: -C H 3< -N H 2< -O H < -F
2. 同族的原子: F > Cl > Br > I 电负性: 4.0 3.0 2.8 2.5
3. 相同的原子: 不饱和度越大,-I 效应越强
C C R > C H C H R
4. 带负电荷的取代基的 -I 强
-I: -N R 3>-N O 2>-N R 2 实用文档
6、分速率系数 P596 苯分子中,环上某一特定位置与苯分子中一个
位置相 一元取代比较,起取代反应的相对速率, 称这一位置的分速率系数。(f0 ; fm fp)
CH3
HNO3+(CH3CO)2O H3C O2N
o:m:p=58.1:3.7:38.2
NO2
苯:硝基甲苯=1:27
实用文档
一取代苯在取代反应中(一取代)总速率常数:
E
+
H
CF3
E +
H
CF3 E
+H
1)邻对位定位基 ----致活作用; -----Ⅰ类定位基中, –X有致钝作用
- N R 2_ N H R _ N H 2_ O H ; _ N H C O R _ O C O R ; _ R _ A r ; _ X
2)间位定位基 ----Ⅱ类定位基致钝作用
_ _ + N R 3 _ _ N O 2 _ _ C F 3 _ _ C C l3 _ _ C N_ _ S O 3 H_ _ C H O _ _ C R _ _ C O O H _ _ C O O R
相对强度: C C C Y C C X
(I)
(II)
Y为吸电子基团时-吸电子共轭效应 (-C),
X为供电子基团时-供电子共轭效应 (+C).
实用文档
一、芳环上的亲电取代
p2 E+
sp2
+E+ k1
K-1
sp3
+ H E+-H k+ 2
k2 > k1 , K-1
sp sp 23
E H -H +
+E
σ-络合物生成是决定反应速率的步骤 这种机理称:Ar-SE
O
实用文档
邻对位定位基 (1)含有未共用电子对的原子与芳环形成大键 ; (2)(2) 含有电子的基团,如:烯基、苯基…… (3)(3) 给电子效应的基团(诱导效应或超共轭效应)
如:烷基……
间位定位基
(1) 与苯环相连的原子有极性双键;
(2) 带正点荷的原子或强的吸电子基,如:-CCl3
-CF3
实用文档
共轭效应 (Conjugation)
1. 共轭体系与共轭效应
π - π 共轭
O
CCCC CCC N CCC H
CCC C
CC
C2 C1
C4 C3
实用文档
p - π 共轭
O
Cl C C RC OH CH3 CH CH CH2
CH3
C2 C3 H
H C1+ H
实用文档
共轭效应:
分子中任何一个原子周围电子云密度变化,马上会 引起其它部分的电子云密度的改变
k C6H5R = 2kO-R +2km-R + kP-R
生成 O、m、kH=P一取代产物的比例与速率常有关 数:
O:% =
2 kO-R k C6H5R
f0= k0-R kH
m:% = km-R k C6H5R
km-R fm=
kH
实用文档
p:% = 2kP-R k C6H5R
实用文档
诱导效应 (Inductive effect)
CC Z
δ
C
Cδ
δ
Cl
δδ
C C Cl
结构特征: 单、双、叁键
Cδ
δ
C
Cl
传递方式:σ、π键
传递强度:与距离相关。距离越大,强度越弱。
诱导效应的相对强度: 取决于取代基和中心原子电负性(Electronegativeties)
实用文档
C ZCH C Z -I 标 准 +I
实用文档
1、σ-络合物寿命很短,一般条件下用光谱法测不 出来. 2、本位进攻 亲电试剂进攻苯环带取得基的C.
亲电试剂不但可以进攻苯环不带取得基的C,也可以 进攻苯环带取得基的C.
NO2+
X
Y
N O2
X N O2
实用文档
HY
HNO3,AC2O
NO2
+
+
NO2
+
NO2
NO2 OAC
实用文档
3、 -络合物
第二十五章 芳环上的取代反应
1. 亲电取代反应 2. 亲核取代反应
实用文档
取代基效应
H HCBr+O H
H
H HCO H+Br
H
反应的本质:旧键的断裂,新键的生成
共价键的极性取决于取代基的效应
CH3COOH ClCH2COOH Cl2CHCOOH Cl3CCOOH
pKa 4.76
2.86
1.29
0
