高等有机第七章+芳环上的取代反应.
有机化学基础知识点整理芳香化合物的取代反应和活化基团

有机化学基础知识点整理芳香化合物的取代反应和活化基团芳香化合物是有机化学中重要的一类化合物,具有特殊的结构和性质。
其取代反应和活化基团的研究,对于理解和应用有机合成具有重要意义。
本文将对芳香化合物的取代反应和活化基团的基本概念和机理进行整理,帮助读者加深对这一领域的理解。
一、芳香化合物的基本概念芳香化合物是指分子中含有芳环结构(类似苯环)的有机化合物。
与脂环化合物相比,芳香化合物具有一系列独特的性质和反应。
其分子中的共轭π电子体系使其具有较高的稳定性和特殊的反应活性。
二、芳香化合物的取代反应芳香化合物的取代反应是指通过在芳香核上引入新的官能团来改变化合物的性质和反应活性。
常见的芳香化合物的取代反应包括取代、亲电取代和核子取代。
1. 取代反应取代反应是指通过一个官能团取代芳环上的原子或基团。
常见的取代反应有硝基取代反应、卤代取代反应等。
其中,硝基取代反应是在芳香化合物上引入硝基(-NO2)官能团的反应,卤代取代反应是在芳香化合物上引入卤素(如氯、溴等)官能团的反应。
2. 亲电取代亲电取代是指通过亲电试剂与芳香化合物发生反应,引入新的官能团。
常见的亲电试剂有卤代烃、酰基卤化物等。
在活化基团的作用下,亲电试剂可与芳环上的电子云形成临时的化学键,进而引发反应。
3. 核子取代核子取代是指通过核子试剂与芳香化合物发生反应,引入新的官能团。
常见的核子试剂有氨、腈等。
核子取代反应通常需要较强的活化基团来促进反应的进行。
三、芳香化合物中的活化基团活化基团是指位于芳香环上的特定官能团,能够通过其电子效应或电子云位移的方式影响芳香化合物的性质和反应活性。
常见的活化基团包括取代基、共轭系统、杂原子等。
1. 取代基的活化作用取代基的活化作用是指通过引入不同的取代基来改变芳香环的电荷分布和反应活性。
不同的取代基具有不同的电子效应,如取代基的电子给体性质(+M效应)、电子吸引性质(-M效应)等。
2. 共轭系统的影响共轭系统是指芳香环与邻近的π电子体系之间存在共轭作用,通过分子内电子转移和共轭效应来调控芳香化合物的反应活性。
芳环的取代反应
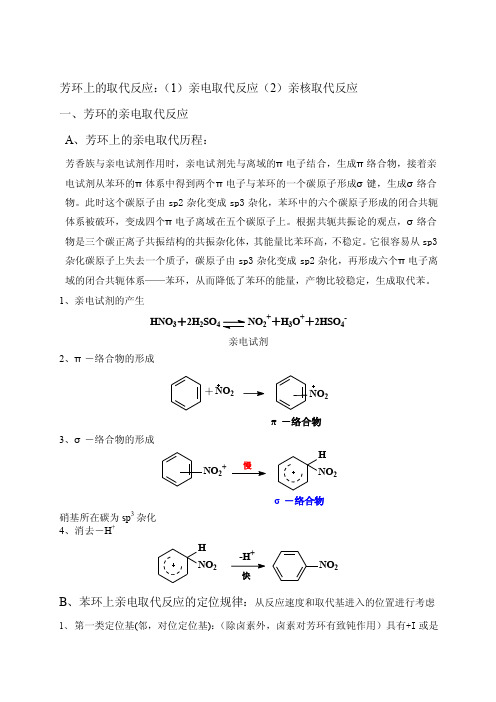
芳环上的取代反应:(1)亲电取代反应(2)亲核取代反应 一、芳环的亲电取代反应 A 、芳环上的亲电取代历程:芳香族与亲电试剂作用时,亲电试剂先与离域的π电子结合,生成π络合物,接着亲电试剂从苯环的π体系中得到两个π电子与苯环的一个碳原子形成σ键,生成σ络合物。
此时这个碳原子由sp2杂化变成sp3杂化,苯环中的六个碳原子形成的闭合共轭体系被破环,变成四个π电子离域在五个碳原子上。
根据共轭共振论的观点,σ络合物是三个碳正离子共振结构的共振杂化体,其能量比苯环高,不稳定。
它很容易从sp3杂化碳原子上失去一个质子,碳原子由sp3杂化变成sp2杂化,再形成六个π电子离域的闭合共轭体系——苯环,从而降低了苯环的能量,产物比较稳定,生成取代苯。
1、亲电试剂的产生HNO 3+2H 2SO4NO 2++H 3O ++2HSO 4-亲电试剂2、π-络合物的形成+NO 2π-络合物23、σ-络合物的形成NO 2+HNO2σ-络合物硝基所在碳为sp 3杂化 4、消去-H ++NO 2H NO 2快B 、苯环上亲电取代反应的定位规律:从反应速度和取代基进入的位置进行考虑1、 第一类定位基(邻,对位定位基):(除卤素外,卤素对芳环有致钝作用)具有+I 或是+C 效应,其作用是增大芳环的电子云密度。
致活基NH 2NHR2OHORNHCROPhR致钝基F Cl BrI2、 第二类定位基(间位定位基):具有-I 或-C 效应,使芳环上的电子云密度降低,均为致钝基NO 2NR 3COOHCOORSO 3HCNCHOCROCCl 3C 、影响亲电取代的因素:(1)芳环上取代基对于E +进入芳环位置的影响第一类定位基-邻对位定位基第二类定位基-间位定位基共振式越多, 正电荷分散程度越大,芳正离子越稳定。
(2) 动力学控制与热力学控制: α位取代-动力学控制产物; β位取代-热力学控制产物。
(3) 邻位和对位定向比:a 亲电试剂的活性越高,选择性越低。
有机化学第7、8章习题答案

第7章芳烃及非苯芳烃思考题答案思考题7-1苯具有什么结构特征? 它与早期的有机化学理论有什么矛盾?答案:苯分子具有高度的不饱和性,其碳氢比相当于同分子量的炔烃,根据早期的有机化学理论,它应具有容易发生加成反应、氧化反应等特性。
但事实上,苯是一种高度不饱和却具异常稳定性的化合物。
因此,要能够很好地解释这一矛盾是当时有机化学家所面临的重大挑战。
[知识点:苯的结构特征]思考题7-2早期的有机化学家对苯的芳香性认识与现代有机化学家对苯的芳香性认识有什么不同?答案:早期的有机化学把那些高度不饱和的苯环类结构并具有芳香气味的化合物称为芳香化合物,这些化合物所具有的特性具称为芳香性。
随着对事物认识的不断深入,人们已经意识到,除了苯环以外还有一些其他类型的分子结构也具有如苯一样的特别性质。
现在仍然迫用芳香性概念,但其内涵已超出了原来的定义范围。
现在对芳香性的定义为:化学结构上环状封闭的共轭大π键,不易被氧化,也不易发生加成反应,但是容易起亲电反应的性质。
[知识点:苯的芳香性]思考题7-3 关于苯分子的近代结构理论有哪些?其中,由Pauling提出的共振结构理论是如何解释苯分子结构?答案:现代价键理论:苯分子中的六个碳原子都以sp2杂化轨道和相邻的碳和氢原子形成σ键,此sp2杂化轨道为平面其对称轴夹角为120°,此外每个碳原子还有一个和平面垂直的p轨道,六个p轨道相互平行重叠形成了一个闭合共轭体系。
分子轨道理论:基态时,苯分子的六个π电子都处在成建轨道上,具有闭壳层电子结构。
离域的π电子使得所有的C-C键都相同,具有大π键的特殊性质因此相比孤立π键要稳定得多。
Pauling提出的共振结构理论:苯的每个1,3,5-环己三烯都是一种共振结构体,苯的真实结构是由这些共振结构式叠加而成的共振杂化体。
【知识点:苯近代结构理论】思考题7-4什么是休克尔规则? 如何利用休克尔规则判别有机分子的芳香性? 答案:休克尔规则:单环化合物具有同平面的连续离域体系,且其π电子数为4n+2,n为大于等于0的整数,就具有芳香性;如果π电子数为芳香性,符合4n,为反芳香性,非平面的环状共轭烯烃则为非芳香性。
有机化学 第7章-2
——生成氧盐 生成氧盐—— 生成氧盐
(2)醚键断裂 伯烷基醚: 伯烷基醚:
CH3CH2CH2OCH3 CH3CH2CH2OCH3 HI H CH3CH2CH2OH CH3I AgNO3 AgI I
SN2
有机分析中用此法测定甲氧基的含量(Zeisel测 有机分析中用此法测定甲氧基的含量(Zeisel测 定法)。 定法)。 芳基混醚: 芳基混醚: OH CH3 I O CH3 HI 叔丁基醚: 叔丁基醚:
——酚的物理性质 酚的物理性质—— 酚的物理性质
酚的结构 酚分子中,酚羟基的氧原子是sp2杂化 杂化, 酚分子中,酚羟基的氧原子是 杂化,形成
p-π共轭作用。由于共轭作用的影响,氧原子上的电子云密 π共轭作用。由于共轭作用的影响, 度向苯环转移,从而使C-O键较难断裂;同时使苯环上的电 键较难断裂; 度向苯环转移,从而使 键较难断裂 子云密度增高,有利于亲电取代反应。 子云密度增高,有利于亲电取代反应。
O
O
CH2 CH CH2 O Cl
3-氯-1,2-环氧丙烷
O
1,4 -环氧丁 烷 1,4 -二氧六 环 ( 二恶烷 ) (四氢呋喃)
(HTF) )
——命名 命名—— 命名
(二)物理性质 沸点:醚分子间不能形成氢键,沸点较低。 沸点:醚分子间不能形成氢键,沸点较低。 溶解度: 与水可形成分子间氢键, 溶解度: 与水可形成分子间氢键,有一定水 溶性。 能与水互溶. 溶性。HTF能与水互溶. 能与水互溶
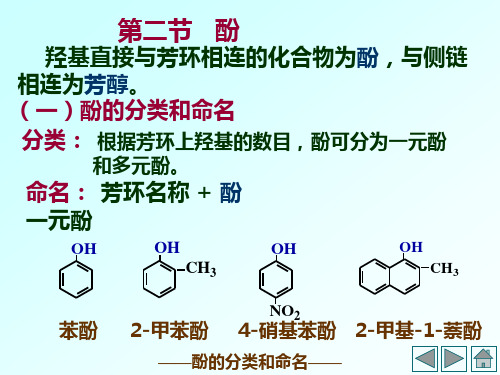
第二节
酚
羟基直接与芳环相连的化合物为酚 羟基直接与芳环相连的化合物为酚,与侧链 相连为芳醇 芳醇。 相连为芳醇。 (一)酚的分类和命名 分类: 根据芳环上羟基的数目, 分类: 根据芳环上羟基的数目,酚可分为一元酚
芳环的亲电取代亲核取代反应芳环取代基的反应

二、取代基对芳环亲电取代反应的影响
4. 定位效应与定位规律的分析与解释 从实验事实提出的问题:
—— 为什么致活基都是邻对位取代基? —— 为什么大多数致钝基都是间位定位基? —— 为什么卤素既是弱的致钝基,又是邻对位定位基?
以下从三个方面进行分析讨论: —— 电子效应对苯环上电子云密度分布的影响 —— 苯环上电子云密度分布的理论计算结果 —— 反应中活泼中间体的结构与稳定性
CH3和烷基:弱致活基,邻对位定位基。
ortho-
CH 3 E H
CH 3 E H
CH 3 E H
parameta-
particularly stable CH 3
SO3
2 中等强度亲电试剂,能取代致活、不能取代致钝 的芳环:
—— R+ (obtained by R-Cl + AlCl3)
—— RC+=O (obtained by RCOCl + AlCl3)
———R2C=O+H(obtained by R2C=O + H+)
3 弱亲电试剂,只能取代高活化的芳环:
一、芳环的亲电取代反应及机制
(1) Halogenation
一、芳环的亲电取代反应及机制
(1) Halogenation
一、芳环的亲电取代反应及机制
(2) Nitration
一、芳环的亲电取代反应及机制
(3) Sulfonation —— reversible reaction
磺化反应是可逆的,存在动力学和热力学控制的竞争
二、取代基对芳环亲电取代反应的影响
1. Experimental Facts:
CH 3 HNO 3
CH 3 NO 2
芳环上的取代反应

+ N2
,
CuBr HBr
N CuCl
+ N2
①历程
N2
+ N
+ CuCl
Cl-
+ CuCl2 +N2
Cl
+ CuCl2
N2Cl-
+ CuCl
②举例
CuCN KCN
CN
+ N2
2. Gattermann(加特曼反应)
N2ClCl
N2Br-
Br
Cu HCl
Cu HBr
注:Cu代替CuCl或CuBr
N2ClNO2
+E+ +H+
中间体碳正离子 σ-络 合 物
2.典型亲电取代反应历程举例: 硝化反应:
HNO3+2H2SO4
H
每摩尔 HNO3在浓 H2SO4中 形成四个质点 (冰点降低实验证实)
H3O+2HSO4+NO2
NO2
H NO2
拉曼光谱中 NO2在 1400cm-1 处有吸收带
NO2
+ NO2
慢
+HSO4 -
COOH C H C C
N2+ COOH
Cu -N2
H COOH
-H
△ 菲
三.苯炔历程(消除-加成历程) Cl 1. 反应历程: NH
2
Cl
-Cl-
NH2
H NH2
NH2
NH3
+ NH2
苯炔历程证明: ①红外光谱证明
(8 K时可观察到它的光谱)
②碘苯与NaNH2反应时,加入1,3-环己二烯或呋喃可生成D-A产物。
N2Cl
芳环上的取代反应

Br2
Me3C
CMe3
kH/kD = 3.6
25.1.5 定位规律 亲电取代反应中取代基的定位首先是根据取代基是给电子或吸 电子推测它们是使芳环活化或钝化,再根据取代基的电效应 (场效应及共振效应)来推测其主要产物为邻、对位或间位取代。 CF3 CF3 CF3 三氟甲基是电子受体,它的 E E E 场效应为–I,亲电取代中生 H H H 成的三种芳基正离子的共振 特别不稳定 式为: E E E 三种芳基正离子的共振结构 H H H 中,进攻邻、对位都有一个 特别不稳定的结构式(电子受 CF3 CF3 CF3 体与带正电荷的碳原子直接 CF3 CF3 CF3 相连),它们的能量较高,而 间位进攻所产生的芳基正离 子相对较为稳定,因此主要生 H E H E H E 成间位产物。
k C6 H 5 R
%( para) =
k p−R k C6 H 5 R
× 100
分速度常数就是取代苯的某一位置的分速度与六分之一苯的反 应速度相比: k p−R k m− R k o−R fm = fp = fo = kH kH kH 取代产物的百分含量可从实验求得,所以可以从式(1)、(2)、(3) 中解出ko-R、km-R和kp-R:
Cl Cl E H H E
按照给电子能力的大小可以将常见的取代基排列如下:
O NR2 OR O OCOR Ph R H Cl NR3 O CR C N NO2
+M, +I
NH2 O OH SR O CO NHCR
+ M, -I
+I -I, +M
Br NH3 O CNH2 SO3H
-M, -I
25.1.6 分速率系数 一元取代苯(C6H5R)分子中苯环上某一特定位置与苯分子中一个 位置相比较,起取代反应的相对速率,称为这一位置的分速率 系数,分速率系数用fo, fm, fp表示。 一取代苯起取代反应生成一取代产物的总速率常数为
有机化学07芳烃_芳香性xiu

AlCl3 80°C
O CCH3 + HCl
苯乙酮 (Acetophenone)(97%)
酰氯的制备 羧酸与亚硫酰氯或PCl5反应: 羧酸与亚硫酰氯或
O CH3C OH + SOCl2
80°C
O CH3C Cl + SO2 + HCl
酸酐: 酸酐
O H O
AlCl3 80°C
7.7联苯及其衍生物 7.7联苯及其衍生物 7.8 稠环化合物 7.9杂环化合物 7.9杂环化合物
芳烃: 芳烃:指苯及其衍生物以及具有类似苯环结构和性质的 一类化合物。 一类化合物。 CH3CHCH3 CH3 CH Cl
7.1芳烃的分类: 7.1芳烃的分类: 芳烃的分类
3
CH3
甲苯 氯苯 异丙(基 苯 异丙 基)苯 邻二甲苯
Br Br + FeBr3
δ δ
Br
Br FeBr3
Br2 与FeBr3 的络合
第二步: 极化了的溴进攻苯环 第二步:
+ Br
δ
Br
FeBr3
δ
慢
Br H + Br
FeBr3
生成苯碳正离子中间体。 生成苯碳正离子中间体。此步骤是 决定反应速率的一步。 决定反应速率的一步。
烯丙基型正离子: 烯丙基型正离子 p - π 共轭 π - 电子的离域产生共振杂化体: 电子的离域产生共振杂化体:
②分子轨道理论
6 相互交盖的 2p轨道 组合成 个分子轨道 轨道 组合成6个分子轨道
图 7.2苯的π分子轨道和能级 7.2苯的π 苯的
③休克尔规则及应用 电子数为( 凡π 电子数为(4n+2)的闭合结构都具有芳香性。 )的闭合结构都具有芳香性。 π 电子数 ,有芳香性 电子数=6, π 电子数 ,无芳香性 电子数=4, ④芳香性判断 判断依据 π 电子数为(4n+2),( 电子数为( ),(n=0,1,2正整数) 正整数) ),( , , 正整数 共平面环状共轭结构
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7.1.3 π-络合物
HE
E+Nu- fast
E+ slow
p-络合物
HE
E
fast
+ H+
决定反应 速度步骤
动力学同位素效应可以证明此步反应速度较快
7.1.4 动力学同位素效应
用氘或氚标记苯环进行亲电取代,kH/kD或kH/kT的数值
接近1,说明C——H键断裂的步骤不是决定反应速率的
步骤。 例如:
-CF3具有强烈的-I
使苯环钝化
进攻邻位
CNFO32
H E
CNFO32
H E
CNOF23
H E
CNFO32
+ E+
对位
NCOF23
NCOF23
不稳定
CNOF32
间位
HE
CNFO32
HE
NCOF23
HE 不稳定
CNOF23
H
H
H
E
E
E
进攻邻位
NH2 H E
NH2 + E+
对位 间位
NH2 HE
NH2
加成-消除机理(Ar-SE)进行的:
HE
E
E+Nu-
k1 k-1
k2
σ-络合物
芳正离子,Wheland络合物
一般地,k2>k1,k-1,所以, σ-络合物生成步骤是决定反应 速度步骤。
7.1.1 σ-络合物存在的证明
一、分离鉴定
Me
Me Et
EtF, BF 3
- 80 oC
H
BF4
Me
Me
Me
Me
NO2+ 本位进攻生成的σ-络合物可以发生几种反应:
NO 2
-X
本位取代
X
X
NO2+
NO 2
Байду номын сангаас
Y
X NO2 σ-络合物与溶剂中的亲
核试剂 Y- 结合
YH
H X
NO 2 - H
X
硝基进攻邻位, NO2 生成邻位取代
产物
例如,1-甲基-4-异丙基苯在乙酐中硝化生成四种产物:
CH3
CH3
CH3
CH3
Me NO 2
例如:酸性白土、超强酸Nafion、镧系元素的盐都可以作 硝化反应的催化剂,此时只用化学剂量的硝酸就可以
氮的氧化物如NO2-O2、NO2-O3等也可以作硝化试剂
五、硝酸溶于乙酐中作硝化试剂
硝酸溶于乙酐中生成乙酸与硝酸形成的混酐:
HO-NO2 + Ac2O
AcONO2 + AcOH
这类硝化试剂可以避免苯酚类或苯胺类发生氧化。
4 75
相同取代基,不同反应。 分速率系数也不同:
CH 3
CH 3
CH 3
47
3 62
硝化
617
4.95 820
氯化
6.0
5.5 2420
溴化
7.2 亲电取代在有机合成中的应用
7.2.1 硝化反应
硝化反应在有机合成中应用广泛。不同的硝化试剂的硝化能 力不同。 一、稀硝酸
稀硝酸的硝化能力很弱,只能硝化高度活化的芳环
COCH 2Br
COCH 3
Br 2
Br 2
AlCl3 (催化量)
AlCl3 (过量)
COCH 3 Br
二、碘化
碘的进攻能力很弱,只能与强活化苯环如苯酚和苯胺 碘代,其它芳环的碘化要在氧化剂如HNO3或HIO3存 在下才能进行。氧化剂的作用可能是使碘生成I+。
三、氟化 一般用芳香重氮盐制备氟代物(Schiemann反应):
NH2 NaNO2 H2SO4
N N HSO4
4
HBF
C6H5N2+BF
4
C6H5F
7.2.3 磺化 磺化试剂:基本试剂SO3 H2SO4、ClSO3H、 FSO3H 磺化能力不同的磺化试剂
CH 3NO 2 SO3
N SO3 O
O SO3 缓和的磺化试剂
7.2.4 Friedel-Crafts烃化 催化剂——Lewis酸:AlCl3(活性最强)、FeCl3
OMe
OMe
OMe
D
D Br2
D
Br
D
+
D
kH/kD=1
D
D
D
D
D
D
D
D
Br
NO 2
NO 2
D
D
D
D
HNO 3/H2SO4
kH/kD=1.05
D
D
D
NO 2
D
D
有一些反应的kH/kD〉1,例如:
Me 3C
CMe 3
Br 2
H Br
Me 3C
CMe 3
Me 3C
Br CMe 3
CMe 3
CMe 3
CMe 3
该羰基必须还原掉,才能进行下一 步的酰化反应,否则反应不发生
O
+
AlCl 3 O
O
[H]
PPA
O
HOOC
HOOC
如果环上有强给电子基,可以连续酰化:
OH O
OH O
+
O
H2SO4
O OH O
OH
O
HOOC OH
OH O
新发展的酰化反应的催化剂——三氟甲磺酸及其盐
例如:三氟甲磺酸铋,Bi(OTf)3 酰氯或酸酐与三氟甲磺酸生成的混酐
NH2 H E
NH2
NH2 H E
不稳定 NH2
HE NH2
HE 不稳定
NH2
H
H
H
E
E
E
-NH2具有-I和+C,+C > -I,总结果给电子,使 苯环活化
NH2 H E
较稳定 NH2
HE 较稳定
Cl
H O-
E +
Cl H
+
E
Cl
H +
E
+Cl H
E
特别稳定
Cl
Cl
Cl
Cl
+Cl
P-
+
HE Cl
+
Me
Me
Br 2
Br
O C COO
Me
O C COO
Br
Me
O
Me
Me
Me
Me
Me
OO
(Ⅰ)
Me
Me
Me
Br
OC(Me) 2COO Br
OC(Me) 2COO
Br
OC(Me) 2COO
7.1.2 本位进攻(ispo attack)
在芳环上已有取代基的位置上,发生的取代作用——Ipso效应. 硝化反应中本位进攻研究得较多。
fo
ko kH
kC6H 5R 邻位产物百分量/ 2 kC6H 5R / 2 邻位产物百分量
k C6H 6/ 6
k C6H 6/ 6
kC6H 5R 3 邻位产物百分量 27 3 58.1% 47 k C6H 6
用同样的方法可以计算出fm=3、fp=62
当 f > 1 时,该位置的活泼性比苯大, 否则比苯小。
HE Cl
+
HE
特别稳定
HE
Cl
M- H E+
+
H
E
+
H E
-Cl具有-I和+C,+C < -I, 总结果吸电子,使苯 环钝化
定位基分类(p595)
(1)邻对位定位基 (Ⅰ类定位基)
-NR2 _NHR _NH2 _OH; _NHCOR _OCOR; _R _Ar; _X
邻对位定位基(除卤素外) 是致活的。 -X致钝。
+ H2O
NO2
硝基苯
发烟HNO3, 浓硫酸
NO2
95。C
四、发烟间混二 酸 硝基苯
发烟硝CH酸3 和+浓H硫N酸COHO的3 混发H合3烟20SH物。NOOC硝34 化能C力HCO更H3强NO2 +
H2SO4
CH3
NO 2
CH3 NO2
工业上用混酸作硝化试剂,会产生大量废酸液,造成环境污染, 使用固体酸催化可以减少废酸液的产生。
RC
AlCl4
用酸酐作酰化试剂,催化剂AlCl3的用量要增加2mol以上 用羧酸作酰化试剂,催化剂AlCl3的用量要增加3mol以上
活性高的芳环进行酰化,可以只用少量催化剂或不加催化剂 或使用缓和催化剂如FeCl3、ZnCl2、I2等。
芳环上有强吸电子基,如硝基、磺酸基时,不发生酰化反应, 除非有强给电子基存在。所以硝基苯可以作酰化反应的溶剂。
mp. -15 oC
二、在超酸中用NMR检测
H
H
H
H
HF-SbF 5-SO2ClF-SO 2F2
Me Et
+ HBF4
Me
Me
H H
H H
186.6ppm 136.9ppm
52.2ppm
HH
186.6ppm
136.9ppm
δ值的大小也充分说明了 正电荷主要分布在邻对位
178.1ppm
三、推测
例如,下列反应中有螺环产物(Ⅰ)出现,可能是由σ-络 合物起分子内反应生成的:
kH/kD=3.6
原因:σ-络合物中H与Br分别处于苯环平面的上下,与邻 位的叔丁基距离较远,相互作用较小。
生成产物后,Br原子不得不与邻位的两个叔丁基共平面, 它们之间的距离变近,相互排斥力增大,生成就较困难。
