分析化学 酸碱滴定公式整理
4酸碱滴定法

(4)Vb > Va :NaOH + NaAc SP后0.1% 时 ,已加入NaOH 20.02mL
36
2.滴定曲线的形状
滴定前,曲线起点高 滴定开始, [Ac-] ↑ ,⊿pH↑ 随滴加NaOH↑缓冲能力↑,
⊿pH微小
滴定近SP,[HAc]↓, 缓冲能力↓↓,⊿pH↑↑ SP前后0.1%,酸度急剧变化, ⊿pH =7.76~9.7
例:酮类,酰胺类,腈类,吡啶类 2)惰性溶剂 不参与质子转移反应,溶剂分子中无转移性 质子和接受质子的倾向,也无形成氢键的能 力常与质子溶剂混用,增加试样的溶解性 例:苯,甲苯,氯仿,四氯化碳
58
(二)溶剂的性质 1.溶剂的离解性 2.溶剂的酸碱性 溶质酸(碱)在溶剂中的表观酸(碱)强度
46
b.NH4+ + OH NH3 + H3BO3
NH3↑+ H2O NH4+ + H2BO3-
H2BO3- + HCl
Cl- + H3BO3
47
(2) 甲醛法 4NH4+ + 6HCHO (CH2)6N4H+ + 3H+ + 6H2O
以酚酞为指示剂,以NaOH滴至浅粉色
48
第四节
滴定终点误差
H3O+ + A2-
8
忽略酸的二级离解,忽略Kw
9
总结:
溶液中[H+]计算的一般方法: 1.写出溶液的质子条件式,然后将有关酸碱平
衡的常数带入,整理后得[H+]的精确式。
2.根据具体情况,对精确式进行适当的简化, 得到近似式或最简式。
10
简化时一般掌握:
分析化学酸碱滴定公式整理
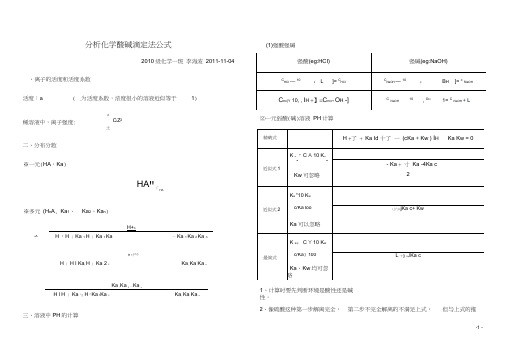
分析化学酸碱滴定法公式(1)强酸强碱、离子的活度和活度系数活度:a i(稀溶液中,离子强度: 二、分布分数※一元(HA,Ka)※多元(H n A, Ka1、n A 2010级化学一班李海波2011-11-04i为活度系数,浓度很小的溶液近似等于1)nC i Z2i 土HA"「HAKa2、Ka n)H+nH 『H 丨Ka 1 H 丨Ka 1 Ka 亠Ka 1 Ka 2 Ka nH +尸©H 丨H l Ka, H 丨Ka 2 2Ka, Ka Ka nKa ,Ka 2…Ka nH l H 丨°Ka 勺H『Ka t Ka 2Ka, Ka Ka n三、溶液中PH的计算⑵一元弱酸(碱)溶液PH计算1、计算时要先判断环境是酸性还是碱性。
2、像硫酸这种第一步解离完全,第二步不完全解离的不满足上式,但与上式的推导过程类似,应用质子守恒列方程, [0H -]太小,忽略。
(3)多元弱酸(碱)溶液 一般都按二元酸处理, Ka 太小省略掉。
(4)两性物质溶液pH 的计算①酸式盐,eg : NaHA②弱酸弱碱盐(1:1 型),eg : CH 2CIC00NH 4 (CH 2CICOOH *a , NH 3^Ka')(非1:1 ), eg : (NH4)2CO3 (1、溶液弱碱性,H2CO3、H+可忽略,只要是c不是很小,Kw 也可忽略)HCO 37:“ N H3 1 T ':HCO _c =、:NH3%(5)混合溶液①两种弱酸:H丄Ka! c, Ka 2c2②一种强酸和一种弱酸:类似硫酸的酸性计算,列出质子守恒,用分布分数求解。
③一种弱碱和一种弱酸:H Ka Ka C酸1 2 c碱(6)缓冲溶液(弱酸HA浓度c i,共轭碱A-浓度C2)※标准缓冲溶液要考虑离子强CK ai _10 -,冰玄2 10 - 可准确滴定HA-六、终点误差公式(以NaOH滴定酸为例)强酸(HCI)滴定兀弱酸(HA)滴定sp epC HA C HAspCHAE t10 ■p H i0』H多元弱酸(H2A )滴定10 •叩_.10款HA和HB混酸(K HA>K HB)10拽_10少E tK CI. HA HA-K CHB HB。
酸碱中和滴定知识梳理

酸碱中和滴定知识梳理一、中和反应及中和滴定原理1、中和反应:酸+碱 (正)盐+水注意:酸和碱恰好完全中和,溶液不一定呈中性,由生成的盐性质而定(盐类水解)。
2、中和滴定原理(只研究一元强酸与一元强碱的中和反应)由于酸、碱发生中和反应时,反应物间按一定的物质的量之比进行,基于此,可用滴定的方法确定未知酸或碱的浓度。
对于反应: HA + BOH====BA+H 2O1mol 1molC (HA).V (HA) C (BOH).V (BOH)即可得 C (HA).V (HA)=== C (BOH).V (BOH))HA ()BOH ()BOH ()HA (V V .C C =若取一定量的HA 溶液(V 足),用标准液BOH[已知准确浓度C (标)]来滴定,至终点时消耗标准液的体积可读出(V 读)代入上式即可计算得C (HA )定读标V V .C C )HA (= 若酸滴定碱,与此同理3、滴定方法的关键(1)准确测定两种反应物的溶液体积(2)确保标准液、待测液浓度的准确(3)滴定终点的准确判定(包括指示剂的合理选用)4、滴定实验所用的仪器和注意事项(1)仪器:酸式滴定管、碱式滴定管、滴定管夹(配铁架台,并垫白纸作背景增加对比度,以便于观察溶液颜色变化)、锥形瓶滴定管的构造特点(与量筒区别)1、滴定管分酸式滴定管;碱式滴定管酸式滴定管-------玻璃活塞-------量取或滴定酸溶液或强氧化性试剂;酸式滴定管不得用于装碱性溶液,因为玻璃的磨口部分易被碱性溶液侵蚀,生成有粘性的硅酸钠,使塞子无法转动。
(玻璃的主要成份为SiO2 属于酸性氧化物。
酸性氧化物+碱→盐+水,即SiO2+2NaOH = Na2SiO3+H2O瓶口内侧与瓶塞都是经过磨砂处理的,表面粗糙,造成碱性的液体容易滞留,并且水分蒸发,碱液浓度增大,促使二者更易反应。
其他部位因表面光滑而难于反应)碱式滴定管-------橡胶管+内嵌玻璃珠(玻璃珠直径稍大于橡胶管内径)-------量取或滴定碱性溶液(可以是氢氧化钠这类强碱,也可以是碳酸钠这类水解呈碱性的盐);不宜于装对橡皮管有侵蚀性的溶液,如强酸、碘、高锰酸钾、硝酸银等。
滴定酸值计算公式

滴定酸值计算公式在化学的奇妙世界里,滴定酸值的计算公式就像是一把神奇的钥匙,能帮助我们打开了解物质酸性程度的大门。
咱先来说说啥是滴定酸值。
想象一下,你面前有一瓶不知道酸性有多强的溶液,就像一个藏着秘密的小盒子。
这时候,咱们通过滴定的方法,一点点地往里面加一种已知浓度的碱溶液,就好像是在一点点地揭开这个小盒子的秘密。
而这个过程中,用来计算这溶液酸性到底有多强的式子,就是滴定酸值计算公式啦。
这计算公式呢,简单来说就是根据咱们滴加的碱溶液的量、浓度,还有反应的化学计量关系等等,算出原来溶液里酸的含量。
比如说,咱们常用的一种计算公式是:酸值(mgKOH/g)=(V×C×56.1)/m 。
这里的 V 代表滴定时消耗的碱溶液的体积(单位是毫升),C 是碱溶液的浓度(单位是摩尔每升),56.1 是氢氧化钾的摩尔质量(单位是克每摩尔),m 是样品的质量(单位是克)。
我给您讲讲我之前在实验室里的一次经历。
那次啊,我们要测定一瓶醋样的酸值。
大家都围在实验台边,眼睛紧紧盯着滴定管,心里既紧张又期待。
我小心翼翼地控制着碱液的滴加速度,就怕一不小心滴多了。
每一滴碱液滴下去,溶液的颜色都好像在跟我们诉说着什么。
当那神奇的一刻到来,溶液突然变色,指示终点到达的时候,我心里那个激动啊!然后赶紧按照公式去计算,算出酸值的那一刻,感觉就像是解开了一道难题,特有成就感。
再回到这个公式,要准确使用它,可不能马虎。
首先,量取碱溶液体积的时候,一定要看准刻度,多一分少一毫都可能影响结果。
还有碱溶液的浓度,得精确配制,不然算出来的酸值可就不靠谱啦。
在实际的实验操作中,有时候会因为一些小失误导致结果不太准确。
比如说,滴定时搅拌不均匀,溶液局部反应过度,那算出来的酸值就可能偏高。
或者是终点判断不准确,早了或者晚了那么一点点,也会让结果有偏差。
所以啊,掌握好滴定酸值计算公式只是第一步,更重要的是在实验中细心操作,严谨对待每一个环节。
四大滴定总结

四大滴定总结分析化学中的四大滴定即:酸碱滴定,氧化还原滴定,配位滴定,沉淀滴定。
一酸碱滴定1原理酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析法。
基本反应为H+ + OH- = H2O也称中和法,是一种利用酸碱反应进行容量分析的方法用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。
[2]2滴定曲线强碱滴定弱酸滴定反应为:以NaOH液(0.1000moL/L滴定20.00ml醋酸(HAc,0.1000mol/L)用NaOH滴定HOAc的滴定曲线为例,滴定曲线如下图:滴定开始前 pH=2.88滴入NaOH 液19.98ml时 pH=7.75化学计量点时 pH=8.73滴入NaOH液20.02ml时 pH=9.70指示剂的选择(1)只能选择碱性指示剂(酚酞或百里酚酞等),不能选用酸性范围内变色的指示剂(如甲基橙、甲基红等)。
因为突跃范围较小,pH值在7.75~9.70之间;计量点在碱性区。
(2)弱酸被准确滴定的判决是C·Ka>10-8。
因为Ka愈大,突跃范围愈大。
而Ka<10-8时,已没有明显突跃,无法用指示剂来确定终点;另外,酸的浓度愈大,突跃范围也愈大。
3酸碱指示剂用于酸碱滴定的指示剂,称为酸碱指示剂。
是一类结构较复杂的有机弱酸或有机弱碱,它们在溶液中能部分电离成指示剂的离子和氢离子(或氢氧根离子),并且由于结构上的变化,它们的分子和离子具有不同的颜色,因而在pH不同的溶液中呈现不同的颜色。
常用类型指示剂名称范围酸色中性色碱色甲基橙 3.1-4.4 红橙黄甲基红4.4-6.2 红橙黄溴百里酚蓝 6.0-7.6 黄绿蓝酚酞 8.2-10.0 无色浅红红紫色石蕊 5.0-8.0 红紫蓝4影响滴定结果的因素⑴读数:滴定前俯视或滴定后仰视(偏大)滴定前仰视或滴定后俯视(偏小)⑵未用标准液润洗滴定管(偏大);未用待测溶液润洗滴定管(偏小)⑶用待测液润洗锥形瓶(偏大)⑷滴定前标准液滴定管尖嘴有气泡,滴定后尖嘴气泡消失(偏大)⑸不小心将标准液滴在锥形瓶的外面(偏大)⑹指示剂(可当作弱酸)用量过多(偏小)⑺滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出(偏小)⑻开始时标准液在滴定管刻度线以上,未予调整(偏小)⑼碱式滴定管(量待测液用)或移液管内用蒸馏水洗净后直接注入待测液(偏小)⑽移液管吸取待测液后,悬空放入锥形瓶,少量待测液洒在外面(偏小)⑾滴定到指示剂颜色刚变化,就是到了滴定终点(偏小)⑿锥形瓶用蒸馏水冲洗后,不经干燥便直接盛待测溶液(无影响)⒀滴定接近终点时,有少量蒸馏水冲洗锥形瓶内壁(无影响)(14)滴定时待测液滴定管尖嘴有气泡,滴定后尖嘴气泡消失(偏小)二配位滴定2滴定曲线。
分析化学:第三章 酸碱滴定法

[HSO4-]=c-b, [SO42-]=b, [HSO4-+2[SO42-]+[OH-]= c+b+[OH-]
所以,[H+]=[OH-]+[HSO4-]+2[SO42-] =c +[SO42-]+[OH-]
22
*质子条件(Proton Condition): 指酸碱反应中质子转移的等衡关系。 它的数学关系式就是质子条件式。
[OH-] +[PO43-]
若c1=c2,则
2[H+]+ [H2PO4-]+3[H3PO4]=
2[OH-] +[HPO42-] +3[PO43-]
28
2. 酸碱溶液中pH计算
一元弱酸碱 HA 多元弱酸碱 H2A, H3A 两性物质 HA类两性物质 A-+HB 混合酸碱:强+弱. 弱+弱 共轭酸碱:HA+A-
例4. H3PO4+ c mol/L HCl
[H+]= [OH-]+[H2PO4-]+2[HPO42-]
+3[PO43-]+[Cl-]
例5. c1 NaH2PO4+c2 Na2HPO4
[H+]+[H3PO4]=[OH-]+[HPO42-]-c2
+2[PO43-]
或
[H+]+ [H2PO4-]-c1+2[H3PO4]=
4
3.1 酸碱质子理论
1.定义
根据1923年布朗斯特(Brnsted)酸碱 理论:酸是能够给出质子的物质;碱是 能接受质子的物质。
分析化学 酸碱滴定公式整理
;.分析化学 酸碱滴定法 公式2010级化学一班 李海波 2011-11-04一、离子的活度和活度系数活度:i i i c a γ= (i γ为活度系数,浓度很小的溶液近似等于1)稀溶液中,离子强度:2121i n i i z c I ∑==二、分布分数δ※一元(HA ,Ka )[][]+++=H Ka H HA δ []++=HKa KaAδ []HA C HA δ⋅= []-⋅=-A C A δ ※多元(H n A ,Ka 1、Ka 2、Ka n ) [][][][]nn n nnA H Ka Ka Ka Ka Ka H Ka H H H n2121211++++=-+-+++δ[][][][]nn n nn AHKaKa Ka Ka Ka H Ka H H KaH n 2121211111++++=-+-++-+--δ [][][]nn n nnA Ka Ka Ka Ka Ka HKa H H Ka Ka Ka n 212121121++++=-+-++-δ 三、溶液中PH 的计算(1)强酸 强碱(2)一元弱酸(碱)溶液PH 计算1、计算时要先判断环境是酸性还是碱性。
2、像硫酸这种第一步解离完全,第二步不完全解离的不满足上式,但与上式的推;.导过程类似,应用质子守恒列方程,[OH -]太小,忽略。
(3)多元弱酸(碱)溶液 一般都按二元酸处理,Ka 太小省略掉。
(4)两性物质溶液pH 的计算①酸式盐,eg :NaHA②弱酸弱碱盐(1:1型),eg :CH 2ClCOONH 4(CH 2ClCOOH →Ka ,NH 3→Ka');.(非1:1),eg :(NH 4)2CO 3 (1、溶液弱碱性,H2CO3、H+可忽略,只要是c 不是很小,Kw 也可忽略) [][]33NH HCO ≈-→ c c NH HCO 233⋅=⋅-δδ(5)混合溶液①两种弱酸:[]2211c Ka c Ka H ⋅+⋅=+②一种强酸和一种弱酸:类似硫酸的酸性计算,列出质子守恒,用分布分数求解。
酸碱滴定法
OH-
Kw
aH aOH a
2 H 2O
活度(activity):溶液中离子强度等于0时的浓度, 即物质的有效浓度。 溶质的活度与浓度的关系:a =γc 活度系数γ与溶液的离子强度I有关。
1 2 I ci zi 2 i 1
n
在稀溶液中,通常将溶剂的活度视为1。则离解 常数为:
[H ][A ] Ka [HA]
[HA][OH ] Kb [A - ]
共轭酸碱对Ka与Kb的关系
H A HA OH Ka Kb H OH K W HA A
[H ][A ] [HA][OH ] [H ][OH ] K W [HA] [A - ]
δ值只是H+浓度的函数。当已知酸或碱溶液的 pH值后,便可计算出δ值。再根据酸碱的分析浓度 进一步求得酸碱溶液中各种存在型体的平衡浓度。
图4-1 HAc各型体的δi -pH曲线
二、多元酸溶液 在 H2C2O4 溶 液 中 存 在 有 H2C2O4 、 HC2O4- 和 C2O42-三种型体,设其总浓度为 cH C O mol/L,则
HCO
3
=[HCO3-]/ c Na 2CO3 = Kb1 [OH-]/([OH-]2+Kb1[OH-]+Kb1Kb2) =Ka1· +] /([H+]2+Ka1[H+]+Ka1· a2) [H K
H CO
2
3
=[H2CO3]/ c Na 2CO3 =Kb1Kb2 /([OH-]2+Kb1[OH-]+Kb1Kb2) =[H+]2 /([H+]2+Ka1[H+]+Ka1· a2) K
分析化学第五章酸碱滴定法
NH4+
NH3
NH4+ + H2O
NH3+H3O+
pX= - lg [X]
Ka = [NH3][H3O+]/[NH4+]
NH3+H2O
NH4++OH-
Kb = [NH4+][OH-]/[NH3] KaKb=[H3O+][OH-]=Kw
pK a pK b pK w 14.00 25 C
水溶液中共轭酸的Ka与其共轭碱的Kb之积
find sulphuric acid ?
(二)电荷平衡CBE 溶液电中性:
阳离子所带正电荷的量=阴离子所带负电荷的量 浓度为c的CaCl2溶液 带正电荷的阳离子H+,Ca2+, 带负电荷的阴离子Cl-,OH[H+]+ 2[Ca2+]=[Cl-]+[OH-] Na2CO3溶液 [Na+]+[H+]=[OH-]+[HCO3-]+2[CO32-]
(三)质子条件式(PBE)
方法 TWO
写PBE时,首先要确定参考水准(大量存在并且参 与质子转移的物质),然后根据参考水准得失质子 情况写出等式。
例:HAc 溶液
H+
参考水准:H2O 和 HAc
H+ OH-
Ac-
H2O HAc
OH-
Ac-
H OH Ac
参考
H+,
H2CO3
例:写出NH4HCO3溶液的PBE
等于水的质子自递常数Kw
例 已知醋酸HAc的Ka=1.810-5, 求其共轭碱Ac -的 Kb. 解: 共轭酸碱对的Ka与Kb满足关系
2024年高考化学实验常见公式总结
2024年高考化学实验常见公式总结一、酸碱滴定实验1. 酸碱滴定反应计算公式:M₁V₁ = M₂V₂其中,M₁为酸的浓度,V₁为酸的体积;M₂为碱的浓度,V₂为碱的体积。
2. pOH和pH的计算公式:pOH = -log[OH⁻]pH = 14 - pOH3. 酸碱滴定指示剂的变色范围:酸性:红色中性:紫色碱性:绿色二、氧化还原滴定实验1. 氧化还原滴定反应计算公式:n₁V₁ = n₂V₂其中,n₁为氧化剂的物质的当量数,V₁为氧化剂的体积;n₂为还原剂的物质的当量数,V₂为还原剂的体积。
2. 氧化还原滴定指示剂的变色范围:还原:蓝色氧化:橙色三、酸碱中和实验1. 酸碱中和反应计算公式:M₁V₁ = M₂V₂其中,M₁为酸的浓度,V₁为酸的体积;M₂为碱的浓度,V₂为碱的体积。
2. 酸碱中和指示剂的变色范围:酸性:红色中性:紫色碱性:绿色四、还原硝酸银法1. 还原硝酸银法计算公式:n₁V₁ = n₂V₂其中,n₁为还原剂的物质的当量数,V₁为还原剂的体积;n₂为硝酸银的物质的当量数,V₂为硝酸银的体积。
2. 指示剂的变色范围:初始颜色:无色变色范围:浑浊,逐渐变淡直至消失五、气体制取实验1. 气体制取实验公式:PV = nRT其中,P为气体的压强,V为气体的体积;n为气体的物质的物质的物质的数量,R为气体常数,T为气体的温度。
六、电解实验1. 电解实验计算电荷公式:Q = It其中,Q为电荷的大小,I为电流的强度,t为流过的时间。
七、离子反应实验1. 离子反应实验计算物质浓度公式:M₁V₁ = M₂V₂其中,M₁为反应物A的浓度,V₁为反应物A的体积;M₂为反应物B的浓度,V₂为反应物B的体积。
以上是____年高考化学实验中常见的公式总结,希望对你的学习有所帮助!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分析化学 酸碱滴定法 公式
2010级化学一班 李海波 2011-11-04
一、离子的活度和活度系数
活度:i i i c a γ= (i γ为活度系数,浓度很小的溶液近似等于1)
稀溶液中,离子强度:2
1
21i n i i z c I ∑==
二、分布分数δ ※一元(HA ,Ka )
[][]
+
+
+=
H Ka H HA δ []
+
+=
H
Ka Ka
A
δ []HA C HA δ⋅= []
-⋅=-A C A δ ※多元(H n A ,Ka 1、Ka 2、Ka n ) [][][][]n
n n n
n
A
H Ka Ka Ka Ka Ka H Ka H H H n ΛΛ2
1
2
1
2
1
1
++++=
-+-+++δ
[][][][]n
n n n
n A
H
Ka
Ka Ka Ka Ka H Ka H H Ka
H n ΛΛ2
1
2
1
2
1
1
1
1
1++++=-+-++-+--δ [][]
[]
n
n n n
n
A Ka Ka Ka Ka Ka H
Ka H H Ka Ka Ka n ΛΛΛ21212
11
21++++=
-+-++-
δ
三、溶液中PH 的计算
1、计算时要先判断环境是酸性还是碱性。
2、像硫酸这种第一步解离完全,第二步不完全解离的不满足上式,但与上式的推
导过程类似,应用质子守恒列方程,[OH -]太小,忽略。
①酸式盐,eg :NaHA
242342 3 小,Kw 也可忽略) []
[]33NH HCO ≈- → c c NH HCO 233
⋅=⋅-δδ
(5)混合溶液
①两种弱酸:[]
2211c Ka c Ka H ⋅+⋅=+
②一种强酸和一种弱酸:类似硫酸的酸性计算,列出质子守恒,用分布分数求解。
③一种弱碱和一种弱酸:[]碱
酸c c Ka Ka H 2
1⋅=+
(6)缓冲溶液(弱酸HA 浓度c 1,共轭碱A -
浓度c 2)※标准缓冲溶液要考虑离子强
四、缓冲溶液的缓冲容量。
