有机化学第三章
有机化学-第三章

这时用“顺序规则”来区分a、b、d、e原子或基团。 连在同一个碳上的两个基团相比较,如果两个碳连的 “较优”基团在π键平面的同侧者称为Z-异构体,用Z 表示;如果两个“较优”基团在π键的两侧者称为E异构体,用E表示。命名时,Z、E放到括号中,放到名 称前面。用“↑”表示顺序方向,箭头指向“较优”
同样用-CH3取代丁烷碳链异构体中的不同类型氢原 子,可以得到戊烷的3个碳链异构体:
以此类推,可以得到不同碳原子数的烷烃的碳链异构 体数目:
C数 1 2 3 4 5 6 7 8 9 20 40 62 491 178 805 831
异构体数
1
1
1
2
3
5
9
18
35
366 319
可见随链烷烃中碳原子数增加,碳链异构体数目 急剧增加。这是逐渐增加C数的方法推导碳链异构 体。
(二)旋光性物质与旋光度 普通光通过两个平行放置的尼科尔棱镜晶体,通过 第一块后变成偏光,偏光也能通过第二块晶体。如果 在两块晶体间放一盛液管,如管内放置水、乙醇、醋 酸等,仍可以看到光通过第二块晶体,如果管内放置 葡萄糖水溶液,观察不到光通过第二块晶体,把第二 块晶体转α角后,才能观察到有光通过
2.环烷烃碳架异构现象 可以用逐步缩小碳环,缩下来的碳原子组成不同的基, 连到缩小后的碳环的不同位置上,写出环烷烃碳架异 构体。 例如:分子式为C6H12的环烷烃可以写出12个异构体:
二、官能团位置异构
各类化合物可以看成是官能团取代相应烃中的氢原子 的产物。官能团取代碳架异构体中的不同氢,形成了 官能团位置异构体 例1.丁烷有两个碳架异构体,可形成四个一元醇的构异 体:
有两个以上环碳原子上各有一个或两个取代基时,选 择其中位次最低者为“参考基团”,在位号前加“r” 表示,其余取代基用顺或反表示与“参考基团”的立 体关系:
有机化学 第三章 环烷烃
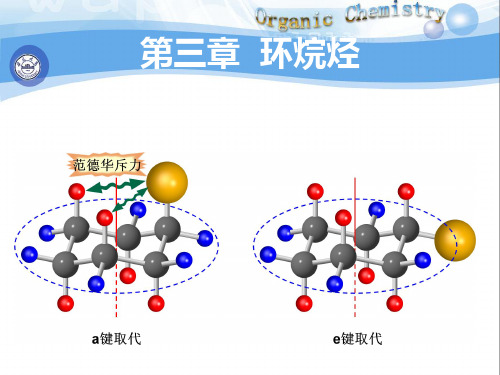
张力学说( 一、Baeyer张力学说(strain theory) 张力学说 )
假定成环碳原子都在同一平面上 并排成正多边形。 同一平面上, ※ 假定成环碳原子都在同一平面上,并排成正多边形。 碳原子间的夹角必偏离正常键角。这种由于键角偏离 碳原子间的夹角必偏离正常键角。 正常键角而引起的张力称为角张力。 正常键角而引起的张力称为角张力。 角张力 。 碳环中碳原子键角偏离正常键角越大,角张力越大, ※ 碳环中碳原子键角偏离正常键角越大,角张力越大, 分子越不稳定,反应活性也越大。 分子越不稳定,反应活性也越大。
E
CH3 CH3 CH CH3
CH3 CH3
1
4-甲基环己烯 5-乙基-1,3-环己二烯 - -乙基- , -
顺-1,3-二甲基环丁烷 , -
第二节 环烷烃的性质
一、物理性质
n = 3,4 , 气态 n=5 ※状态 液态 n≥6 固态 ※m.p.: 环烷烃比直链烷烃能够更紧密地排列于晶格中 .: 同数碳原子的直链烷烃。 故m.p.>同数碳原子的直链烷烃。 同数碳原子的直链烷烃 0.688<d<0.853 ※d: 环烷烃不溶于水 ※s: 环烷烃不溶于水
在不同的环烃中键角大于或小于109° ,而正常的SP ※在不同的环烃中键角大于或小于 °28′,而正常的 3 杂化轨道之间的夹角为109°28′即C-C之间的电子云没有达 ° 即 - 之间的电子云没有达 杂化轨道之间的夹角为 到最大程度的重叠。 到最大程度的重叠。 1
( 109 °2 8′- 6 0°) = 24°64′ - ) 2 1 ( 1 09°28 ′- 90 °) = 9 °44 ′ - ) 2 1 ( 109 °2 8′- 1 08°) = 0°44′ - ) 2 1 1 09°28′- 120 °) = -5°1 6′ - ) 2(
有机化学 第三章 烯烃、炔烃和二烯烃

第三章烯烃、炔烃和二烯烃第一节烯烃和炔烃单烯烃是指分子中含有一个C=C的不饱和开链烃,简称烯烃.通式为C n H2n。
炔烃是含有(triple bond) 的不饱和开链烃。
炔烃比碳原子数目相同的单烯烃少两个氢原子,通式CnH2n-2。
一、烯烃和炔烃的结构乙烯是最简单的烯烃, 乙炔是最简单的炔烃,现已乙烯和乙炔为例来讨论烯烃和炔烃的结构。
(一)乙烯的结构分子式为C2H4,构造式H2C=CH2,含有一个双键C=C,是由一个σ 键和一个π 键构成。
现代物理方法证明,乙烯分子的所有原子都在同一平面上,每个碳原子只和三个原子相连.杂化轨道理论根据这些事实,设想碳原子成键时,由一个s轨道和两个p轨道进行杂化,组成三个等同的sp2杂化轨道,sp2轨道对称轴在同一平面上, 彼此成1200角.此外,还剩下一个2p轨道,它的对称轴垂直于sp2轨道所在的平面。
乙烯:C-C σ键4C-H σ键在乙烯分子中,两个碳原子各以一个sp2轨道重叠形成一个C-Cσ键,又各以两个sp2轨道和四个氢原子的1s轨道重叠,形成四个C-Hσ键,五个σ键都在同一平面上。
每个碳原子剩下的一个py轨道,它们平行地侧面重叠,便组成新的分子轨道,称为π轨道。
其它烯烃的双键也都是由一个σ键和一个π键组成的。
双键一般用两条短线来表示,如:C=C,但两条短线含义不同,一条代表σ键,另一条代表π 键。
π键重叠程度比σ键小,不如σ键稳定,比较容易破裂。
(二)乙炔的结构乙炔的分子式是C2H2,构造式H-C≡C-C,碳原子为sp 杂化。
两个sp杂化轨道向碳原子核的两边伸展,它们的对称轴在一条直线上,互成180°。
在乙炔分子中,两个碳原子各以一个sp轨道互相重叠,形成一个C-Cσ键,每个碳原子又各以一个sp轨道分别与一个氢原子的1s轨道重叠形成C-Hσ键。
此外,每个碳原子还有两个互相垂直的未杂化的p轨道(px,py),它们与另一碳的两个p轨道两两相互侧面重叠形成两个互相垂直的π键。
有机化学 第三章 烯烃全

KOH
Br
C2H5OH
+ HBr
17
3-4 烯烃的物理性质
物质状态 C2~C4 气体,C5~C18液体 ,C19~固体
沸点、熔点和相对密度 均随相对分子量的增加而上升;直链烯烃的沸 点略高于支链烯烃;末端烯烃(α-烯烃)的沸点 略低于双键位于碳链中间的异构体。
溶解性 不溶于水,易溶于有机溶剂。
HCl CF3CH2CH2 Cl
Cl
CF3CH2CH2
(主)
HCl CF3CHCH3
Cl
Cl
CF3CHCH3
35
烯烃的亲电加成反应
HX反应活性 HI > HBr > HCl > HF
H2C CH2
HBr HAc
CH2 Br
CH2 H
HCl H2C CH2 AlCl3
H2C CH3 Cl
36
与硫酸的加成 ——间接水合
H3C C
H
CH3 C
H
H C
H3C
CH3 C
H
顺式
反式
7
3-2 烯烃的异构和命名
系统命名法
选主链:选择含双键的最长碳链作主链, 称 “某烯”, 若碳原子数大于10, 则称为“某碳 烯”;
编号:从靠近双键的一端开始编号,确定双键 (两双键碳原子中编号小的数字)及其它取代 基的位次;
其它同烷烃的命名。
18
顺 反 异 构 体 的 差 异
极性较大, b.p. 较高 极性较小, b.p. 较低
对称性较差,m.p. 较低
对称性较好,m.p. 较高19
3-5 烯烃的化学性质(重点)
• 反应:加成、氧化、卤代
α HCCC
有机化学第三章不饱和烃

4 H +C
+
C
H
H
C
C
H H
H
+
H
C
.C
H H
• 键两部分电子云,象两块面包夹住圆柱型 键。
第三章 不饱和脂肪烃
学问如清泉,越掘越甘甜
(二)炔烃的结构
• 1、叁键上的碳原子以sp杂化。
2 S
2 P
2 Py 2 Pz SP
18O0
+
一个杂化
轨道
第三章 不饱和脂肪烃
学问如清泉,越掘越甘甜
2、乙炔分子中三个 键,2个π键的形成。
1)原子序数大的优先。
• Cl > F > O>N >C >B >H >孤电子对
2) 从离烯碳最近的原子
第二
(第一道弧线上)开始比
较, 如果都相同,依次比 较第二道弧线上的原子; H 3 C
如果还相同, 就比较第三道弧线上的 原子……
C l 第一
弧线
直到有一个优先。
弧线
H
H
H
HH
H
第三
H
弧线
H OH 第三章H不饱和脂肪烃
H+
C
+
C
+ H 三个 键
H
C
C
H
的形成
二个π键
+
的形成
HC
CH
三键的筒 状电 子云
第三章 不饱和脂肪烃
学问如清泉,越掘越甘甜
• 三.烯烃和炔烃的性质
• (一)烯烃和炔烃的物理性质
• 烯烃、炔烃物理性质与烷烃的相似。 ➢均不溶于水。 ➢2~4个碳原子的烯烃、炔烃在室温下为气体,
5~19个碳原子的烯烃在室温下为液体。
有机化学 第三章讲解

CH 2 =CH 2
+ HO Cl
Cl-CH 2 -CH 2 -OH
-氯乙醇
实际操作时,常用氯和水直接反应。例:
Cl CH 2 =CH 2
Cl 2 -Cl
-
CH 2 Cl
+
CH 2
H 2O -H
+
CH 2
CH 2 (主) OH
Cl -
Cl CH 2
-氯乙醇
CH 2 (副) Cl
33
b a CH 3 -CH=CH
CH 3 CH 3 -C CH-CH 3
30
3 碳正离子
。
H
Cl H
重 排 产 物 (主 )
(d) 过氧化物效应
但有过氧化物存在时:
CH 3 -CH=CH
2
+ HBr
hor
过氧化物
CH 3 CH 2 CH 2 Br (反马)
只能是HBr (HCl、HI都不反马)
31
(丙) 与硫酸加成
烯烃与H2SO4的加成反应也是亲电加成反应,加成方向 遵循马氏规则。例:
2
+ HCl
CH 3 -CH-CH Cl
2-氯丙烷 主要产物
乙酸 80%
3
+ CH 3 CH 2 CH 2 Cl
1-氯丙烷 次要产物
CH 3 CH 2 CH=CH
2
+ HBr
CH 3 CH 2 CH CH Br
HBr
2
H
2-溴丁烷
Br
CH 3 CH 2 CH 2 C CH
HBr
CH 3 CH 2 CH 2 C=CH 2 Br
2
(一) 烯烃和炔烃的结构
《有机化学》第三章 不饱和烃
吸电子基团: +NR3>NO2>CN>COOH>F>Cl>Br>I>COOR>OR>
COR>SH>OH> C CR>C6H5>CH=CH2>H
诱导效应的特点:
(1)诱导效应的强弱取决于原了或基团的电负性的大小
的两原子可相对的自由旋转。 能相对自由旋转。Βιβλιοθήκη c.键的可极化度:较小。 较大
1.2 单烯烃的异构现象
1.2.1 结构异构
CH3 CH2 CH CH2 CH3 CH CH CH3
1-丁 烯
2-丁 烯
官能团碳碳双键 位置异构
CH3 C CH2 2-甲 基 丁 烯 CH3
碳链异构
结构异构是由于分子中各原子的结合顺序不同而引起的, 位置异构和碳链异构均属于结构异构。
(2) 与卤化氢的加成
CH3CH CHCH3 + HCl CH3CH2CHCH3
2–丁烯
HBr CH3CH2CH CH2
Markovnikov规则
Cl
2–氯丁烷
Br
CH3CHCH CH3
80 %
CH3CHCH2 CH2Br 20 %
当不对称的烯烃与卤化氢等极性试剂加成时,氢原总
是加到含氢较多的双键碳原子上,卤原子(或其子或
上相互重叠。
从侧面重叠。
电子云的分布情况 a. 电子云集中于两原子 电子云分布在 键所
核的连线上,呈圆柱形分布。 在平面的上下两方,呈块
状分布。
有机化学-第三章
A molecule is achiral if its two mirror image forms are superposable.
Enantiomers
nonsuperposable mirror images are called enantiomers
and
are enantiomers with respect to each other
对称因素: 对称因素:
1. 对称面( σ ) 对称面(
2. 对称中心(i) 对称中心(
H H3C H H H H H CH3
3. 对称轴(Cn) 对称轴(Cn) 以设想直线为轴旋转360。/ n,得到与原分子 以设想直线为轴旋转 , 相同的分子,该直线称为n重对称轴 又称n阶对 重对称轴( 相同的分子,该直线称为 重对称轴(又称 阶对 称轴)。 称轴)。
对映体:成对存在,旋光能力相同, 对映体:成对存在,旋光能力相同,但旋光 方向相反。二者能量相同( 方向相反。二者能量相同(分子中任何两原子的 距离相同)。 距离相同)。 换句话说, 换句话说,具有实物和镜象关系的两个化 合物互称对映异构体。 合物互称对映异构体。
COOH C CH3 H OH COOH H C CH3 HO R-(-)-乳酸 乳
二、分子的对称性和手性
手性( 手性(Chirality) )
Left hand and right hand
相似而不重合
手性( 手性(Chirality) )
物质与其镜象相似而不重合的特征。 物质与其镜象相似而不重合的特征。 不重合的特征
scissors chair
screw
car
scoop
bottle
=
α
有机化学 第三章 烯烃和炔烃
炔烃的加氢:
炔烃的催化加氢反应是逐步实现的。
R C C R' + H2
pd
R H
C C
R' H 2 H pd
RCH2CH2R'
选择适当的催化剂可是产物停留在烯烃阶段: 使用Lindlar催化剂、Pd/C、硼化镍(P-2)催化剂可得顺 式烯烃;在液氨中用Na、Li还原炔烃主要得到反式产物。
RC CR' + H2
H2C 乙烯 HC 乙炔
2013年8月2日7时17分
CH2
H2C
H C 丙烯
CH3
C11H22 十一(碳)烯
CH
HC
C 丙炔
CH3
C15H28 十五(碳)炔
22
2)从靠近重键端开始编号,并以构成重键的 两个碳原子中号数小的一个表示重键的位置, 将重键位号写在母体名称之前:
H2 C
H3C
C H C
H C H2 C
2013年8月2日7时17分
10
碳碳双键(C≡ C)中C的杂化轨道:
C C
C
sp 杂化
杂化 2s2
2013年8月2日7时17分
2p2
sp 杂化
2p
11
C C
2013年8月2日7时17分 12
C2H2(乙炔)分子:
H
2013年8月2日7时17分
C C
H 线型分子
13
2013年8月2日7时17分
Lindlar Cat.
R H
R' C C H
C2H5 C C H H
38
(顺式烯烃); H2
2013年8月2日7时17分
Pd/CaCO3 喹啉
《有机化学》第三章 不饱和烃
第三章 不饱和烃不饱和烃是指分子结构中含有碳碳双键或三键的烃。
不饱和烃中含有碳碳双键的叫烯烃,含有碳碳三键的称为炔烃。
含有两个或多个碳碳双键的不饱和烃称为二烯烃和多烯烃。
一个不饱和烃分子结构中同时含有碳碳双键和三键则称为烯炔。
不饱和烃的双键和三键不太牢固,容易发生亲电加成反应、取代反应及氧化反应。
烯烃是指含有碳碳双键的不饱和烃,包括链状烯烃和环状烯烃,其官能团为碳碳双键。
链状烯烃的通式为C n H 2n (n ≥2)。
相对于饱和烷烃,烯烃分子结构中每增加1个双键则减少2个氢原子。
一、烯烃的结构和异构现象 (一)烯烃的结构烯烃的结构中主要特征部分为碳碳双键,以最简单的烯烃-乙烯为例来了解双键的结构,乙烯的分子式为C 2H 4,乙烯的两个C 原子和四个氢原子均在同一个平面上,每个碳原子只和3个原子相连,为平面型分子。
碳碳双键由1个σ键和1个π键构成,而不是两个单键构成。
乙烯的平面构型如图3-1(a )所示,分子模型见图3-1(b )和3-1(c )。
CCH HH H121.7°117°0.108nm(a)乙烯的平面构型 (b)球棍模型 (c)比例模型图3-1 乙烯分子的结构拓展阅读碳原子的sp 2杂化和π键杂化轨道理论认为,乙烯分子中的碳原子在成键过程中,处于激发态的1个2s 轨道和2个2p 轨道进行杂化,形成3个能量相同的sp 2杂化轨道,称为sp 2杂化,其杂化过程可表示为:2s 2p激发sp 2杂化sp 2杂化轨道2p2s 2p基态激发态杂化态形成的3个sp 2杂化轨道中每个含有1/3的s 轨道成分和2/3的p 轨道成分,形状是一头大一头小;3个sp 2杂化轨道的对称轴分布在同一平面上,夹角为120°,呈平面三角形,每个碳原子还有一个2p z 轨道未参与杂化,其对称轴垂直于3个sp 2杂化轨道的对称轴所形成的平面,见图3-2。
由此可见,乙烯分子中碳碳双键是由1个σ键和1个π键组成的,π键是由2个p 轨道侧面重叠形成的,电子云分布于键轴上下,键能较小,同时由于π键电子云离核较远,受原子核束缚力较弱,容易被外电场极化,所以π键不稳定,比σ键容易断裂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
通常将碳碳双键处于端位的烯烃, 统称α- 烯烃。 碳碳三键处于端位的炔烃,一般称为端位炔烃。
环烯烃和环炔烃的命名
以环为母体,成环碳原子编号时,将1,2位次给双键或叁键碳 原子,但命名时位次号“1”省略。取代基放在母体名称之前。
CH3 3
7 6
4 5 CH3
8 1 2
3 2 1 5 4
C2H5
3-戊烯 - 1-炔
CH3C CCHCH2CH CH2 C2H5
4- 乙基 -1-庚烯 -5-炔
注:若双键和三键处于相同的位次供选择时, 优先给 双键最低编号。
HC C CH CH2 CH3C CCHCH2CH CHCH3 CH CH2
1-丁烯 -3- 炔 5- 乙烯基 -2- 辛烯 -6- 炔
四、 烯烃和炔烃的物理性质
二、烯烃和炔烃的同分异构
1、构造异构:含有四个或四个以上碳原子的烯烃和 炔烃不仅存在碳架异构,还存在官能团位次异构。
CH3CH2CH CH2
1-丁烯
CH3
CH3 C CH2
CH3CH CHCH3
2-甲基丙烯 2-丁烯 (异丁烯) CH3 CH3CH2CH2C CH CH3 CH C CH CH3CH2C CCH3 1-戊炔 3-甲基-1-丁炔 2-戊炔
C2H5C CC2H5 + H2 P-2 催化剂
C2H5 C C H 97%
C2H5 H
CH3CH2C C(CH2)3CH3
Na, 液NH3, -78 C
o
H
(CH2)3CH3 C C H 97%~99%
CH3CH2
(2) 氢化热与烯烃的稳定性
1mol 不饱和烃氢化时所放出的热量称为氢化热。利用氢化热可 以获得不饱和烃相对稳定性的信息。
沸点:3.5 熔点: -139.3
0.9 -105.5
五、烯烃和炔烃的化学性质
C C + X Y C C X Y C C X Y X Y X Y C C X Y
C C
+ X Y
Π 键的加成反应——烯烃和炔烃最主要的反应
CH CH CH2
烯、炔的α-氢原子的 被取代的反应
炔氢的被取代的反应
C CH
1、加氢 (1)催化氢化和还原
CH3 C C
丙炔基 1-丙炔基
CH CH
1,2-亚乙烯基
2、烯烃和炔烃的命名
CH2 C CH2CH3 CH3 CH2CH2CH3 CH3 C CH CHCH3 CH3 CH2CH3 CH3CH C CH2 CH2CH2CH3
2-乙基-1-戊烯
4,4-二甲基-2-戊烯
3-甲基-2-乙基 -1-己烯
2 1 6
CH3
5 4 3
4-乙基环戊烯
3,5-二甲基环己烯
5-甲基环辛炔
3、烯烃顺反异构体的命名 (1)顺,反-标记法
H3C C C H H H3C
顺 - 2 - 戊烯
CH2CH3
H C C
CH2CH3 H
反 - 2- 戊烯
但当两个双键碳原子所连接的四个原子或基团都 不相同时, 则难用顺反命名法命名。
2、构型异构:当烯烃的两个双键碳原子各 连有不同取代基时, 会产生顺反异构。
CH3 C C CH3
HCH3 C CH NhomakorabeaH
H
CH3
顺- 2 -丁烯
反- 2 -丁烯
单炔烃不存在顺反异构现象。
• 产生顺反异构体的必要条件: 构成双键 的任何一个碳原子上所连的两个基团要 不同。
a C b C a b a C b C a d a a C C a b a b C C d d
说明:2
• 对于相同碳原子数的顺反异构体,顺式结构是 不对称,有弱极性;反式结构是对称的,无极 性。 • 沸点:顺式>反式。 • 晶态时,反式结格较为紧密,熔点:反式>顺式。
顺-2-丁烯和反-2-丁烯极性差异:
CH3 H
CH3 C C H
H C C CH3 μ =0
CH3 H
μ = 1.1 10-30C m ·
20
û Æ Ã ³ Ò È ² û ² ±È 1-¶ È ¡ ² 1-Î È ì ² 2-Î È ì ² 3-¼ ù -1-¶ È ³» ¡ ² 1-¼ È º ² 1-· È ý ² 1-Ê °Ì È ® Ë ¼ ²
Û ã È µ /C -81.8 -101.5 -122.5 -98 -101 -124 -80.9 22.5
û Æ Ã ³ Ò Ï © û © ±Ï 1-¶ Ï ¡ © ³ Ë -2-¶ Ï ¡ © ²-2-¶ Ï ´ ¡ © 2-¼ » ±Ï ³ù û © 1-Î Ï ì © 2-¼ » -1-¶ Ï ³ù ¡ © 3-¼ » -1-¶ Ï ³ù ¡ © 1-¼ Ï º © 1-· Ï ý © 1-Ê °Ì Ï ® Ë ¼ © Û ã È µ /C -169.5 -185.2 -130 -139.3 -105.5 -140.8 -166.2 -137.6 -168.5 -139 -119 17.5 Ð ã ²µ / C -103.7 -47.7 -6.4 3.5 0.9 -6.9 30.1 31.2 20.1 63.5 93.6 179 ´ Ô Ü È Ï ¶ à ¶ (d 4 ) 0.570 0.610 0.625 0.621 0.604 0.631 0.641 0.650 0.633 0.673 0.697 0.791
第三章 不 饱 和 烃
一、 二、 三、 四、 五、 六、 烯烃和炔烃的结构 烯烃和炔烃的同分异构 烯烃和炔烃的命名 烯烃和炔烃的物理性质 烯烃和炔烃的化学性质 烯烃和炔烃的工业来源和制法
学习要求
• 1.掌握sp2杂化的特点,形成π键的条件以及π 键的特性,掌握烯烃的结构。 • 2.掌握sp杂化的特点,炔烃的结构。 • 3.掌握烯烃、炔烃的命名方法,了解次序规 则的要点及Z / E命名法。 • 4.掌握烯烃、炔烃的重要反应(加成反应、 氧化反应、α-H的反应)。 • 5.掌握烯烃的亲电加成反应历程,马氏规则 和过氧化物效应。
前一页
说明:1
• 由于s轨道的电子比p轨道的电子更靠近原子 核,受原子核的束缚力大。所以,杂化轨道 中的S成份越多,电子就越靠近原子核,碳 原子的电负性就越大。 • 极性:三键碳原子(sp杂化)>双键碳原子(sp2杂 化) >饱和碳原子(sp3杂化) 。 • 故在烯烃和炔烃分子中,具有一定的极性, 使分子产生偶极距,是弱极性分子,其中炔 的极性略大。 • 相同碳原子数的烷、烯、炔,沸点(熔点): 炔>烯>烷。
(N (C) ) C N 相当于 C N (N) (C)
优先顺序:
C N > > C CH > CH CH2
B、Z,E — 命名法:依据次序规则比较出两个双键碳原 子所连接取代基优先次序。当较优基团处于双键的同侧 时,称 Z 式;处于异侧时,称 E 式。
H C C H3C
CH2CH3 CH3
H3C C C H
H
乙烯中的 σ 键
π 键的形成
2、碳碳叁键的组成:
(1)碳原子轨道的 sp 杂化
激发 2p 2s 2s 2p
杂化 p sp
1sp 杂化轨道 = 1/2 s + 1/2p
一个sp 杂化轨道
二个sp 杂化轨道
未参与杂化的两个p轨道的对称轴互相垂直且都垂直 于sp杂化轨道对称轴所在直线。
(2)碳碳三键的组成
Ni,C2H5OH 25 C,5MPa Ni,C2H5OH
25 C,5MPa
CH3CH CH2 + H2
CH3C CCH3 + 2H2
CH3CH2CH3
CH3CH2CH2CH3
• 说明: • 1、催化加氢的用途。 • 2、催化加氢的反应机理。
3、炔烃比烯烃更容易进行催化氢化(但可控制 反应条件,使其停留在烯烃阶段)。
H C C CH3 CH2CH2CH3 CH3 CH2CH3 CH3CH2 C C CH2CH2CH3 CH(CH3)2
(2) Z , E - 标记法
A、次序规则: (a) 与双键碳原子直接相连的原子按原子序数大小排 列, 大者 “较优”。 I > Br > Cl > S > O > N > C > H (b) 如与双键碳原子直接相连的原子的原子序数相同, 则需再比较由该原子外推至相邻的第二个原子的原 子序数,如仍相同,继续外推,直到比较出 “较优” 基团为止。(“外推法”)
CH3 CH3 Pd-CaCO3 H2C CHC CHCH2CH2OH HC C C CHCH2CH2OH + H2 喹啉 80%
4、加成产物的构型:一般是顺式加成。 5、炔烃的部分氢化:
用喹啉或醋酸铅部分毒化的Pd-CaCO3一般称为Lindlar催化剂; 用醋酸镍在乙醇溶液中用硼酸还原的Ni2B,称为P—2催化剂。
2p
2p
sp2 sp sp2
2
2s
激发态
杂化态
1个sp 杂化轨道 = 1/3 s + 2/3 p
2
sp2
sp2
余下一个未参与杂化的p轨道,垂直 于三个杂化轨道对称轴所在的平面。
(2)碳碳双键的组成 以乙烯分子为例:
乙烯分子中的σ键
乙烯分子中的π键
H
H
H H
H H
H H
H H
π 电子云形状
C
H
C
CH2CH3 CH3
(E) - 3- 甲基 - 2- 戊烯 课堂练习:P75的(4)
(Z) - 3- 甲基 - 2- 戊烯
顺和Z、反和E 没有对应关系!
Z-1-甲基-3-异丙基-2-已烯
4、 烯炔的命名:选择同时含有碳碳双键和碳碳 叁键在内的最长碳键作为主键,叫作某“烯炔”。
