【新教材】3.1.2 铁及其化合物之间的转化关系教学设计(2)-鲁科版高中化学必修第一册 (2)
2019-2020年高中化学 3.1.2《碳及其化合物间的转化》教学设计 鲁科版必修1
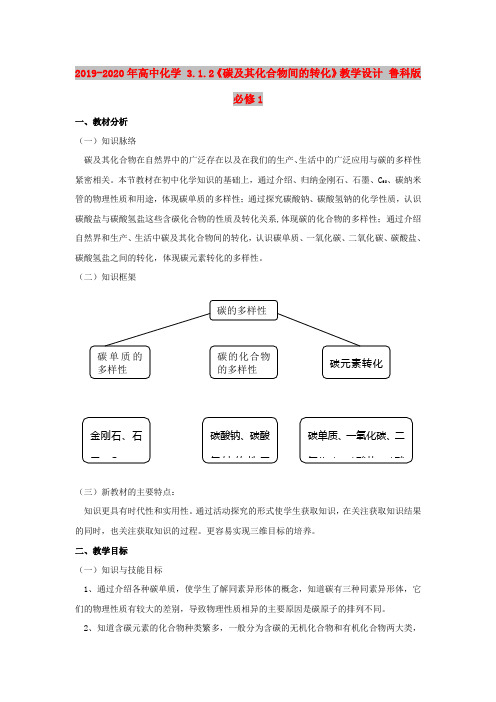
2019-2020年高中化学 3.1.2《碳及其化合物间的转化》教学设计 鲁科版必修1一、教材分析(一)知识脉络碳及其化合物在自然界中的广泛存在以及在我们的生产、生活中的广泛应用与碳的多样性紧密相关。
本节教材在初中化学知识的基础上,通过介绍、归纳金刚石、石墨、C 60、碳纳米管的物理性质和用途,体现碳单质的多样性;通过探究碳酸钠、碳酸氢钠的化学性质,认识碳酸盐与碳酸氢盐这些含碳化合物的性质及转化关系,体现碳的化合物的多样性;通过介绍自然界和生产、生活中碳及其化合物间的转化,认识碳单质、一氧化碳、二氧化碳、碳酸盐、碳酸氢盐之间的转化,体现碳元素转化的多样性。
(二)知识框架(三)新教材的主要特点:知识更具有时代性和实用性。
通过活动探究的形式使学生获取知识,在关注获取知识结果的同时,也关注获取知识的过程。
更容易实现三维目标的培养。
二、教学目标(一)知识与技能目标1、通过介绍各种碳单质,使学生了解同素异形体的概念,知道碳有三种同素异形体,它们的物理性质有较大的差别,导致物理性质相异的主要原因是碳原子的排列不同。
2、知道含碳元素的化合物种类繁多,一般分为含碳的无机化合物和有机化合物两大类,通过活动探究认识碳酸钠和碳酸氢钠的主要性质,初步体会它们性质的差异。
3、根据生产、生活中的碳元素转化的实例,了解碳单质、一氧化碳、二氧化碳、碳酸盐、碳酸氢盐之间的转化,从而进一步了解它们的性质。
使学生能够解释与含碳化合物有关的现象和解决简单问题,如水垢的形成与消除、木炭燃烧的现象、工业上炼铁的原理等,体会化学在人类生产、生活中的应用,激发学生学习化学的兴趣。
(二)过程与方法目标1、通过探究碳酸钠和碳酸氢钠的主要性质,进一步熟悉研究物质性质的基本程序,培养学生利用实验科学探究的能力。
2、体会将自然界中的转化与实验室中的转化统一起来的科学思维方法。
(三)情感态度与价值观目标1、通过实验探究激发学生探究化学的兴趣,发扬合作学习的精神,养成严谨科学的学习习惯。
【新教材】3.1.2 铁及其化合物之间的转化关系练习(2)(解析版)

3.1.2 铁及其化合物之间的转化关系第I卷(选择题)一、单选题1.①FeCl2②Fe(OH)3③FeCl3,通过化合、置换、复分解反应均能制得的是()A.只有①B.只有②C.只有①③D.全部【答案】A①Fe与氯化铁发生化合反应生成氯化亚铁,铁与盐酸发生置换反应生成氯化亚铁,氢氧化亚铁与盐酸发生复分解反应生成氯化亚铁,都能制得,故①符合题意;②Fe(OH)3可通过氢氧化亚铁、氧气、水发生化合反应生成,可通过NaOH与FeCl3发生复分解反应生成,但不能通过置换反应得到,故②不符合题意;③FeCl3可通过铁和氯气发生化合反应生成,可通过氯化钡与硫酸铁发生复分解反应生成,不能通过置换反应得到,故③不符合题意;2.常温下,向下列各溶液中分别投入铁片,溶液质量变化最小的是A.浓HNO3B.HCl C.CuSO4D.AgNO3【答案】A试题分析:常温下,向浓HNO3中投入铁片,铁钝化,溶液质量几乎不变;常温下,向HCl中投入铁片,生成氯化亚铁和氢气,溶液质量增加;常温下,向CuSO4溶液中投入铁片,生成硫酸亚铁和铜,溶液质量减小;常温下,向AgNO3溶液中投入铁片,生成硫酸亚铁和银,溶液质量减小,故A正确。
3.下列关于铝热剂的有关叙述中正确的是()A.氧化铝和铁的混合物是铝热剂B.利用铝热反应,常用于冶炼高熔点的金属C.铝热剂发生的铝热反应需要用镁带和氯酸钾引燃,所以铝热反应是吸热反应D.工业上常用铝热反应来大量冶炼金属铁【答案】BA选项,铝热剂应是铝和金属性比铝弱的金属氧化物形成的混合物,故A错误;B选项,利用铝热剂的反应,常用于冶炼高熔点的金属,故B正确;C选项,铝热剂发生的铝热反应需要用镁带和氯酸钾引燃,反应释放出大量的热,因此铝热反应是放热反应,故C错误;D选项,工业上不能用铝热反应来大量冶炼金属铁,因为制得金属铝会消耗大量的能源,主要用碳还原法来制铁,故D错误;综上所述,答案为B。
4.下列关于铁的叙述正确的是( )①铁能被磁铁吸引,但纯铁易被腐蚀②在人体内的血红蛋白中含有铁元素③铁位于元素周期表中第四周期第ⅧB族④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧⑤铁与强氧化剂硝酸反应的产物仅是Fe(NO3)3⑥不能通过化合反应制得FeCl2和Fe(OH)3A.①③B.②④C.②⑤D.④⑥【答案】B当铁中含有杂质时,在潮湿的空气中会发生电化学腐蚀,而纯铁的抗腐蚀能力较强;铁位于元素周期表的第Ⅷ族,而不是第ⅧB族;铁与强氧化剂反应,能被氧化为Fe3+,但若铁过量,则Fe3+被Fe还原为Fe2+,所以,Fe与HNO3反应的产物可能因铁过量而生成Fe(NO3)2;FeCl2、Fe(OH)3可分别通过化合反应Fe+2FeCl3=3FeCl2、4Fe(OH)2+O2+2H2O=4Fe(OH)3制得。
高中化学 3.1.2《碳及其化合物间的转化》导学案 鲁科版必修1

3.1.2《碳及其化合物间的转化》导学案一、自然界中碳及其化合物间的转化1.转化形式 ⎪⎪⎪⎪化石燃料燃烧—动物遗体分解—火山喷发—动植物呼吸—――→产生 大 气 的CO 2――→消耗⎪⎪⎪⎪ —光合作用—溶解 2.溶洞及钟乳石、石笋的形成 (1)溶洞形成的化学方程式为_______________________________________________。
________________________________________________________________________ (2)钟乳石、石笋形成的化学方程式为______________________________________ ________________________________________________________________________。
二、生产和生活中碳及其化合物间的转化 1.高炉炼铁(1)原料:______和__________(主要成分是______)。
(2)过程(实际起还原作用的是______)①CO 的产生 相关反应的化学方程式为:_______________________________________________ ②铁矿石被还原相关反应的化学方程式为_________________________________________________; ________________________________________________________________________; ________________________________________________________________________。
2.木炭燃烧(用化学方程式表示)①________________________________________________________________________, ②________________________________________________________________________, ③________________________________________________________________________,④________________________________________________________________________。
高中教育化学必修第一册鲁科版《3.1.2 铁及其化合物之间的转化关系》教学课件

2.部分含铁物质的分类与相应化合价关系如图所示。下列推断不合 理的是( )
答案:C
A.a可与e反应生成b B.b既可被氧化,也可被还原 C.可将e加入浓碱液中制得d的胶体 D.可存在b→c→d→e→b的循环转化关系
3.以下转化过程不可以通过化合反应一步实现的是( )
A.Fe→FeCl3 C.Fe2O3→Fe(OH)3
状元随笔 解答无机框图题的关键是依据物质的特性或反应特征确 定“突破口”,本题的突破口为:
(1)F是一种红褐色固体 (2)B 与 盐 酸 反 应 生 成 两 种 盐 且 能 相 互 转 化 —— 含 变 价 金 属 , B 为
Fe3O4
[提升] 某化学小组为验证Fe3+与Fe2+能够相互转化,进行如下实验。
(2)不同价态含铁物质之间的转化
Fe2+:_F_e+__2H_+_=_=_=F_e_2+_+_H_2_↑__________
①Fe→ FeCl3:_2_F_e+__3C_l2_=_点=_燃=_=_2F_e_C_l3__________
Fe3O4:3Fe+2O2==点=燃==Fe3O4
②Fe2O3→Fe:_F_e2_O_3+_3_C_O_=_高=_温=_=2_F_e+__3C_O_2_______。
红的现象,故D项正确。
4.为什么补铁剂与维生素C一起服用效果更好?
答案:补铁剂中铁元素的化合价是+2价,具有还原性,因维生素C的还原性比Fe2+强,因此补铁剂与维 生素C一起服用,可以防止补铁剂中的Fe2+被氧化。
5.在验证补铁口服液中是否含有Fe2+的实验中,向溶液中加入酸性 KMnO4溶液,紫红色褪色,则一定证明含有Fe2+吗?
4.A、B、C三种物质中均含有同一种元素M,它们之间有如图所示的 转化关系。A为一种金属单质,其产量直接关系国民经济命脉。反应① ②③均为化合反应,反应④为置换反应。下列有关说法不正确的是( )
《探究铁及其化合物的转化》 教学设计

《探究铁及其化合物的转化》教学设计一、教学目标1、知识与技能目标(1)学生能够掌握铁单质、亚铁离子、铁离子的性质及相互转化关系。
(2)学生能够学会运用氧化还原反应的原理分析铁及其化合物的转化。
2、过程与方法目标(1)通过实验探究,培养学生的观察能力、动手操作能力和分析解决问题的能力。
(2)通过小组讨论,培养学生的合作交流能力和思维逻辑能力。
3、情感态度与价值观目标(1)激发学生学习化学的兴趣,培养学生的创新精神和实践能力。
(2)培养学生的环保意识和节约意识,让学生认识到化学在生活中的重要性。
二、教学重难点1、教学重点(1)铁单质、亚铁离子、铁离子的性质。
(2)铁及其化合物的相互转化。
2、教学难点(1)运用氧化还原反应的原理分析铁及其化合物的转化。
(2)实验方案的设计和实验现象的分析。
三、教学方法讲授法、实验探究法、小组讨论法四、教学过程1、导入新课(1)展示生活中常见的铁制品,如铁钉、铁丝、铁锅等,提问学生这些铁制品在使用过程中会发生什么样的变化。
(2)播放一段铁生锈的视频,引导学生思考铁生锈的原因,从而引出本节课的主题——探究铁及其化合物的转化。
2、知识讲解(1)铁单质的性质①物理性质:展示铁钉,让学生观察铁的颜色、状态、导电性、导热性等物理性质。
②化学性质:通过实验演示铁与氧气、盐酸、硫酸铜溶液的反应,让学生观察实验现象,写出化学方程式,总结铁的化学性质。
(2)亚铁离子和铁离子的性质①展示氯化亚铁溶液和氯化铁溶液,让学生观察溶液的颜色。
②实验探究:向氯化亚铁溶液中滴加氯水,向氯化铁溶液中滴加铁粉,观察实验现象,写出离子方程式,总结亚铁离子和铁离子的化学性质。
(3)铁及其化合物的相互转化①利用氧化还原反应的原理,分析铁单质、亚铁离子、铁离子之间的转化关系,写出相应的化学方程式。
②通过实验验证铁及其化合物的转化,如:向氯化亚铁溶液中滴加双氧水,观察溶液颜色的变化;向氯化铁溶液中滴加氢氧化钠溶液,观察沉淀的颜色和生成过程。
鲁科版高中化学必修一 3.1.2 碳及其化合物间的转化 教学设计

第3章自然界中的元素第1节碳的多样性第2课时碳及其化合物间的转化三维目标【知识与技能】1. 知道碳和碳的氧化物的性质。
2. 知道不同的元素可以组成不同的物质,同一种元素也可以组成不同的物质。
3. 会用图表表示碳、一氧化碳、二氧化碳、碳酸钙、碳酸等物质的相互关系,并能用化学方程式准确表示各种化学变化事实。
【过程与方法】1. 通过复习碳和碳的化合物的相关知识,归纳、总结形成知识网络,提高学生记忆能力和思维能力,培养学生概括、整理知识的能力。
2. 从知识归纳整理建网,再到知识的应用的过程中,让学生领会对零散知识进行复习的有效方法——构建知识网络和对比学习的复习方法。
【情感态度与价值观】1. 明确知识之间的联系,能有意识的思考知识之间的联系并以知识网络的形式展现出来。
2. 感受生活、生产实际与化学知识密不可分,培养学生化学学习兴趣。
教学重点碳和碳的氧化物的性质,并能用化学方程式准确表示各种化学变化事实。
教学难点用图表表示碳、一氧化碳、二氧化碳、碳酸钙、碳酸等物质的相互关系。
教学方法引导—归纳,建构知识网络复习法。
教学过程(1)溶洞形成的化学方程式:CaCO3+ CO2+H2O===Ca(HCO3)2一、自然界中碳及其化合物间的转化 1. 二氧化碳的产生和消耗 2.溶洞及钟乳石、石笋的形成(1)溶洞形成的化学方程式:CaCO 3+ CO 2+H 2O===Ca(HCO 3)2(2)钟乳石、石笋形成的化学方程式:Ca(HCO 3)2=====△CaCO 3↓+H 2O+CO 2↑ 二、生产和生活中碳及其化合物之间的转化 1.高炉炼铁a .一氧化碳的生成:C + O 2=====点燃CO 2 、C + CO 2=====点燃2CO b .氧化铁被还原的化学方程式: 3CO + Fe 2O 3=====高温3CO 2 + 2Fe 2.木炭燃烧①2C +O 2=====点燃2CO ②2CO +O 2=====点燃2CO 2③C +O 2=====点燃CO 2④CO 2+C=====高温2CO 3. 碳在有机物和无机物之间的转化 4.水垢Ca(HCO 3)2=====△CaCO 3↓+ H 2O+CO 2↑ 课堂小结自然界中碳及其化合物间的转化当堂检测1. 向下列物质:①大理石;②钟乳石;③锅垢;④贝壳;⑤蛋壳。
鲁科版高中化学必修一 3.1.2 碳及其化合物间的转化 学案2

第3章自然界中的元素第1节碳的多样性第2课时碳及其化合物间的转化学习目标1. 了解碳及其化合物间的转化。
2. 了解高炉炼铁涉及的主要化学反应。
学习重点碳及其化合物间的转化。
学习难点高炉炼铁涉及的主要化学反应学习探究一、自然界中碳及其化合物间的转化1.植物通过__________吸收空气中的_________,形成________,并释放出________,________再转化为淀粉。
2.空气中的__________有很大一部分被海水吸收,溶于水中的__________逐渐转变为________。
这些________又与空气中的二氧化碳和水反应,生成________溶于水归入大海。
3.用化学方程式表示溶洞的形成过程:____________________________________、_____________________________________ 。
4.防止温室效应可采取的措施:____________________________________________________________________________。
【实验探究】设计实验探究溶洞形成的反应原理:(1)Ca(OH)2溶液中通入CO2,。
(2)向CaCO3浊液中通入足量的CO2 ,。
(3)加热Ca(HCO3)2溶液,。
二、生产和生活中碳及其化合物间的转化1.碳在无机物间的转化(1)高炉炼铁高炉炼铁的过程是将铁矿石还原成金属铁的过程,原料是____________,但实际起还原作用的主要是_________。
相关反应:①一氧化碳的生成:__________________________________。
②氧化铁的还原:化学方程式为___________________________________________________。
(2)木炭燃烧在木炭燃烧的过程中发生:碳单质、一氧化碳和二氧化碳之间的转化:①C→CO:________________________ 。
化学1 3.1.2 铁及其化合物之间的转化关系教学设计

第3章物质的性质与转化3.1.2 铁及其化合物之间的转化关系教材分析:本节课是鲁科版高一化学(必修一)第三章第一节《铁的多样性》第二课时的内容。
上节课主要是运用的氧化还原反应的理论,探究铁及其化合物的氧化性或还原性。
通过铁及其化合物相互转化的关系,让学生建构起分类观和转化观等化学基本方法。
了解铁的化合物知识在人类生活和生产中的重要作用,明确化学来源于生活并服务于生活的思想。
教学目标与核心素养:宏观辨识与微观探析:掌握选用不同的氧化剂与还原剂实现铁与铁的化合物的相互转化。
掌握检验Fe2+、Fe3+的方法。
证据推理与模型认知:通过铁及其化合物之间转化的学习,让学生建构起分类观和转化观等化学基本方法。
科学探究与创新意识:通过对铁及其化合物性质转化关系、补铁剂中铁元素价态的探究,让学生体验科学探究成功的喜悦。
科学精神与社会责任:通过对铁及其化合物性质转化关系、补铁剂中铁元素价态的探究,培养他们的探究意识和善于与他人合作的精神,体会化学知识在生活中具体应用。
教学重难点:教学重点:1. 铁及其化合物之间转化的方法。
2.掌握检验Fe2+、Fe3+的方法。
教学难点:铁及其化合物之间转化的方法。
教学过程:【引入】小明这几天全身乏力、头痛头晕、眼花耳鸣、暴躁、容易发怒、注意力很难集中。
到医院检查,医生诊断换了缺铁性贫血症。
医生给他开出了以下的药方。
药剂:硫酸亚铁片、Vc片各2片/天辅助治疗:多食用含铁丰富的食物并配合Vc服用。
请同学们思考一下为什么维生素C和补铁剂搭档效果会更好?那么今天老师就和大家来探讨一下这个问题。
【板书】三、铁及其化合物之间的转化关系1.铁及其化合物之间的转化【活动∙探究】P871 .【小组讨论】并写出相应的化学方程式。
【小结】2.说明实现铁及其化合物之间转化的思路与方法。
【小结】含有相同价态铁元素的物质之间的转化,可借助复分解反应实现;含有不同价态铁元素的物质之间的转化,可借助氧化还原反应实现。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.1.2 铁及其化合物之间的转化关系
本节教学内容是鲁教版高中化学必修第一册第三章第一节《铁的多样性》的第二课时。
该部分的教学内容涉及到铁元素的相关知识和概念,铁的各种重要化合物的相关性质和反应现象,不同铁的化合物的用途。
通过研究铁的化合物的性质和用途,可以使我们从物质类别和元素价态的视角认识物质间的转化关系,深化对物质及其变化多样性的认识。
本节安排了“铁及其化合物的“价----类”二维图”、“补铁剂中铁元素价态检验”这两部分内容。
通过学习这部分知识,学生将学习并掌握铁的氧化物及相关反应;学习并掌握铁盐和亚铁盐及相关反应;学习并掌握铁的氢氧化物及相关反应。
通过本节内容的学习,学生将感受铁元素的多种化合物的不同特性和用途。
并学习到检验溶液中三价铁原子的方法。
宏观辨识与微观探析:从宏观上学习铁的多种化合物的特点和用途,从微观上辨析不同化合物之间的区别与相似点,体会微观粒子的变化对宏观物质的性质的影响。
证据推理与模型认知:通过物质分类的基本模型,理解铁元素的氧化物、氢氧化物和各类铁盐、亚铁盐的区别,通过结合理论与实际感知化学学习的魅力,为后续的化学知识的学习奠定坚实的方法基础。
科学探究与创新意识:熟悉并掌握多种铁的化合物的概念,熟练掌握通过实验分析不同化合物的性质和用途的能力,体会化学研究过程中的科学方法。
科学精神与社会责任:通过对铁单质以及铁的化合物的规律的学习和探究,掌握更高效的学习方法,建立高效学习的科学精神。
重点:学习并掌握铁的氧化物及相关反应;学习并掌握铁盐和亚铁盐及相关反应;学习并掌握铁的氢氧化物及相关反应
多媒体、某补铁口服液、稀硫酸溶液、氢氧化钠溶液、酸性高锰酸钾溶液、氯水、硫氰化钾溶液、试管、胶头滴管
一、知识回顾
1.铁元素可以形成三种氧化物,分别是氧化亚铁(FeO)、氧化铁(Fe2O3)和四氧化三铁(Fe3O4)。
2.铁有两种氢氧化物,氢氧化铁(Fe(OH)3)和氢氧化亚铁(Fe(OH)2)它们可以分别由相对的可溶性盐与碱
溶液反应而制得。
3.在试管中加入少量的FeCl3溶液,然后滴入NaOH溶液。
观察到产生了红褐色沉淀。
4.含有Fe3+的盐溶液遇到KSCN溶液时变成红色,我们可以利用这一反应检验Fe3+的存在。
二、导语
大自然向人类提供了丰富的金属矿物资源,人类每年要提取数以亿吨计的金属,用于农业生产和其他领域,其中,提取量最大的是铁。
那么,人们是如何将铁的氧化物变成单质铁呢?
三、讲授新课
活动一:列举含铁的物质并书写其化学式:
单质:铁(Fe)
铁氧化物:氧化铁(Fe2O3)、氧化亚铁(FeO)、四氧化三铁(Fe3O4)
铁的氯化物:氯化铁(FeCl3)、氯化亚铁(FeCl3)
铁的氢氧化物:氢氧化亚铁【Fe(OH)2】、氢氧化铁【Fe(OH)3】
活动二:与同伴说一说上述含铁元素物质中铁元素化合价分别是多少?在图中适当位置标注含有铁元素物质,完成铁及其化合物的“价----类”二维图。
能否用箭头标明物质之间的转化关系并说明依据。
能否图中转化关系的化学方程式或离子方程式写下来。
教师引导并总结:
铁物质中铁元素化合价为0价;
氧化铁中铁元素化合价为+3价,氧化亚铁中铁元素化合价为+2价;
氯化铁中铁元素化合价为+3价,氯化亚铁中铁元素化合价为+2价;
氢氧化铁中铁元素化合价为+3价,氢氧化亚铁中铁元素化合价为+2价。
1.Fe+2H+=H2↑+Fe2+(氧化还原反应)
2.3Fe+2O2=Fe3O4(氧化还原反应)
3.3CO+Fe2O3=2Fe+3CO2(氧化还原反应)
4.FeO+2H+=Fe2++H2O (复分解反应)
5.Fe(OH)2+2H+=Fe2++H2O (复分解反应)
6.Fe2++2OH-=Fe(OH)2↓(复分解反应)
7.4Fe(OH)2+O2+H2O=4Fe(OH)3(氧化还原反应)
8.Fe2O3+6H+=2Fe3++3H2O (复分解反应)
9.2Fe2++Cl2=3Fe3++2Cl-(氧化还原反应)
10.2Fe3++Fe=3Fe2+(氧化还原反应)
11.Fe3++3OH-=Fe(OH)3↓(复分解反应)
12.Fe(OH)3+3H+=Fe3++3H2O (复分解反应)
活动三:铁及其化合物的转化的思路与方法是什么?铁及其化合物之间存在几种转化关系?
板书:铁及其化合物之间存在两种转化关系
1.含有相同价态铁元素的物质之间的转化,可借助复分解反应等实现;
2.含有不同价态铁元素的物质之间的转化,可借助氧化还原反应实现。
铁元素在人体中起着重要的作用。
如果人体缺铁,就会出现贫血症状。
轻度缺铁性贫血可以用饮食疗法治疗,严重缺铁时则需要服用补铁剂。
补铁口服液是常见的补铁剂,其中除了含铁化合物外,还常添加抗氧化物质(如维生素C)、甜味剂、香精等。
你能否设计实验说明补铁剂中铁元素价态。
活动四:补铁剂中铁元素价态的检验
实验目的:检验某补铁口服液中铁元素的价态
实验用品:某补铁口服液、稀硫酸溶液、氢氧化钠溶液、酸性高锰酸钾溶液、
氯水、硫氰化钾溶液、试管、胶头滴管
实验方案设计与实施
活动五:思考与交流
1.在你所设计的实验方案中,涉及哪些含铁物质之间的转化?为什么要利用这些转化?
2.可以用氢氧化钠溶液检验补铁剂中铁元素的价态吗?为什么?
3.补铁剂中含有的其他成分是否会影响实验结果的可靠性?
板书:
练习:现有下列物质:①新制氯水、②铁、③铜、④稀硫酸。
(1)将Fe2+转化为Fe3+,可选用的物质有________;相关的离子方程式:
________________________________________________________________。
(2)将Fe3+转化为Fe2+,可选用的物质有________;相关的离子方程式:
________________________________________________________________
(任写一个即可)。
(1)①2Fe2++Cl2===2Fe3++2Cl-
(2)②③2Fe3++Fe===3Fe2+(或2Fe3++Cu===2Fe2++Cu2+)(合理即可)
解析(1)将Fe2+转化为Fe3+,须加入强氧化剂,如氯水、溴水、HNO3等。
(2)将Fe3+转化为Fe2+,须加入还原剂,如铁、铜、I-、S2-等。
四、作业布置
1.铁及其化合物之间的转化关系
2.Fe3+的检验——KSCN溶液
Fe2+的检验——先加KSCN溶液再滴加新制氯水(或HNO3或H2O2)。
