分子晶体
【知识解析】分子晶体

分子晶体温故1.晶体中的粒子可以是分子、原子或离子;粒子间的相互作用可以是共价键、离子键、金属键或分子间作用力。
2.根据晶体中粒子间的相互作用及排列方式,可把晶体分为分子晶体、共价晶体、离子晶体和金属晶体。
1 分子晶体的定义只含分子的晶体,或者分子间以分子间作用力结合形成的晶体叫分子晶体。
如I2、H2O、NH3、H3PO4、萘等在固态时都是分子晶体。
名师提醒(1)定义中的“分子”指真实存在的小分子、分子的聚集体、缔合分子、大分子(高分子),因此,H2SO4、H2O2、C4H10等既是化学式也是分子式。
(2)离子化合物、金属单质、原子间相互结合形成空间网状结构(如金刚石、SiO2)的物质中没有分子,因此,Na2O2、Fe、SiO2等是化学式而不是分子式。
(3)稀有气体的分子是单原子分子,因此,由稀有气体单质形成的晶体也是分子晶体。
2 分子晶体中的粒子及粒子间的相互作用3 常见的典型分子晶体(1)所有非金属氢化物:H2O、H2S、NH3、CH4、HX(卤化氢)等。
(2)部分非金属单质:X2(卤素单质)、O2、H2、S8、N2、P4、C60、稀有气体等。
(3)部分非金属氧化物:CO2、SO2、NO2、P4O6、P4O10等。
(4)几乎所有的酸:H2SO4、HNO3、H3PO4、H2SiO3等。
(5)绝大多数有机物:苯、四氯化碳、乙醇、冰醋酸、蔗糖等。
4 分子晶体的物理性质(1)分子晶体具有较低的熔、沸点和较小的硬度。
分子晶体熔化时要破坏分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低,部分分子晶体易升华(如干冰、碘、红磷、萘等),且硬度较小。
(2)分子晶体不导电。
分子晶体在固态和熔融状态下均不存在自由移动的离子或电子,因而分子晶体在固态和熔融状态下都不能导电。
有些分子晶体的水溶液能导电,如HI、乙酸等。
(3)分子晶体的溶解性一般符合“相似相溶”规律,即极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。
分子晶体

BC
A组 Cl键键 Ⅰ.H—I键键能大于H—Cl键键 I键键能大于H Cl 能 C1键键 Ⅱ.H—I键键能小于H—C1键键 I键键能小于H C1 能 HI分子间作用力大于 分子间作用力大于HCl Ⅲ.HI分子间作用力大于HCl 分子间作用力 HI分子间作用力小于 分子间作用力小于HCl Ⅳ.HI分子间作用力小于HCl 分子间作用力
5,关于下列常见晶体说法正确的是
2 60
冰中每个水分子周围有12 12个紧邻的水分子 B.冰中每个水分子周围有12个紧邻的水分子 C.水在固态时密度一定比液态小 干冰中, 个分子周围有12的紧邻分子, 12的紧邻分子 D.干冰中,1个分子周围有12的紧邻分子, 密度比冰小. 密度比冰小.
有下列两组命题,B组中命题正确,且能用A ,B组中命题正确 6,有下列两组命题,B组中命题正确,且能用A组 命题加以正确解释的是 A. Ⅰ ① B. Ⅱ ② C. Ⅲ ③ D. Ⅳ ④
B组 ①HI比HCI稳定 HI比HCI稳定 ②HCl比HI稳定 HCl比HI稳定 ③HI沸点比HCl高 HI沸点比HCl 沸点比HCl高 ④HI沸点比HCl低 HI沸点比HCl 沸点比HCl低
�
5,典型的分子晶体
(1)所有非金属氢化物: (1)所有非金属氢化物: H2O,H2S,NH3,CH4,HX 所有非金属氢化物 (2)部分非金属单质:X (2)部分非金属单质:X2,O2,H2, S8,P4, C60,稀有气体 部分非金属单质 60, (除硼,金刚石,晶体硅) 除硼,金刚石,晶体硅) (3)部分非金属氧化物: CO2, SO2, NO2, P4O6, P4O10 (3)部分非金属氧化物: 部分非金属氧化物 (除二氧化硅) 除二氧化硅) (4)几乎所有的酸: (4)几乎所有的酸:H2SO4,HNO3,H3PO4 几乎所有的酸 (5)大多数有机物的晶体:冰醋酸, (5)大多数有机物的晶体:冰醋酸,蔗糖 大多数有机物的晶体
分子晶体_课件

典型分子晶体
典型的分子晶体有哪些 ?(1)所有_非__金___属__氢__化__物___,如H2O、NH3、CH4等 ;(2)部分__非__金__属__单___质__,如卤素、O2、S8、C60、稀有气体等 ;(3)部分_非___金__属__氧__化___物__,如CO2、SO2、P4O6、P4O10等 ;(4)几乎所有的_酸___,如HNO3、H2SO4、H3PO4等 ;(5)绝大多数__有__机__物___的晶体,如蔗糖、乙醇等 。
干冰就是CO2的晶体,外观像冰,硬度也和冰相似,而熔 点比冰低得多,易升华(想想为什么),在工业上广泛用 作制冷剂。
分子晶体的结构特征
(2)分子非密堆 积此时分子间有氢键——氢键具有方向性和饱和性,使晶体中
的空间利用率不高,留有相当大的空隙。这种晶体不具有分 子密堆积特征,如:HF、NH3、冰等。
444.6 ℃
C.熔点1400 ℃ ,可做半导体材料,难溶于水
分子晶体
练习2:下列属于分子晶体的一组物质是 B
(
)A.CaO、NO、乙醇l4、H2O2、
HeC.CO2、HNO3、NaClD.CH4、O2、Na2O
分子晶体
1、下列分子晶体,关于熔、沸点高低叙述中,正确的是(B )A.Cl2>I2 B.SiCl4>CCl4 C.NH3<PH3 D.C(CH3)4>CH3(CH2)3CH3
( A )A.CO2
B.O2
C.NH4Br
D.Ar
分子晶体
3.SiCl4的分子结构与CCl4相似,下列推测不正确的是(B )A.SiCl4晶体是分子晶体B.常温、常压下SiCl4是气体C. SiCl4的分子是由极性键形成的非极性分子D.SiCl4的熔点 高于CCl4
分子晶体
分子晶体

3、典型物质
ቤተ መጻሕፍቲ ባይዱ
(1)碘晶体
长方体
每个晶胞中有 4 个碘分子
什么体? 几个分子?
3、典型物质
(2)干冰 面心立方 每个晶胞中有 4 个二氧化碳分子
什么体? 几个分子?
3、典型物质
(3)冰 氢键具有方向 性
冰中1个水分子周围有4个水分子
冰的结构
4、物理性质 (1)分子晶体有低熔点(破坏的是分子间作用力) (2)不导电(三态下均不存在带电荷的离子,共价 键没有被破坏)(水溶液 中有些导电有些不导电) (3)相似相溶 (4)易挥发、硬度小(分子间作用力弱)
3.下列化学式既能表示物质的组成,又能表示物质 分子式的是 ( C )。 A.NH4NO3 B.SiO2 C.C2H5OH D.Fe 4.氮化铝(AlN)常做砂轮及高温炉衬材料,熔化状态 下不导电,可知它属于 ( C )。 A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
1 .当下列物质以晶体形式存在时,其所属晶体类 型和所含化学键类型分别相同的是 ( C )。 A.氯化钠和氯化氢 B.二氧化碳和二氧化硅 C.四氯化碳和四氯化硅 D.单质铁和单质碘 2.下列有关物质的熔点高低顺序不正确的是( C ) A.HF>HCl,HCl<HBr B.CF4<CCl4<CBr4 C.I2>SiO2 D.H2O>H2S,SO2<SeO2
1、定义:分子间通过分子间作用力构成的晶体称 为分子晶体。
注意点: I 构成分子晶体的粒子是分子。 II 在分子晶体中,分子内的原子间以共价键结合, 而相邻分子靠分子间作用力相互吸引。
例 CO2 H2O 存在分子
2、结构特点:由于分子间作用力不具有 方向性 ,所以分子晶体在堆积排列时尽可能的 ________ 利用空间采取紧密堆积的方式。
常见分子晶体

常见分子晶体分子晶体是由大量的有机分子(或者有机分子和无机分子的混合)组成的三维晶体。
它们是化学物质的纯净结晶形态,具有高度定向的分子团簇结构,因此具有各种独特的化学和物理特性。
常见的分子晶体有芳烃晶体、烷烃晶体、烯烃晶体、萘烷晶体和苯烷晶体等。
芳烃晶体是指碳原子四面有同种或不同种芳基的晶体结构。
芳烃的晶体常由四面环结构所组成,这些环可以是环状的(例如苯和芘),也可以是网状的(例如吡啶)。
芳烃晶体的晶体结构的分子间的互相接触是由共价键形成的,因此它们具有非常高的熔点,比其它晶体都要高。
烷烃晶体是指由碳原子四面均附有烷基(由一个羟基和一个不饱和羟基连接而成)的晶体结构。
它们具有非常高的熔点,晶体结构的分子间由共价键构成的范式,如甲烷的「空气状(cellular)」晶体结构。
烯烃晶体也是四面均有烷基附有的晶体,但是具有一个不饱和三环(即烯烃),而不是共价键构成的范式。
烯烃晶体有大量的晶体结构类型,其中包括有萘烷(naphthalene)、芘(phenanthrene)和芪(acenaphthene)等。
萘烷晶体是指一种晶体结构,由两个连在一起的萘环(含有八个碳原子)所组成。
由于其具有古老的烯烃结构,萘烷晶体通常具有较高的熔点和灭火点,而且还具有很强的光学特性,如上转换性、荧光光谱和悬浮特性等。
苯烷晶体是指碳原子四面都附有苯基的晶体结构。
它们的分子间的相互作用是由共价键构成的,而不是烯烃晶体的烯环,因此它们的晶体结构就像甲烷一样,并且具有较高的熔点。
苯烷晶体有一种变体,称为叶绿素晶体,它由二环芳烃和两个饱和羟基所组成,具有丰富的荧光特性和传输性。
总之,常见的分子晶体有芳烃晶体、烷烃晶体、烯烃晶体、萘烷晶体和苯烷晶体等,它们均具有高度定向的分子团簇结构,因此具有各种独特的化学和物理特性。
其中,芳烃晶体是由碳原子四面有同种或不同种芳基的晶体结构组成,而烷烃晶体和烯烃晶体则是由碳原子四面均附有烷基的晶体结构,萘烷晶体是由两个连在一起的萘环构成,而苯烷晶体则是由碳原子四面都附有苯基的晶体结构。
分子晶体

分子晶体分子晶体,指分子间以范德华力相互结合形成的晶体。
大多数非金属单质及其形成的化合物如干冰(CO2)、I2、大多数有机物,其固态均为分子晶体。
分子晶体是由分子组成,可以是极性分子,也可以是非极性分子。
分子间的作用力很弱,分子晶体具有较低的熔、沸点,硬度小、易挥发,许多物质在常温下呈气态或液态,例如O2、CO2是气体,乙醇、冰醋酸是液体。
同类型分子的晶体,其熔、沸点随分子量的增加而升高,例如卤素单质的熔、沸点按F2、Cl2、Br2、I2顺序递增;非金属元素的氢化物,按周期系同主族由上而下熔沸点升高;有机物的同系物随碳原子数的增加,熔沸点升高。
但HF、H2O、NH3、CH3CH2OH等分子间,除存在范德华力外,还有氢键的作用力,它们的熔沸点较高。
分子组成的物质,其溶解性遵守“相似相溶”原理,极性分子易溶于极性溶剂,非极性分子易溶于非极性的有机溶剂,例如NH3、HCl极易溶于水,难溶于CCl4和苯;而Br2、I2难溶于水,易溶于CCl4、苯等有机溶剂。
根据此性质,可用CCl4、苯等溶剂将Br2和I2从它们的水溶液中萃取、分离出来。
物质类别及举例所有非金属氢化物:如水、硫化氢部分非金属单质:如卤素单质部分非金属氧化物:如CO2、SO2绝大多数有机物(有机盐除外)几乎所有的酸(除外:一水合高氯酸的是离子晶体)离子晶体物理学概念,指离子间通过离子键结合形成的晶体。
离子间通过离子键结合形成的晶体。
在离子晶体中,阴、阳离子按照一定的格式交替排列,具有一定的几何外形,例如NaCl是正立方体晶体,Na+离子与Cl-离子相间排列,每个Na+离子同时吸引6个Cl离子,每个Cl-离子同时吸引6个Na+。
不同的离子晶体,离子的排列方式可能不同,形成的晶体类型也不一定相同。
离子晶体中不存在分子,通常根据阴、阳离子的数目比,用化学式表示该物质的组成,如NaCl表示氯化钠晶体中Na+离子与Cl-离子个数比为1∶1,CaCl2表示氯化钙晶体中Ca2+离子与Cl-离子个数比为1∶2。
10-典型晶体简介(分子晶体)
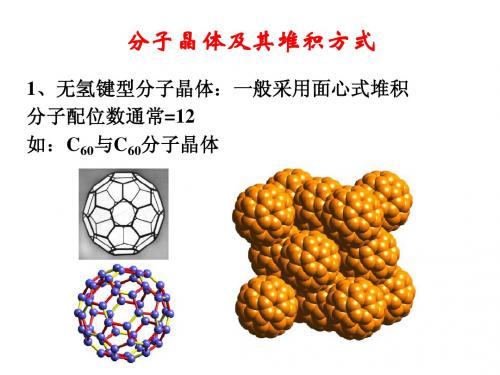
1、无氢键型分子晶体:一般采用面心式堆积 、无氢键型分子晶体: 分子配位数通常=12 分子配位数通常 如:C60与C60分子晶体
分子晶体及其堆积方式
1、无氢键型分子晶体:一般采用面心式堆积 、无氢键型分子晶体: 分子配位数通常=12 分子配位数通常 分子晶体(干冰) 如:CO2与CO2分子晶体(干冰)
分子晶体熔点的相对高低规律之四
讨论: 讨论: 实验测得气态氯化铝的相对分子质量等于267,则其分 实验测得气态氯化铝的相对分子质量等于 , 子式为 ,其结构式可能为 。
分子晶体小结
• 分子晶体的一般情况: 分子晶体的一般情况:
所有非金属氢化物、部分共价化合物 所有非金属氢化物、部分共价化合物 非金属氢化物 物质种类 少数盐类 盐类, 少数盐类,如AlCl3 单核或多核的) 晶体中的微粒 (单核或多核的)分子 微粒间的作用力 范德华力或氢键 微粒内部的 微粒内部的 无化学键 有非极性共价键或 作用力 或有非极性共价键或有极性共价键 干冰、 典型代表 氦、氢、干冰、冰 He 、 H2 、 CO2 、 H2O 化学式 较软易碎、部分可溶于水、 较软易碎、部分可溶于水、 物理共性 熔点沸点较低、晶体导电导热性差 熔点沸点较低、晶体导电导热性差
分子晶体熔点的相对高低规律之四
升华问题: 升华问题: 某些分子晶体受热时 不经过熔化直接变成气态 这种现象叫升华 这种现象叫升华 升华的条件 条件是 升华的条件是: 在一定的压强条件下物质的熔点 熔点>沸点 在一定的压强条件下物质的熔点 沸点 能升华的常见物质有: 能升华的常见物质有: 干冰、 苯甲酸、 干冰、碘、萘、苯甲酸、氯化铝等
分子晶体熔点的相对高低规律之一
参考f=k·m1·m2/r2 (1)组成与结构相似时:—二
分子晶体

�
注意: 注意:分子晶体熔化不破坏共价键
分子晶体的性质
(2)分子晶体在固态和液态都不导电 分子晶体在固态和 分子晶体在固态 (3)分子晶体容易溶解在与组成它的 分子晶体容易溶解在与组成它的 分子晶体容易溶解 分子极性相似 溶剂中(相似相溶 极性相似的 相似相溶) 分子极性相似的溶剂中 相似相溶 (4)构成分子晶体的微粒是分子,因 构成分子晶体的微粒是分子, 构成分子晶体的微粒是分子 此分子晶体的化学式也是分子式 此分子晶体的化学式也是分子式 化学式也是
分子晶体
自然界中的分子晶体
雪花
硫磺
ห้องสมุดไป่ตู้干冰
分子晶体是分子间以分子间作用力[包括 分子晶体是分子间以分子间作用力 包括 ( )或( )]相互作用而形成的晶体 或 相互作用而形成的晶体
定义: 分子晶体是分子间以分子间 定义 : 分子晶体 是分子间以分子间 作用力(包括范德华力或氢键)相互作 包括范德华力 作用力 包括范德华力或氢键 相互作 用而形成的晶体 说明:分子晶体的构成微粒是(分子 , 说明:分子晶体的构成微粒是 分子), 分子 分之间以(分之间作用力 分之间作用力)相互作用而 分之间以 分之间作用力 相互作用而 结合,而分子内部则是以(共价键 共价键)相 结合,而分子内部则是以 共价键 相 互作用而结合,但是(稀有气体 稀有气体)晶体 互作用而结合,但是 稀有气体 晶体 除外,它们是(单原子 单原子)分子 除外,它们是 单原子 分子
哪些晶体属于分子晶体呢? 哪些晶体属于分子晶体呢?
(1)所有非金属氢化物 , 如水 , 硫化氢 , 氨 , 卤化 所有非金属氢化物 如水,硫化氢, 所有 非金属氢化物, 氢,甲烷等 (2)部分 非金属单质 , 如卤素 2), 氧气 2), 硫 部分非金属单质 部分 非金属单质, 如卤素(X , 氧气(O , (S8),氮 (N2),白磷 4),碳 60(C60),稀有气体等 , ,白磷(P , , (单晶硅,金刚石,石墨,单晶硼不是 单晶硅, 单晶硅 金刚石,石墨,单晶硼不是) (3)部分 非金属氧化物 , 如 CO2 , P4O6 , P4O10 , 部分非金属氧化物 部分 非金属氧化物, SO2等(二氧化硅,氧化硼不是 二氧化硅, 不是) 二氧化硅 氧化硼不是 (4)几乎所有的酸,如硫酸,硝酸,磷酸等 几乎所有的酸 几乎所有的酸,如硫酸,硝酸, (5)绝大多数有机物晶体 , 如乙醇 , 醋酸 , 蔗糖等 绝大多数有机物晶体 绝大多数 有机物晶体,如乙醇,醋酸, (有机盐类不是:如乙酸钠等) 有机盐类不是: 乙酸钠等 有机盐类不是
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、定义:只含分子 的晶体称为分子晶体。
2、构成微粒: 分子
Байду номын сангаас
分子晶体
3、晶体中的作用力
分子内: 共价键 分子间: 分子间作用力(范德
华力、氢键)
4、分子晶体物理性质的共 性:
熔点低、易升华、硬度小
导电性: 通常,晶体本 身不导电,熔融状态也不
决定分子晶体 的熔、沸点
能导电,但某些分子晶体 的水溶液能导电。
3.同分异构体之间,一般支链越多,熔沸点越低;
4.根据物质在相同条件下的状态判定。
S>L>g
活学活用
下列物质,按沸点降低顺序排列的一组是
A.HF、HCl、HBr、HI C.H2O、H2S、H2Se、H2Te
B.F2、Cl2、Br2、I2
√D.CI4、CBr4、CCl4、CF4
解析 A、C中HF和H2O分子间含有氢键,沸点反常; 对结构相似的物质,B中沸点随相对分子质量的增加而增大;
北国风光,千里冰封,万里雪飘 -----毛泽东 已是悬崖百丈冰,犹有花枝俏-----毛泽东 夜阑卧听风吹雨,铁马冰河入梦来-----陆游 间关莺语花底滑,幽咽泉流冰下难-----白居易 冰泉冷涩弦凝绝,凝绝不通声暂歇-----白居易
第二节 分子晶体与原子晶体
(第一课时)
“三块冰”的奥秘 ——认识分子晶体
分子晶体结构特征
(1)有分子间氢键—分子非密堆积 氢键具有方向性和饱和性,使晶体中的空间利率不
高,留有相当大的空隙。 如:HF 、NH3、冰(每个水 分子周围只有4个紧邻的水分子)。 (2)只有范德华力,无分子间氢键-分子密堆积 分子密堆积-- 每个分子周围有12个紧邻的分子。 如:C60、干冰 、O2 (3)分子晶体中存在单个分子,化学式就是分子式
活学活用
1.下列各组物质各自形成晶体,均属于分子晶体的
化合物是
A.NH3、H2、C10H8 C.SO2、SiO2、P2O5
B√.PCl3、CO2、H2SO4
l4、Na2S、H2O2
分子晶体熔沸点高低判定
1.组成和结构相似的分子晶体,一般相对分子质量 越大,熔沸点越高;
2.组成和结构不相似的分子晶体,分子极性越大, 熔沸点越高;
1、定义:只含分子 的晶体称为分子晶体。
2、构成微粒: 分子
分子晶体
3、晶体中的作用力 分子内: 共价键
4、分子晶体物理性质的共 性:
分子间: 分子间作用力(范德 华力、氢键)
熔点低、易升华、硬度小
决定分子晶体 的熔、沸点
壹
H2SO4 (s) 溶于水或熔融时分别破坏什么作用? H2SO4 (s) 溶于水或熔融时导电情况如何?
第三块“冰”—“可燃冰”
石油级别的宝藏
天然气水合物晶体,又称可燃冰,属于分子晶 体。理想的甲烷水合物的化学式为8CH4 ·46H2O。
可燃冰资源储量丰富,其广泛分布于全球大洋海域,甲 烷含量是天然气资源量的60倍,估算其资源量相当于全球已 探明传统化石燃料碳总量的两倍。
气体分子
水分子
天然气分子藏在水分子笼内
H2SO4 HNO3 H3PO4
子
(3)部分非金属单质: X2
晶
O2 H2 S8 P4 C60
体
(例外:金刚石、晶体硅、
晶体硼、石墨等)
壹
常温下为气态或液态的物质, 晶体一般是分子晶体
(4)部分非金属氧化物: CO2 SO2 NO2 P4O6
例外:二氧化硅等
(5)绝大多数有机物: 乙醇 冰醋酸 蔗 糖
D中沸点依次降低。
第一块“冰”—由水构成的“冰”
1、冰晶体中,每个水分子周围 有几个紧邻的分子?他们是什么样 的空间关系?为什么会这样排列?
2、为何冰的密度小于水的密度?为何水在 4℃以下,热缩冷胀,在4℃以上热胀冷缩?
分子的非密堆积 氢键具有方向性
氢键具有饱和性
冰的结构
冰中1个水分子周围有4个水分子
有氢键的分子晶体具有更为特殊的物理性质 。
随堂练习 1、下列物质属于分子晶体的化合物是(C )
A、石英 B、硫磺 C、干冰 D、食盐 2、(多选)干冰气化时,下列所述内容发生变化的是 A、分子内共价键 B、分子间作用力 BC
C、分子间距离 D、分子间的氢键
3、下列分子晶体:①HCl ②HBr ③HI ④CO ⑤N2 ⑥ H2熔沸点由高到低的顺序是 ( C )
为何冰的密度小于水的密度?为何水在4℃以下,热缩 冷胀,在4℃以上热胀冷缩?
第二块“冰”—“干冰”
分子的密堆积
范德华力 共价键
(8×1/8 + 6 ×1/2 )=4
1、一个晶胞中含有 4 个CO2分子 2、每个CO2分子周围最近且等距离的CO2有12个
分子的密堆积
O2的晶体结构
C60的晶胞
(与每个分子距离最近的相同分子共有12个 )
③已知氢键也有方向性,试分析为什么冬季河 水总是从水面上开始结冰?
由于氢键的方向性,使冰晶体中每个水分子与四面体顶点的 4个分子相互吸引,形成空隙较大的网状体,密度比水小,所以
A.①②③④⑤⑥
B.③②①⑤④⑥
C.③②①④⑤⑥
D.⑥⑤④③②①
4.如图为甲烷晶体的晶胞,根据图形回答:
(1)每个晶胞中有____4____个甲烷分子。
(2)此晶体在常温、常压下不能存在的原因是: 甲烷晶体为分子晶体,甲烷分子间靠
分子间作用力结合,故而分子晶体熔、沸 点在常压下很低,且甲烷的相对分子质量 很小,分子间作用力很小,故在常温、常 压下甲烷以气体形式存在而不能形成晶体!
水分子笼是多种多样的
课堂 小结
概念
只含分子的晶体称为分子晶体。
分子 分子内的原子之间 共价键
晶体
中作
结构 用力 分子之间
只有范德华力 分子密堆积 如干冰 、 C60、I2、O2等
含有氢键
分子非密堆积
如:冰、 HF 、NH3等
由于分子间作用力较弱,分子晶体具有低熔
性质 点、升华 ,以及硬度小等物理特性,部分含
作业
如果你是分子晶体,请你 为自己设计一张名片。
水分子间存在着氢键的作用,使水分子彼 此结合而成(H2O)n。在冰中每个水分子被4 个水分子包围形成变形的正四面体,通过“氢 键”相互连接成庞大的分子晶体,其结构如图: 试分析:
①1mol 冰中有 2 mol氢键?
②H2O的熔高沸点比H2S高还氢是键低?为什么?
议一议: 以下晶体中哪些属于分子晶体?
NH3、 H2SO4、 C60、 Cl2、 C(金刚石)、 SO2、 SiO2、 乙醇、 冰醋酸
判断标准----只含分子
以上属于分子晶体的物质属于哪些类别?
(1)所有非金属氢化
物:H2O H2S NH3
常
CH4 HX
见
(2) 几 乎 所 有 的 酸 : 的
分
目
标 1.熟知分子晶体的概念、结构特点
定
及常见的分子晶体。 2.能够从范德华力、氢键的特征,
位 分析理解分子晶体的物理特性。
思考:常规加热冰、碘会有什么现象?
融化
升华
共性:熔、沸点低
思考:常规加热冰、碘会有什么现象?
融化
升华
共性: 熔、沸点低
构成微粒:分子
构成微粒间作用:分子间作用力(范德华 力、氢键)
