实验八GUS组织化学定位
最新GUS组织化学染色

GUS组织化学染色1. 实验原理适宜的反应条件下,β-葡聚糖苷酶(GUS)可将X-Gluc水解成蓝色物质,因此具有GUS活性的部位或位点呈现蓝色或蓝色斑点,可用肉眼或显微镜观察到。
2.实验材料1)转基因烟草叶片或试管苗2)非转基因烟草的叶片或试管苗(阴性对照)3.药品试剂1) X-Gluc,用N-N-二甲基酰胺配成20mM的贮存液,分装成每管100µL,保存于-20℃。
2) 底物溶液(染色液):3) 1mM X-Gluc加入100mM磷酸钠缓冲液(pH=7.0),缓冲液中含10mM ED TA-Na2,1-5mM K3[Fe(CN)6](铁氰化钾),1-5mM K4[Fe(CN)6](亚铁氰化钾),0.001%(V/V)Triton X-1004.实验器材小药瓶,培养皿,培养箱(37℃),微量移液器5.实验步骤1) 将准备好的叶片放入小药瓶,加入染色液浸没试材,封好盖子;2) 37℃培养箱中温育1小时至过夜;3) 将浸染过的试材转入70%或95%乙醇中脱色2-3次(除去叶绿素),至阴性对照材料呈白色为止。
6.结果叶片上GUS活性的部位或位点呈现蓝色或蓝色斑点。
先用DMSO溶解X-GLUC 好像是100mg/2ml PBF 94ML+X-GLUC 0.1ML+TRIT ION X-100 2ML +FE2+ 2ML+ FE3+ 2ML/plsc/labs/sherrierlab/Methods_pdf/microscopy/Protocol%2 0for%20Fluorescent%20GUS%20Staining%20of%20Root%20Nodules.pdf /stockingerlab/Protocols/GUS-HistochemicalS taining.pdf/langdalelab/protocols/misc/Dex_induc_GUS_stain.p dfGus staining1. Excise root and leaf segments, wash with 100mM potassium phosphate buffer (pH7.0) for 3 times.2. Immerse in the Gus substrate solution, 37C, dark, 12-24h3. Rinse in phosphate buffer4. Fix for 4h or longer5. Rinse in the same buffer6. Observe as whole specimens or as sections.1M potassium phosphate buffer (pH7.0)K2HPO4: 34.8g --->200mlKH2PO4: 27.2g---->200ml184.5ml K2HPO4+115.5ml KH2PO4----> 300ml 1M potassium phosphate b uffer(pH7.0)Gus substrate solutionVolume(500ml)Final concentrationPotassium ferricyanide82mg0.5mMPotassium ferrocyanide105.6mg0.5mMPotassium phosphate buffer (pH7.0, 1M)50ml100mMStore at -20C. Add 1mM x-gulc (MW521.8~~0.5mg/ml) freshly when use. Fix solution2.5% glutaraldehyde200mM sodium cacodylate, pH7.2共培养后愈伤的瞬时表达、抗性愈伤的鉴定以及转基因植株的鉴定用GUS组织化学法测定.将待测定的材料,如愈伤或叶片,浸入适量X-Gluc溶液,于37 ℃保温过夜后,在体视显微镜下观察,拍照记录.若将加有X-Gluc溶液的材料抽真空,染色效果将更好.如材料存在色素干扰问题,染色后用酒精脱色,使色素的颜色褪掉而使染成的蓝色保存.X-Gluc染色液:(20*)0.2mol/L Na3PO4缓冲液(62mL0.2mol/L Na2HPO4;38mL0.2 mol/L NaH2PO4),pH7.0;0.1 mol/L K3[Fe(CN)6];0.1 mol/L K4[Fe(CN)6].3H2O;1.0 mol/L Na2EPTA;0.1% X-Gluc.1000mlx-gluc 1000mg (20ml dmso)Na2HPO4: 620*0.2*M=0.620*0.2*358(12H2O)=44NaH2PO4: 380*0.2*M=0.358*0.2*156(2H2O)=11K3[Fe(CN)6:1000*0.01*M=329.26*0.01=3.3K4[Fe(CN)6]:1000*0.01*M=422.39(3H2O)*0.01=4.2Triton 1MLNa2EPTA:1000*0.1*M=372.24(2H2O)=371. 取5 mg X-Gluc (5-bromo-4-chloro-3-indolyl glucuronide)溶於100 l DMSO於中.2. 加入10 ml reaction buffer (10 mM Na2EDTA, 100 mM NaH2PO4·H2O, 0.1% Triton, 0.5 mM potassium ferricyanide, 0.5 mM potassium ferrocyanide, pH7.0).3. 混合均匀后分装於eppendorf tube中,保存於-20℃冰箱内.100ml x-gluc染液配制x-gluc 50mg加入溶入1ml dmso1ml triton 100Na2EDTA (20mM) 10mM 5ml ; K3Fe(CN)6 (0.1M) 5mM 0.5mlK4Fe(CN)6 (0.1M) 5mM 0.5ml ; Na2HPO4 (0.2M) 100mM 3.1mlNaH2PO4 (0.2M) 100mM 1.9mlX-Gluc 0.1% 10ul Western实验步骤Western,也称Western blot、Western blotting、Western印迹,是用抗体检测蛋白的重要方法之一。
实验八、转基因生物的GUS检测

精选ppt课件
2
原理
•
适宜的反应条件下,β- 葡萄糖苷酸酶
(GUS)可将X-Gluc水解成蓝色物质,因
此具有GUS活性的部位或位点呈现蓝色或
蓝色斑点,可用肉眼或显微镜观察到。
精选ppt课件
3
相关知识链接——标记基因
•
标记基因是帮助对转基因生物体进行
筛选和鉴定的一类外源基因,包括选择标
记基因和报告基因。
Na2HPO4 1.79g/100ml共同溶解; Na2EDTA (10mM, 372mg),Triton-100(0.1%,100μl), K3 [Fe(CN) 6] (铁氰化钾)(0.5mM,16.5mg)K4 [Fe(CN) 6] (亚铁氰化钾)(0.5mM,21.1mg) • 染色液:50μl X-Gluc母液+450μl基液
敏度高而且重现性好,表达产物能进行定量测定。 • (4) 细胞内其它的基因产物不会干扰报告基因产物的
检测。
精选ppt课件
6
常见的报告基因:
• 在植物基因工程研究领域,已使用的报告基因有 以下几种:
常用的报告基因包括β—葡萄糖苷酸酶报告基因
(gus), 胭脂碱合成酶基因(nos)、章鱼碱合成酶基 因(ocs)、新霉素磷酸转移酶(NPTll)、氯霉素乙酰 转移酶基因(cat)、β-半乳糖苷酶(β-gal,βgalactosidase)、萤光素酶(luc,luciferase)、和 绿色荧光蛋白基因(gfp,green fluorescence
精选ppt课件
8
gus基因简介
• gus基因是目前常用的一种报告基因,是β-D- 葡 萄糖苷酸酶(gus)基因,其表达产物β-葡萄糖苷酸酶
(GUS)能催化裂解一系列的β-葡萄糖苷酸 ,它可以 将5-溴-4-氯-3-吲哚-β-葡萄糖苷酸酯(X-Gluc) 分解为蓝色的物质,也可以将4-甲基-伞形花酮-β-D葡萄糖苷酯(4-MUG)分解为蓝色物质。 其检测方法简 单、快速、灵敏、稳定,且背景活性低。
GUS组织化学染色方法

GUS基因组织化学染色
将共培养后的材料从培养基中取出,用蒸馏水洗去残留菌体,切至0.2cm大小,放入离心管中,加入Buffer A至没过愈伤组织,置于37℃环境中,侵泡1 h。
用移液枪将Buffer A 吸出,加入Buffer B至没过愈伤组织,置于37℃黑暗环境中染色,至材料出现蓝色。
若叶绿素影响观察,可用75%乙醇漂洗材料,做脱色处理。
最后用蒸馏水将材料洗净,观察统计染色数。
Buffer A成分如下:
0.2 M NaPO4 buffer (PH 7.0)25 ml
蒸馏水23.75 ml
0.1 M K3[Fe(CN)6] 0.25 ml
0.5 M Na2EDTA 1 ml
Total 50 ml
其中0.2 M NaPO4 buffer(PH 7.0)溶液由0.2 M Na2HPO4和0.2 M NaH2PO4配制而成。
每100ml的0.2 M NaPO4 buffer(PH 7.0)溶液由62 ml 0.2 M Na2HPO4和38 ml 0.2 M NaH2PO4混合而成。
Buffer A置于4℃保存。
Buffer B由Buffer A和X-gluc 1:1混合配制而成。
Buffer B置于-20℃,避光保存。
gus染色原理

gus染色原理Gus染色原理及应用引言:Gus染色原理是一种常用的实验方法,主要用于检测和定位β-葡萄糖苷酶的活性。
本文将介绍Gus染色原理的基本概念、实验步骤以及其在生物学研究中的应用。
一、Gus染色原理的基本概念Gus染色原理,即β-葡萄糖苷酶染色原理,是通过Gus染色剂对β-葡萄糖苷酶进行染色,从而观察其活性和分布情况。
Gus染色剂是一种人工合成的染料,它能与β-葡萄糖苷酶发生化学反应,形成蓝色沉淀物。
这种染色剂在染色过程中是无色的,但在与酶反应后会产生明显的颜色变化。
二、Gus染色的实验步骤1. 制备Gus染色剂:将Gus染色剂溶解于适当的缓冲液中,制备成一定浓度的染色溶液。
2. 取样:选择待检测的生物组织或细胞,进行取样。
3. 固定:将取样的生物组织或细胞进行固定处理,以保持其形态结构的完整性。
4. 染色:将固定的生物组织或细胞浸泡于Gus染色溶液中,进行染色反应。
5. 观察:观察染色结果,通过显微镜对染色的生物组织或细胞进行观察和记录。
三、Gus染色在生物学研究中的应用1. 植物生物学研究:Gus染色可以用于检测植物中β-葡萄糖苷酶的活性和分布情况,帮助研究植物生长和发育过程中的基因调控机制。
2. 动物生物学研究:Gus染色可用于检测动物组织和细胞中β-葡萄糖苷酶的表达情况,有助于研究动物发育、疾病发生和治疗等方面的问题。
3. 微生物学研究:Gus染色可以用于检测细菌和真菌中β-葡萄糖苷酶的活性和分布情况,对于研究微生物代谢途径和菌种鉴定等具有重要意义。
4. 分子生物学研究:Gus染色可以与基因表达报告载体结合,用于检测基因的活性和表达水平,为分子生物学研究提供了一个简便、直观的方法。
结论:Gus染色原理是一种常用的实验方法,通过对β-葡萄糖苷酶的染色反应,可以检测和定位其活性和分布情况。
该方法在植物学、动物学、微生物学和分子生物学等领域具有广泛的应用。
通过对Gus染色原理的了解和掌握,我们可以更好地开展生物学研究,揭示生物体内重要酶的功能和调控机制,为相关领域的研究提供有力的支持。
gus染色原理

gus染色原理Gus染色原理。
Gus染色是一种常用的生物学实验技术,主要用于检测β-葡萄糖苷酶(β-glucuronidase)的活性。
β-葡萄糖苷酶是一种水解酶,能够水解含有葡萄糖醛酸的底物。
在实验中,通过对含有β-葡萄糖苷酶的细胞或组织进行Gus染色,可以直观地观察到β-葡萄糖苷酶的活性分布情况,从而对生物学研究提供重要的信息。
Gus染色的原理主要包括底物、酶作用和染色三个步骤。
首先是选择合适的底物,通常使用5-溴-4-氯-3-吲哚基葡萄糖苷(X-Gluc)作为底物,它在β-葡萄糖苷酶的作用下会产生可染色的产物。
其次是酶作用,β-葡萄糖苷酶在底物的作用下水解产生的产物,这些产物会与染色剂发生化学反应,形成蓝色的沉淀物。
最后是染色,将样品浸泡在染色液中,待染色完成后观察样品的染色情况。
Gus染色的实验步骤相对简单,但在实验过程中仍需注意一些关键的技术细节。
首先是对样品的处理,样品的预处理对实验结果有着重要的影响。
其次是对底物和染色剂的选择,合适的底物和染色剂可以提高实验的准确性和可靠性。
最后是对实验条件的控制,包括温度、时间、pH值等因素的控制都会对实验结果产生影响。
Gus染色技术在生物学研究中有着广泛的应用,特别是在植物和微生物领域。
通过对植物组织进行Gus染色,可以观察到β-葡萄糖苷酶在不同组织和不同发育阶段的表达情况,从而研究植物的生长发育过程。
在微生物研究中,Gus染色也常用于检测转基因微生物中外源基因的表达情况,为基因功能研究提供重要的数据支持。
总的来说,Gus染色是一种简单而有效的生物学实验技术,通过对β-葡萄糖苷酶活性的检测,为生物学研究提供了重要的手段。
在实际应用中,我们需要充分理解其原理和操作技巧,才能更好地利用这一技术进行科学研究。
希望本文对Gus染色的原理有所帮助,谢谢阅读!。
实验七、GUS组织化学定位

报告基因GUS的表达的检测
➢ 材料:拟南芥AK12-pro ➢ 试剂:
GUS工作液:在450mlddH2O中加入82mg铁氰化钾,105.6mg亚 铁氰化钾,50ml 1mol/L磷酸钾缓冲液(pH7.0),加水至500ml, 4℃储存备用。1mol/LGUS染色液:用DMSO溶解100mg X-Gluc, 再加入GUS工作液,定容至100ml,分装成小管,置于-20℃储存备 用。
蓝白斑筛选的原理( α-互补)
蓝白斑筛选的原理( α-互补)
现在使用的许多载体都带有β-半乳糖苷酶基因(lacZ)的调控序列 和前146个氨基酸的编码信息。在这个编码区中插入了一个多克隆位点( MCS),它并不破坏读框;宿主细胞编码β-半乳糖苷酶C端部分序列。 这样,宿主和质粒编码的片段虽都没有酶( β-半乳糖苷酶)活性,但它 们同时存在时,可形成具有酶学活性的蛋白质。这种现象称为α-互补。
• 37度培养12-14h,会长出如上图所示的单 菌落(乳白色、浑圆、饱满、菌落高度明 显突出培养基表面)。
• 培养时间过长,比如超过16小时,在这些 单菌落周围会出现一小密集的像针尖一样 大小的菌落,称为卫星菌落。这说明,培 养的时间太长了。
卫星菌落
• 有些载体带有β-内酰胺酶的基因,表达出β-内酰胺酶,它 可以破坏氨卞青霉素。当细菌培养时间过长,β-内酰胺酶 积累过多,就会使周围的氨卞青霉素失效,导致不含质粒 的空菌落大量生长,这就是卫星菌落。
➢ 由于绝大多数植物没有检测到葡萄糖苷酸酶的背 景活性,因此这个基因被广泛应用于基因调控的 研究中(作为报告基因)。根据gus基因检测所用 的底物不同,可以选择三种检测方法:组织化学 法、分光光度法和荧光法(灵感度为分光光度检 测法最高),其中最为常用的是组织化学法。
GUS活性的组织化学检测

GUS染色液的配制GUS染色液的配制主要参照Jefferson(1987)的方法。
(1)配制50mmol/L磷酸钠缓冲液(pH7.0):A液:称取NaH2PO4.2H2O 3.12g 溶于无菌蒸馏水,定容至100ml。
B液:称取Na2HPO4.12H2O 7.7g 溶于溶于无菌蒸馏水,定容至100ml。
取39ml A液与61ml B液混合。
(2)配制X-Gluc(5-bromo-4chloro-3indolylglucuronide)母液:称5mg X-Gluc,溶于1mlDMF(二甲基甲酰胺)。
(3)染色液配制:磷酸钠缓冲液50 mmol/L(pH7.0),0.1%TritonX-100, 亚铁氰化钾5mmol/L,高铁氰化钾5mmol/L,X-Gluc 0.5mg/ml。
GUS活性的组织化学检测GUS活性的组织化学检测主要参照Jefferson(1987)的方法。
(1)愈伤组织瞬间表达及稳定转化的GUS检测愈伤组织瞬间表达的GUS检测:用带有重组质粒pOsMT2bL-GUS和35S-GUS的农杆菌EHA105感染水稻愈伤,共培养3d后,从每皿中各取10颗愈伤,用蒸馏水清洗除去愈伤表面附着的农杆菌。
滤纸吸干水分。
同时用未作任何处理的愈伤作阴性对照,将这些愈伤分别浸没在染色液中,37℃保温3-20h。
肉眼或显微镜下观察,愈伤上的蓝色小点即为GUS表达位点。
愈伤组织稳定转化的GUS检测:取经两轮抗性筛选后pOsMT2bL-GUS和35S-GUS转基因抗性愈伤,同时用未作任何处理的愈伤作阴性对照,将这些愈伤分别浸没在染色液中,37℃保温3-20h。
肉眼或显微镜下观察,愈伤上的蓝色小点即为GUS表达位点。
(2)根、茎、叶中的GUS检测剪取pOsMT2bL-GUS和35S-GUS转基因水稻及未转基因水稻成熟植株的根、茎、叶、叶鞘、叶舌叶耳结合部(其中根、茎、叶鞘用解剖刀横切),浸没在染色液中,37℃保温3-20h,转入70%乙醇中脱色2-3次,至阴性对照材料呈白色。
GUS荧光定量分析方法
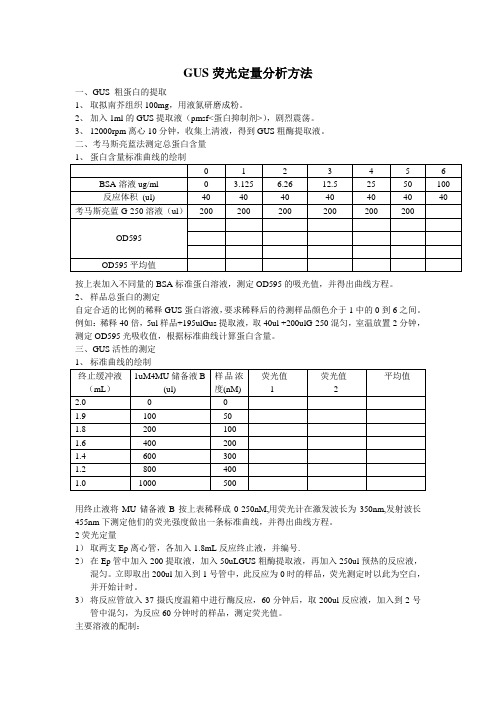
GUS荧光定量分析方法一、GUS 粗蛋白的提取1、取拟南芥组织100mg,用液氮研磨成粉。
2、加入1ml的GUS提取液(pmsf<蛋白抑制剂>),剧烈震荡。
3、12000rpm离心10分钟,收集上清液,得到GUS粗酶提取液。
二、考马斯亮蓝法测定总蛋白含量按上表加入不同量的BSA标准蛋白溶液,测定OD595的吸光值,并得出曲线方程。
2、样品总蛋白的测定自定合适的比例的稀释GUS蛋白溶液,要求稀释后的待测样品颜色介于1中的0到6之间。
例如:稀释40倍,5ul样品+195ulGus提取液,取40ul +200ulG-250混匀,室温放置2分钟,测定OD595光吸收值,根据标准曲线计算蛋白含量。
三、GUS活性的测定用终止液将MU储备液B按上表稀释成0-250nM,用荧光计在激发波长为350nm,发射波长455nm下测定他们的荧光强度做出一条标准曲线,并得出曲线方程。
2荧光定量1)取两支Ep离心管,各加入1.8mL反应终止液,并编号.2)在Ep管中加入200提取液,加入50uLGUS粗酶提取液,再加入250ul预热的反应液,混匀。
立即取出200ul加入到1号管中,此反应为0时的样品,荧光测定时以此为空白,并开始计时。
3)将反应管放入37摄氏度温箱中进行酶反应,60分钟后,取200ul反应液,加入到2号管中混匀,为反应60分钟时的样品,测定荧光值。
主要溶液的配制:1、GUS提取缓冲液:1)0.1M磷酸钠缓冲液(pH7.0)50mL:0.1M磷酸钠缓冲液(pH7.0):557mL0.1mol/LNa2HPO4+42.3mL1mol/L NaH2PO4定容到1000mL(35.814gNaHPO4.12H2O(358.14)定容到1000mL;15.6g NaH2PO4.2H2O(156.01)定容到100Ml)2) 0.5M Na2EDTA (pH8.0) 2.00mL:9.31gEDTA加水剧烈搅拌,加入约1g NaOH, 定容到50 mL.3) 30% 十二烷基肌氨酸钠0.33 mL:1.5g加水定容到504)10% Triton X-100 1 mL:1 mL Triton X-100 加9 mL水混匀5)β-巯基乙醇0.07-0.10 mL(马琳论文里面有)6)甲醇 20ml(网上有的文献里有)蒸馏水定容至100mL。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
报告基因GUS的表达的检测
材料:拟南芥AK12-pro 试剂: GUS工作液:在450mlddH2O中加入82mg铁氰化钾,105.6mg亚 铁氰化钾,50ml 1mol/L磷酸钾缓冲液(pH7.0),加水至500ml, 4℃储存备用。1mol/LGUS染色液:用DMSO溶解100mg X-Gluc, 再加入GUS工作液,定容至100ml,分装成小管,置于-20℃储存备 用。 组织化学染色检测 -- GUS染色 1. 取2支1.5ml离心管,各加入0.5ml 1mol/L GUS染色液; 2. 用镊子夹取 转基因和野生型拟南芥幼苗各1根,分别放入上述离心 管中; 3. 37℃浸泡2-5h(或过夜);(晚上继续下面的脱色和照相步骤) 4. 倒掉染色液,加入75%乙醇脱色;30min后换一次75%乙醇脱色; 肉眼下观察染色情况;拍照。如果有GUS基因表达产物,则出现 蓝色。
实验报告
转基因作物的检测
新霉素磷酸转移酶II(nptⅡ )基因(卡那霉素抗性)
AK12- pro RB 35S-pro NPT П NOS-ter GUS NOS-ter LB
p动子 nopaline synthase(NOS)gene 终止子 胭脂碱合成酶
考核
成绩计算方法(百分制):
期末考试: 50分(考试内容包括平时操作和涉及实
验的理论基础)
平时成绩: 50分 (共5份实验报告,每份10分)
基 因 工 程 的 基 本 路 线
质粒DNA提 取和酶切
PCR
连接
转化
• 基因的组织特异性表达
原 理
GUS基因就是转β-葡萄糖醛酸酶基因 ,它存在于 E.coli等一些细菌基因组内,编码β-葡萄糖苷酸酶。 β-葡萄糖苷酸酶是一个水解酶,以β-葡萄糖苷酸酯 类物质为底物,其分解产物呈蓝色。 由于绝大多数植物没有检测到葡萄糖苷酸酶的背 景活性,因此这个基因被广泛应用于基因调控的 研究中(作为报告基因)。根据gus基因检测所用 的底物不同,可以选择三种检测方法:组织化学 法、分光光度法和荧光法(灵感度为分光光度检 测法最高),其中最为常用的是组织化学法。
实验七、转基因植物中报告基因 GUS组织化学定位检测
如何检测基因的组织特异性表达?
• 基因的组织特异性表达主要是由该基因特异 性启动子决定的。即,某些启动子有组织特 异性,它会启动该基因的特异性表达。
• 启动子没有基因特异性,它会启动任何下 游基因的表达。
• 只要知道启动子在什么部位表达,就可以推 测出该启动子所启动的基因的表达部位。 • 启动子的表达如何才能肉眼可见呢?——连 接报告基因(GUS,分解底物呈蓝色)。
• 组织化学法检测:以5-溴-4-氯-3-吲哚-β-葡萄糖苷 酸酯(X-Gluc)作为反应底物。将被检材料用含有 底物的缓冲液浸泡,若组织细胞被转入了GUS基 因,并表达出Gus,在适宜的条件下,该酶就可将 X-Gluc水解生成蓝色产物,这是由其初始产物经氧 化二聚作用于形成的靛蓝染料,它使具Gus活性的 部位或位点呈现蓝色,用肉眼或在显微镜下可看到 ,且在一定程度下根据染色深浅可反映出Gus活性 。因此利用该方法可观察到外源基因在特定器官、 组织,甚至单个细胞内的表达情况。
转基因作物的检测方法
(一)以载体为检测对象:PCR扩增载体序列,根据扩 增产物的大小或有无来判断是否为转基因植物。 目前, 瑞典等欧洲国家普遍以35S 的检测结果作为转基因 食品标签的重要依据。 (二)以插入的外源基因为检测对象:PCR扩增插入的 外源基因;或者利用抗体与抗原的反应来检测(Western blotting,ELASA等)。 (三)以插入的报告基因为检测对象:GUS染色法。
本实验材料中使用的转基因载体的部分图谱
克隆拟南芥中的 AK12 基因的启动子,插入到 PBI101载体GUS基因上游的克隆位点(具体图 示如下) 农杆菌转化
转化拟南芥
AK12- pro RB 35S-pro NPT П NOS-ter GUS NOS-ter LB
pBI101
PBI101载体
新霉素磷酸转移酶II(nptⅡ )基因(卡那霉素抗性)
• 37度培养12-14h,会长出如上图所示的单 菌落(乳白色、浑圆、饱满、菌落高度明 显突出培养基表面)。 • 培养时间过长,比如超过16小时,在这些 单菌落周围会出现一小密集的像针尖一样 大小的菌落,称为卫星菌落。这说明,培 养的时间太长了。
卫星菌落
• 有些载体带有β-内酰胺酶的基因,表达出β-内酰胺酶,它 可以破坏氨卞青霉素。当细菌培养时间过长,β-内酰胺酶 积累过多,就会使周围的氨卞青霉素失效,导致不含质粒 的空菌落大量生长,这就是卫星菌落。
AK12- pro RB 35S-pro NPT П NOS-ter GUS NOS-ter LB
pBI101
花椰菜花叶病毒( CaM V)启动子 nopaline synthase(NOS)gene 终止子 胭脂碱合成酶
本实验基本流程
拟南芥AK12-pro
种子萌发,长成幼苗
取幼苗
组织化学检测 -- GUS检测
