DNA3’端生物素标记
生物素标记方法

生物素标记方法
生物素标记方法是研究分子生物学、生物医学以及基因工程领域中常用的一种技术手段。
生物素是一种小分子,能够稳定结合在蛋白质、DNA、RNA等生物分子上,然后通过化学反应将其标记,从而实现对这些生物分子的检测、分离、纯化等目的。
下面,我将介绍几种常用的生物素标记方法。
1. 化学合成法
该方法是指直接将生物素与目标分子进行化学反应合成标记物。
一般情况下,将生物素与分子中含有取代基或官能团的氨基酸、碳水化合物、核苷酸等分子反应,形成生物素标记分子。
这种方法操作简单,标记分子的稳定性相对较高,但也存在反应产物多样性和纯化难度较大的问题。
2. 酶标法
生物素酶标方法是通过先将目标分子与无生物素酶的生物素结合蛋白偶联,然后加入酶标记化学底物,使之被生物素结合蛋白吸附,生成酶标记。
该方法不需要化学反应,有色或荧光信号明显,而且有较高的检测灵敏度和特异性,可以用于定量检测和高通量筛选。
3. 亲和柱纯化法
该方法是利用生物素亲和柱的特异性吸附作用,对生物素标记蛋白、DNA等生物大分子进行纯化,从而获得高质量的样品。
最常用的是streptavidin疏水亲和纯化柱和avidin疏水亲和纯化柱。
这种方法操作简单,纯化效果好,但标记分子的稳定性较低,可能存在对目标蛋白活性影响等问题。
以上是生物素标记方法的三种常用技术手段,可以根据不同的研究需求选择合适的方法使用。
生物素标记技术的广泛应用不仅有助于分子生物学和生物医学的研究发展,也为新药发现和治疗提供了重要的帮助。
生物素标记质粒

生物素标记质粒生物素标记质粒是在质粒DNA上引入生物素标记序列,使得质粒DNA具有特定的生物素亲和性。
生物素是一种维生素B家族的水溶性维生素,与亲生物素蛋白的结合具有高度的特异性和亲和力。
因此,通过将生物素标记引入质粒DNA上,可以利用生物素和亲生物素蛋白之间的结合特性来实现对质粒DNA的检测、纯化和操作等。
生物素标记质粒的应用十分广泛,其中一项常见应用是在原核和真核系统中进行蛋白表达和检测。
通过将目标基因与生物素标记质粒融合,可以实现对目标蛋白的高效表达,并通过生物素亲和纯化技术对蛋白进行纯化。
这样,不仅可以获得高纯度的目标蛋白,而且可以避免与其他蛋白的非特异性结合和干扰。
此外,生物素标记质粒还可以应用于基因编辑领域。
例如,研究人员可以将CRISPR-Cas9系统中的Cas9蛋白与生物素标记质粒进行融合,从而实现对基因组的高效编辑。
通过亲生物素蛋白与生物素的结合,可以准确地将CRISPR-Cas9系统导入到特定的细胞中,并选择性地编辑目标基因。
除了上述应用外,生物素标记质粒还可以用于药物传递和基因治疗等领域。
例如,可以将药物载体与生物素标记质粒结合,实现对药物的靶向传递和释放。
同时,生物素标记质粒也可以与基因治疗载体结合,实现对治疗基因的传递和表达,从而可以用于治疗遗传性疾病、癌症等疾病的基因治疗研究。
总结起来,生物素标记质粒在蛋白表达、基因编辑、药物传递和基因治疗等领域具有广泛的应用前景。
通过引入生物素标记序列,可以实现对质粒DNA的高效检测、纯化和操作,并且还可以利用生物素和亲生物素蛋白之间的结合特性实现对目标蛋白、基因组和药物的靶向识别和传递。
因此,生物素标记质粒在生命科学研究和生物技术应用中具有重要的作用。
参考文献:1. Hartley JL, Temple GF, Brasch MA (2000). "DNA clonin-using in-vitro site-specific recombination". Genome research 10 (11): 1788–95.2. Binderow BD, Santana-Santos L, Chua JH, Kaplan DL (2012). "Recombinant protein purification from an E. coli lysate using bioengineered silk-binding protein". Journal of Chromatography B 911: 37–44.3. Chen R, Snyder M (2012). "Promoter proximal elements are responsible for the majority of the signal amplification in alternative promoter selection in Saccharomyces cerevisiae". PLoS genetics 8 (12): e1003082.。
修饰引物十问十答
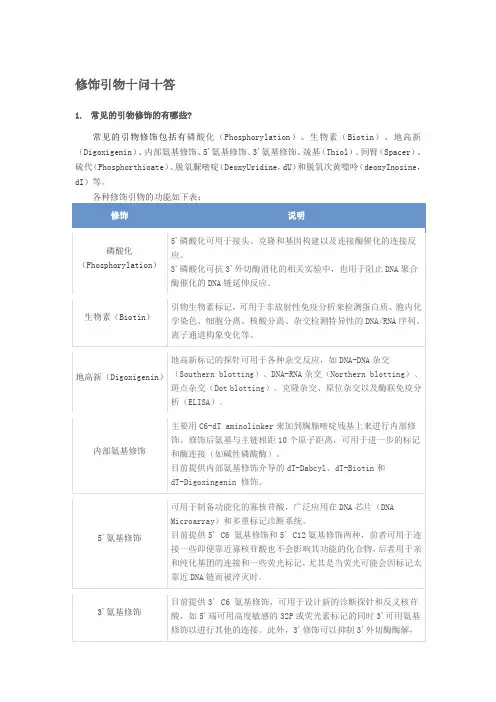
修饰引物十问十答1.常见的引物修饰的有哪些?常见的引物修饰包括有磷酸化(Phosphorylation)、生物素(Biotin)、地高新(Digoxigenin)、内部氨基修饰、5'氨基修饰、3'氨基修饰、巯基(Thiol)、间臂(Spacer)、硫代(Phosphorthioate)、脱氧脲嘧啶(DeoxyUridine,dU)和脱氧次黄嘌呤(deoxyInosine,dI)等。
2.为什么修饰引物的产量要比一般引物低,价格要高?由于修饰单体稳定性较差,偶联时间长,效率低,最后得到的产量自然低于一般的引物。
并且,修饰引物通常需要PAGE或HPLC纯化,纯化过程损失较大。
修饰引物使用的原料是一般引物原料的几百倍,所以产品的价格自然高。
3. 合成的荧光标记探针应如何保存?1)荧光探针必须避光保存。
2)干品可于-80℃保存一年以上,无条件时可于-20℃保存。
3)强烈建议用RNase-free的TE (pH 8.0) buffer溶解探针,这样得到的探针溶液更稳定,保存时间更长。
4)可将探针配制成100 pmol/μl的储备液,分装成几份于-20 ℃保存。
使用前,将配制好的储备液稀释成工作液 (10 pmol/μl或20 pmol/μl),剩余部分于-20 ℃保存,防止反复冻融。
4. 修饰标记对OD值的测量有影响吗?有些荧光基团在260 nm处也有吸收光,例如 FAM, HEX, TAMRA, TET。
其它在260 nm 处可能也有吸收值,但是数据没有公布,因此计算时不包括在里面。
5. 磷酸化是怎么回事?5'磷酸化作用是通过B-氰乙基化学反应添加到引物5'端的糖环上,而不是最后一个碱基上;3'磷酸盐被连接到固体支持介质上,所以在合成的第一个循环,碱基就与它偶联。
3'磷酸化修饰具有阻止聚合酶延伸的功能。
6. Phospothioate(S-oligos)硫代引物和普通的引物有什么区别?S-oligos是寡核苷酸中的单核苷酸之间的磷酸二酯键中的一个氧被硫代替后形成的。
生物素标记探针退火反应

生物素标记探针退火反应引言生物素标记探针退火反应是一种常用的实验技术,用于检测和定量分析生物学样本中的特定分子。
本文将介绍生物素标记探针退火反应的原理、步骤和应用。
一、原理生物素标记探针退火反应是一种基于亲和配对原理的实验技术。
生物素是一种小分子化合物,具有与亲和素相结合的能力。
在该实验中,探针分子通过与目标分子的亲和反应结合,进而标记目标分子。
二、步骤生物素标记探针退火反应一般包括以下步骤:1. 选择合适的探针分子:根据实验目的选择合适的探针分子,可以是DNA、RNA或蛋白质等。
2. 生物素标记:将探针分子与生物素结合,通常采用化学交联或酶促反应的方法。
这样可以在探针分子上引入生物素分子,从而实现标记。
3. 目标分子结合:将标记后的探针分子与待检测的目标分子进行结合反应。
目标分子可以是DNA、RNA或蛋白质等,具体根据实验需要而定。
4. 退火反应:将探针分子和目标分子进行退火反应,使其形成稳定的亲和配对。
退火反应的条件包括温度、时间和缓冲液等,需要根据实验需求进行优化。
5. 检测分析:通过合适的检测方法,如荧光染料或酶标记等,对探针分子和目标分子的结合情况进行分析和定量。
常用的检测方法包括荧光检测、酶标记检测和放射性测定等。
三、应用生物素标记探针退火反应在生物学研究中具有广泛的应用。
以下列举几个常见的应用领域:1. 基因表达分析:通过标记与目标基因匹配的探针分子,可以研究基因的表达水平和调控机制。
常见的应用包括DNA微阵列分析和实时荧光定量PCR等。
2. 蛋白质相互作用研究:通过标记蛋白质的探针分子,可以研究蛋白质之间的相互作用及其调控网络。
常用的应用包括蛋白质亲和纯化和蛋白质相互作用分析等。
3. 细胞信号传导研究:通过标记与目标信号分子结合的探针分子,可以研究细胞信号传导通路及其调控机制。
常见的应用包括免疫组化和荧光共振能量转移等。
4. 病原体检测和诊断:通过标记与目标病原体相关基因或蛋白质的探针分子,可以进行病原体的检测和诊断。
emsa探针设计原则

EMSA(Electrophoretic Mobility Shift Assay)是一种用于研究蛋白质与DNA 相互作用的实验技术。
在EMSA实验中,DNA与蛋白质结合形成复合物后,由于蛋白质的结合,DNA的迁移速度减缓,从而产生电泳迁移的变化。
设计EMSA 探针时,需要考虑一些原则以确保实验的有效性和准确性。
以下是一些EMSA探针设计的原则:1. DNA序列选择:-选择包含蛋白质结合位点的DNA序列。
-序列长度通常在20到30个碱基对之间。
2. GC含量:-控制DNA探针的GC含量,使其在40-60%之间,以确保适当的二级结构形成。
3. 端标记:-选择适当的标记方法,如放射性同位素标记(如^32P)或非放射性标记(如荧光标记或生物素标记)。
-注意标记效率和探针稳定性。
4. 双链DNA vs. 单链DNA:-双链DNA探针更接近实际生物条件,但单链DNA可能更容易与蛋白质结合。
-根据实验需求选择双链或单链DNA。
5. 非特异性竞争:-添加非特异性竞争DNA片段可以用于确认蛋白质结合的特异性。
-非特异性竞争物质的浓度需要经过优化。
6. 核苷酸突变:-引入特定核苷酸的突变以确认蛋白质结合的特异性。
-突变的核苷酸位置需要根据先前的研究或生物信息学分析来选择。
7. 探针浓度:-确定适当的DNA探针浓度,通常需要进行一系列的浓度测试以确定最佳条件。
8. 探针纯度:-使用纯度高的DNA探针,以避免非特异性结合或其他干扰。
9. 探针长度:-考虑探针的长度,太长可能影响迁移速度,太短可能不足以与蛋白质结合。
10. 实验条件优化:-需要优化电泳条件,如凝胶浓度、电场强度、电泳时间等,以确保蛋白质- DNA复合物和未结合的DNA可以明显分离。
设计EMSA探针时需要根据具体的实验目的和条件进行调整和优化。
在实验过程中,注意控制实验的质量和可重复性,以获得可靠的结果。
分子生物学-背诵版

名词解析1、原位PCR(in situ PCR):直接用细胞涂片或石蜡包埋组织切片在完整细胞中进行PCR抗增的方法。
2、实时定量PCR(qPCR):在反应中引入了荧光标记分子,在反应过程中对反应过程中每一时刻的产物量进行实时分析。
3、易错PCR(error-prone PCR):通过改变PCR 条件,提高扩增产物的碱基错配率,从而获得与原来不同的 DNA 序列或基因。
4、分子信标:是一种茎环结构的双标记寡核苷酸探针。
在此结构中,位于分子一端的荧光基团与分子另一端的淬灭基团靠近。
5、荧光阈值:在荧光扩增曲线指数增长期设定一个荧光强度标准(即PCR扩增产物量的标准)。
如果检测到荧光信号超过阈值则被认为是真正的信号。
荧光阈值通常设置为3-15个循环的荧光信号的标准差的10倍。
6、Ct值(循环阈值):PCR扩增过程中,扩增产物(荧光信号)到达阈值时所经过的扩增循环次数。
Ct值与模板起始拷贝数(起始模板量)的对数呈线性关系,模板起始拷贝数越大,Ct值越小。
7、限制性核酸内切酶:是一类能识别双链DNA中的某些特定核苷酸序列,并由此切割DNA 双链的核酸内切酶,又称为内切酶或限制酶。
8、限制性核酸内切酶的星号活性:限制酶在一些特定条件下使用时,对于底物DNA的特异性可能降低。
即可以把与原来识别的特定的DNA序列不同的碱基序列切断。
9、质粒(plasmid):是存在于细菌染色质以外,具有自我复制能力的双链环状DNA。
10、蓝白斑筛选:是重组子筛选的一种方法,是根据载体的遗传特征筛选重组子,主要为α-互补与抗生素基因。
蓝白斑筛选在指示培养基上,未转化质粒的菌落因无抗生素抗性而不能生长,重组质粒的菌落是白色的,非重组质粒的菌落是蓝色的,以颜色不同为依据直接筛选重组克隆的方法。
11、转化:将质粒DNA或以质粒载体构建的重组DNA导入原核细胞细菌(大肠埃希菌)的过程。
12、包含体:是无定型的蛋白质聚合物,其中大部分(50%以上)是外源基因的表达产物,这些产物一级结构正确,但空间构像错误。
生物素标记引物
生物素标记引物生物素标记引物是一种在分子生物学实验中常用的工具,可以用来检测、定位和分离特定的核酸或蛋白质。
本文将从生物素标记引物的原理、应用以及优缺点等方面进行介绍。
一、生物素标记引物的原理生物素标记引物的原理是利用生物素与亲生素之间的高度特异性结合。
生物素(biotin)是一种小分子化合物,与维生素H同属于B 族维生素。
生物素标记引物通常是通过在引物的末端或内部加入生物素分子,使得引物与生物素之间形成稳定的结合。
这种结合可以通过生物素与亲生素之间的非共价相互作用(如亲和力、电荷吸引力等)来实现。
生物素标记引物在分子生物学实验中有广泛的应用。
其中,最常见的应用包括:1. 探针:生物素标记引物可以与特定的DNA或RNA序列结合,用于检测目标序列的存在和定位。
这种技术常被应用于杂交、原位杂交、Northern blot和Southern blot等实验中。
2. 亲和纯化:生物素标记引物可以与生物素结合蛋白质特异性亲生素结合,通过亲和层析等技术将目标蛋白质从复杂的混合物中分离和纯化。
3. 免疫印迹:生物素标记引物可以与生物素结合的抗体结合,用于检测目标蛋白质的存在和定量。
这种技术常被应用于Western blot等实验中。
4. 荧光检测:生物素标记引物可以与荧光染料结合,用于荧光定量PCR、荧光原位杂交等实验中,从而实现对DNA或RNA的快速、敏感的检测。
三、生物素标记引物的优缺点1. 优点:(1)高度特异性:生物素与亲生素之间的结合是高度特异性的,可以准确地检测目标分子的存在和定位。
(2)稳定性:生物素与亲生素之间的结合是稳定的,不易受到环境因素的影响。
(3)灵敏度:生物素标记引物可以通过荧光或酶的反应来增强信号,从而提高检测的灵敏度。
2. 缺点:(1)成本较高:与其他标记方法相比,生物素标记引物的成本较高。
(2)标记容易:生物素标记引物的标记过程相对复杂,需要一些特殊的试剂和步骤。
(3)标记效率不高:生物素标记引物的标记效率一般较低,需要进行一定的优化。
生物素-亲和素标记技术完整讲解
4.1.5 在ELISA中的应用 用生物素化的抗体替代常规ELISA中的酶标抗 体,然后连接亲和素-酶结合物(BA-ELISA)、或亲 和素及酶标生物素(BAB-ELISA)或ABC试剂(ABCELISA),从而使反应信号放大,提高检测的灵敏 度。王传彬等用生物素标记的纯化抗禽流感病毒 H5亚型血凝素单抗和酶标亲和素检测H1、H15亚 型AIV标准毒株和H5、H7、H9亚型AIV分离株, 与血凝和血凝抑制试验比较,纯化后的单抗具有 良好的反应活性。祝军等将BA-辣根过氧化物酶 复合物系统ELISA策略,对ANEPⅢ寡核苷酸适配 子的亲合力进行测定。
4.2 在分子生物学中的应用
• 不对称PCR 目的:扩增产生特异长度的单链DNA。 方法:采用两种不同浓度的引物。分别称 为限制性引物和非限制性引物,其最佳比例 一般是0.01∶0.5μM,关键是限制性引物的 绝对量。 用途:制备核酸序列测定的模板;制备杂 交探针;基因组DNA结构功能的研究
4 .4 在分离纯化中的应用(亲和层析)
1.平衡
2.上样
3.洗杂 4.洗脱
五 反应特点
1. BAS具有高灵敏度、高特异性、高稳定性和适用性等特点。 2.生物素易与蛋白质和核酸类等生物大分子结合,再和生物素 衍生物结合,将信号多级放大,能保持大分子物质的原有生 物活性。 3.亲和素与生物素间的结合具有极高的亲和力,其反应呈高度 专一性,不增加非特异性干扰,也不会因反应试剂浓度高低 受影响。 4.酸、碱、变性剂及有机溶剂均不会影响亲和素与生物素的结 合力。裴仁军等试验结果表明,链霉亲和素与生物素能够在 结合表面形成均一的多层膜维系紧密的结合。 5.BAS不仅能与酶、荧光素和放射性核素等各类标记技术结合, 还可制成亲和介质,用于分离提纯。 6.BAS操作方便,反应结果可用肉眼观察,实验成本低。
D3118 生物素随机引物DNA标记试剂盒
-
孵育1小时
孵育20小时
10ng
80ng
900ng
30ng
150ng
1350ng
100ng
350ng
1650ng
300ng
750ng
2200ng
1000ng
1300ng
2600ng
3000ng
1600ng
2600ng
注意:具体的探针标记效率还和模板DNA的长度、纯度等因素有关,上表的数值仅供参考。
12. 使用本试剂盒所获得的生物素标记DNA的长度通常在数百bp左右。具体的长度因模板的长度而有所不同。例如模板DNA 的长度为1kb,则生物素标记DNA产物的长度通常为100-1000bp,平均长度约为300bp左右。
探针标记终止液 说明书
包装 105µl 11µl 50µl 1ml 50µl 100µl 1份
保存条件:
-20℃保存。
注意事项:
¾ 需自备用于探针标记效率检测的相关试剂。 ¾ 为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
超纯水
1. 在一离心管或PCR管内加入100ng-1µg DNA模板,再加入适量试剂盒提供的Ultrapure Water,至总体积为34µl。
说明:通常100-300ng DNA模板已经足够用于一次标记反应。
2. 加入10µl Random Primer in Buffer (5X),混匀。如有液滴沾在管壁上,高速离心数秒使所有液体集中在管底。
3. 沸水浴加热5分钟,或在PCR仪上100℃加热5分钟(如果不能设置100℃,99℃加热5分钟也完全可以)。
(34-x)µl
Random Primer in Buffer (5X)
生物素标记3篇
生物素标记第一篇:生物素标记概述生物素标记是分子生物学中研究分子相互作用、鉴定蛋白质、分析蛋白质结构和功能的重要工具之一。
生物素是一种水溶性的维生素,其结构特点是含有水溶性羧酸和脂溶性异戊二烯基。
生物素可以与酶促反应产生稳定的亲和素-生物素复合物,具有高亲和力、高灵敏性和高稳定性的特点,因此被用作构建生物学标记体系中的活性物质。
生物素标记的主要方法包括生物素化学标记法、生物素免疫标记法、生物素酶标记法和生物素荧光标记法等。
其中,生物素化学标记法是一种常用的方法,其原理是将生物素化合物与待标记的蛋白质进行反应,形成生物素-蛋白质复合物。
生物素免疫标记法和生物素酶标记法则是在生物素-抗生素相互作用的基础上,使用免疫学技术或酶学技术进行标记。
生物素荧光标记法则是将生物素与荧光染料反应,形成生物素荧光物质,用于荧光显微镜下的检测。
生物素标记的优点包括灵敏性高、特异性强、易于操作和广泛用途等。
现已广泛应用于分子生物学、免疫学、分子遗传学及基因工程等领域中的蛋白质定量、蛋白质交互作用、蛋白质表达和酶促反应等方面的研究中。
第二篇:生物素标记在蛋白质鉴定中的应用生物素标记在蛋白质鉴定中是一种非常有效的方法。
其原理是将生物素化合物与待鉴定的蛋白质进行反应,形成生物素-蛋白质复合物,然后使用亲和素-生物素标记进行检测。
这种方法不仅能够鉴定蛋白质,而且还能定量分析蛋白质。
生物素标记在蛋白质鉴定中的优点在于:首先,生物素标记不会影响蛋白质的活性或特性。
其次,生物素标记灵敏度高,可以检测到非常低浓度的蛋白质。
最后,在亲和素-生物素标记过程中,可以通过蛋白质的特异性结合来消除杂质的影响,从而大大提高鉴定结果的准确性。
生物素标记在蛋白质鉴定中的应用广泛,例如,可以用生物素标记来鉴定蛋白质的纯度和分子量。
此外,还可以使用生物素标记来检查蛋白质的表达水平和鉴定蛋白质结构中的关键氨基酸。
第三篇:生物素标记在分子细胞生物学中的应用生物素标记在分子细胞生物学中也有着广泛的应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、准备工作:
A、取出TdT Buffer (5X)、Biotin-11-dUTP和Ultrapure water溶解,并置于冰浴上备用。
B、取出待标记的单链EMSA探针,用水稀释至1μM,并置于冰浴上备用。
如果待标记的EMSA探针为双链,
95℃加热2分钟,然后立即放置到冰水浴中,使双链的EMSA探针转变为单链的探针,然后同样用水稀
释至总的单链DNA浓度为1μM,即每条单链的浓度为0.5μM,相当于最初双链的EMSA 探针浓度为0.5μM。
2、DNA探针的标记:
Ultrapure water 29μl
TdT Buffer(5X) 10μl
待标记探针(1μM) 5μl
Biotin-11-dUTP(5μM) 5μl
TdT(10U/μl) 1μl
总体积50μl
A、参考上述设置反应体系。
注:对于双链的EMSA探针的标记反应,建议一次做两管,即总体积共100μl,以最终获得足够的生物素标记EMSA探针用于后续EMSA检测。
B、用枪轻轻吹打混匀,切勿vortex。
37℃孵育30分钟。
C、加入2.5μl 探针标记终止液,轻轻混匀终止反应。
3、TdT的去除:
A、探针标记反应终止后,加入52.5μl氯仿-异戊醇(24:1),vortex使有机相和水相充分混合以抽提TdT(说明:静止后有机相和水相会很快分层)。
B、12000-14000g离心1-2分钟。
吸取上清备用。
上清即为被生物素标记的单链DNA探针。
4、探针的纯化(选做):
通常为实验简便起见,可以不必纯化标记好的探针。
有些时候,纯化后的探针会改善后续实验的结果。
如需纯化,可以按照如下步骤操作:
A、对于100μl标记好的探针,加入1/4体积即25μl的5M醋酸铵,再加入2体积即200μl的无水乙醇,混匀。
B、-70℃至-80℃沉淀1小时,或-20℃沉淀过夜。
C、4℃,12,000g-16,000g离心30分钟。
小心去除上清,切不可触及沉淀。
D、4℃,12,000g-16,000g离心1分钟。
小心吸去残余液体。
微晾干沉淀,但不宜过分干燥。
E、加入50μl TE,完全溶解沉淀。
标记好的探针可以-20℃保存。
5、生物素标记探针标记效率的检测:
A、取5μl Biotin-Control Oligo(0.4μM),加入196μl TE,混匀,稀释成10nM Biotin-Control Oligo(作为标准品)。
取出适量10nM Biotin-Control Oligo,依次稀释成5nM、2.5nM、1nM、0.5nM和0.25nM。
B、取3μl步骤3B所获得的生物素标记的DNA探针(100nM),加入27μl TE,混匀,稀释成10nM 生物素标记的探针(作为待测样品)。
取出适量的10nM 生物素标记的探针,依次稀释成5nM、2.5nM、1nM、0.5nM和0.25nM。
C、参考下面的表格,取一适当大小的带正电荷尼龙膜,在膜上做好相应标记。
对于经过
梯度稀释的标准品和待测样品,分别取2μl滴加到膜上。
在膜上滴加标准品或待测样品时,请注意使液滴充分被膜吸收,在膜上形成一个湿的圆形小斑点。
说明:如果条件许可,可以使用专门用于点杂交或狭缝杂交的设备进行探针标记效率的检测,探针的用量参考下表,浓度可以再稀释50倍,而所用体积可以相应放大50倍至100μl。
探针浓度 10nM 5nM 2.5nM 1nM 0.5nM 0.25nM Biotin-Control Oligo 2μl2μl2μl 2μl 2μl 2μl 生物素标记的探针2μl 2μl 2μl 2μl2μl2μl 探针量 20fmol 10fmol 5fmol 2fmol 1fmol 0.5fmol
D、滴加完所有的标准品和样品后,将膜室温晾干。
E、用紫外交联仪(UV-light cross-linker)选择254nm紫外波长,120mJ/cm2,交联30-45秒。
如果没有紫外交联仪可以使用普通的手提式紫外灯(例如碧云天的手提紫外检测仪(EUV002)),距离膜5-10厘米左右照射1-5分钟。
也可以使用超净工作台内的紫外灯,距离膜5-10厘米左右照射1-10分钟。
最佳的交联时间可以使用标准品自行摸索。
F、随后可以立即采用各种生物素检测试剂盒,检测出样品的生物素标记效率;也可以室温存放数天直至进行后续检测。
G、如果最后采用的是ECL类试剂或其它类似试剂进行检测,则可以对比样品和标准品的灰度,从而计算出探针的标记效率。
例如2fmol量的待测样品探针的灰度和1fmol标准品的灰度相同,则说明探针的标记效率大致为50%,待测样品中总探针的浓度约为1μM,而实际被生物素标记的探针约为0.5μM。
探针的标记效率也可以通过建立标准曲线进行比较精确的计算。
用于后续检测时通常要求标记效率不低于30%。
有文献报道标记效率和3'末端的碱基无关,但和整个待标记探针的序列有关。
由于在TdT的催化下可以在待标记探针的3'端加上多个Biotin标记的dUTP,因此有时会出现标记效率大于100%的情况。
6、生物素标记EMSA探针的制备:
A、对于步骤3B标记好的单链DNA探针,把正义链和反义链等体积混合(不可根据标记效率调整摩尔比例)。
对于最初使用变性的双链EMSA探针进行探针标记的情况,直接进入下一步。
B、加入退火缓冲液(10X),使退火缓冲液的最终浓度为1X,混匀。
例如待退火探针的体积为100微升,则加入11微升退火缓冲液(10X)。
C、如下设置PCR仪进行退火反应:
步骤 1 2 3
温度 95℃每8秒下降0.1℃,降至25℃(注1) 4℃
时间 2min 约90min 长时间保持
说明让oligo充分变性退火暂时存放
注1:如果所用的PCR仪不具备下降0.1℃的功能,也可以设置为每90秒下降1℃。
D、退火反应结束后,-20℃保存标记好的EMSA探针。
此时的EMSA探针已经可以直接用于后续的EMSA检测,也可以对探针进行适当纯化后再进行EMSA检测。
