生物素标记EMSA探针-AP1
EMSA原理简介

EMSA实验技术及方法简介实验简介凝胶迁移或电泳迁移率实验(EMSA-electrophoretic mobility shift assay)是一种研究DNA 结合蛋白和其相关的DNA结合序列相互作用的技术,可用于定性和定量分析。
这一技术最初用于研究DNA结合蛋白,目前已用于研究RNA结合蛋白和特定的RNA序列的相互作用。
通常将纯化的蛋白和细胞粗提液和32P同位素标记的DNA或RNA探针一同保温,在非变性的聚丙烯凝胶电泳上,分离复合物和非结合的探针。
DNA-复合物或RNA-复合物比非结合的探针移动得慢。
同位素标记的探针依研究的结合蛋白的不同,可是双链或者是单链。
当检测如转录调控因子一类的DNA结合蛋白,可用纯化蛋白,部分纯化蛋白,或核细胞抽提液。
在检测RNA结合蛋白时,依据目的RNA结合蛋白的位置,可用纯化或部分纯化的蛋白,也可用核或胞质细胞抽提液。
竞争实验中采用含蛋白结合序列的DNA或RNA片段和寡核苷酸片段(特异),和其它非相关的片段(非特异),来确定DNA或RNA结合蛋白的特异性。
在竞争的特异和非特异片段的存在下,依据复合物的特点和强度来确定特异结合。
凝胶迁移或电泳迁移率检测(Electrophoretic Mobility Shift Assay, EMSA)是一种检测蛋白质和DNA序列相互结合的技术,最初用于研究DNA结合蛋白和其相关的DNA结合序列相互作用,可用于定性和定量分析。
这一技术目前已用于研究RNA结合蛋白和特定的RNA 序列的相互作用。
由于很多研究的TF不具有结合的特异性,所以即使发现TF和被研究的寡核苷酸探针结合,也不表示在体内该TF不能和其它寡核苷酸结合,运用一些生物信息学软件,可以模拟表示TF与基因启动子区寡核苷酸结合的具体情况,发现TF可以和启动子区PUTATIVE 结合。
同时,由于EMSA在体外不能模拟细胞内众多生物分子的相互作用,比如,某一TF 在细胞内由于受到其它TF的协同或者修饰后才能与寡核苷酸结合的话,那么在体外是不能重现这一结果的。
什么是凝胶迁移或电泳迁移率实验(EMSA)
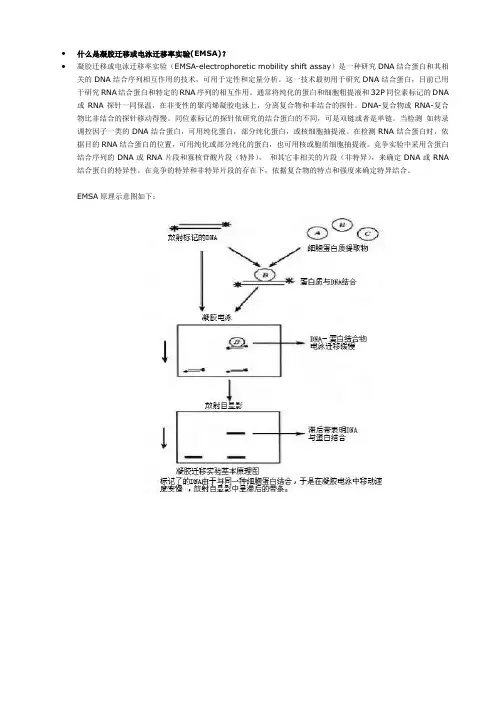
∙什么是凝胶迁移或电泳迁移率实验(EMSA)?∙凝胶迁移或电泳迁移率实验(EMSA-electrophoretic mobility shift assay)是一种研究DNA结合蛋白和其相关的DNA结合序列相互作用的技术,可用于定性和定量分析。
这一技术最初用于研究DNA结合蛋白,目前已用于研究RNA结合蛋白和特定的RNA序列的相互作用。
通常将纯化的蛋白和细胞粗提液和32P同位素标记的DNA 或RNA探针一同保温,在非变性的聚丙烯凝胶电泳上,分离复合物和非结合的探针。
DNA-复合物或RNA-复合物比非结合的探针移动得慢。
同位素标记的探针依研究的结合蛋白的不同,可是双链或者是单链。
当检测如转录调控因子一类的DNA结合蛋白,可用纯化蛋白,部分纯化蛋白,或核细胞抽提液。
在检测RNA结合蛋白时,依据目的RNA结合蛋白的位置,可用纯化或部分纯化的蛋白,也可用核或胞质细胞抽提液。
竞争实验中采用含蛋白结合序列的DNA或RNA片段和寡核苷酸片段(特异),和其它非相关的片段(非特异),来确定DNA或RNA 结合蛋白的特异性。
在竞争的特异和非特异片段的存在下,依据复合物的特点和强度来确定特异结合。
EMSA原理示意图如下:∙凝胶迁移或电泳迁移率实验(EMSA)常用的实验手段有同位素32P法和非同位素法(化学发光法)。
∙一般做这样的实验需要什么试剂?凝胶迁移实验需要的结合蛋白,可来源于纯化或部分纯化的蛋白,或粗的核和胞质抽提液。
还必须制备同位素标记的DNA或RNA。
一般,DNA核苷酸探针用g-32P和T4多核苷酸激酶来作末端标记,同位素标记的RNA用噬菌体RNA聚合酶和同位素标记的核苷酸在体外合成。
结合反应所需的组分有:含盐的溶液(氯化镁,氯化钠,或氯化钾)、缓冲体系(Tris-HCl或HEPES)、还原剂(DTT)、甘油、非特异的竞争DNA(poly(dI:dC)(dI:dC)),也可能含非离子去污剂。
在结合蛋白和同位素标记的探针作用后,在非变性的聚丙烯凝胶电泳上,分离复合物,随后将凝胶干燥并放射自显影,或用PhosphorImage分析。
emsa实验

emsa实验
EMSA实验是基于DNA结合蛋白与DNA的特异性结合,依据实验需要,设计标记探针、非标记探针、蛋白特异性抗体等参照物。
通过电泳迁移率的变化来进行定性和定量分析,钟鼎生物提供的EMSA实验(凝胶/电泳迁移率实验)基于生物素标记探针与对应的DNA结合蛋白的特异性结合,设计合理、科学的实验方案,为客户提供验证性的EMSA,竞争性的EMSA以及超迁移EMSA(Super-shift EMSA)实验服务。
1、细胞核蛋白或纯化的转录因子,部分实验亦可使用重组表达的蛋白,依据实验设计每张膜至少提供50ul,浓度大于0.5mg/ml。
2、探针序列,如无探针序列,请提供DNA结合蛋白相关信息或相关文献,便于钟鼎生物技术人员设计探针。
3、结合蛋白特异性抗体50ul以上,浓度大于0.5mg/ml。
凝胶迁移阻滞实验(EMSA)实验操作方法及注意事项

凝胶迁移阻滞实验(EMSA)实验操作方法及注意事项凝胶迁移阻滞实验(EMSA)转载丁香园大神的帖子!非常详细!EMSA实验技术作为一个经典的DNA/protein,RNA/protein的检测技术,不是很多简单的实验技术可以替代的! EMSA试验技术的独特性和复杂性决定了,要想做成功EMSA试验,拿到阳性结果可总结为一句话: 把握整体,注意细节!EMSA的整体性包括6大点:探针制备(设计,合成,标记,纯化,退火);个人实验设计(时间剃度浓度查阅文献等);核蛋白制备;浓度测定;EMSA 操作;实验时竞争设计. 这六大点都是会直接影响到EMSA试验的成功与否!简介:EMSA ( Electrophoretic Mobility Shift Assay ) 凝胶迁移实验是一种研究DNA与蛋白质或RNA与蛋白质相互作用的常用技术。
这项技术是基于DNA/蛋白质或RNA/蛋白质复合体在聚丙烯酰胺凝胶电泳(PAGE)中有不同迁移率的原理。
当核转录因子与一条人工合成的特异的DNA或RNA结合后,其在PAGE中的迁移率将小于未结合核蛋白转录因子的DNA,从而检测到活化的与DNA或RNA结合的蛋白转录或调节因子。
发展:从发展史来看,这项实验技术起初是用32P同位素标记人工合成的寡核苷酸形成探针,但是由于同位素的放射性很强,而且半衰期为14天,所以从定购到标记再到做完试验,必须14天完成,种种制约因素导致现代科技发展非同位素EMSA试验技术,这就出现了地高辛标记为探针的非放射EMSA实验技术.在实践中没多久,地高辛标记为探针的非放射EMSA实验技术就暴露了一个严重的缺陷,标记的探真纯化后灵敏度弱,导致实验结果的信号不行,最终就出现了现在的生物素标记探真的EMSA实验技术.配合化学发光技术良好的解决了灵敏度的问题,到目前为止, 生物素标记探真的EMSA实验技术广为应用!EMSA试验成功的关键因素:1.1.试验设计,主要是你用药品刺激细胞时,设计的药品浓度和时间剃度的问题,这个很关键,很多同学不注意这一点,最后试验确实是拿不到阳性结果,比如我一前一个朋友用药物处理SGC7901细胞,就是因为时间点设计的不好EMSA试验结果是阴性的,后来根据自己药品刺激的特性重新设计了刺激时间剃度,最终得到阳性结果! 所以这个设计很关键给一个个人的实验总结希望能帮助大家:一是受体结合类的直接刺激激活信号通路的方法,一般达到EMSA核转运高峰的时间比较短,大概控制在30min-2h之间,很多时候都是在45min和1h达到高峰,当然还有合适的浓度二是是你用的是药物刺激产生受体可能时间会长一些,因为药物还有一个渗透和刺激产生细胞因子的过程.时间可以长一些,主要根据自己的药物刺激特性确定时间点.2.核蛋白样品的制备;制备蛋白样品的关键是:1.注意用专用的和核蛋白抽提试剂来做,才能使制备的核蛋白保持蛋白原有的天然活性和构像.2.掌握好核蛋白的浓度和纯度,尤其是浓度. 能入核的蛋白本来就不是很多,所以核蛋白的浓度往往不会很高,但是EMSA试验对核蛋白的浓度要求还是听高的! 一般要求在1ug/ul以上!有时候稍微低于这个数量级也可以,但是不能太低,否则影响结合反应拿不到结果. 这就要求核蛋白抽提尽量避免核蛋白的损失.同时,一般制备核蛋白的材料为细胞和组织, 细胞要比组织好做的多,最重要的是用细胞得到核蛋白的纯度比组织要高很多. 而组织抽提后杂蛋白相对较多!杂蛋白多会影响试验结果不容易得到EMSA阳性结果!!3.探针的制备:又很多站友都在问我生物素标记到3’端还是5’端,其实我觉得最好还是两端都标记,这样才能更好的提高灵敏度, 国内的标记技术我还不是很了解,我们这边的探真都是国外定做的,还算可以,其制作程序如下: 合成寡核苷酸---标记生物素---纯化---退火合成双链.也是一个比较复杂的过程.4.EMSA实验技术. 这一点主要是操作的细节问题! 下面会更细的谈到.技术要点:关于技术要点,我在这里只提一下关键的几点需要注意的细节操作,其他的照正常程序就可以了!1. 制胶必须是非变性PAGE凝胶,我们实验室一般用6.5%的非变性胶.制胶很重要,直接影响电泳的效果!一般控制在5分钟凝固的效果.10X TBE 1.0ml40% Acrylamide(40%聚丙烯酰胺)3.3ml50% Glycerol(50%甘油)1.0mldH2O(蒸馏水)14.8mlTEMED(四甲基乙二氨)20μl脱气10min10% AP(过硫酸氨)120μl总量20.0ml2. 一般试剂盒包括的试剂l 10X Binding Buffer(10X 结合反应液)(-20 oC)l Poly (dI:dC) (dI:dC)(聚核苷酸竞争物)(-20 oC)l 6X Loading Buffer(10X 上样缓冲液)(4 oC)l Cold oligonucleotides(非标记竞争性寡核苷酸)(-20 oC)l Biotin-Labeled Probe(生物素标记探针)(-20 oC)l Streptavidin-HRP(链霉亲核素-HRP)(4oC)l 2×Blocking Buffer(2×封闭液)(4 oC)l 5×Washing Buffer(5×洗涤液)(4 oC)l Equilibration Solution(平衡液)(4 oC)l Binding-membrane(结合反应膜)(RT)3. 结合反应每次结合反应需1-5μl核蛋白(根据核蛋白浓度而定),根据不同的核提取物浓度加入核提取物用量,用双蒸蒸馏水将终体积调节到15μl (1)结合反应体系:10X 结合反应液1.5μlPoly(dI:dC)(dI:dC) 1.0μl细胞核提取物* ? μl双蒸水* ? μl混匀室温静置20 分钟生物素标记的探针0.5μl总量15μl混匀室温静置20分钟或以上。
生物素标记EMSA探针-AP1

⽣物素标记EMSA探针-AP1⽣物素标记EMSA探针-AP1产品简介:⽣物素标记EMSA探针-AP1是⽤于EMSA(也称gel shift)研究的并经⽣物素(Biotin)标记的AP1 consensus oligonucleotide。
这个⽣物素标记的双链寡核苷酸含有公认的AP1结合位点,可以⽤作EMSA研究时的探针。
AP1 consensus oligo的序列如下:5’-CGC TTG ATG ACT CAG CCG GAA-3’3’-GCG AAC TAC TGA GTC GGC CTT-5’本⽣物素标记EMSA探针已经过纯化,可以直接⽤于EMSA结合反应。
本⽣物素标记EMSA探针可以和碧云天的化学发光法EMSA试剂盒(GS009)配套使⽤。
⼀个包装的⽣物素标记探针可以进⾏约200-400个样品的EMSA检测。
保存条件:-20℃保存,⼀年有效。
注意事项:避免加热到40℃以上,温度过⾼会导致双链DNA探针解聚成单链。
⽽单链⽆法⽤于EMSA研究。
对于基于⽣物素标记的EMSA检测的详细操作可以参考碧云天的化学发光法EMSA试剂盒(GS009)的使⽤说明。
为了您的安全和健康,请穿实验服并戴⼀次性⼿套操作。
使⽤说明:1.本⽣物素标记EMSA探针⽤于EMSA结合反应时,参考如下步骤进⾏:A.如下设置EMSA结合反应:阴性对照反应:Nuclease-Free Water 7-7.5µl EMSA/Gel-Shift 结合缓冲液(5X) 2µl 细胞核蛋⽩或纯化的转录因⼦ 0µl ⽣物素标记探针 0.5-1µl 总体积 10µl探针冷竞争反应:Nuclease-Free Water 4-4.5µl EMSA/Gel-Shift 结合缓冲液(5X) 2µl 细胞核蛋⽩或纯化的转录因⼦ 2µl 未标记的探针 1µl ⽣物素标记探针 0.5-1µl 总体积 10µlSuper-shift反应:Nuclease-Free Water 4-4.5µl EMSA/Gel-Shift 结合缓冲液(5X) 2µl 细胞核蛋⽩或纯化的转录因⼦ 2µl ⽬的蛋⽩特异抗体 1µl ⽣物素标记探针 0.5-1µl 总体积 10µl 样品反应:Nuclease-Free Water 5-5.5µl EMSA/Gel-Shift 结合缓冲液(5X) 2µl 细胞核蛋⽩或纯化的转录因⼦ 2µl ⽣物素标记探针 0.5-1µl 总体积 10µl突变探针的冷竞争反应:Nuclease-Free Water 4-4.5µl EMSA/Gel-Shift 结合缓冲液(5X) 2µl 细胞核蛋⽩或纯化的转录因⼦ 2µl 未标记的突变探针 1µl ⽣物素标记探针 0.5-1µl 总体积 10µl注:⽣物素标记EMSA探针的推荐⽤量为每个反应0.5微升,如果检测出来的⽬的蛋⽩的EMSA条带偏弱,可以适当加⼤⽣物素标记EMSA探针的⽤量⾄0.75微升或1微升。
《现代生命科学研究技术》实验指导-EMSA验证蛋白与DNA的结合-笔记版

利用凝胶阻滞实验(EMSA)验证蛋白与DNA的结合一、实验原理及应用凝胶阻滞实验(Electrophoretic mobility shift assay,EMSA),是一种研究蛋白和核酸相互作用的技术。
蛋白质与放射性标记或生物素标记的探针结合后,形成的复合物在非变性聚丙烯酰胺凝胶电泳中的迁移率比自由探针的迁移率大大降低,表现为条带滞后。
凝胶阻滞实验具有简单、快捷、灵敏等优点,可用于检测DNA结合蛋白、RNA结合蛋白,并可通过加入特异性的抗体来进一步确定阻滞条带所结合的蛋白质。
结合定点突变技术,还可以用来研究蛋白结合核酸的关键位点。
许多生物学过程,如染色体的包装、维持及控制,都与蛋白质-DNA间的非特异性相互作用有关。
在古菌中发现的某些小分子量DNA结合蛋白具有与组蛋白类似的功能,按分子量不同分为7kDa、8kDa和10kDa三类。
本实验中所用的蛋白质Sul7d是来源于嗜酸热硫化叶菌(Sulfolobus acidocaldarius)中的7kDa 蛋白,能够和DNA非特异性结合。
本实验中利用EMSA实验验证体外表达的Sul7d蛋白和DNA的相互作用。
60 bp的DNA片段由公司合成。
部分DNA片段由生物素标记。
将纯化好的Sul7d蛋白与DNA底物共孵育,然后进行非变性聚丙烯酰胺凝胶电泳;将凝胶上的样品转移到NC膜,利用显色剂显影后即观察到目标蛋白与不同结构底物的结合情况。
生物素标记法采用随机引物标记法,利用DNA聚合酶,以目标DNA为模板,以随机引物为起始引物,将生物素标记的dUTP引入到合成的DNA探针中,产生高活性生物素标记的DNA片段。
生物素标记相对于同位素标记,操作方便、安全。
为了获得准确的实验结果,还应该在蛋白质-核酸混合液中分别加入不同浓度的“竞争剂”(competitor)。
竞争剂与探针序列相同,但没有被标记。
如果被检测的滞后条带随“竞争剂”浓度增加而逐渐减弱,说明蛋白质和探针之间的结合是特异的。
EMSA原理简介
EMSA实验技术及方法简介实验简介凝胶迁移或电泳迁移率实验(EMSA-electrophoretic mobility shift assay)是一种研究DNA 结合蛋白和其相关的DNA结合序列相互作用的技术,可用于定性和定量分析。
这一技术最初用于研究DNA结合蛋白,目前已用于研究RNA结合蛋白和特定的RNA序列的相互作用。
通常将纯化的蛋白和细胞粗提液和32P同位素标记的DNA或RNA探针一同保温,在非变性的聚丙烯凝胶电泳上,分离复合物和非结合的探针。
DNA-复合物或RNA-复合物比非结合的探针移动得慢。
同位素标记的探针依研究的结合蛋白的不同,可是双链或者是单链。
当检测如转录调控因子一类的DNA结合蛋白,可用纯化蛋白,部分纯化蛋白,或核细胞抽提液。
在检测RNA结合蛋白时,依据目的RNA结合蛋白的位置,可用纯化或部分纯化的蛋白,也可用核或胞质细胞抽提液。
竞争实验中采用含蛋白结合序列的DNA或RNA片段和寡核苷酸片段(特异),和其它非相关的片段(非特异),来确定DNA或RNA结合蛋白的特异性。
在竞争的特异和非特异片段的存在下,依据复合物的特点和强度来确定特异结合。
凝胶迁移或电泳迁移率检测(Electrophoretic Mobility Shift Assay, EMSA)是一种检测蛋白质和DNA序列相互结合的技术,最初用于研究DNA结合蛋白和其相关的DNA结合序列相互作用,可用于定性和定量分析。
这一技术目前已用于研究RNA结合蛋白和特定的RNA 序列的相互作用。
由于很多研究的TF不具有结合的特异性,所以即使发现TF和被研究的寡核苷酸探针结合,也不表示在体内该TF不能和其它寡核苷酸结合,运用一些生物信息学软件,可以模拟表示TF与基因启动子区寡核苷酸结合的具体情况,发现TF可以和启动子区PUTATIVE 结合。
同时,由于EMSA在体外不能模拟细胞内众多生物分子的相互作用,比如,某一TF 在细胞内由于受到其它TF的协同或者修饰后才能与寡核苷酸结合的话,那么在体外是不能重现这一结果的。
EMSA原理和方法
EMSA原理和方法EMSA(Electrophoretic Mobility Shift Assay,电泳迁移位移分析)是一种常用的分析DNA结合蛋白与DNA结合的技术。
它可以通过观察DNA是否与蛋白结合来研究蛋白与DNA的相互作用。
EMSA方法具有操作简便、成本低廉、结果可靠等优点,因此被广泛应用于生物医学、遗传学以及分子生物学等领域。
EMSA基于DNA与蛋白质所生成的复合物的电泳迁移速度与DNA的游离状态不同的原理。
DNA与蛋白质结合后形成的复合物较大,迁移速度较慢,而游离状态的DNA则迁移速度较快。
通过将待测的DNA与蛋白反应,将形成的DNA-蛋白复合物与游离状态的DNA物理上分离,然后经过聚丙烯酰胺凝胶电泳,进一步观察蛋白与DNA结合的结果。
EMSA方法步骤:1.准备工作:制备DNA探针和蛋白样品。
DNA探针可以是标记有放射性核素或融合具有染色剂/荧光信号的探针。
蛋白样品可以是纯化的蛋白或细胞提取物等。
2.反应:将DNA探针与蛋白样品一起孵育,使其发生结合反应。
孵育条件可以根据实验需要进行调节,如温度、时间和缓冲液组分等。
3.分离:将反应体系进行电泳分离。
一般来说,使用聚丙烯酰胺凝胶作为电泳介质,并在缓冲液中加入电解质以产生电场。
根据DNA与蛋白复合物的大小不同,可以调整电泳条件以实现适当的分辨率。
4.可视化:根据标记方式的不同,可以采用相应的方法进行检测。
对于放射性标记的DNA探针,可以使用放射自显影或闪烁计数方法来观察。
而对于使用染料或荧光标记的DNA探针,则可以使用紫外线照射或荧光成像等方式进行可视化。
EMSA应用:1.鉴定和验证DNA-蛋白相互作用:通过EMSA可以迅速判断DNA与特定蛋白是否发生结合,从而推断该蛋白是否与一些基因或DNA序列相关联。
2.研究DNA结合蛋白的特性:EMSA可以帮助研究DNA结合蛋白的亲和性、特异性以及结合位点等特性。
3.研究信号转导通路:EMSA可以用于检测信号转导通路中的激活因子与DNA的结合情况,从而了解这些激活因子在信号转导过程中的作用。
碧云天 EMSA突变探针-SP1 说明书
碧云天生物技术/Beyotime Biotechnology 订货热线:400-168-3301或800-8283301 订货e-mail :****************** 技术咨询:***************** 网址:碧云天网站 微信公众号EMSA 突变探针-SP1 (1.75μM)产品编号 产品名称包装 GS078MEMSA 突变探针-SP1 (1.75µM)60µl产品简介:EMSA 突变探针-SP1是用于EMSA(也称gel shift)研究的SP1 consensus oligonucleotide 的突变体。
可以作为EMSA 探针-SP1的阴性对照,用于EMSA 结合反应中突变探针的冷竞争反应等。
EMSA 突变探针-SP1的序列如下:5' -ATT CGA TCG GTT CGG GGC GAG C-3' 3' -TAA GCT AGC CAA GCC CCG CTC G-5'EMSA 突变探针-SP1中SP1的公认的结合位点发生了突变,从而使SP1无法和该突变探针结合。
在探针冷竞争反应中,正常的标记探针和SP1的结合的条带会被抑制;而在突变探针冷竞争反应(cold competition)中,正常的标记探针和SP1的结合的条带不会被抑制。
参考下图。
图1. 一个典型的EMSA/Gel- Shift 分析图1,阴性对照反应(标记探针);2,常规反应(含激活的目的转录因子的核蛋白+标记探针);3,探针冷竞争反应(含激活的目的转录因子的核蛋白+标记探针+标记探针100倍量的未标记探针);4,突变探针的冷竞争反应(含激活的目的转录因子的核蛋白+标记探针+标记探针100倍量的未标记突变探针);5,Super-shift 反应(含激活的目的转录因子的核蛋白+标记探针+目的转录因子的特异抗体)。
一个包装的突变探针,如果用于同位素标记EMSA 探针的突变探针冷竞争反应,可以进行30-60个突变探针的冷竞争反应。
生物素标记和化学发光检测技术在核酸杂交和EMSA中的应用
18
探针制备三之探针定量 探针制备三之探针定量
1. 500ul去离子水,260nm调零 2. 充分混匀2.5ul 探针和47.5ul 去离子水(即稀释20倍)分光光度计测 定OD260值 3. 定量计算公式:1 OD260 dsDNA = 50 μg/ml; 4. 样品浓度(μg/ml)=OD值X50X稀释倍数; 5. 样品浓度μg/ul= OD260值X50X20/1000 6. 样品浓度ng/ul= OD260值X50X20(注:如果稀释20倍,实际测定的 OD260值应该在0.02-0.05之间) Note:大多数情况下,由于各实验室用来测定核酸的仪器不同,检测灵 Note: 敏度不同以及样品中的一些干扰物质,测出的OD值往往是0甚至是负值 ,如果出现这种情况,再进行核酸定量没有实际价值,因此,根据经验 ,保守估计,在每次至少合成1ug探针的前提下,在杂交时,探针的用 量按照每ul含有20ng探针来使用,即每毫升杂交液加入变性的纯化过的 探针1.5-2ul.
22
对照DNA点杂交 对照DNA点杂交 DNA
备用试剂:0.1N NaOH 煮沸变性DNA变性成单链( 对照DNA,5μl,250ng/μl) 准备生物素标记的对照探针或阳性样品探针(见探针标记,纯化和定量 ) 准备目标膜(注意:推荐使用带正电尼龙膜,需带无粉手套并用乙醇净 化的镊子拿膜。) • 0.1N NaOH稀释变性DNA得到1,0.5,0.25,0.125,0.0625, 0.0312,和0.015ng/μl稀释梯度。 • 在膜上平行点两点。点前最好把膜预洗一下,半干的时候点,但 干点同样有用。 • 用1X TE轻轻漂洗膜(~10秒),微波炉高火加热2分钟,紫外交 联(自动交联)或烘干固定。注:如果没有紫外交联仪,则可以 注 将膜置于80度温箱烘烤2-3小时,可达到固定目的 • 交联固定完,用0.1%SDS预湿润膜,进入下面预杂交,杂交以及 底物孵育和曝光 杂交,严谨洗膜和封闭,抗体孵育,洗膜,平衡,底物孵育以及曝光见 前所述
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生物素标记EMSA探针-AP1
产品简介:
生物素标记EMSA探针-AP1是用于EMSA(也称gel shift)研究的并经生物素(Biotin)标记的AP1 consensus oligonucleotide。
这个生物素标记的双链寡核苷酸含有公认的AP1结合位点,可以用作EMSA研究时的探针。
AP1 consensus oligo的序列如下:
5’-CGC TTG ATG ACT CAG CCG GAA-3’
3’-GCG AAC TAC TGA GTC GGC CTT-5’
本生物素标记EMSA探针已经过纯化,可以直接用于EMSA结合反应。
本生物素标记EMSA探针可以和碧云天的化学发光法EMSA试剂盒(GS009)配套使用。
一个包装的生物素标记探针可以进行约200-400个样品的EMSA检测。
保存条件:
-20℃保存,一年有效。
注意事项:
避免加热到40℃以上,温度过高会导致双链DNA探针解聚成单链。
而单链无法用于EMSA研究。
对于基于生物素标记的EMSA检测的详细操作可以参考碧云天的化学发光法EMSA试剂盒(GS009)的使用说明。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1.本生物素标记EMSA探针用于EMSA结合反应时,参考如下步骤进行:
A.如下设置EMSA结合反应:
阴性对照反应:
Nuclease-Free Water 7-7.5µl EMSA/Gel-Shift 结合缓冲液(5X) 2µl 细胞核蛋白或纯化的转录因子 0µl 生物素标记探针 0.5-1µl 总体积 10µl
探针冷竞争反应:
Nuclease-Free Water 4-4.5µl EMSA/Gel-Shift 结合缓冲液(5X) 2µl 细胞核蛋白或纯化的转录因子 2µl 未标记的探针 1µl 生物素标记探针 0.5-1µl 总体积 10µl
Super-shift反应:
Nuclease-Free Water 4-4.5µl EMSA/Gel-Shift 结合缓冲液(5X) 2µl 细胞核蛋白或纯化的转录因子 2µl 目的蛋白特异抗体 1µl 生物素标记探针 0.5-1µl 总体积 10µl 样品反应:
Nuclease-Free Water 5-5.5µl EMSA/Gel-Shift 结合缓冲液(5X) 2µl 细胞核蛋白或纯化的转录因子 2µl 生物素标记探针 0.5-1µl 总体积 10µl
突变探针的冷竞争反应:
Nuclease-Free Water 4-4.5µl EMSA/Gel-Shift 结合缓冲液(5X) 2µl 细胞核蛋白或纯化的转录因子 2µl 未标记的突变探针 1µl 生物素标记探针 0.5-1µl 总体积 10µl
注:生物素标记EMSA探针的推荐用量为每个反应0.5微升,如果检测出来的目的蛋白的EMSA条带偏弱,可以适当加大生物素标记EMSA探针的用量至0.75微升或1微升。
注2:对于冷竞争时使用的未标记的探针或未标记的突变探针,使用量可以根据实际情况调整使用的体积。
推荐的用于冷竞争的未标记的探针或突变探针的用量为生物素标记探针的50-100倍。
B.按照上述顺序依次加入各种试剂,在加入标记好的探针前先混匀,并且室温(20-25℃)放置10分钟,从而消除可能发
生的探针和蛋白的非特异性结合,或者让冷探针优先反应。
然后加入标记好的探针,混匀,室温(20-25℃)放置20分钟。
C.加入1µl EMSA/Gel-Shift上样缓冲液(无色,10X),混匀后立即上样。
注意:有些时候溴酚蓝会影响蛋白和DNA的结
合,建议尽量使用无色的EMSA/Gel-Shift上样缓冲液。
如果对于使用无色上样缓冲液在上样时感觉到无法上样,可以在无色上样缓冲液里面添加极少量的蓝色的上样缓冲液,至可以观察到蓝颜色即可。
2.对于基于生物素标记的EMSA检测的更多详细操作可以参考碧云天的化学发光法EMSA试剂盒(GS009)的使用说明。
使用本产品的文献:
1.Yang W, Lu CL, Yu FQ, Liu T, Hu ZY, Liu YX
Mitogen-activated protein kinase regulates FSH-induced expression of tissue-type plasminogenactivator through an activator protein 1 response element. Endocrine. 2008 Aug-Dec;34(1-3):101-7.
2. Ding RY, Zhao DM, Zhang ZD, Guo RX, Ma XC
Pretreatment of Rho kinase inhibitor inhibits systemic inflammation and prevents endotoxin-induced acute lung injury in mice.
J Surg Res. 2011 Dec;171(2):e209-14.。
