最新高考生物重要考点双向细目表
高中生物知识双向细目表

高中生物知识双向细目表高三生物知识点双向细目表考试次数第1次第2次第3次第4次第5次第6次第7次第8次第9次第10次第11次第12次第13次第14次第15次第16次1-1细胞的分子组成(1) 蛋白质、核酸的结构和功能(2) 糖类、脂质的种类和作用(3) 水和无机盐的作用1-2 细胞的结构(1) 细胞学说的建立过程(2) 原核细胞和真核细胞的异同(3) 细胞膜系统的结构和功能(4) 主要细胞器的结构和功能(5) 细胞核的结构和功能1-3 细胞的代谢(1) 物质出入细胞的方式(2) 酶在代谢中的作用(3) ATP 在能量代谢中的作用(4) 光合作用的基本过程(5) 影响光合作用速率的环境因素(6) 细胞呼吸1-4 细胞的增殖(1) 细胞的生长和增殖的周期性(2) 细胞的无丝分裂(3) 细胞的有丝分裂1-5 细胞的分化、衰老和凋亡(1) 细胞的分化(2) 细胞的全能性(3) 细胞的衰老和凋亡以及与人体健康的关系(4) 癌细胞的主要特征及防治2-1遗传的细胞基础(1) 细胞的减数分裂(2) 动物配子的形成过程(3) 动物的受精过程2-2 遗传的分子基础(1) 人类对遗传物质的探索过程(2) DNA 分子结构的主要特点(3) 基因的概念(4) DNA 分子的复制(5) 遗传信息的转录和翻译2-3 遗传的基本规律(1) 孟德尔遗传实验的科学方法(2) 基因分离定律和自由组合定律(3) 基因与性状的关系(4) 伴性遗传2-4 生物的变异(1) 基因重组及其意义(2) 基因突变的特征和原因(3) 染色体结构变异和数目变异(4) 生物变异在育种上的应用(5) 转基因食品的安全2-5 人类遗传病(1) 人类遗传病的类型(2) 人类遗传病的监测和预防(3) 人类基因组计划及意义2-6 生物的进化(1) 现代生物进化理论的主要内容(2) 生物进化与生物多样性的形成3-1 植物的激素调节(1) 植物生长素的发现和作用(2) 其他植物激素(3) 植物激素的应用3-2 动物生命活动的调节(1) 人体神经调节的结构基础和调节过程(2) 神经冲动的产生、传导和传递(3) 人脑的高级功能(4) 脊椎动物激素的调节(5) 脊椎动物激素在生产中的应用3-3 人体的内环境与稳态(1) 稳态的生理意义(2) 神经、体液调节在维持稳态中的作用(3) 体温调节、水盐调节和血糖调节(4) 人体免疫系统在维持稳态中的作用(5) 艾滋病的流行和预防3-4 种群和群落(1) 种群的特征(2) 种群的数量变化(3) 群落的结构特征(4) 群落的演替3-5生态系统(1) 生态系统的结构(2) 生态系统中物质循环和能量流动的基本规律及应用(3) 生态系统中的信息传递(4) 生态系统的稳定性3-6 生态环境的保护(1) 人口增长对环境的影响(2) 全球性的环境问题(3) 生物多样性保护的意义和措施4-1实验(1) 观察DNA、RNA 在细胞中的分布(2) 检测生物组织中还原糖、脂肪和蛋白质(3) 用显微镜观察多种多样的细胞(4) 观察线粒体和叶绿体(5) 通过模拟实验探究膜的透性(6) 观察植物细胞的质壁分离和复原(7) 探究影响酶活性的因素(8) 叶绿体色素的提取和分离(9) 探究酵母菌的呼吸方式(10) 观察细胞的有丝分裂(11) 模拟探究细胞表面积与体积的关系4-2 遗传与进化(1) 观察细胞的减数分裂(2) 低温诱导染色体加倍(3) 调查常见的人类遗传病4-3 稳态与环境(1) 探究植物生长调节剂对扦插枝条生根的作用(2) 模拟尿糖的检测(3) 探究培养液中酵母菌数量的动态变化(4) 土壤中动物类群丰富度的研究(5) 探究水族箱(或鱼缸) 中群落的演替5-1 微生物的利用(1) 微生物的分离和培养(2) 某种微生物数量的测定(3) 培养基对微生物的选择作用(4) 利用微生物发酵来生产特定的产物以及微生物在其他方面的应用5-2酶的应用(1) 酶活力测定的一般原理和方法(2) 酶在食品制造和洗涤等方面的应用(3) 制备和应用固相化酶5-3 生物技术在食品加工及其他方面的应用(1) 从生物材料中提取某些特定的成分(2) 运用发酵加工食品的基本方法(3) 测定食品加工中可能产生的有害物质(4) 蛋白质的提取和分离6-1基因工程(1) 基因工程的诞生(2) 基因工程的原理及技术(含PCR 技术)(3) 基因工程的应用(4) 蛋白质工程6-2 克隆技术(1) 植物的组织培养(2) 动物细胞培养与体细胞克隆(3) 细胞融合与单克隆抗体6-3 胚胎工程(1) 动物胚胎发育的基本过程与胚胎工程的理论基础(2) 胚胎干细胞的移植(3) 胚胎工程的应用6-4 生物技术的安全性和伦理问题(1) 转基因生物的安全性(2) 生物武器对人类的威胁(3) 生物技术中的伦理问题6-5 生态工程(1) 简述生态工程的原理(2) 生态工程的实例7-1基因工程DNA 的粗提取与鉴定。
高中生物知识双向细目表

(1) 转基因生物的安全性
(2) 生物武器对人类的威胁
(3) 生物技术中的伦理问题
6-5 生态工程
(1) 简述生态工程的原理
(2) 生态工程的实例
7-1基因工程
DNA 的粗提取与鉴定
(3) 细胞膜系统的结构和功能
(4) 主要细胞器的结构和功能
(5) 细胞核的结构和功能
1-3 细胞的代谢
(1) 物质出入细胞的方式
(2) 酶在代谢中的作用
(3) ATP 在能量代谢中的作用
(4) 光合作用的基本过程
(5) 影响光合作用速率的环境因素
(6) 细胞呼吸
1-4 细胞的增殖
(1) 细胞的生长和增殖的周期性
(6) 观察植物细胞的质壁别离和复原
(7) 探究影响酶活性的因素
(8) 叶绿体色素的提取和别离
(9) 探究酵母菌的呼吸方式
(10) 观察细胞的有丝分裂
(11) 模拟探究细胞外表积与体积的关系
4-2 遗传与进化
(1) 观察细胞的减数分裂
(2) 低温诱导染色体加倍
(3) 调查常见的人类遗传病
4-3 稳态与环境
(3) 体温调节、水盐调节和血糖调节
(4) 人体免疫系统在维持稳态中的作用
(5) 艾滋病的流行和预防
3-4 种群和群落
(1) 种群的特征
(2) 种群的数量变化
(3) 群落的结构特征
(4) 群落的演替
3-5生态系统
(1) 生态系统的结构
(2) 生态系统中物质循环和能量流动的基本规律及应用
(3) 生态系统中的信息传递
(2) 其他植物激素
(3) 植物激素的应用
3-2 动物生命活动的调节
高中生物双向细目表

高中生物双向细目表
一、植物结构与功能
- 植物细胞的结构与功能
- 植物组织的类型与功能
- 植物器官的结构与功能
- 植物生殖的过程与机制
二、动物结构与功能
- 动物细胞的结构与功能
- 动物组织的类型与功能
- 脊椎动物的器官结构与功能
- 动物生殖的过程与机制
三、遗传与进化
- 基因与遗传变异
- 遗传与表型特征
- 进化的机制与证据
- 物种形成与演化
四、生物多样性
- 物种多样性的保护与维持
- 生物圈与生态系统
- 生态位与生物相互关系
- 物种适应与演化
五、人体与健康
- 人体组织器官的结构与功能
- 消化与营养
- 呼吸与循环
- 免疫与疾病
六、生物技术与实践
- 生物技术的原理与应用
- 生物资源与可持续利用
- 生物制品的生产与应用
- 生物安全与伦理
以上是高中生物双向细目表的内容,涵盖了植物结构与功能、动物结构与功能、遗传与进化、生物多样性、人体与健康以及生物
技术与实践等主题。
通过学习这些知识,可以帮助学生全面了解生物学的基本概念和原理,培养科学思维和探索精神。
高中学习生物知识双向细目表格
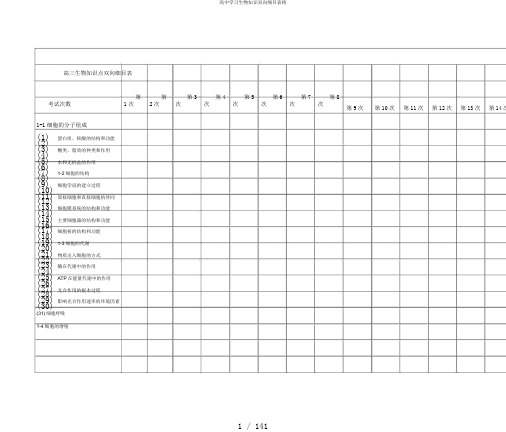
高三生物知识点双向细目表考试次数第1次第2次第3次第4次第5次第6次第7次第8次第9次第10次第11次第12次第13次第14次1-1细胞的分子组成(1)蛋白质、核酸的结构和功能(2)(3)糖类、脂质的种类和作用(4)(5)水和无机盐的作用(6)(7)1-2细胞的结构(8)(9)细胞学说的建立过程(10)(11)原核细胞和真核细胞的异同(12)(13)细胞膜系统的结构和功能(14)(15)主要细胞器的结构和功能(16)(17)细胞核的结构和功能(18)(19)1-3细胞的代谢(20)(21)物质出入细胞的方式(22)(23)酶在代谢中的作用(24)(25)ATP在能量代谢中的作用(26)(27)光合作用的根本过程(28)(29)影响光合作用速率的环境因素(30)(31)细胞呼吸1-4细胞的增殖(1)细胞的生长和增殖的周期性(2)(3)细胞的无丝分裂(4)(5)细胞的有丝分裂(6)(7)1-5细胞的分化、衰老和凋亡(8)(9)细胞的分化(10)(11)细胞的全能性(12)(13)细胞的衰老和凋亡以及与人体健康的关系(14)(15)癌细胞的主要特征及防治(16)(17)2-1遗传的细胞根底(18)(19)细胞的减数分裂(20)(21)动物配子的形成过程(22)(23)动物的受精过程(24)(25)2-2遗传的分子根底(26)(27)人类对遗传物质的探索过程(28)(29)DNA分子结构的主要特点(30)(31)基因的概念(32)(33)DNA分子的复制(34)(35)遗传信息的转录和翻译2-3遗传的根本规律(1)孟德尔遗传实验的科学方法(2)(3)基因别离定律和自由组合定律(4)(5)基因与性状的关系(6)(7)伴性遗传(8)(9)2-4生物的变异(10)(11)基因重组及其意义(12)(13)基因突变的特征和原因(14)(15)染色体结构变异和数目变异(16)(17)生物变异在育种上的应用(18)(19)转基因食品的平安(20)(21)2-5人类遗传病(22)(23)人类遗传病的类型(24)(25)人类遗传病的监测和预防(26)(27)人类基因组方案及意义(28)(29)2-6生物的进化(30)(31)现代生物进化理论的主要内容(32)(33)生物进化与生物多样性的形成(34)(35)3-1植物的激素调节(36)(37)植物生长素的发现和作用(2)其他植物激素(1)植物激素的应用(2)(3)3-2动物生命活动的调节(4)(5)人体神经调节的结构根底和调节过程(6)(7)神经冲动的产生、传导和传递(8)(9)人脑的高级功能(10)(11)脊椎动物激素的调节(12)(13)脊椎动物激素在生产中的应用(14)(15)3-3人体的内环境与稳态(16)(17)稳态的生理意义(18)(19)神经、体液调节在维持稳态中的作用(20)(21)体温调节、水盐调节和血糖调(22)(23)节(24)(25)人体免疫系统在维持稳态中的作用(26)(27)艾滋病的流行和预防(28)(29)3-4种群和群落(30)(31)种群的特征(2)种群的数量变化(1)群落的结构特征(2)(3)群落的演替(4)(5)3-5生态系统(6)(7)生态系统的结构(8)(9)生态系统中物质循环和能量流动的根本规律及应用(10)(11)生态系统中的信息传递(12)(13)生态系统的稳定性(14)(15)3-6生态环境的保护(16)(17)人口增长对环境的影响(18)(19)全球性的环境问题(20)(21)生物多样性保护的意义和措施(22)(23)4-1实验(24)(25)观察DNA、RNA在细胞中的分布(26)(27)检测生物组织中复原糖、脂肪和蛋白质(28)(29)用显微镜观察多种多样的细胞(30)(31)观察线粒体和叶绿体(5)通过模拟实验探究膜的透性(1)观察植物细胞的质壁别离和复(2)(3)原(4)(5)探究影响酶活性的因素(6)(7)叶绿体色素的提取和别离(8)(9)探究酵母菌的呼吸方式(10)(11)观察细胞的有丝分裂(12)(13)模拟探究细胞外表积与体积(14)(15)的关系(16)(17)4-2遗传与进化(18)(19)观察细胞的减数分裂(20)(21)低温诱导染色体加倍(22)(23)调查常见的人类遗传病(24)(25)4-3稳态与环境(26)(27)探究植物生长调节剂对扦插枝条生根的作用(28)(29)模拟尿糖的检测(30)(31)探究培养液中酵母菌数量的动态变化(32)(33)土壤中动物类群丰富度的研究(5)探究水族箱(或鱼缸)中群落的(1)演替(2)(3)5 -1微生物的利用(4)(5)微生物的别离和培养(6)(7)某种微生物数量的测(8)(9)培养基对微生物的选择作用(10)(11)利用微生物发酵来生产特定的产物以及微生物方面的应用(12)(13)5 -2酶的应用(14)(15)酶活力测定的一般原理和方法(16)(17)酶在食品洗涤等方面的应用(18)(19)制备和应用固相化酶(20)(21)5 -3生物技术在食品加工及(22)(23)面的应用(24)(25)从生物材料中提取某些特定的成分(26)(27)运用发酵加工食品的根本(28)(29)测定食品加工中可能产生的有害物质(4)蛋白质的提取和别离(1)6-1基因工程(2)(3)基因工程的诞生(4)(5)基因工程的原理及技术〔含(6)(7)PCR技术〕(8)(9)基因工程的应用(10)(11)蛋白质工程(12)(13)6-2克隆技术(14)(15)植物的组织培养(16)(17)动物细胞培养与体细胞克隆(18)(19)细胞融合与单克隆抗体(20)(21)6-3胚胎工程(22)(23)动物胚胎发育的根本过程与胚胎工程的理论根底(24)(25)胚胎干细胞的移植(26)(27)胚胎工程的应用(28)(29)6-4生物技术的平安性和伦理问题(30)(31)转基因生物的平安性(32)(33)生物武器对人类的威胁(34)(35)生物技术中的伦理问题6-5生态工程。
高考生物双向细目表

高考生物双向细目表细目一:分子与细胞生物学1.1 生物大分子的组成与结构1.1.1 糖类1.1.2 脂类1.1.3 蛋白质1.1.4 核酸1.1.5 高分子化合物的功能与作用1.1.6 生物分子的合成与降解1.2 细胞结构与功能1.2.1 细胞的组成与分类1.2.2 细胞膜的结构与功能1.2.3 细胞壁的结构与功能1.2.4 细胞质的组成与功能1.2.5 细胞核的结构与功能1.2.6 细胞器的结构与功能1.3 细胞代谢与能量转化1.3.1 酶的特性与作用1.3.2 细胞呼吸过程与能量释放1.3.3 光合作用的过程与能量转化1.3.4 发酵过程与能量转化细目二:生命的遗传与变异2.1 遗传物质的结构与功能2.1.1 DNA 结构2.1.2 RNA 结构2.1.3 遗传物质的复制与传递2.2 基因的组合与表达2.2.1 基因的组合形式2.2.2 基因的调控与表达2.2.3 基因突变与遗传变异2.3 遗传与进化2.3.1 遗传的基本规律2.3.2 遗传变异的来源与意义2.3.3 进化的基本概念与理论细目三:生命系统与生物多样性3.1 生物的层次与分类3.1.1 生物的层次结构3.1.2 生物的分类与命名3.2 动植物的结构与功能3.2.1 动物组织的结构与功能3.2.2 植物组织的结构与功能3.2.3 动植物器官的结构与功能3.3 生命的起源与进化3.3.1 生命起源的理论与证据3.3.2 生物进化的过程与机制3.3.3 物种形成与多样性细目四:生物与环境4.1 生物圈与生态系统4.1.1 生态学的基本概念与原理4.1.2 生态系统的组成与结构4.1.3 生态因子与生态位4.2 生物的适应与演替4.2.1 生物的适应与生存策略4.2.2 生物的演替与群落发展4.2.3 生物多样性的维持与保护4.3 生物与环境的相互作用4.3.1 生物间的相互关系4.3.2 生物与环境的平衡与失衡4.3.3 生物资源的利用与保护细目五:生物技术与社会5.1 生物工程与基因工程5.1.1 基因工程的原理与技术5.1.2 生物工程在农业与医学上的应用5.1.3 基因工程的风险与伦理问题5.2 生物技术与人类健康5.2.1 疾病的诊断与治疗5.2.2 克隆技术与干细胞研究5.2.3 基因检测与个性化医疗5.3 生物技术与农业发展5.3.1 转基因技术与农作物种质改良5.3.2 生物农药与农业生产5.3.3 生态农业与可持续发展细目六:人类与健康6.1 人体的结构与功能6.1.1 人体器官系统的结构与功能6.1.2 人体生长发育与老化6.1.3 人体的免疫与抗病能力6.2 遗传与人类健康6.2.1 遗传病的分类与诊断6.2.2 遗传疾病防治与咨询6.2.3 遗传因素与环境因素在疾病中的相互作用6.3 环境因素与人类健康6.3.1 环境污染与健康危害6.3.2 饮食与营养健康6.3.3 生活方式与心理健康以上是一份高考生物双向细目表,内容涵盖了分子与细胞生物学、生命的遗传与变异、生命系统与生物多样性、生物与环境、生物技术与社会以及人类与健康等方面的知识点。
202X新高考生物考点细目表

千里之行,始于足下。
202X新高考生物考点细目表202X新高考生物考点细目表(假设总计)1. 细胞结构与功能1.1 细胞的基本结构1.2 细胞器的结构和功能1.3 细胞的代谢活动1.4 细胞的运动和分裂2. 遗传与进化2.1 遗传的基本规律2.2 DNA和RNA的结构和功能2.3 遗传信息的复制和转录2.4 遗传信息的转换和表达2.5 进化的基本理论2.6 进化的证据和方式2.7 物种起源和演化2.8 生物多样性与生物资源保护3. 生物分类与系统演化3.1 生物分类的基本原则3.2 生物分类的方法和技术3.3 动物和植物的分类3.4 生物系统演化的基本过程3.5 生物系统演化的特点和规律4. 植物的生命周期与繁殖第1页/共3页锲而不舍,金石可镂。
4.1 植物的结构与功能4.2 植物的生长与发育4.3 植物的繁殖方式与生命周期5. 动物的生命活动与调节5.1 動物的结构和功能5.2 動物的繁殖和发育5.3 動物的营养5.4 動物的运动和行为5.5 動物的调节和免疫6. 生物科学与生物技术6.1 生物科学的研究方法和技术6.2 生物科学的应用6.3 基因工程和基因编辑技术6.4 细胞工程和组织工程技术6.5 生物科学对社会的影响和伦理问题7. 生物与环境7.1 生物适应环境的特点和机制7.2 生物与生物圈的相互关系7.3 生物对环境的影响7.4 生态系统和生物多样性的保护8. 生命伦理与健康8.1 生命伦理的基本原则和价值观8.2 生命伦理与科技发展的关系8.3 生命伦理的应用8.4 健康与疾病的基本概念8.5 健康管理与健康促进千里之行,始于足下。
以上是202X新高考生物考点细目表,涵盖了生物学中的各个重要知识点。
学生在备考时应根据该细目表有计划地进行学习和复习,并进行相关练习和实验操作,以提高对生物学的理解和运用能力。
第3页/共3页。
重点高中生物知识双向细目表

重点高中生物知识双向细目表————————————————————————————————作者:————————————————————————————————日期:高三生物知识点双向细目表考试次数第1次第2次第3次第4次第5次第6次第7次第8次第9次第10次第11次第12次第13次第14次第15次第16次1-1细胞的分子组成(1) 蛋白质、核酸的结构和功能(2) 糖类、脂质的种类和作用(3) 水和无机盐的作用1-2 细胞的结构(1) 细胞学说的建立过程(2) 原核细胞和真核细胞的异同(3) 细胞膜系统的结构和功能(4) 主要细胞器的结构和功能(5) 细胞核的结构和功能1-3 细胞的代谢(1) 物质出入细胞的方式(2) 酶在代谢中的作用(3) ATP 在能量代谢中的作用(4) 光合作用的基本过程(5) 影响光合作用速率的环境因素(6) 细胞呼吸1-4 细胞的增殖(1) 细胞的生长和增殖的周期性(2) 细胞的无丝分裂(3) 细胞的有丝分裂1-5 细胞的分化、衰老和凋亡(1) 细胞的分化(2) 细胞的全能性(3) 细胞的衰老和凋亡以及与人体健康的关系(4) 癌细胞的主要特征及防治2-1遗传的细胞基础(1) 细胞的减数分裂(2) 动物配子的形成过程(3) 动物的受精过程2-2 遗传的分子基础(1) 人类对遗传物质的探索过程(2) DNA 分子结构的主要特点(3) 基因的概念(4) DNA 分子的复制(5) 遗传信息的转录和翻译2-3 遗传的基本规律(1) 孟德尔遗传实验的科学方法(2) 基因分离定律和自由组合定律(3) 基因与性状的关系(4) 伴性遗传2-4 生物的变异(1) 基因重组及其意义(2) 基因突变的特征和原因(3) 染色体结构变异和数目变异(4) 生物变异在育种上的应用(5) 转基因食品的安全2-5 人类遗传病(1) 人类遗传病的类型(2) 人类遗传病的监测和预防(3) 人类基因组计划及意义2-6 生物的进化(1) 现代生物进化理论的主要内容(2) 生物进化与生物多样性的形成3-1 植物的激素调节(1) 植物生长素的发现和作用(2) 其他植物激素(3) 植物激素的应用3-2 动物生命活动的调节(1) 人体神经调节的结构基础和调节过程(2) 神经冲动的产生、传导和传递(3) 人脑的高级功能(4) 脊椎动物激素的调节(5) 脊椎动物激素在生产中的应用3-3 人体的内环境与稳态(1) 稳态的生理意义(2) 神经、体液调节在维持稳态中的作用(3) 体温调节、水盐调节和血糖调节(4) 人体免疫系统在维持稳态中的作用(5) 艾滋病的流行和预防3-4 种群和群落(1) 种群的特征(2) 种群的数量变化(3) 群落的结构特征(4) 群落的演替3-5生态系统(1) 生态系统的结构(2) 生态系统中物质循环和能量流动的基本规律及应用(3) 生态系统中的信息传递(4) 生态系统的稳定性3-6 生态环境的保护(1) 人口增长对环境的影响(2) 全球性的环境问题(3) 生物多样性保护的意义和措施4-1实验(1) 观察DNA、RNA 在细胞中的分布(2) 检测生物组织中还原糖、脂肪和蛋白质(3) 用显微镜观察多种多样的细胞(4) 观察线粒体和叶绿体(5) 通过模拟实验探究膜的透性(6) 观察植物细胞的质壁分离和复原(7) 探究影响酶活性的因素(8) 叶绿体色素的提取和分离(9) 探究酵母菌的呼吸方式(10) 观察细胞的有丝分裂(11) 模拟探究细胞表面积与体积的关系4-2 遗传与进化(1) 观察细胞的减数分裂(2) 低温诱导染色体加倍(3) 调查常见的人类遗传病4-3 稳态与环境(1) 探究植物生长调节剂对扦插枝条生根的作用(2) 模拟尿糖的检测(3) 探究培养液中酵母菌数量的动态变化(4) 土壤中动物类群丰富度的研究(5) 探究水族箱(或鱼缸) 中群落的演替5-1 微生物的利用(1) 微生物的分离和培养(2) 某种微生物数量的测定(3) 培养基对微生物的选择作用(4) 利用微生物发酵来生产特定的产物以及微生物在其他方面的应用5-2酶的应用(1) 酶活力测定的一般原理和方法(2) 酶在食品制造和洗涤等方面的应用(3) 制备和应用固相化酶5-3 生物技术在食品加工及其他方面的应用(1) 从生物材料中提取某些特定的成分(2) 运用发酵加工食品的基本方法(3) 测定食品加工中可能产生的有害物质(4) 蛋白质的提取和分离6-1基因工程(1) 基因工程的诞生(2) 基因工程的原理及技术(含PCR 技术)(3) 基因工程的应用(4) 蛋白质工程6-2 克隆技术(1) 植物的组织培养(2) 动物细胞培养与体细胞克隆(3) 细胞融合与单克隆抗体6-3 胚胎工程(1) 动物胚胎发育的基本过程与胚胎工程的理论基础(2) 胚胎干细胞的移植(3) 胚胎工程的应用6-4 生物技术的安全性和伦理问题(1) 转基因生物的安全性(2) 生物武器对人类的威胁(3) 生物技术中的伦理问题6-5 生态工程(1) 简述生态工程的原理(2) 生态工程的实例7-1基因工程DNA 的粗提取与鉴定。
高考生物知识点双向细目表

高考生物知识点双向细目表高考生物知识清单分类:I。
细胞的结构和功能1.蛋白质和核酸的结构和功能2.糖类和脂质的种类和作用3.水和无机盐的作用4.细胞学说的建立过程5.多种多样的细胞6.生物膜系统的结构和功能7.主要细胞器的结构和功能8.细胞核的结构和功能9.物质进入细胞的方式10.酶在代谢中的作用11.ATP在能量代谢中的作用12.光合作用的基本过程13.影响光合作用速率的环境因素14.细胞呼吸II。
细胞的代谢15.细胞的生长和增殖的周期性16.细胞的无丝分裂17.细胞的有丝分裂18.细胞的分化19.细胞的全能性20.细胞的衰老和凋亡与人体健康的关系21.癌细胞的主要特征及防治22.细胞的减数分裂23.动物配子的形成过程24.动物的受精过程25.人类对遗传物质的探索过程III。
遗传基础26.DNA分子结构的主要特点27.基因的概念28.DNA分子的复制29.遗传信息的转录和翻译30.___遗传实验的科学方法31.基因的分离定律和自由组合定律32.基因与性状的关系33.伴性遗传34.基因重组及其意义35.基因突变的特征和原因36.染色体结构变异和数目变异37.生物变异在育种上的应用38.转基因食品的安全39.人类遗传病的类型40.人类遗传病的监测和预防41.人类基因组计划及意义IV。
生物的进化42.现代生物进化理论的主要内容43.生物进化与生物多样性的形成V。
植物激素调节44.植物生长素的发现和作用45.其他植物激素46.植物激素的应用VI。
动物生命活动的调节47.人体神经调节的结构基础和调节过程48.神经冲动的产生和传导49.人脑的高级功能50.脊椎动物激素在生产中的应用VII。
生物的变异51.稳态的生理意义52.神经、体液调节在维持稳态中的作用53.体温调节、水盐调节和血糖调节54.人体免疫系统在维持稳态中的作用55.艾滋病的流行和预防VIII。
种群生态学56.种群的特征57.种群的数量变化58.群落的结构特征59.群落的演替改写后的文章:高考生物知识清单I。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
说明细胞呼吸的原理和意义,列举其在生产和生活中的应用(粮食储存——干燥、低温、低氧(充入氮气)、充入二氧化碳等)
通过实验,探讨酵母菌细胞的呼吸方式
1.4
细
胞
的
增
殖
(3)
细胞的生长和增殖的周期性
Ⅰ
√
简述细胞生长的概念
说出真核细胞的两种主要分裂方式
说出细胞不能无限长大和细胞也不是越小越好的原因
尝试探究影响光合作用强度的环境因素,学习科学研究的一般方法
细胞呼吸
Ⅱ
√
概述细胞呼吸的概念
举例说出有氧呼吸和无氧呼吸
阐明有氧呼吸和无氧呼吸过程(场所、过程(物质、能量变化)、反应式)
比较有氧呼吸和无氧呼吸的异同,学会运用对比的方法理解相关的生物学知识
阐明呼吸作用的本质,了解细胞呼吸与细胞供能的关系
应用三个反应方程式计算能量的释放量
Ⅱ
√
说出核酸的元素组成和基本单位(连接方式)
列举核酸的种类及主要存在部位
DNA的平面结构,碱基互补配对原则的应用和计算
DNA的空间结构及特点、功能、结构和功能的关系(多样性原因)
认同核酸是细胞内携带遗传信息的物质,在生物体的遗传、变异和蛋白质的生物合成过程中具有极其重要的作用(核酸功能)
知道DNA和RNA的分布和功能(、区别与联系),RNA的分类
解释蛋白质分子结构多样性的原因
概述蛋白质的在生命活动中的主要功能
列举导致蛋白质变性的原因(变性的结果)
认同蛋白质的结构和功能的关系,清楚蛋白质结构和功能的多样性(统一性)
简述鉴定蛋白质的实验原理,尝试检测组织中的蛋白质的一般方法
(合成蛋白质在细胞内外分布、细胞核内作用、细胞膜成分的更新)
核酸的结构和功能
Ⅱ
√
识别线粒体、叶绿体的形态
说出线粒体、叶绿体的结构和功能
其他细胞器的结构和功能
Ⅰ
√
识别内质网、核糖体、高尔基体、中心体、液泡、溶酶体的形态
说出内质网、核糖体、高尔基体、中心体、液泡、溶酶体的结构和功能
制作临时装片,使用高倍显微镜观察叶绿体和线粒体
确立“结构与功能相统一、局部与整体相统一”的观点
细胞核的结构与功能
举例说出脂质是细胞内良好的贮能物质
列举出脂肪、类脂和固醇的主要作用。
简述鉴定脂肪的实验原理,尝试生物组织中脂肪的检测方法
水和无机盐的作用
Ⅰ
√
说出水在细胞中的含量、存在形式和作用
说出I、Mg、Fe、Na、K等离子在生物体中的主要作用
1.2
细
胞
的
结
构
(6)
细胞学说建立的过程
Ⅰ
√
细胞的发现
分析细胞学说建立的过程(主要时期、代表性科学家)
最新高考生物重要考点双向细目表
知识内容
考纲要求
课标要求
考 点 细 化
了解
理解
应用
必 修 1
1.1
细
胞
的
分
子
组
成
(5)
蛋白质的结构和功能
Ⅱ
√
说出蛋白质的(含量)元素组成和基本单位
列举氨基酸的种类
写出氨基酸的分子结构通式并说明其结构特点
简述氨基酸通过脱水缩合形成蛋白质的过程(计算、能量)
简述蛋白质的化学结构(肽键,肽链)和空间结构
举例说出细胞增殖的意义
举例说出真核细胞增殖的方式
简述细胞周期的概念,指出其内涵
细胞的无丝分裂
Ⅰ
√
描述细胞无丝分裂的过程和特点
举例说出进行无丝分裂的细胞
细胞的有丝分裂
Ⅱ
√
概述有丝分裂的过程,识别并准确描述细胞有丝分裂各时期的重要特征
描述细胞膜的流动镶嵌模型
体验用红细胞制备细胞膜的方法与过程
举例说明细胞膜的功能 认同细胞膜作为系统的边界,对于细胞这个生命系统的重要意义
说出细胞膜具有流动性的原因
简述膜中各种组分的作用
简述细胞膜系统的结构和功能的联系:(以分泌蛋白为例)
认同线粒体、叶绿体、内质网、高尔基体是膜系统的一部分
线粒体、叶绿体的结构和功能
观察DNA和RNA在细胞中的分布
糖类的种类和作用
Ⅱ
√
说出糖类的组成元素
列举糖类的主要类别
说明动植物细胞中主要的单糖、二糖、多糖的分布、作用、相互关系及各自功能(动植物特有的糖类)
认同糖类是主要的能源物质(功能)
简述鉴定还原糖的实验原理,尝试组织中还原糖的检测方法
脂质的种类和作用
Ⅰ
√
说出脂质的种类及组成元素
说明光合作用的光反应过程的能量变化和物质变化
说明光合作用的暗反应过程的能量变化和物质变化
解释光合作用的光反应、暗反应过程的相互关系
举例说明光合作用的原理和应用
概述光合作用的实质
简述化能合成作用
影响光合作用速率的环境因素
Ⅱ
√
解释环境因素(光照强度、温度、CO2浓度等)对光合作用强度的影响
收集农业生产上提高农作物光合作用强度的有关信息,了解温室中提高农作物产量的方法
细胞学说的主要内容
认同细胞学说的建立是一个开拓、继承、修正和发展的过程
举例说明技术进步在科学发展中的作用
原核细胞与真核细胞结构的区别
Ⅱ
√
使用高倍显微镜观察各种不同的生物材料
会辨别不同细胞的结构
说出不同生物类型细胞结构的异同点
认同细胞的多样性与统一性。
细胞膜系统的结构和功能
Ⅱ
√
知道生物膜系统的概念 简述细胞膜的成分
解释ATP在能量代谢中的作用,了解ATP的用途
说出ATP的形成途径
说明ATP与ADP相互转化的过程
概述ATP在生命活动中的意义
光合作用的基本过程
Ⅱ
√
概述色素提取和分离实验的原理,并说出叶绿体中色素的种类、分布和作用
说出叶绿体的结构和功能
说明光合作用(总反应方程式、原料、场所、条件、产物)
了解光合作用研究的历史(发现相关实验设计原理及过程)
知道酶产生的部位,简述酶的发现过程
说出酶的本质和作用,尝试比较过氧化氢在不同条件下的分解效果
举例说明酶的特性概述酶的概念概述酶促反应的原理阐明酶的高效性和专一性
通过实验说明影响酶活性的因素,掌握控制变量的科学方法
简述酶在生活中的应用
ATP在能量代谢中的作用
Ⅱ
√
简述ATP的化学组成和结构特点
写出ATP的分子简式
举例说明细胞膜是选择透过性膜
简述细胞被动运输的两种方式
阐明细胞渗透作用的原理(①渗透装置②质壁分离概念、条件③原生质层)
阐明主动运输的原理、特点和意义
指出被动运输与主动运输方式的异同点
简述主动运输对细胞生活的意义
举例说出大分子跨膜运输的方式、过程和意义
观察植物细胞的质壁分离和复原
酶在代谢中的作用
Ⅱ
√
Ⅱ
√
概述细胞核的结构(核膜、核仁、染色质(体))和功能
简述染色体与染色质的区别与联系
简述原核细胞的形态和结构
认同细胞核是细胞生命系统的控制中心
说出原核细胞与真核细胞的区别与联系(实例)
举例说明细胞是一个有机的统一整体
1.3
细
胞
的
代
谢
(6)
细
胞
的
代
谢
(6)
物质进出细胞的方式
Ⅱ
√
通过渗透实验说出细胞吸水或失水情况
