药品检验报告书
药品检验报告模板_胶囊剂
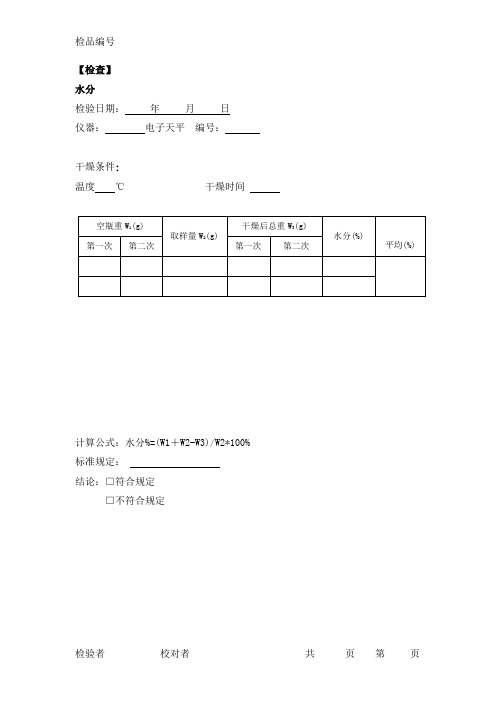
水分
检验日期:年月日
仪器:电子天平编号:
干燥条件:
温度℃干燥时间
计算公式:水分%=(W1+W2-W3)/W2*100% 标准规定:
结论:□符合规定
□不符合规定
检验日期:年月日温度: ℃湿度: %
仪器:电子天平编号:
取供试品10粒,结果:
标示装量:
平均装量:
限度:标示装量(或平均装量)的±10%
上限: ×(1+ %)=
下限: ×(1- %)=
10粒的情况:
标准规定:每粒装量与平均装量相比较,超出装量差异限度的不得多于2粒,并不得有1粒超出装量差异限度1倍。
结论:□符合规定
□不符合规定
崩解时限
检验日期:年月日温度: ℃湿度: %
仪器:ZBS-6E崩解时限仪编号:YWH-003
溶剂:溶剂温度: ℃
是否加挡板□是□否
崩解时间:分钟
崩解情况:片均在分钟内全部崩解
标准规定:□硬胶囊应在30分钟内全部崩解
□软胶囊应在1小时内全部崩解
□肠溶胶囊先不加挡板在盐酸溶液(9→1000)中检查2小时,每粒的囊壳均不得有裂缝或崩解现象,继加入挡板在人工肠液中检查,1小时内应全部崩解
结论:□符合规定
□不符合规定
微生物限度见微生物限度检查表。
药品检验报告书
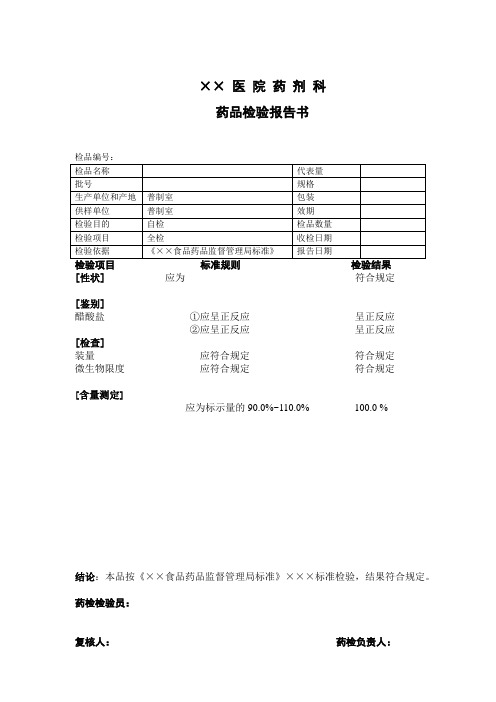
[含量测定]
应为标示量的90.0%~110.0%100.0 %
结论:本品按《××食品药品监督管理局标准》×××标准检验,结果符合规定。
药检检验员:
复核人:药检负责人:
××医院药剂科
药品检验报告书
检品编号:
检品名称
代表量
批号
规格
生产单位和产地
普制室
包装
供样单位
普制室
效期
检验目的
自检
检品数量
检验项目
全检
收检日期
检验依据
《××项目标准规则检验结果
[性状]应为符合规定
[鉴别]
醋酸盐①应呈正反应呈正反应
②应呈正反应呈正反应
[检查]
装量应符合规定符合规定
药品检验报告书模板(共7篇)

药品检验报告书模板(共7篇) (一)药品检验报告书模板本次检验的药品信息如下:药品名称:xxx生产厂家:xxx药品批号:xxx生产日期:xxx有效期:xxx检验部门:xxx检验时间:xxx检验结论:xxx检验人员:xxx检验主要参数:xxx检验结果:xxx检验结论及建议:xxx(二)药品检验报告书模板检验药品信息:药品名称:xxx生产厂家:xxx药品批号:xxx生产日期:xxx有效期:xxx检验部门:xxx检验时间:xxx检验结果:外观质量:xxx理化性质:xxx残留量:xxx微生物限度:xxx重金属含量:xxx感官性状:xxx检验结论:xxx检验建议:xxx(三)药品检验报告书模板检验药品信息:药品名称:xxx生产厂家:xxx药品批号:xxx生产日期:xxx有效期:xxx检验部门:xxx检验时间:xxx检验项目:外观质量:xxx薄层色谱:xxx高效液相色谱:xxx峰纯效果:xxx理化性质:xxx检验结论:xxx检验建议:xxx(四)药品检验报告书模板检验药品信息:药品名称:xxx生产厂家:xxx药品批号:xxx生产日期:xxx有效期:xxx检验部门:xxx检验时间:xxx检验项目:理化性质:xxx药效物质:xxx抗病毒检测:xxx感官性状:xxx检验结论:xxx检验建议:xxx(五)药品检验报告书模板检验药品信息:药品名称:xxx生产厂家:xxx药品批号:xxx生产日期:xxx有效期:xxx检验部门:xxx检验时间:xxx检验项目:理化性质:xxx抗菌活性:xxx毒性测试:xxx稳定性测试:xxx感官性状:xxx检验结论:xxx检验建议:xxx(六)药品检验报告书模板检验药品信息:药品名称:xxx 生产厂家:xxx 药品批号:xxx 生产日期:xxx 有效期:xxx 检验部门:xxx 检验时间:xxx 检验项目:外观质量:xxx 理化性质:xxx 细菌检测:xxx 感官性状:xxx 检验结论:xxx 检验建议:xxx(七)药品检验报告书模板检验药品信息:药品名称:xxx生产厂家:xxx药品批号:xxx生产日期:xxx有效期:xxx检验部门:xxx检验时间:xxx检验项目:理化性质:xxx流变性质:xxx药效物质:xxx感官性状:xxx检验结论:xxx 检验建议:xxx。
药品检验报告书写细则

药品检验记录与检验报告书的书写细则检验记录是出具检验报告书的依据,是进行科学研究和技术总结的原始资料;为保证药品检验工作的科学性和规范化,检验记录必须做到:记录原始、真实,内容完整、齐全,书写清晰、整洁。
药品检验报告书是对药品质量作出的技术鉴定,是具有法律效力的技术文件;药检人员应本着严肃负责的态度,根据检验记录,认真填写“检验卡”,经逐级审核后,由所领导签发“药品检验报告书”。
要求做到:依据准确,数据无误,结论明确,文字简洁,书写清晰,格式规范;每一张药品检验报告书只针对一个批号。
1 检验记录的基本要求:1.1 原始检验记录应采用统一印制的活页记录纸和各类专用检验记录表格(见附件),并用蓝黑墨水或碳素笔书写(显微绘图可用铅笔)。
凡用微机打印的数据与图谱,应剪贴于记录上的适宜处,并有操作者签名;如系用热敏纸打印的数据,为防止日久褪色难以识别,应以蓝黑墨水或碳素笔将主要数据记录于记录纸上。
1.2 检验人员在检验前,应注意检品标签与所填检验卡的内容是否相符,逐一查对检品的编号、品名、规格、批号和效期,生产单位或产地,检验目的和收检日期,以及样品的数量和封装情况等。
并将样品的编号与品名记录于检验记录纸上。
1.3 检验记录中,应先写明检验的依据。
凡按中国药典、部颁标准、地方药品标准或国外药典检验者,应列出标准名称、版本和页数;凡按送验者所附检验资料或有关文献检验者,应先检查其是否符合要求,并将前述有关资料的影印件附于检验记录之后,或标明归档编码。
1.4 检验过程中,可按检验顺序依次记录各检验项目,内容包括:项目名称,检验日期,操作方法(如系完全按照1.3检验依据中所载方法,可简略扼要叙述;但如稍有修改,则应将改变部分全部记录),实验条件(如实验温度,仪器名称型号和校正情况等),观察到的现象(不要照抄标准,而应是简要记录检验过程中观察到的真实情况;遇有反常的现象,则应详细记录,并鲜明标出,以便进一步研究),实验数据,计算(注意有效数字和数值的修约及其运算,详见《中国药品检验标准操作规范》第414页)和结果判断等;均应及时、完整地记录,严禁事后补记或转抄。
药品检验报告书写细则

02
原始检验记录应采用统一印制的活页记录纸和各类专用检验记录表格(见附件),并用蓝黑墨水或碳素笔书写(显微绘图可用铅笔)。凡用微机打印的数据与图谱,应剪贴于记录上的适宜处,并有操作者签名;如系用热敏纸打印的数据,为防止日久褪色难以识别,应以蓝黑墨水或碳素笔将主要数据记录于记录纸上。
检验人员在检验前,应注意检品标签与所填检验卡的内容是否相符,逐一查对检品的编号、品名、规格、批号和效期,生产单位或产地,检验目的和收检日期,以及样品的数量和封装情况等。并将样品的编号与品名记录于检验记录纸上。
薄层扫描法:除应按2.2.4记录薄层色谱的有关内容外,尚应记录薄层扫描仪的型号,扫描方式,供试品和对照品的称量(平行试验各2份),测定值,结果计算。
气相色谱法:记录仪器型号,检测器及其灵敏度,色谱柱长与内径,柱填料与固定相,载气和流速,柱温,进样口与检测器的温度,内标溶液,供试品的预处理,供试品与对照品的称量(平行试验各2份)和配制过程,进样量,测定数据,计算式与结果;并附色谱图。标准中如规定有系统适用性试验者,应记录该试验的数据(如理论板数,分离度,校正因子的相对标准偏差等)。
重金属(或铁盐):记录采用的方法,供试液的制备,标准溶液的浓度和用量,比较结果。
砷盐(或硫化物):记录采用的方法,供试液的制备,标准溶液的浓度和用量,比较结果。
2.3.19 乙醇量测定法:记录仪器型号,载体和内标物的名称,柱温,系统适用性试验(理论板数、分离度和校正因子的变异系数),标准溶液与供试品溶液的制备(平行试验各2份)及其连续3次进样的测定结果,平均值。并附色谱图。
03
重量分析法:记录供试品的称量(平行试验2份),简要的操作方法,干燥或灼烧的温度,滤器(或坩埚)的恒重值,沉淀物或残渣的恒重值,计算式与结果。
药品检验报告书

药品检验报告书是对药品质量的客观评价,是药品品质的重要指标之一。
在现代药品市场中,是证明药品质量的重要凭证,其合格与否关系到药品是否能够上市,对消费者的保健起到重要的作用。
通常由实验室按照国家药品质量标准进行严格的检测和分析,包括药品的物理性质、化学成分、微生物质量、安全性等方面的检验。
下面,本文将从的意义、内容和影响等多个方面进行论述。
一、的意义是保障人民生命健康的重要工具,其合格与否关系到药品市场秩序的维护和药品的生产和销售。
是药品质量的基本证明材料,是药品出厂前必须进行的必要程序。
只要合格,就能够证明药品符合国家药品质量标准,能够安全使用。
同时,也是药品监管部门进行监管和执法的重要依据,能够有效地遏制假冒伪劣药品的生产和流通,保护消费者利益。
二、的内容一般包括以下内容:药品名称、批号、规格、生产厂家、检验时间、检验机构、样品来源、检验项目、检验结果和评价等。
其中,检验项目通常包括药品的物理性质、化学成分、微生物质量、安全性等方面的检验,从而确保药品质量的全面评价。
各项检验结果都是客观性的,有强烈的科学性和专业性保证,消费者可以通过来了解药品的真实情况,从而选择合适的药品。
三、的影响是药品销售和市场监管的重要参考依据,它的合规与否关系到药品上市和销售。
如果药品检验不合格,那么药品就不能上市销售,也不能被消费者使用,从而有效地保障了消费者的健康权益。
同时,的准确性和可靠性也是药品生产企业的重要指标之一,它的合格意味着企业得到了市场和消费者的认可,可以有效提高企业的市场知名度和品牌知名度。
总之,是目前市场中对药品质量的客观评价,是药品品质的重要指标之一。
它的意义、内容和影响都是不可忽视的,对于维护药品市场秩序和消费者健康权益具有重要的意义。
在我们使用药品时是必不可少的,我们需要认真阅读并对药品的质量进行全面的评价。
药品检验报告书

药品检验报告书
药品检验报告书是制药行业中的一种文件,用于记录药品检验的结果和相关数据。
它包含以下主要内容:
1. 药品基本信息:包括药品名称、批号、规格、生产日期等。
2. 检验项目:列出需要检验的项目,如外观检查、含量测定、纯度检验等。
3. 检验方法:详细描述每个检验项目所采用的检验方法和操作步骤。
4. 检验结果:记录每个检验项目的检验结果,包括合格/不合格、数值或定性描述等。
5. 分析及讨论:针对不合格结果或异常情况,进行分析并提出讨论和建议。
6. 结论:根据检验结果和分析讨论,给出整体的结论,判断药品是否符合质量标准。
7. 签名和日期:检验报告应有相关检验人员的签名和日期,以表明报告的真实性和可靠性。
药品检验报告书是质量控制的重要文件,具有法律效力。
它对于确保药品质量和安全性至关重要,也为各方提供了参考依据。
药品检验报告书的书写及要求

药品检验报告书
5 药品检验报告书中检验项目的编排与格式:报告书中检验项目的编排和格式, 应与检验卡完全一致。 5.1 表头之下的首行,横向列出“检验项目”、“标准规定”和“检验结果” 表头之下的首行,横向列出“检验项目” 标准规定” 检验结果” 三个栏目。 5.2 “检验项目”下,按质量标准列出[性状]、[鉴别]、[检查]与[含量 检验项目” 测定]等大项目;大项目名称需添加方括号。每一个大项下所包含的具体检 验项目名称和排列顺序,应按质量标准上的顺序书写。 6 药品检验报告书中各检测项目的书写要求: 6.1 [性状] 6.1.1 外观性状:在“标准规定”下,按质量标准内容书写。“检验结果”下, 外观性状:在“标准规定”下,按质量标准内容书写。“检验结果” 合格的写“符合规定” 合格的写“符合规定”,必要时可按实况描述;不合格的,应先写出不符合 标准规定之处,再加写“不符合规定” 标准规定之处,再加写“不符合规定”。 6.1.2 熔点、比旋度或吸收系数等物理常数:在“标准规定”下,按质量标准内 熔点、比旋度或吸收系数等物理常数:在“标准规定” 容书写。在“检验结果”下,写实测数值;不合格的应在数据之后加写“ 容书写。在“检验结果”下,写实测数值;不合格的应在数据之后加写“不 符合规定” 符合规定”。
药品检验报告书 7.1.3 如非全项检验,合格的写“本品按×××检验上述项目,结果符 如非全项检验,合格的写“本品按×××检验上述项目,结果符 合规定”;如有一项不合格时,则写“本品按××××检验上述项目, 合规定”;如有一项不合格时,则写“本品按××××检验上述项目, 结果不符合规定” 结果不符合规定”。 7.2 进口检验:除应包括检验依据和检验结论外,还应写明是否准予进 口。 8 检验报告书底稿的签名:检验者、校核者和各级审核者均应在检验卡 (或报告书底稿)上签具姓名和经办日期(年、月、日)。 或报告书底稿)上签具姓名和经办日期(年、月、日) 9 本细则未函盖的检验项目,可按已批准的标准进行检验和书写。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
海南和信堂药业有限公司
药品检验报告书
检验项目标准规定检验结果
[性状] 应为白色或微黄色结晶性粉末;
无臭、味苦
为微黄色结晶性粉末;无臭、味苦
比旋度应-1°~+1°+0.5°
[鉴别]
HPLC 应与对照品保留时间一致与对照品保留时间一致红外光谱鉴别应与对照品红外图谱一致与对照品红外图谱一致[检查]
溶液的澄清度应符合规定符合规定
吸光度A
450nm
应≤0.25 0.0046
有关物质应≤0.5% 0.14%
干燥失重应≤0.5% 0.25%
炽灼残渣应≤0.2% 0.03%
重金属应≤10ppm <10ppm
[含量测定] 以干燥品计,含C
18H
20
FN
3
O
4100.9%
不得少于 98.5%
结论:本品按内控质量标准检验,结果符合规定。
质保部部长: QC主任:检验员:。
