药品检验报告书
药品检验报告书写细则

药品检验记录与检验报告书的书写细则检验记录是出具检验报告书的依据,是进行科学研究和技术总结的原始资料;为保证药品检验工作的科学性和规范化,检验记录必须做到:记录原始、真实,内容完整、齐全,书写清晰、整洁。
药品检验报告书是对药品质量作出的技术鉴定,是具有法律效力的技术文件;药检人员应本着严肃负责的态度,根据检验记录,认真填写“检验卡”,经逐级审核后,由所领导签发“药品检验报告书”。
要求做到:依据准确,数据无误,结论明确,文字简洁,书写清晰,格式规范;每一张药品检验报告书只针对一个批号。
1 检验记录的基本要求:1.1 原始检验记录应采用统一印制的活页记录纸和各类专用检验记录表格(见附件),并用蓝黑墨水或碳素笔书写(显微绘图可用铅笔)。
凡用微机打印的数据与图谱,应剪贴于记录上的适宜处,并有操作者签名;如系用热敏纸打印的数据,为防止日久褪色难以识别,应以蓝黑墨水或碳素笔将主要数据记录于记录纸上。
1.2 检验人员在检验前,应注意检品标签与所填检验卡的内容是否相符,逐一查对检品的编号、品名、规格、批号和效期,生产单位或产地,检验目的和收检日期,以及样品的数量和封装情况等。
并将样品的编号与品名记录于检验记录纸上。
1.3 检验记录中,应先写明检验的依据。
凡按中国药典、部颁标准、地方药品标准或国外药典检验者,应列出标准名称、版本和页数;凡按送验者所附检验资料或有关文献检验者,应先检查其是否符合要求,并将前述有关资料的影印件附于检验记录之后,或标明归档编码。
1.4 检验过程中,可按检验顺序依次记录各检验项目,内容包括:项目名称,检验日期,操作方法(如系完全按照1.3 检验依据中所载方法,可简略扼要叙述;但如稍有修改,则应将改变部分全部记录),实验条件(如实验温度,仪器名称型号和校正情况等),观察到的现象(不要照抄标准,而应是简要记录检验过程中观察到的真实情况;遇有反常的现象,则应详细记录,并鲜明标出,以便进一步研究),实验数据,计算(注意有效数字和数值的修约及其运算,详见《中国药品检验标准操作规范》第414 页)和结果判断等;均应及时、完整地记录,严禁事后补记或转抄。
药品质检报告模板电子版

药品质检报告模板电子版篇一:药品检验报告书摩达公司药品检验报告书检验项目 [性状] 比旋度 [鉴别] HPLC [检查] 吸光度有关物质干燥失重炽灼残渣重金属 [含量测定] 标准规定应为白色或微黄色结晶性粉末;无臭、味苦应-1°~+1°应与对照品保留时间一致A450nm应≤应≤% 应≤% 应≤% 应≤10ppm以干燥品计,含C18H20FN3O4 不得少于 %检验结果为微黄色结晶性粉末;无臭、味苦+°红外光谱鉴别应与对照品红外图谱一致溶液的澄清度应符合规定与对照品保留时间一致与对照品红外图谱一致符合规定 % % % <10ppm %结论:本品按内控质量标准检验,结果不符合规定。
质保部部长:xxx QC主任:xxx 检验员:xxx篇二:药品检验报告模板_胶囊剂水分检验日期:年月日仪器:电子天平编号:干燥条件:温度℃干燥时间计算公式:水分%=/W2*100%标准规定:结论:□符合规定□不符合规定检验日期:年月日温度: ℃湿度: %仪器:电子天平编号:取供试品10粒,结果:标示装量:平均装量:限度:标示装量(或平均装量)的±10%上限: ×=下限:×=10粒的情况:标准规定:每粒装量与平均装量相比较,超出装量差异限度的不得多于2粒,并不得有1粒超出装量差异限度1倍。
结论:□符合规定□不符合规定崩解时限检验日期:年月日温度: ℃湿度: %仪器:ZBS-6E崩解时限仪编号:YWH-003溶剂:溶剂温度: ℃是否加挡板□是□否崩解时间:分钟崩解情况:片均在分钟内全部崩解标准规定:□硬胶囊应在30分钟内全部崩解□软胶囊应在1小时内全部崩解□肠溶胶囊先不加挡板在盐酸溶液(9→1000)中检查2小时,每粒的囊壳均不得有裂缝或崩解现象,继加入挡板在人工肠液中检查,1小时内应全部崩解结论:□符合规定□不符合规定微生物限度见微生物限度检查表。
篇三:食品药检所检验报告书模板XXXXXXXXXXX食品药品检验所检验报告书报告书编号: 20XXA 二维码第3页共3页检验项目【检查】【含量测定】(以下空白)【性状】性状【鉴别】标准规定检验结果结论:本品按,结果符合规定。
正确解读药品检验报告书【范本模板】

正确解读药品检验报告书药品检验报告书是判定抽验药品质量是否合格的法定依据,也是药品监督管理部门对不合格药品实施行政处罚的重要依据之一。
然而,对同一份药品检验报告书,可能会因理解不同而得出假药或劣药两种不同的结论。
因此,正确解读药品检验报告书所反映的药品质量信息,对判定假药、劣药,正确实施行政处罚具有相当重要的作用。
本文阐明了药品标准与检验结果之间的关系,剖析了药品检验报告书各个项目的实际内涵,并提出了“否定优先”的原则,有助于基层药品监督和检验人员更准确地依据药品检验报告书对抽验药品做出正确的判断。
由于受版面等因素限制,一份药品检验报告书所反映的药品质量信息是较为抽象的,这就要求药品监督人员在实践中充分利用专业知识,读懂、读透药品检验报告书中各项目的内涵。
■符合标准也可能是假药药品监督人员要正确解读药品检验报告书,首先要清楚药品检验报告书的法定依据——药品质量标准的由来。
药品质量标准是根据药品在正常的生产工艺及投料情况下,对该药品从整体上进行的综合评定;是反映个体是否符合群体要求的一个尺度。
药品质量标准受科技水平、检验成本等多方面因素的影响,它不可能是完美的,可能在某些方面存在瑕疵、缺陷甚至漏洞,因此,对于药品非正常生产过程中的一些人为因素,按照药品质量标准去检验,并不一定都能检验出来;也就是说,按照药品质量标准检验合格的药品并不一定都合格,有可能是假药。
例如,在中药制剂中加入化学药品或者在药品中人为加入药品质量标准以外的成分及对检测的任何项目有干扰的成分,都有可能使检验结果呈现假相,导致假药被检验成合格药品。
通过这种方式生产出来的假药,披上检验合格的“外衣”,往往更具迷惑性,对人民群众用药安全的危害也更大。
■剖析检验项目内涵正确解读药品检验报告书,要熟悉药品检验报告书各检验项目的实际内涵。
不论是化学原料药、化学药制剂、中成药还是中药材,药品检验的内容通常分为性状、鉴别、检查和含量测定四大项,但由于每个药品品种检验的内容不尽相同,各个项目中包含的子项目也会有所不同。
药品检验报告书
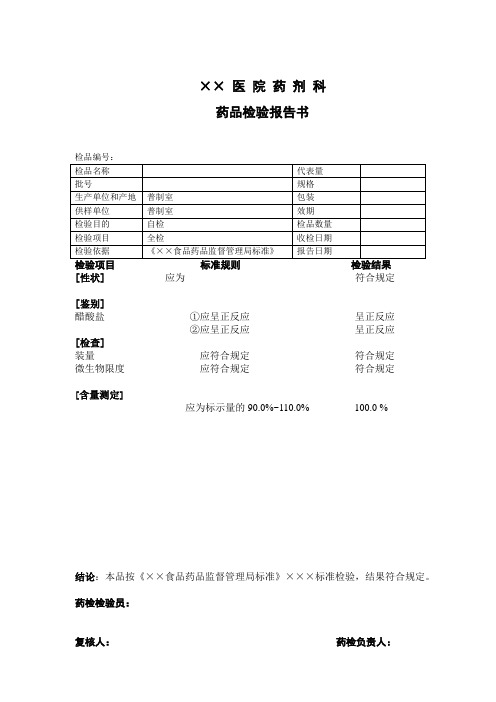
[含量测定]
应为标示量的90.0%~110.0%100.0 %
结论:本品按《××食品药品监督管理局标准》×××标准检验,结果符合规定。
药检检验员:
复核人:药检负责人:
××医院药剂科
药品检验报告书
检品编号:
检品名称
代表量
批号
规格
生产单位和产地
普制室
包装
供样单位
普制室
效期
检验目的
自检
检品数量
检验项目
全检
收检日期
检验依据
《××项目标准规则检验结果
[性状]应为符合规定
[鉴别]
醋酸盐①应呈正反应呈正反应
②应呈正反应呈正反应
[检查]
装量应符合规定符合规定
药品检验报告书模板(共7篇)

药品检验报告书模板(共7篇) (一)药品检验报告书模板本次检验的药品信息如下:药品名称:xxx生产厂家:xxx药品批号:xxx生产日期:xxx有效期:xxx检验部门:xxx检验时间:xxx检验结论:xxx检验人员:xxx检验主要参数:xxx检验结果:xxx检验结论及建议:xxx(二)药品检验报告书模板检验药品信息:药品名称:xxx生产厂家:xxx药品批号:xxx生产日期:xxx有效期:xxx检验部门:xxx检验时间:xxx检验结果:外观质量:xxx理化性质:xxx残留量:xxx微生物限度:xxx重金属含量:xxx感官性状:xxx检验结论:xxx检验建议:xxx(三)药品检验报告书模板检验药品信息:药品名称:xxx生产厂家:xxx药品批号:xxx生产日期:xxx有效期:xxx检验部门:xxx检验时间:xxx检验项目:外观质量:xxx薄层色谱:xxx高效液相色谱:xxx峰纯效果:xxx理化性质:xxx检验结论:xxx检验建议:xxx(四)药品检验报告书模板检验药品信息:药品名称:xxx生产厂家:xxx药品批号:xxx生产日期:xxx有效期:xxx检验部门:xxx检验时间:xxx检验项目:理化性质:xxx药效物质:xxx抗病毒检测:xxx感官性状:xxx检验结论:xxx检验建议:xxx(五)药品检验报告书模板检验药品信息:药品名称:xxx生产厂家:xxx药品批号:xxx生产日期:xxx有效期:xxx检验部门:xxx检验时间:xxx检验项目:理化性质:xxx抗菌活性:xxx毒性测试:xxx稳定性测试:xxx感官性状:xxx检验结论:xxx检验建议:xxx(六)药品检验报告书模板检验药品信息:药品名称:xxx 生产厂家:xxx 药品批号:xxx 生产日期:xxx 有效期:xxx 检验部门:xxx 检验时间:xxx 检验项目:外观质量:xxx 理化性质:xxx 细菌检测:xxx 感官性状:xxx 检验结论:xxx 检验建议:xxx(七)药品检验报告书模板检验药品信息:药品名称:xxx生产厂家:xxx药品批号:xxx生产日期:xxx有效期:xxx检验部门:xxx检验时间:xxx检验项目:理化性质:xxx流变性质:xxx药效物质:xxx感官性状:xxx检验结论:xxx 检验建议:xxx。
药品检验报告书模板

药品检验报告书模板
参考文档如下:
检验单位:XXXX检验中心
检验日期:xxxx年xx月xx日
被检验药品:XXXX
规格:XXX
批号:XXXX
报告单号:XXXX
一、检验依据
本报告所检验的药品按照《药品检验技术规范》(2023年9月1日)(GMP:2023)的要求进行检验。
二、检验内容
本次检验按照药品检验技术规范所列出的检验内容进行检验,共检验
X项内容,明细如下:
1、外观检验
2、形状检验
3、性状检验
4、成分鉴定
5、重量检验
6、容量检验
7、熔点检验
8、溶解度检验
9、流变性检验
10、稳定性检验
11、菌落总数检验
12、质量指标检验
三、检验结果
1、外观检验:本批药品外观正常,未发现异议。
2、形状检验:本批药品形状检验结果符合标准,未发现异议。
3、性状检验:本批药品性状检验结果符合标准,未发现异议。
4、成分鉴定:本批药品成分鉴定结果符合标准,未发现异议。
5、重量检验:本批药品重量检验结果符合标准,未发现异议。
6、容量检验:本批药品容量检验结果符合标准,未发现异议。
药品检验记录与检验报告书的书写细则
药品检验记录与检验报告书的书写细则检验记录是出具检验报告书的依据,是进行科学研究和技术总结的原始资料;为保证药品检验工作的科学性和规范化,检验记录必须做到:记录原始、真实,内容完整、齐全,书写清晰、整洁。
药品检验报告书是对药品质量作出的技术鉴定,是具有法律效力的技术文件;药检人员应本着严肃负责的态度,根据检验记录,认真填写“检验卡”,经逐级审核后,由所领导签发“药品检验报告书”。
要求做到:依据准确,数据无误,结论明确,文字简洁,书写清晰,格式规范;每一张药品检验报告书只针对一个批号。
1 检验记录的基本要求:1.1 原始检验记录应采用统一印制的活页记录纸和各类专用检验记录表格(见附件),并用蓝黑墨水或碳素笔书写(显微绘图可用铅笔)。
凡用微机打印的数据与图谱,应剪贴于记录上的适宜处,并有操作者签名;如系用热敏纸打印的数据,为防止日久褪色难以识别,应以蓝黑墨水或碳素笔将主要数据记录于记录纸上。
1.2 检验人员在检验前,应注意检品标签与所填检验卡的内容是否相符,逐一查对检品的编号、品名、规格、批号和效期,生产单位或产地,检验目的和收检日期,以及样品的数量和封装情况等。
并将样品的编号与品名记录于检验记录纸上。
1.3 检验记录中,应先写明检验的依据。
凡按中国药典、部颁标准、地方药品标准或国外药典检验者,应列出标准名称、版本和页数;凡按送验者所附检验资料或有关文献检验者,应先检查其是否符合要求,并将前述有关资料的影印件附于检验记录之后,或标明归档编码。
1.4 检验过程中,可按检验顺序依次记录各检验项目,内容包括:项目名称,检验日期,操作方法(如系完全按照1.3检验依据中所载方法,可简略扼要叙述;但如稍有修改,则应将改变部分全部记录),实验条件(如实验温度,仪器名称型号和校正情况等),观察到的现象(不要照抄标准,而应是简要记录检验过程中观察到的真实情况;遇有反常的现象,则应详细记录,并鲜明标出,以便进一步研究),实验数据,计算(注意有效数字和数值的修约及其运算,详见《中国药品检验标准操作规范》第414页)和结果判断等;均应及时、完整地记录,严禁事后补记或转抄。
药品检验报告书写细则
药品检验记录与检验报告书的书写细则检验记录是出具检验报告书的依据,是进行科学研究和技术总结的原始资料;为保证药品检验工作的科学性和规范化,检验记录必须做到:记录原始、真实,内容完整、齐全,书写清晰、整洁。
药品检验报告书是对药品质量作出的技术鉴定,是具有法律效力的技术文件;药检人员应本着严肃负责的态度,根据检验记录,认真填写“检验卡”,经逐级审核后,由所领导签发“药品检验报告书”。
要求做到:依据准确,数据无误,结论明确,文字简洁,书写清晰,格式规范;每一张药品检验报告书只针对一个批号。
1 检验记录的基本要求:1.1 原始检验记录应采用统一印制的活页记录纸和各类专用检验记录表格(见附件),并用蓝黑墨水或碳素笔书写(显微绘图可用铅笔)。
凡用微机打印的数据与图谱,应剪贴于记录上的适宜处,并有操作者签名;如系用热敏纸打印的数据,为防止日久褪色难以识别,应以蓝黑墨水或碳素笔将主要数据记录于记录纸上。
1.2 检验人员在检验前,应注意检品标签与所填检验卡的内容是否相符,逐一查对检品的编号、品名、规格、批号和效期,生产单位或产地,检验目的和收检日期,以及样品的数量和封装情况等。
并将样品的编号与品名记录于检验记录纸上。
1.3 检验记录中,应先写明检验的依据。
凡按中国药典、部颁标准、地方药品标准或国外药典检验者,应列出标准名称、版本和页数;凡按送验者所附检验资料或有关文献检验者,应先检查其是否符合要求,并将前述有关资料的影印件附于检验记录之后,或标明归档编码。
1.4 检验过程中,可按检验顺序依次记录各检验项目,内容包括:项目名称,检验日期,操作方法(如系完全按照1.3检验依据中所载方法,可简略扼要叙述;但如稍有修改,则应将改变部分全部记录),实验条件(如实验温度,仪器名称型号和校正情况等),观察到的现象(不要照抄标准,而应是简要记录检验过程中观察到的真实情况;遇有反常的现象,则应详细记录,并鲜明标出,以便进一步研究),实验数据,计算(注意有效数字和数值的修约及其运算,详见《中国药品检验标准操作规范》第414页)和结果判断等;均应及时、完整地记录,严禁事后补记或转抄。
药品检验记录和报告书的书写规范与要求
药品检验记录和报告书的书写规范与要求四川省德阳食品药品检验所卿三根药品检验报告书是鉴定药品质量的法律文书,对药品抽样记录及凭证、检验记录及检验报告书的书写进行规范,是保证药品检验数据和结果准确可靠,结论正确的前提。
笔者结合自身工作特点,简要介绍本所在药品检验记录和报告书的书写规范与要求上的一些做法。
一、职责明确1检验员负责检验记录书写规范,做到记录原始、数据真实、字迹清晰、资料完整。
[/b]2 抽样人员负责填写药品抽样记录及凭证,做到记录与样品相符,字迹清晰、内容完整。
3 室主任负责对检验员的检验记录及结果进行审核,并签署科室意见。
4 业务股股长负责检验报告的审核。
5 所长(或授权签字人)负责签发报告书。
6 打字员负责报告书的打印。
7 校核人负责报告书的校对和发出。
[b]二、抽样记录及凭证的书写要求1抽样作为检验内容的开始,是药品检验内容的重要组成部份。
应坚持《药品抽样指导原则》,遵循抽样的科学性、公正性与真实性,做到手续上合法,技术上可靠,程序上规范。
2检查药品所处环境是否符合要求,确定抽样批,检查该批药品内、外包装情况,标签上的药品名称、批准文号、批号、生产企业名称等字样是否清晰,标签和说明书内容是否符合国家药品监督管理局或者省、自治区、直辖市药品监督管理局所核准的内容,核实被抽取药品的库存量。
必要时,按《药品监督检验工作管理办法》规定向被抽样单位或者个人查看或者索取有关资料。
3确定抽样单元数、抽样单元及抽样量。
检查抽样单元的外观情况,如无异常,进行下一步聚;如发现异常情况(如破损、受潮、受污染、混有其他品种、批号,或者有掺假、掺劣、假冒迹象等),应当作针对性抽样。
4用适宜取样工具抽取单元样品,进而制作最终样品,分为三份,分别装入盛样器具并签封。
将被拆包的抽样单元重新包封,贴上已被抽样的标记。
5填写“药品抽样记录及凭证”。
药品抽样记录及凭证上的信息应完整填写,不得遗漏,尤其应注意药品抽样时的状态,异常情况必须注明。
药品检验报告书写细则
02
原始检验记录应采用统一印制的活页记录纸和各类专用检验记录表格(见附件),并用蓝黑墨水或碳素笔书写(显微绘图可用铅笔)。凡用微机打印的数据与图谱,应剪贴于记录上的适宜处,并有操作者签名;如系用热敏纸打印的数据,为防止日久褪色难以识别,应以蓝黑墨水或碳素笔将主要数据记录于记录纸上。
检验人员在检验前,应注意检品标签与所填检验卡的内容是否相符,逐一查对检品的编号、品名、规格、批号和效期,生产单位或产地,检验目的和收检日期,以及样品的数量和封装情况等。并将样品的编号与品名记录于检验记录纸上。
薄层扫描法:除应按2.2.4记录薄层色谱的有关内容外,尚应记录薄层扫描仪的型号,扫描方式,供试品和对照品的称量(平行试验各2份),测定值,结果计算。
气相色谱法:记录仪器型号,检测器及其灵敏度,色谱柱长与内径,柱填料与固定相,载气和流速,柱温,进样口与检测器的温度,内标溶液,供试品的预处理,供试品与对照品的称量(平行试验各2份)和配制过程,进样量,测定数据,计算式与结果;并附色谱图。标准中如规定有系统适用性试验者,应记录该试验的数据(如理论板数,分离度,校正因子的相对标准偏差等)。
重金属(或铁盐):记录采用的方法,供试液的制备,标准溶液的浓度和用量,比较结果。
砷盐(或硫化物):记录采用的方法,供试液的制备,标准溶液的浓度和用量,比较结果。
2.3.19 乙醇量测定法:记录仪器型号,载体和内标物的名称,柱温,系统适用性试验(理论板数、分离度和校正因子的变异系数),标准溶液与供试品溶液的制备(平行试验各2份)及其连续3次进样的测定结果,平均值。并附色谱图。
03
重量分析法:记录供试品的称量(平行试验2份),简要的操作方法,干燥或灼烧的温度,滤器(或坩埚)的恒重值,沉淀物或残渣的恒重值,计算式与结果。
