东华大学物理化学物化练习卷2014-期中答案
东华大学物理化学复习

第0-6 章绪论第1 章: 第零定律与物态方程第2 章: 热力学第一定律第3章: 热力学第二定律第4 章:组份体系的热力学第5 章: 相平衡及相图第6 章: 化学平衡热力学第 7-13 章第7 章:计热力学基础第8 章: 反应速率与机理第9 章: 动力学统计理论第10 章: 特殊性质反应动力学第11 章: 电化学第12 章: 界面现象第13 章: 胶体1 第零定律与物态方程1 第零定律与物态方程2 热力学第一定律2 热力学第一定律3 热力学第二定律3 热力学第二定律4 多组份体系的热力学4 多组份体系的热力学5 相平衡及相图5 相平衡及相图6 化学平衡热力学6 化学平衡热力学7 统计热力学基础7 统计热力学基础8 化学动力学8 化学动力学9 化学动力学的统计理论9 化学动力学的统计理论10 特殊性质反应动力学10 特殊性质反应动力学11 电化学11 电化学12 界面现象12 界面现象13 胶体各章导练习与反应的气相物质。
(6) 对 Hg( l ) +S(s ) = Hg(s ) 反应,因有平衡限制,因此, Hg(l )无法全部参与反应。
提示答案:〔(1) 错, 是平衡常数,可由 求得,(2) 对, ,(3) 正向不能自发进行,而反向自发进行。
(6) 不对,对该反应 〕4. 有 1mol 的 N 2 和 3mol 的 H 2 混合气在 400℃ 通过催化剂达平衡,平衡压力为 ,分析 NH 3 的摩尔分数是 0.0044 ,求 K p 、K c 、K x 。
提示答案:5. 将固体 NH 4I 迅速加热到 308.8K ,测得其蒸气压为 3.666 ×10 4Pa ,在此温度气态 NH 4I 实际上完全分解为 NH 3 和 HI ,因此测得的蒸气压等于 NH 3 和 HI 分压之和。
如果在每一段时间内保持这个温度不变, 则由于 HI 按下式分解:而使 NH 4I( s )上方的压力增大。
《物理化学》试卷及答案解析

《物理化学》试卷及答案解析得分1评卷人、填空题(旬小题2分,共20分)l、状态函数可分为两类:其数值在系统中具有加和性的是,请举三个这类函数的例子;其数值取决于系统自身而与系统中物质数量无关的是,请举三个这类函数的例子。
2、写出Joul e-T homson系数的定义式:该气体经节流过程后,随压力降低,温度3、可逆热机的效率与两热源温度的关系是逆热机去牵引机车,机车的速度将会是。
若Joule-T homson系数大千O,则。
;在其他条件都相同的前提下,用可。
4、Zn与稀硫酸作用,其他条件相同的情况下,分别在敞口容器中进行和在密闭容器中进行,所放出的热量进行比较,前者后者。
(填"<"、">"或"=")5、NH4C l(s)在真空容器中分解生成NH3(g)和HC I(g)达平衡,该系统的组分数为,相数为,自由度数为。
6、某分解反应为A(s)= 2B(g)+C(g) , 气体视为理想气体,其标准平衡常数K o与解离压力P 之间的关系是7、双变量体系的热力学基本公式:dU= PdV ; dG= VdP。
8、在200°C和25°C之间工作的卡诺热机,其效率为%。
9、纯物质混合形成理想液态混合物时,I:::.V 0, I:::. . H 0, I:::. S 0, I:::. Gmix mix mix mix 0。
(填“<“、">"或'=")是系是10、理想气体反应,标准平衡常数K汇与用分压表示的经验平衡常数K之间的关系;标准平衡常数K臼与用物质的量分数表示的经验平衡常数K之间的关。
得分1评卷人1二、选择题(每小题2分,共20分)l、某气体的压缩因子z> 1, 表示该气体比理想气体( )(A)容易压缩(B)不易压缩(C)容易液化(D)不易液化2、关千气体的隙流,下列说法错误的是(A)气体隙流速度与摩尔质量的平方根成正比CB)隙流定律可以用来求气体的摩尔质噩CC)利用隙流作用可以分离摩尔质量不同的气体CD)气体分子运动论是隙流定律的理论依据()3、系统从一个状态经不可逆过程到达另一状态,系统的�sc )(A)大千零(B)小千零CC)等千零(D)无法确定4、碳酸钠和水可以形成Na 2C03·H 20,Na 2C03·7H 20, N a 2C03·10H 20三种水合物,在101.3kPa 时该物系共存的相数最多为(A) 2 (B) 3 (C) 45、常压下-l0°C过冷水变成-l0°C 的冰,此过程的(A)�G <O ,�H>O (C)�G=O ,�H =O CB) Li G >O ,LiH >O (D) Li G <O ,LiH <O(D) 5 ()6、A、B 两组分的气液平衡T-x 图上,有-最低恒沸点,恒沸物组成为X A =Q.7。
物理化学练习题4参考答案
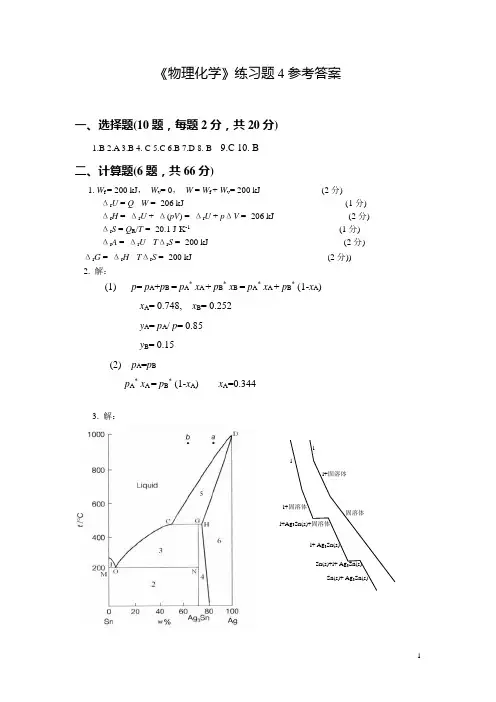
《物理化学》练习题4参考答案一、选择题(10题,每题2分,共20分)1.B2.A3.B4. C5.C6.B7.D8. B9.C 10. B二、计算题(6题,共66分)1. W f = 200 kJ , W v = 0, W = W f + W v = 200 kJ (2分)Δr U = Q - W = -206 kJ (1分) Δr H = Δr U + Δ(pV ) = Δr U + p ΔV = -206 kJ (2分) Δr S = Q R /T = -20.1 J·K -1 (1分) Δr A = Δr U - T Δr S = -200 kJ (2分) Δr G = Δr H - T Δr S = -200 kJ (2分)) 2. 解:(1) p = p A +p B = p A * x A + p B * x B = p A * x A + p B * (1-x A ) x A = 0.748, x B = 0.252 y A = p A / p = 0.85 y B = 0.15 (2) p A =p Bp A * x A = p B * (1-x A ) x A =0.3443. 解:l+固溶体 ll+ Ag 3Sn(s)Sn(s)+ Ag 3Sn(s)l+Ag 3Sn(s)+固溶体Sn(s)+l+ Ag 3Sn(s)ll+固溶体固溶体解:(1) 1: Sn(s)+l ;2:Sn(s)+Ag 3Sn(s);3:l+Ag 3Sn(s);4:Ag 3Sn(s)+固溶体;5: l+固溶体;6:固溶体。
(2) CGH : l+固溶体→Ag 3Sn(s);MON : l →Sn(s)+Ag 3Sn(s) (3) 见图。
(4) 点D 为Ag(s)的熔点,C=1;F =C +1-P =1+1-2=0 (5) 在3区。
4. 解:(1) 正极反应: Hg 2Cl 2(s) + 2e -−−→2Hg(s) + 2Cl - 负极反应: H 2(g)−−→2H + +2 e - 电池反应: Hg 2Cl 2(s) + H 2(g)2Hg(s) + 2Cl - + 2 H +(2) 293K 时电池的电动势E / V = 0.0694 + 1.881×10-3 ×293K / K - 2.9×10-6 ( 293K / K )2 = 0.3716 ∆r G m = -zFE = - 2 × 96500C ·mol -1×0.3716V = -71718.8J = -71.72kJ ·mol -1 ∆r S m = - (∂∆r G m / ∂T )p = zF (∂E / ∂T )p = zF (1.881×10-3 - 5.8×10-6 T / K ) V ·K -1 = 2×96500C ·mol -1×(1.881×10-3 - 5.8×10-6 ×293K/ K ) V ·K -1 = 35.05 J ·K -1·mol -1∆r H m =∆r G m +T ∆r S m = -71720J ·mol -1 + 293K×35.05J ·K -1·mol -1 = - 61450J ·mol -1 = 61.45kJ ·mol -15. 解:(1) Langmuir 吸附等温式 :a a 1/V V ∞= bp 1/(1+bp 1) a a 2/V V ∞= bp 2/(1+bp 2) 得: b = [(a 1V p 2/a 2V p 1)-1] / [ p 2(1-a 1V /a 2V )]= [(1.12dm 3·kg -1×23kPa)/( 1.46dm 3·kg -1×11kPa)-1]/ [23kPa ×(1-1.12dm 3·kg -1/1.46dm 3·kg -1)] = 0.1128kPa -1a V ∞= a 1V (1+bp 1)/ bp 1 = 1.12dm 3·kg -1(1+0.1128kPa -1×11kPa)/ 0.1128kPa -1×11kPa = 2.02 dm 3·kg -1(2) 1kg 催化剂单分子层吸附的分子数= L a V ∞ /22.4dm 3·mol -1 = 6.022×1023mol -1×2.02 dm 3·kg -1/22.4dm 3·mol -1= 5.43×1022 kg-1正丁烷分子的截面积= 1.55×104 m2·kg-1/5.43×1022kg-1 = 28.5×10-20 m26. 解:(1)由一级反应的微分式:υ = kc A,得反应速率常数为k =υ/c A=5.3×10-2 s-1(2)由ln(c A,0/c A)= kt得ln(0.2/c A)=5.3×10-2Χ15c A=0.09 mol·dm-3(3) 根据阿雷尼乌斯关系式可得:ln(k’/k) = -(E a/R)[(1/T’)-(1/T)]ln(k’/5.3×10-2 )= -(183300/8.315)* [(1/630)-(1/600)]k’= 0.3047 s-1ln(1-x) =- k’t = - 0.3047*15可得x =90 %三、简答题(2题,共14分)1. 答:(1) KBr过量,为稳定剂。
物理化学试题及答案解析

物理化学试题一、单项选择题(每小题2分,共30分)1、下面说法错误的是(A)系统的同一状态可具有不同的体积(B)系统的不同状态可具有相同的体积(C)系统的状态改变了,可能所有的状态函数都要发生改变(D)系统的某一状态改变了,其状态必定发生改变2、理想气体经可逆与不可逆两种绝热过程,则(A)可以从同一始态出发达到同一终态。
(B)不可以达到同一终态。
(C)不能确定以上A、B中哪一种正确。
(D)可以达到同一终态,视绝热膨胀还是绝热压缩而定3、下述说法何者确……………………………………………( )(A)水的生成热即是氧气的燃烧热(B)水蒸汽的生成热即是氧气的燃烧热(C)水的生成热即是氢气的燃烧热(D)水蒸汽的生成热即是氢气的燃烧热4、反应2A+B=C中,反应物A从6mol变到2mol,则反应进度为(A)1mol (B)-2mol (C)4mol (D)2mol5、苯和甲苯在恒温恒压条件下混合形成理想液体混合物,其△mix S… ( )(A) >0 (B) <0 (C) =0 (D) 0第 2 页 共 9 页6、在刚性的密闭容器中,有下列理想气体反应达到平衡A(g)+2 B(g)⇔C(g),若在恒温下加入一定惰性气体,则平衡将(A) 向右移动 (B) 向左移动 (C) 不移动 (D) 无法确定 7、 纯水的凝固点为T f *,沸点为T b *,食盐稀溶液的凝固点为T f ,沸点为T b 则(A) T f *>T f ,T b *<T b (B) T f *<T f ,T b *>T b (C) T f *>T f ,T b *>T b (D) T f *<T f ,T b *<T b 8、反应A=2B 在温度T 时的速率方程为B B A dc dt k c =,则此反应的半衰期为(A) ln2/k B (B) 21n2/k B (C) k B ln2 (D) 2k B ln2 9、下列各式哪一个是对化学势的正确表示(A)C n ,p ,T B B n U ⎪⎪⎭⎫ ⎝⎛∂∂=μ (B)C n ,p ,T B B n G ⎪⎪⎭⎫⎝⎛∂∂=μ(C)Cn ,V ,S B B n A ⎪⎪⎭⎫⎝⎛∂∂=μ (D)C n ,V ,S B B n H ⎪⎪⎭⎫⎝⎛∂∂=μ10、在讨论稀溶液的蒸气压降低规律时,溶质必须是 (A) 挥发性物质 (B) 电解质(C) 非挥发性物质 (D) 气体物质11、在732K 时反应NH 4Cl(s) = NH 3(g) + HCl(g)的△r G m 为-20.8kJ·mol -1,△r H m 为154kJ·mol -1,则反应的△r S m 为(A)239J·K -1·mol -1 (B) 0.239J·K -1·mol -1 (C) 182J·K -1·mol -1 (D) 0.182J·K -1·mol -112、已知温度为T 时反应H 2O(g) = H 2(g)+1/2O 2(g) 的K 1和反应CO 2(g) = CO(g)+1/2 O 2 (g)的K 2,则反应CO(g)+H 2O(g)=CO 2(g)+H 2(g)的K 为(A) K =K 1+K 2 (B) K =K 1×K 2 (C) K =K 1/K 2 (D) K =K 2/K 1 13、在相图上,当系统处于下列哪一点时只存在一个相(A)恒沸点 (B) 熔点 (C) 临界点 (D) 低共熔点 14、一球形肥皂泡半径为r ,肥皂水溶液的表面张力为σ,则泡内的附加压力为(A)2p rσ∆= (B)4p r σ∆=(C)2p r σ∆=(D)4p r σ∆=15、在α、β两相中都含有A 和B 两种物质,当达到相平衡时 (A)()()B μαμα=A (B) ()()A μαμβ=A(C)()()B μβμβ=A (D)()()B μαμβ=A二、填空题(每小题2分,共10分)1、理想气体在定温下向真空膨胀, ΔU 0,ΔH 0,W 0,ΔS 0 (填>、< 或 = 符号)2、已知18℃时,Ba(OH)2、BaCl 2、NH 4Cl 溶液的极限摩尔电导率分别为22.8810-⨯、21.20310-⨯、21.29810-⨯21S m mol-⋅⋅,那么18℃时NH 4OH 的m ∞Λ= 。
物化期中练习

6、若将1mol、p=101.325kPa、t=100℃的液体水放入到恒温100℃的真空密闭的容器中,最终变为100℃、101.325kPa的水蒸气,△vapHm=40.63KJ·mol-1,则此系统在此过程中所作的功W=KJ,过程的△U=KJ
三、是非判断题(正确的打“√”,错误的打“×”,本大题共5小题,每小题1分,计5分)
1、一氧化碳的标准摩尔生成焓也是同温下石墨标准摩尔燃烧焓。()
2、实际气体绝热可逆过程的△S一定为零,△G不一定为零。()
3、拉乌尔定律和亨利定律既适合于理想溶液,也适合于稀溶液。()
4、对化学反应 ,当 时,产物的浓度最高。()
(A)mA>mB;(B)mA<mB;(C)mA=mB;(D)无法确定。
11、对于液态非理想混合物中的溶质B的活度系数γB,下列判断正确的是:
(A)当xB→0,γB→1;(B)当xB→1,γB→0;
(C)当xB→0,γB→0;(D)当xB→1,γB→1。
12、等温等压下,1mol C6H6与1mol C6H5CH3形成了理想溶液,现要将两种组分完
五、简答题(本大题共2题,第1题5分,第2题15分,共20分)
1、求证:
(2)对理想气体
2、A—B二元凝聚系统相图示意如右,试
1、标出各相区的稳定相态;
2、熔融液从a点出发冷却,经a→b→b′→b″
再到c点。试画出该过程的步冷曲线,并描
述冷却过程中的相变化情况。
3、当冷却到c点时,系统中两相物质的质量
3、已知下列反应的平衡常数:H2(g) + S(s) = H2S(s)①K1;S(s) + O2(g) = SO2(g)②K2。则反应H2(g) + SO2(g) = O2(g) + H2S(g)的平衡常数为__________。
《物理化学》期中试卷答案.doc

⋯⋯⋯2007 —2008 学年第一学期栏⋯⋯⋯⋯⋯⋯⋯⋯⋯化学与材料学院2006级材料科学与工程专业《物理化学》期中试卷答案题号分数试卷类别:开卷()闭卷(√)一考试用时:120分钟息号学⋯⋯⋯线⋯⋯⋯二三考试时间:2008 年10 月20 日上午考试地点:四(1)信生考⋯⋯⋯⋯名⋯姓订⋯⋯⋯⋯⋯⋯⋯⋯装⋯级⋯⋯班)⋯系⋯(⋯院⋯四(2)四(3)四(4)五(1)五(2)注意事项1、学生的院(系)别、专业、班级、姓名、学号必须填写在考生信息栏内指定的位置。
2、学生在考试之前必须填写考试时间和地点。
3、答题字迹要清楚,并保持卷面清洁。
总分评卷人⋯复核人⋯⋯⋯⋯⋯⋯⋯⋯⋯物理化学期中试卷共9页第 1 页⋯考生考试诚信承诺书在我填写考生信息后,表示我已阅读和理解《龙岩学院考试纪律与违纪处分办法》的有关规定,承诺在考试中自觉遵规守纪,如有违反将接受处理;我保证在本科目考试中,本人所提供的个人信息是真实、准确的。
考生签名:⋯⋯⋯⋯⋯⋯⋯⋯一、判断题(每题1分,其10 分,正确的打“√”,错误的打“×”。
)物理化学期中试卷共9页第 2 页1.绝热过程都是等熵过程(×)。
2.热力学第二定律的开尔文说法是:从一个热源吸热使之完全转化为功是不可能的(×)。
3. 在等温等压条件下,G 0 的过程一定不能进行(×)。
4. 在-10℃,101.325 kPa 下过冷的H2O ( l ) 凝结为冰是一个不可逆过程,故此过程的熵变大于零(×)。
5. 理想气体在恒定的外压力下绝热膨胀。
因为是恒压,所以H = Q;又因为是绝热,Q= 0 ,故H= 0 (×)。
6. 100℃时,1 mol H 2O(l) 向真空蒸发变成1mol H2O(g),这个过程的热量即为H2O( l ) 在100℃的摩尔汽化焓(×)。
7. 系统从同一始态出发,经绝热不可逆到达终态,若经绝热可逆过程,则一定达不到此终态(√)。
(完整版)物理化学习题答案
《物理化学》作业习题物理化学教研组解2009,7第一章 热力学第一定律与热化学1. 一隔板将一刚性决热容器分为左右两侧,左室气体的压力大于右室气体的压力。
现将隔板抽去左、右气体的压力达到平衡。
若以全部气体作为体系,则ΔU 、Q 、W 为正为负或为零解:0===∆W Q U2. 试证明1mol 理想气体在衡压下升温1K 时,气体与环境交换的功等于摩尔气体常数R 。
证明:R T nR V V p W =∆=-=)(123. 已知冰和水的密度分别为:×103kg ·m -3,现有1mol 的水发生如下变化: (1) 在100o C ,下蒸发为水蒸气,且水蒸气可视为理想气体; (2) 在0 o C 、下变为冰。
试求上述过程体系所作的体积功。
解:(1) )(m 1096.11092.010183633--⨯⨯⨯==冰V )(m 1096.1100.110183633--⨯⨯⨯==水V )(10101.3373314.81)(3J nRT V V p W e ⨯=⨯⨯===冰水- (2) )(16.0)108.11096.1(101325)(55J V V p W e =⨯-⨯⨯=-=--水冰4. 若一封闭体系从某一始态变化到某一终态。
(1)Q 、W 、Q -W 、ΔU 是否已经完全确定。
(2)若在绝热条件下,使体系从某一始态变化到某一终态,则(1)中的各量是否已完全确定为什么解:(1) Q -W 与ΔU 完全确定。
(2) Q 、W 、Q -W 及ΔU 均确定。
5. 1mol 理想气体从100o C 、0.025m 3 经过下述四个过程变为100o C 、0.1m 3: (1) 恒温可逆膨胀; (2) 向真空膨胀;(3)恒外压为终态压力下膨胀;(4)恒温下先以恒外压等于气体体积为0.05m 3时的压力膨胀至0.05 m 3,再以恒外压等于终态压力下膨胀至0.1m 3。
求诸过程体系所做的体积功。
物理化学__华东理工大学(4)--《物理化学》(上)中期学习测试卷及答案
液态环己烷的标准摩尔生成焓。
四、(12 分)
2mol 单原子分子理想气体在 25 C ,0.1MPa 下绝热可逆压缩至1MPa ,试求终态温度及 Q,
dV
与 dAT
=
− pdV
比较得:
p
=
nRT V
;
(13)ΔS; (14)ΔG; (15) ΔU; (16)ΔH; (17)S;
(18)237.14; (19) ∆rGmo- ;(20) 0K 时,纯物质完美晶体的熵等于零
二、(10 分,每小题 5 分) 1. 证明: 因为: dS = d-QV T = (nCV ,m T )dT , dS = d-Qp T = (nCp,m T )dT
交换,在 ΔU、ΔH、ΔS、ΔA、ΔG 中等于零的是_________________。 16. 在一绝热良好的、无摩擦、带有活塞的气缸中发生了一化学反应,系统温度和体积均发生
了变化。如反应过程始终处于恒压状态,在 ΔU、ΔH、ΔS、ΔA、ΔG 中等于零的是__________。 17. 理想气体经节流膨胀后,在 T、H、U 和 S 中,其值一定发生变化的是_______________。
六、(15 分) CS2 的正常沸点为 46.25 ℃,在此温度下的摩尔蒸发焓为 26.79kJ ⋅ mol−1 。若有1mol CS2 (l)
恒温恒压蒸发为 46.25°C ,101325Pa 的蒸气,试求该过程的 Q 、W 、∆U 、∆H 、∆S 、∆A 和
东华大学物理化学考试复习题
9 下图是SiO2-Al2O3体系在高温区间的相图,本相图在 耐火材料工业上具有重要意义,在高温下,SiO2有白 硅石和磷石英两种变体,AB是这两种变体的转晶线, AB线之上为白硅石,AB线之下为磷石英。 (1)指出各相区分别 由那些相组成; (2) 图中三条水平线 分别代表那些相平衡 共存; (3) 画出从x、y、z点 冷却的步冷曲线。 (莫莱石的组成为 2Al2O3.3SiO2)
1 (1) 在298.2K时,将1mol O2从101.325kPa等温压缩到 6×101.325kPa,求Q、W、ΔU、ΔH、ΔG、ΔS。 (2)若自始自终用6×101.325kPa的外压等温压缩到终态, 求上述各热力学量的变化值。
2 -59℃过冷二氧化碳液体的饱和蒸气压为3495mmHg;同 温度二氧化碳固体的饱和蒸气压为3249mmHg;求1摩尔过 冷液体二氧化碳凝固变成固体的△G
ห้องสมุดไป่ตู้
8 下述电池在298k时的电动势为1.0896V, 电动势的温度
系数是-9.45×10-4 V.K-1, Hg(l)│Hg2Cl2(s)│HCl (0.1mol.l-1)│Cl2 (g, 101325Pa), Pt 1) 写出电池内所起反应的化学反应式 2) Hg2Cl2的标准生成吉布斯自由能是多少?(298K) 3) Hg2Cl2的标准生成焓是多少?(298K) 4) 已知Hg(l), Cl2(g)的标准熵在298k时分别为77.4 J.K-1. mol-1, 223.0 J.K-1.mol-1, 求Hg2Cl2的标准熵是多少? 5) 当此电池在等温可逆放电时,电池是从外界吸收热量还 是向外界放出热量?
6 燃料电池的电池反应为 : H2(g)+O2(g)─→H2O(l) 已知EΦ (O2,H+,H2O)=1.229 V, (A) 写出电池表示式及电极反应 (B) 当H2,O2的压力都为pΦ 时,计算电动势值 (C) 计算电池反应的平衡常数 (D) 计算每摩尔H2(g)所能作出的最大电功 7. 某溶液中反应开始前含有NaOH和CH3COOC2H5的浓 度均为1.00×10-2 mol· -3, 在298 K时,10 min内有39 dm %的CH3COOC2H5分解,而在308 K时,10 min内分解了 55%。试求288 K时,若有24.2%的CH3COOC2H5分解, 需时多少?已知反应为二级。
第一学期物理化学期中试卷
第一学期物理化学期中试卷一、选择题(30分)1.恒容下,一定量的理想气体,当温度升高时内能将------------()A.降低B.增加C.不变D.增加、减小不能确定2.热力学第二定律不正确的说法是----------------------------()A.不可能把热从低温热源传到高温热源而不引起其他任何变化B.功可以全部转化成热,而热不可能全部转化成功C.不可能从单一热源取出热使之全部转化为功而不引起其他任何变化D.第二类永动机是不可能造成的3.当以5mol H2气与4mol Cl2气混合,最后生成2mol HCl 气。
若以下是其基本单元,则反应进度ζ应是--------------------------------()H2(g)+Cl2(g)=2HCl(g)(A)1mol(B)2mol(C)4mol(D)5mol4.戊烷的标准摩尔燃烧焓是-3520KJ/mol,CO2(g)和H2O(l)的标准摩尔生成焓分别是-395KJ/mol和-286KJ/mol,则戊烷的标准摩尔生成焓为----()A.2839KJ/molB.-2839KJ/molC.171KJ/molD.-171KJ/mol5.对于理想气体的内能有下述四种理解(1)状态一定,内能也一定(2)对应于某一状态的内能是可以直接测定的(3)对应于某一状态,内能只有一个数值,不可能有两个或两个以上的数值(4)状态改变时,内能一定跟着改变;其中正确的是----------------------------------------------()A.(1)(2)B.(3)(4)C.(2)(4)D.(1)(3)6.有一容器四壁导热,上部有一可移动的活塞,在该容器中同时放入锌块和盐酸,发生化学反应后活塞将上移一定距离,若以锌和盐酸为体系则-----()A.Q<0,W=0,ΔrU<0B.Q=0,W<0,ΔrU<0C.Q<0,W<0,ΔrU=0D.Q<0,W<0,ΔrU<07.下列说法中,哪一个是错误的------------------------------()A.体系放出的热量一定等于环境吸收的热量B.体系温度的降低值一定等于环境温度的升高值C.热力学平衡时体系的温度与环境的温度相等D.若体系1与体系2分别与环境达成热平衡,则此两体系的温度相同8.1mol单原子分子理想气体从298K,202.65KPa经历:(1)等温(2)绝热(3)等压。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物化练习卷
班级学号:姓名:
一、选择题(10题,各1分)
1.1mol 单原子理想气体从298K,20
2.65kPa 经历①等温可逆过程; ②绝热可逆过程;
③等压; 三条途径膨胀使体积增加到原来的2倍,所作的功分别为W1,W2, W3,三者的关系是: ( B )
(A) W1> W2> W3 (B) W2> W1> W3
(C) W3> W2> W1 (D) W3> W1> W2
2、理想气体在绝热条件下,经恒外压压缩至稳定,此变化中的体系熵变∆S体及环境熵∆S环
应为: ( C )
A. ∆S体 > 0, ∆S环< 0
B. ∆S体 < 0, ∆S环 > 0
C. ∆S体> 0, ∆S环= 0
D. ∆S体< 0, ∆S环= 0
3、已知苯一乙醇双液体系中,苯的沸点是353.3K, 乙醇的沸点是351.6K, 两者的恒沸组成为:含乙醇47.5%(摩尔分数),沸点为341.2K。
今有含乙醇77.5%的苯溶液,在达到气、液平衡后,气相中含乙醇为y2,液相中含乙醇为x2。
问:下列结论何者正确? ( C )
A. y2 >x2
B.y2 =x2
C. y2<x2
D. 不确定
4、理想气体反应CO(g)+2H2(g) = CH3OH(g)的∆r G mθ与温度T的关系为:∆r G mθ=-21660+52.92T,若要使反应的平衡常数K pθ >1,则应控制的反应温度: ( C ) A.必须低于409.3℃ B.必须高于409.3K
C.必须低于409.3K
D.必须等于409.3K
5、25℃时水的饱和蒸气压为 3.168kPa, 此时液态水的标准生成吉布斯自由能∆f G mθ为-237.19kJ·mol-1,则水蒸气的标准生成吉布斯自由能为: ( D )
A. -245.76kJ·mol-1
B. -229.34kJ·mol-1
C. -245.04kJ·mol-1
D. -228.60kJ·mol-1
6、在标准压力和268.15K时,冰变为水,体系的熵变∆S 体应: ( A )
A. 大于零
B. 小于零
C. 等于零
D. 无法确定
7、一定量的理想气体,从同一初态分别经历等温可逆膨胀、绝热可逆膨胀到具有相同压力的终态,终态体积分别为V1、V2。
( C )
A. V1 < V2
B. V1 = V2
C. V1 > V2
D. 无法确定
8、2mol A物质和3mol B物质在等温等压下混和形成液体混合物,该系统中A和B的偏摩尔体积分别为1.79*10-5m3·mol-1, 2.15*10-5 m3·mol-1, 则混合物的总体积为:(C )
A. 9.67*10-5m3
B. 9.85*10-5m3
C. 1.003*10-4m3
D. 8.95*10-5m3
9、在刚性密闭容器中,有下列理想气体的反应达到平衡
A(g) + B(g) =C(g) 若在恒温下加入一定量的惰性气体,则平衡将( C ) A. 向右移动 B. 向左移动
C. 不移动
D. 无法确定
10、 298K时,HCl(g,Mr=36.5)溶解在甲苯中的亨利常数为245kPa·kg·mol-1,当HCl(g)在甲苯溶液中的浓度达2%时,HCl(g)的平衡压力为: ( A )
A. 138kPa
B. 11.99kPa
C. 4.9kPa
D. 49kPa
二、计算题(3题)
1、 0.5mol氧气(理想气体),经过下列三步可逆变化回复到原态:
1.从2pθ , 5dm3在恒温T1下压缩至1dm3
2.恒压可逆膨胀至5dm3,同时温度由T1变至T2;
3.恒容下冷却至始态T1,2pθ , 5dm3。
试计算:(1)T1 , T2;(2)经此循环的ΔU总,ΔH总,Q总,W总。
(12分)T
=244 K, T2= 1220 K,ΔU总= 0 J ,ΔH总=0 J,Q总=-2423 J, Q总=2423 J
1
2、将495.5 K,600 kPa的1 mol N2绝热可逆膨胀到100 kPa,试求该过程的Q,W,ΔU,ΔH,ΔA,ΔG,ΔS体,ΔS隔离。
已知S
(N2,495.5 K)=191.5 J·K-1·mol-1。
设N2为理想气体。
m
(13分)
Q=0 ,ΔS=0,ΔS隔离=0,T2=297.0 K,W=ΔU= n C v,m(T2-T1)= - 4.126 kJ
ΔH=n C p,m(T2-T1)=-5.776 kJ ,ΔA=ΔU-SΔT=33.89 kJ ,ΔG=ΔH-SΔT=32.24 kJ
3、某体积可变的容器中,放入7.82g N2O4(g),此化合物在298K时部分解离。
N2O4(g)2N O2(g)
实验测得pө下,容器体积为2.425dm3,求
(1)N2O4的解离度α及解离反应的Kө和∆r Gmө。
(假设气体为理想气体)
(2)此时,控制体系体积为2.425dm3不变,测得实验温度为348K时,实验测得压力为
1.77p ө时,该温度下解离度α为多少?(14分)
设解离度为α, 容器中N2O4的物质的量:
n (N2O4)=7.82/92.0=0.085 mol
N 2O 4(g ) 2N O 2(g )
平衡时 n (1-α) 2n α
∑ni=n (1+α)
pV =∑ni RT =n (1+α)RT , 得α=0.152
=0.0954
∆rGm ө= – RT ln K ө= 5.82 kJ ⋅mol-1
2)pV =∑ni RT =n (1+α)RT
α=0.751
4、333K 时,溶液A 和溶液B 完全反应,蒸气压分别等于40.40kPa 和80.0kPa 。
在该温度时A 和B 形成稳定化合物AB ,AB 的蒸气压为13.3kPa ,假定由A 和B 组成的溶液为理想溶液,求:333K 时,一个含有1mol A 和4mol B 的溶液的蒸气压p (kPa)和蒸气组成y AB 。
P=13.3×0.25+80×0.75=63.3 kPa
y AB =13.3×0.25/63.3=0.053 ⎪⎪⎭⎫ ⎝⎛∑=i n n p p K K O O )1()1()2(22422ααα+-=∑=n n n n n n i O N NO 2
2
14αα-=。
