细胞周期的流式检测方法
细胞周期预操作(BD)
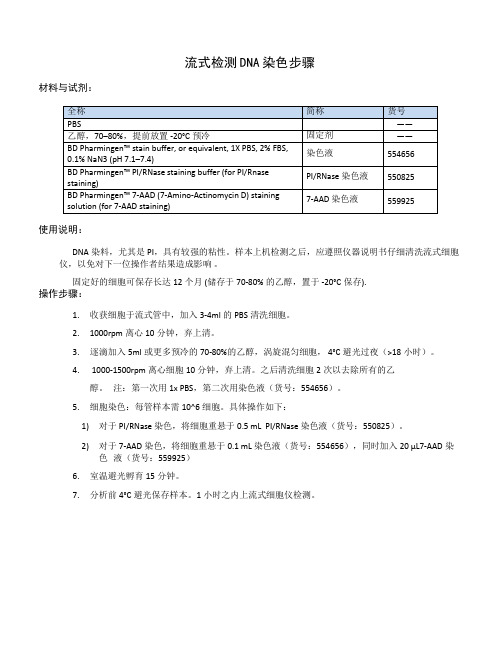
流式检测DNA染色步骤
材料与试剂:
使用说明:
DNA染料,尤其是PI,具有较强的粘性。
样本上机检测之后,应遵照仪器说明书仔细清洗流式细胞仪,以免对下一位操作者结果造成影响。
固定好的细胞可保存长达12个月(储存于70-80%的乙醇,置于-20°C保存).
操作步骤:
1. 收获细胞于流式管中,加入3-4ml的PBS清洗细胞。
2. 1000rpm离心10分钟,弃上清。
3. 逐滴加入5ml或更多预冷的70-80%的乙醇,涡旋混匀细胞,4°C避光过夜(>18小时)。
4. 1000-1500rpm离心细胞10分钟,弃上清。
之后清洗细胞2次以去除所有的乙醇。
注:第一次用1xPBS,第二次用染色液(货号:554656)。
5. 细胞染色:每管样本需10^6细胞。
具体操作如下:
1) 对于PI/RNase 染色,将细胞重悬于0.5mLPI/RNase 染色液(货号:550825)。
2) 对于7-AAD染色,将细胞重悬于0.1mL染色液(货号:554656),同时加入20μL7-AAD染
色液(货号:559925)
6. 室温避光孵育15分钟。
7. 分析前4°C避光保存样本。
1小时之内上流式细胞仪检测。
流式细胞术测定细胞周期

流式细胞术测定细胞周期一、实验原理碘化丙锭(PI)可以与细胞内DNA和RNA结合,采用RNA抑制剂将RNA 消化后,通过流式细胞术检测到的与DNA 结合的PI的荧光强度直接反映了细胞内DNA 含量的多少。
由于细胞周期各时相的DNA 含量不同,通常正常细胞的G1/G0期具有二倍体细胞的DNA含量(2N),而G2/M期具有四倍体细胞的DNA 含量(4N),而S期的DNA含量介于二倍体和四倍体之间。
因此,通过流式细胞术PI染色法对细胞内DNA含量进行检测时,可以将细胞周期各时相区分为G1/G0期,S期和G2/M 期,并可通过Multicycle软件计算各时相的百分率。
值得注意的是, PI不能通过细胞膜完整的细胞(如活细胞和早期凋亡细胞) ,在标本制备时,必须先用乙醇或其他破膜剂增强细胞膜的通透性,才能使PI进入细胞内与细胞内的核酸结合。
乙醇通常为终浓度为70%的冷乙醇。
二、实验准备1、试剂胰酶、PBS、纯乙醇(4℃)、RNase A、Triton X-1002、主要器材300目尼龙过滤网三、实验步骤1、每个样品细胞数不得少于100万。
2、胰酶消化,收集细胞(贴壁细胞)或1000rpm离心5分钟直接收集细胞(悬浮细胞)。
3、4℃ PBS洗一次,将细胞重悬于0.3ml 4℃ PBS,加入0.7ml 4℃的纯乙醇,将枪头伸入液面下,轻轻打入乙醇,轻柔混匀两次,4℃固定过夜。
4、1000rpm离心5分钟,去上清,加入染色缓冲液PI染色缓冲液:50 μg/ml PI0.1 mg/ml RNase A0.05% Triton X-100总体积1ml/样品,37℃孵育40分钟。
5、1000rpm 离心5分钟,小心去除上清,加入1ml PBS,轻柔混匀,300目过滤,上机检测。
流式检测细胞周期要点

1.收集细胞;~5000rpm离心5min,收集沉淀,重悬于200ul的PBS中,再次离心收集沉淀;%冰冻乙醇(-20度保存)4度固定过夜or-20度固定1h;4.离心收集沉淀,PBS洗一次(视沉淀量可忽略);5.沉淀重悬于200~500ul的PBS,加入Rnase A 37度水浴1h;目纱布过滤至流式管,加入PI染色,4度避光30min-1h,上机器。
1、Q:要做胃粘膜组织的DNA含量及倍体检查,但取材后要等几个星期才会做流式细胞术检查,请问:胃组织要怎样保存好呢?用低温保存,还是用乙醇固定?或者固定后再低温下保存?A:我做过乳腺细胞的DNA含量测定,取得组织以后,先处理成单细胞悬液,然后再加70%冰乙醇固定,要保证冰乙醇的最终浓度为50%,这样固定的细胞悬液可以至少保存12小时,最多可保存一个月,上机检测前再加PI综合染液。
我就是这样做的,保存了将近三个星期,结果还可以,变异系数为5%.2、实验中想用PI分析细胞周期及凋亡率,请教几个问题:Q:(1)所用的RNAs酶用什么配制呢?用PBS配吗?A:RNaseA用PBS配制没有问题,但是注意要沸水浴去除DNase的活性。
Q:(2)测细胞周期和凋亡率时都要用RNAs酶,可以一起检测吗?A:用流式细胞仪测定时细胞周期和凋亡率是同时测定的,不用担心。
Q:(3)Triton-x-100是固定剂吧,用了70%的冷乙醇(是4℃吗?),是不是就不用Triton-x-100固定了?A:Triton X-100是起透化作用的,不是固定剂,可以用75%的乙醇于-20度固定。
Q:(4)还要设什么内参标准(5%鸡红细胞)吗?A:对照肯定是需要的,这个根据自己的需要进行设置。
Q:(5)不用试剂盒行不行啊?A:完全可以不用试剂盒。
以下提供一个自己的实验步骤供参考:(1)200×g离心10min收集细胞;(2)弃去上清,PBS漂洗一次,将细胞重悬于预冷的80%乙醇中,-20°C固定24h以上;(3)进行流式细胞仪检测前,200×g离心10min收集固定后的细胞;(4)PBS洗涤一次,200×g离心10min收集细胞;(5)将细胞重悬于含100ug/ml RNase A和50ug/ml PI的PBS中,室温孵育30min;(6)将经PI染色和RNase A消化后的细胞悬液用300目的尼龙膜过滤后即可利用流式细胞仪进行细胞周期分布和凋亡细胞定量的分析。
流式检测细胞周期和凋亡实验步骤

流式细胞技术检测细胞周期分布1) 已转染miRNA mimics的细胞培养达到85%融合时,用胰酶消化细胞。
1000 rpm,离心5min,收集细胞沉淀;2) 已消毒的PBS重悬细胞,1000 rpm/min,离心5 min,收集细胞。
重复此步骤2次,以除去胰酶;3) 加入预冷的70%乙醇固定细胞过夜;4) 第二天1000rpm,离心5 min,收集细胞沉淀,PBS重悬两次,以除去乙醇;5) 离心后加入500ul PBS重悬细胞,加入碘化丙锭(PI)染色液(含50mg/L PI,1g/L Triton X-100,100g/L RNase)混匀,4℃避光孵育30min。
6)流式细胞仪FACStar (美国BD公司) 检测。
接收的信号经Cellquest软件处理,对检测细胞的荧光强度进行分析。
实验重复3次。
2.11流式细胞技术检测细胞凋亡水平1) 已转染BART6-3p mimics的细胞培养达到85%融合时,将上清培养液收集至离心管内;常常2)PBS清洗贴壁细胞3次,用胰酶消化细胞(注意:消化时不可过度),收集于第一步的离心管内;3) 1000 rpm离心5min,弃上清收集细胞,PBS轻轻重悬后,加入195 ulAnnexin V-FITC结合液,吹打混匀,重悬细胞,加入5ul Annexin V,轻轻混匀。
避光室温孵育15min;4) 加入10 ul PI染色液,轻轻混匀,避光孵育;空白:Annexin V—FITC结合液200ul双染:185ul结合液+5 ulAnnexin V—FITC+10ul PI单染:195ul结合液+5ul Annexin V—FITC190ul结合液+10PI5) 进行流式细胞仪检测,Annexin V-FITC为绿色荧光,PI为红色荧光。
细胞周期和DNA倍体流式细胞术分析

细胞周期和DNA倍体流式细胞术分析细胞周期是指细胞从一个有丝分裂开始到下一次有丝分裂开始所经历的一系列连续的时期。
细胞周期通常被分为四个阶段:G1期(Gap1期,细胞生长期)、S期(DNA合成期)、G2期(Gap2期,前期细胞准备期)和M期(有丝分裂期)。
细胞周期具有非常重要的生物学意义,它决定了一个细胞的生长、分化和复制过程。
了解细胞周期的调控机制对于研究细胞增殖、肿瘤发生机制等具有重要的意义。
DNA倍体流式细胞术是一种通过荧光染料标记DNA,利用流式细胞术分析细胞DNA含量和细胞周期的技术。
该技术通过细胞破碎和DNA染色使细胞DNA可见,并将细胞通过流式细胞术导入流式细胞仪中进行分析。
DNA倍体流式细胞术可以帮助我们了解细胞的DNA含量和倍体状态,从而推测细胞的生活循环和增殖能力。
DNA倍体流式细胞术的主要步骤包括:1.细胞处理:将细胞收集并进行预处理,使其达到适宜测量的状态;2.细胞固定:使用适当的化学物质固定细胞,以便于后续的染色和分析;3.DNA染色:通过DNA染色剂(如荧光素染剂)染色细胞DNA,使其可见;4.流式细胞术:将染色后的细胞通过流式细胞仪分析流式细胞术;5.数据分析:根据细胞染色的荧光强度和形态学特征来判断细胞周期和DNA倍体状态。
细胞周期和DNA倍体流式细胞术在分析细胞生命活动和基因组复制状态方面具有广泛的应用前景。
首先,细胞周期和DNA倍体流式细胞术可用于研究肿瘤的发生和发展机制。
在肿瘤细胞中,由于基因突变等原因,细胞周期的调控失去平衡,细胞周期的不正常分布和DNA倍体异常常常出现。
通过检测细胞周期和DNA倍体状态,可以更好地了解肿瘤细胞的生物学特性,从而为肿瘤治疗提供理论依据。
其次,细胞周期和DNA倍体流式细胞术还可用于研究细胞分化和发育过程。
细胞分化和发育是多个细胞周期的连续进行,通过细胞周期和DNA 倍体状态的测量,可以揭示不同细胞类型的分化和发育过程的调控机制,进一步推测细胞分化和发育的时序和关系。
流式细胞术步骤

6. 加入5 μL RNaseA(10 mg/ml)37℃消化1小时,加入终浓度50 mg/mL碘化丙啶(propidium iodide PI)4℃避光染色过夜(或者 37℃避光染色1小时),在EPICS XL流式细胞仪上分析。
对照
照
C组
IR DyLight 488 实验组3
GLUT4检测 类型 NC组 细胞
NC组
一抗 无 IgG2a
NC组 A组
B组
C组
GLUT4 GLUT4 GLUT4 GLUT4
二抗 无
目的 空白 对照
DyLight DyLight DyLight DyLight
567
567
567
567
同型对照 实验组对 实验组1 实验组2 照
2. 胰酶消化收集细胞,并用1 mL PBS缓冲液清洗剩余细胞一次, 全部加入15ML管中。
3. 800 rpm离心5分钟,去除上清,加5 mL PBS缓冲液重悬细胞, 再次离心弃上清,重复两次,最后重悬细胞于0.5mL PBS中。
4. 用低速振荡器边震动边加入5 mL预冷的70%乙醇,固定,4℃过 夜。
DyLight 567
实验组3
(因为IR 和GLUT4同样为鼠源抗体,并且分开进行检测,二抗颜色可 进行调试。尽可能选择效果好的同一种二抗。可能使用一绿一红,也可 能使用两个同样颜色的二抗)
利用流式细胞抗体检测检测细胞膜表面蛋白的变化
1. 细胞按每孔4×105 个的密度接种于60 mm细胞培养皿内,培养过 夜后,用相应药物处理细胞。
2.胰酶消化收集细胞,并用1 mL PBS缓冲液清洗剩余细胞一次,全部 加入15ML管中。 3 . 800 rpm离心5分钟,去除上清,加5 mL PBS缓冲液重悬细胞,再次
流式检测细胞周期protocol

PI染色检测细胞周期
1、HepG2细胞培养至70%左右,细胞铺板(60mm小皿),8万/皿,饥饿48小时,加药处理96h(加药组10万/皿)
2、收集培养基,2ml胰酶消化细胞,新培养基3ml重悬,收集细胞悬液,1000rpm,5min离心
3、弃去上清,加入1ml预冷的PBS充分重悬细胞,转移到1.5ml的EP管
4、混匀,4°,600g,5min离心
5、弃去上清,用250ul预冷的PBS重悬细胞,充分重悬,加入至750ul冰浴的无水乙醇,轻轻吹打混匀;
6、用封口膜封口,—20°,4h,最好过夜,可在—20°保存1w左右;
7、染色:
㈠、除去封口膜,加入500ulPBS重悬细胞,4°,600g,5min离心;
㈡、弃去上清,加入1ml预冷的PBS洗涤一次;
㈢、同上离心,弃去上清;
㈣、每管加入200ul PBS +2ul RnaseA(100µg/ml)溶液缓慢充分混匀后,室温,避光孵育30min, 再加2.5ul PI(250µg/ml),室温避光15min;
㈤、24h内流式检测。
试剂:RnaseA,beyotime,10mg/ml,ST576
PI, beyotime,20 mg/ml,ST512。
细胞周期的流式检测方法

细胞周期的流式检测方法细胞周期(cell cycle )是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,分为G0/G1 期、S 期、G2/M 期。
在科研实践中,很多实验具有对细胞群体的周期分布进行检测的需求。
细胞群体周期测定的方法有很多种,最常用的是PI(碘化丙啶)渗入DNA 进行染色,然后通过流式细胞仪检测PI 从而测定细胞群体的周期分布。
因此,下面笔者主要通过BD(Becton&Dickinson )公司生产的BD FACSCalibur 流式细胞仪测定PI 标记的细胞群体为例,对细胞周期的流式检测方法进行阐述。
一、PI 染色步骤概略1、单细胞悬液离心,1500rpm , 5min ,弃上清。
2、PBS 1ml 离心,弃上清。
3、70%酒精2ml,4℃,30min,离心,弃上清液。
4、PBS 1ml 离心,弃上清。
5、RNase A 的PBS 溶液(20ug/ml) ,500ul,37℃,30min,离心弃上清。
6、PBS 1ml 离心,弃上清。
7、PI 的PBS 溶液(50ug/ml) ,500ul,室温避光孵育30min。
8、吹打混匀,300 目筛网过滤至流式管中,4℃保存,待测。
二、Calibur 仪器设置及数据收集1、依次打开Calibur 机器电源、电脑开关和CellQuest Pro 软件,按快捷键Command+B 连机,按快捷键Command+1 、2、3、4 调出Detectors/Amps 面板、Threshold 面板、Compensation面板和Status面板,软件的操作界面如图 1 所示。
图1. Cell Quest Pro 软件操作界面2、建立实验模板,包括FSC/SSC 散点图、FL2-W/FL2-A 散点图和FL2-A 直方图。
因为PI在Calibur 上是由488nm 的激光器激发,530/30 滤光片收集信号,所以选择FL2 通道进行检测。
细胞周期是2N 和4N 的循环,所以FL2 通道的Mode 参数应设置为Lin 模式,同时阈值(Threshold)的Primary Param 参数设置为FL2-H ,Four Color DDM Param 参数设置为FL2,如图2、图 3 所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
细胞周期的流式检测方法
细胞周期(cell cycle)是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,分为G0/G1期、S期、G2/M期。
在科研实践中,很多实验具有对细胞群体的周期分布进行检测的需求。
细胞群体周期测定的方法有很多种,最常用的是PI(碘化丙啶)渗入DNA进行染色,然后通过流式细胞仪检测PI从而测定细胞群体的周期分布。
因此,下面笔者主要通过BD(Becton&Dickinson)公司生产的BD FACSCalibur流式细胞仪测定PI标记的细胞群体为例,对细胞周期的流式检测方法进行阐述。
一、PI染色步骤概略
1、单细胞悬液离心,1500rpm , 5min,弃上清。
2、PBS 1ml离心,弃上清。
3、70%酒精2ml,4℃,30min,离心,弃上清液。
4、PBS 1ml离心,弃上清。
5、RNase A的PBS溶液(20ug/ml),500ul,37℃,30min,离心弃上清。
6、PBS 1ml离心,弃上清。
7、PI的PBS溶液(50ug/ml),500ul,室温避光孵育30min。
8、吹打混匀,300目筛网过滤至流式管中,4℃保存,待测。
二、Calibur仪器设置及数据收集
1、依次打开Calibur机器电源、电脑开关和CellQuest Pro软件,按快捷键Command+B连机,按快捷键Command+1、
2、
3、4调出Detectors/Amps面板、Threshold面板、Compensation 面板和Status面板,软件的操作界面如图1所示。
图1. Cell Quest Pro软件操作界面
2、建立实验模板,包括FSC/SSC散点图、FL2-W/FL2-A散点图和FL2-A直方图。
因为PI 在Calibur上是由488nm的激光器激发,530/30滤光片收集信号,所以选择FL2通道进行检测。
细胞周期是2N和4N的循环,所以FL2通道的Mode参数应设置为Lin模式,同时阈值(Threshold)的Primary Param参数设置为FL2-H,Four Color DDM Param参数设置为FL2,
如图2、图3所示。
图2. Detectors/Amps面板图3. Threshold面板3、设置细胞的收集数目,数据保存的路径和名称,如图4、图5所示。
图4. Acquisition&Storage面板
图5. Acquisition面板
4、在图6所示的操作面板中,勾选Setup选项,点击Acquire按钮进行数据收集并调节FL2通道的电压值使得周期图位于FL2直方图中合适的位置。
调好电压后,将Setup选项勾掉,点击Acquire按钮收集数据。
数据以.FCS格式保存在之前预设好的文件夹中。
图6. Acquisition Control面板
三、细胞周期数据的分析
流式数据分析软件有很多种,比如Cell Quest、BD FCAS Diva、FlowJo等等。
但对于细胞周期数据的分析,统一的分析步骤如下:
1、建立FSC/SSC散点图,圈定细胞群,如图7所示。
图7. FSC/SSC散点图
2、建立FL2-W/FL2-A散点图,去除粘连细胞,如图8所示。
图8. FL2-W/FL2-A散点图
3、建立FL2-A直方图分析细胞周期,如图9所示。
图9. FL2-A直方图。
