芳香性和芳香族化合物的取代反应
芳香族取代反应

活性药物成分的合成
某些芳香族取代反应可以用于直接合成活性药物成分,如合成抗高血压药物、抗 抑郁药物等。
工业生产中的芳香族取代反应
染料工业
芳香族取代反应在染料工业中应用广泛,如偶氮染料、荧光 染料的合成。
高分子材料
芳香族化合物可用于合成高分子材料,如聚酯、聚酰胺等, 这些高分子材料在工业生产中有广泛应用。
分类
根据取代基和环的大小,芳香族化合 物可以分为苯环化合物、萘环化合物 、蒽环化合物等。
芳香族化合物的结构特点
共轭体系
芳香族化合物具有环状共轭体系,这是其具有特殊性质的关键结构特点。
π电子
芳香族化合物中的π电子数决定了其化学性质,尤其是取代反应的性质。
芳香族化合物的性质
稳定性
芳香族化合物在化学反应中相对稳定,不易发 生氧化或还原反应。
当底物中的取代基具有给电子效应时, 有利于亲核取代反应;而具有吸电子 效应时,则有利于亲电取代反应。
反应条件的影响
温度
01
温度对芳香族取代反应的影响显著,高温有利于提高反应速率,
但可能导致副反应增多。
压力
02
对于某些需要特定压力条件的芳香族取代反应,压力的变化会
对反应产生影响。
溶剂
03
溶剂的极性和酸碱性等性质会影响反应物的溶解度和反应中间
常见的自由基取代反应有烯烃的氧化、烷烃的氧化等。
04构的影响
取代基的性质
底物中取代基的性质对芳香族取代反 应的速度和选择性有重要影响。一般 来说,取代基的电子效应和立体效应 都会影响取代反应的进程。
取代基的电子效应
取代基的立体效应
芳香族化合物亲核取代反应机理以及在有机合成中的应用

芳香族化合物亲核取代反应机理以及在有机合成中的应用化学化工学院院化学S0702 3071302012 王辰孖我们生活的环境中,有机物随处可见。
可以说,有机物在我们的生活中有着举足轻重的地位。
那么,什么是有机物呢?从定义的角度来说,有机物通常指含碳元素的化合物,或碳氢化合物及其衍生物总称为有机物。
还有几点需要说明的是:1.有机物是有机化合物的简称。
目前人类已知的有机物达3000多万种,数量远远超过无机物。
2.早先,人们已知的有机物都从动植物等有机体中取得,所以把这类化合物叫做有机物。
到19世纪20年代,科学家先后用无机物人工合成许多有机物,如尿素、醋酸、脂肪等等,从而打破有机物只能从有机体中取得的观念。
但是,由于历史和习惯的原因,人们仍然沿用有机物这个名称。
3.有机物一般难溶于水,易溶于有机溶剂,熔点较低。
绝大多数有机物受热容易分解、容易燃烧。
有机物的反应一般比较缓慢,并常伴有副反应发生。
4.有机物种类繁多,可分为烃和烃的衍生物两大类。
根据有机物分子中所含官能团的不同,又分为烷、烯、炔、芳香烃和醇、醛、羧酸、酯等等。
根据有机物分子的碳架结构,还可分成开链化合物、碳环化合物和杂环化合物三类。
5.有机物对人类的生命、生活、生产有极重要的意义。
地球上所有的生命体中都含有大量有机物。
有机物的种类繁多,其中非常重要的一类就是芳香族化合物。
历史上曾将一类从植物胶中取得的具有芳香气味的物质称为芳香族化合物。
但根据气味分类并不科学,现在是指分子中至少含有一个苯环,具有与开链化合物或脂环烃不同的独特性质(称芳香性,aromaticity)的一类化合物。
如苯、萘、蒽及其衍生物。
苯是最简单、最典型的代表。
它们容易发生亲电取代反应、对热比较稳定,主要来自石油和煤焦油。
有些分子中虽然不含苯环但也具有与苯相似的芳香性的化合物,称为非苯芳香化合物,如草盐、薁等。
分子中含有苯环的有机化合物叫做芳香族化合物。
它包括芳香烃及其衍生物,如卤代芳香烃、芳香族硝基化合物、芳香醇、芳香酸等。
有机化学第八版答案

有机化学第八版答案简介《有机化学第八版答案》是针对《有机化学》第八版教材的辅助答案,并提供了详细的解题步骤和解释。
本答案的目的是帮助有机化学学习者更好地理解和掌握课本的知识,并提供参考答案以帮助他们解决习题和案例。
目录1.分子结构与化学键2.烷烃与立体化学3.单键取代反应:化学与构造概念4.单键取代反应:醇、卤代烷和乙烯5.双键取代反应与消除反应6.单键酸碱反应:有机酸碱7.单键酸碱反应:胺和两性物质8.烷基卤化物:亲电取代反应9.芳香化合物:芳香性和芳香族化合物的亲电取代10.碳负离子的核磁共振:1H和13C NMR谱11.乙炔的化学12.合成和反应阻碍:有机化学第一部分的综合问题13.活性化学和有机催化剂:库伦沙酮反应14.极性加合反应:加酸和加氢内容1. 分子结构与化学键本章介绍了有机化学的基础知识,包括化学键的概念、键的能量和长度、电子结构和杂化等内容。
这些知识对于后续章节的学习非常重要,因为它们构成了有机分子的基本组成部分。
2. 烷烃与立体化学本章主要介绍了烷烃的命名和构象,以及立体化学的基本原理。
学习者将学会如何使用化学式和线结构式来命名烷烃,并了解立体化学对有机化学反应的影响。
3. 单键取代反应:化学与构造概念本章介绍了单键取代反应的基本概念和机制。
学习者将学会如何预测和解释单键取代反应的产物,并理解反应速率与反应物浓度之间的关系。
4. 单键取代反应:醇、卤代烷和乙烯本章主要讨论了醇、卤代烷和乙烯的单键取代反应。
学习者将学会如何预测和解释这些化合物的反应,以及它们在实际合成中的应用。
5. 双键取代反应与消除反应本章介绍了双键取代反应和消除反应的基本原理和机制。
学习者将学会如何预测和解释这些反应的产物,并了解双键和消除反应在有机合成中的应用。
6. 单键酸碱反应:有机酸碱本章主要讨论了有机化合物的酸碱性质和相关的反应机制。
学习者将学会如何判断和解释有机化合物的酸碱性,并预测其在酸碱反应中的行为。
芳香族化合物的取代反应

(D)H (D)H NO2 H(D) HNO3/H2SO4 H(D) H(D) kH/kD = 1.05 (D)H (D)H NO2 H(D) NO2 H(D)
容易观察到较小的同位素效应 (kH/kD = 1-3,而非正常的6-7): 第一步具有可逆性及由此引起 的分配效应所产生的。
:
:
:
:OMe
+
H
E
H
E :
H
E : :OMe H E
H
E
:OMe
+
:
:OMe
+
H E
H E
+
化学
-I > +C ,钝化苯环:X
Cl
Cl E H H E
B间位定位基 的定位能力次序大致为(从强到弱) 2.
-NR3, -NO2, -CF3, -CCl3, -CN, -SO3H, -CHO, -COR,-COOH, -CONH2。
反 应 进 程
化学
2. 同位素效应 当一个反应进行时,在决定反应速率的步骤中发生 了反应物分子的同位素键的断裂,将显示初级动力 学同位素效应。最常见的是,反应物分子中的氢被 氘取代后,反应时有速率上的不同,这种变化称为 氘同位素效应,用kH/kD表示。 例如下列反应有 动力学同位素效 应,说明质子是 在决速步的失去 的:
CH2CH3 H
CH3CH2 + [AlCl3Br]
CH2CH3
H+
+
HBr AlCl3
化学
特点: 1°常用的催化剂是无水AlCl3,此外 FeCl3、BF3、 无水HF、SnCl4、ZnCl2、H3PO4、H2SO4等都有催 化作用。
芳香亲核取代机理

芳香亲核取代机理芳香亲核取代是一种有机化学反应,常用于合成芳香化合物。
本文将详细介绍芳香亲核取代的机理和应用。
一、芳香亲核取代的机理芳香亲核取代是指在芳香环上发生亲核试剂(如醇、胺等)与芳香化合物之间的反应。
它是通过亲核试剂攻击芳香环上的亲电位点来实现的。
1. 亲电位点的生成芳香化合物的亲电位点主要是指芳香环上的取代基,如卤素、羰基、羟基等。
亲电位点的生成可以通过酸性、碱性等条件来实现。
例如,将氯代苯溶于碱性溶液中,可以使氯代苯分子中的氯离子脱去,形成亲电位点。
2. 亲核试剂的攻击亲核试剂中具有亲核性的原子(如氧、氮等)会攻击芳香环上的亲电位点。
攻击过程中,试剂中的亲核原子与亲电位点形成共价键,并将芳香环上的取代基替换出去。
3. 生成产物芳香亲核取代反应生成的产物是具有亲核试剂取代芳香环上取代基的芳香化合物。
产物的结构取决于亲电位点的位置以及亲核试剂的性质。
二、芳香亲核取代的应用芳香亲核取代反应广泛应用于有机合成领域,可以用于合成各种具有芳香性质的化合物。
以下是一些常见的应用:1. 合成酚类化合物亲核试剂常用醇来代表,通过芳香亲核取代反应可以将醇中的氧原子取代芳香环上的取代基,生成酚类化合物。
酚类化合物在医药、染料等领域有广泛的应用。
2. 合成胺类化合物亲核试剂常用胺类化合物来代表,通过芳香亲核取代反应可以将胺中的氮原子取代芳香环上的取代基,生成胺类化合物。
胺类化合物在制药、农药等领域具有重要的应用价值。
3. 合成醛酮类化合物亲核试剂常用醛酮类化合物来代表,通过芳香亲核取代反应可以将醛酮中的氧原子取代芳香环上的取代基,生成醛酮类化合物。
醛酮类化合物在有机合成中起到重要的中间体作用。
4. 合成杂环化合物除了上述常见的亲核试剂外,还可以使用含有其他原子的化合物,如含有硫、氧、氮等的化合物,来进行芳香亲核取代反应,合成具有杂环结构的化合物。
总结:芳香亲核取代是一种重要的有机合成反应,可以用于合成各种具有芳香性质的化合物。
芳香烃及亲电取代反应
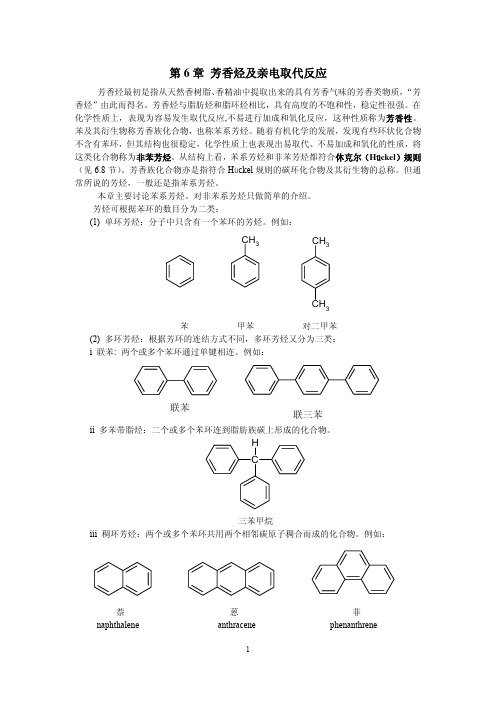
苯的三元取代物有三种,取代基的相对位置可用阿拉伯数字标记,也可用“连”、“偏”、
“均”表示。例如:
CH3 CH3
CH3 CH3
CH3
CH3
CH3
H3C
CH3
1,2,3-三甲苯
1,2,4-三甲苯
1,3,5-三甲苯
(连三甲苯)
(偏三甲苯)
(均三甲苯)
当侧链结构比较复杂或侧链上有不饱和键时,可以把苯环作为取代基来命名。例如:
H
C
三苯甲烷 iii 稠环芳烃:两个或多个苯环共用两个相邻碳原子稠合而成的化合物。例如:
萘 naphthalene
蒽 anthracene
1
菲 phenanthrene
6.1 单环芳烃的同分异构和命名
苯的一元取代物只有一种,命名时称为“某苯”。如:
CH3
H3C CH
CH3
甲苯
异丙苯
苯的二元取代物有三种结构,两个取代基在苯环上的相对位置常用邻、间、对来表示,
H
HCH
C
C
简写为
或
C
C
HCH
H
因此这个式子称凯库勒结构式。 现代物理方法证明,苯分子的六个碳原子和六个氢原子在同一平面上。六个碳原子构
成平面正六边形,碳碳键长均为 0.14nm,比碳碳双键键长(0.134nm)长,比碳碳单键键长
3
(0.154nm)短;碳氢键长均为 0.108nm;所有的键角都为 120°。
H
120o
H
H
0.14nm
H
H
H 0.108nm
根据杂化轨道理论,苯分子中的碳原子都是 sp2 杂化,每个碳的 3 个 sp2 杂化轨道分别
第5章芳香性和亲电取代1

对称性匹配的两个原子轨道形成分子轨道示意图
A
B
+. +.
2S 2S
-
++
-
2Px 2Px
.+.
σ 成键
+. . - σ *反键
. . -
+
- σ 成键
- + + . - σ *反键
++
-2Py2Py
. +..
-
+
.-
-
+
π成键 π *反键
A 对称性匹配的两个原子轨道组合 B 形成的分子轨道
2. 休克尔(Hückel)分子轨道理论
环丙烯负离子的性质
E
反键轨道 E
反键Hale Waihona Puke 道成键轨道成键轨道
环丙烯正离子分子轨道能级图
环丙烯负离子分子轨道能级图
三、非苯芳烃结构
环丙烯正离子
白色固体,与空气隔绝,室温可以保存 几天。
环丁烯双正离子:
环戊二烯负离子:
成 成
杯烯:
环庚三烯正离子:
环庚三烯异硫腈酯离解
蓝烃: 一个天蓝稳定的化合物,偶极矩约为1.0
环辛三烯正离子:
化学位移: 8.5 (H2~H6) 6.4 (H1,H7) 5.1 (Hb) -0.73 (Ha)
∏电子为6个, 具有芳香性。 ∏76
同芳体系是指被一个或两个Csp3隔开的环 状∏体系,其分子的几何形状允许P轨道超越间 隔间隙进行有效重叠,且∏电子数符合4n+2规则 而具有芳香性。因此产生芳香性的结构,叫同芳 结构。此结构可由NMR证明。
E
反键轨道
E
反键轨道
06 芳香性和芳香化合物的取代反应(2)

+ +NO2 slow
- H+ +
3.卤化
芳香化合物在催化剂(常用铁粉)存在下用 溴或氯处理发生溴化或氯化作用,真实的催化 剂不是铁,而是反应中生成的少量溴化铁或氯 化铁。氯化铁及其它Lewis酸也常直接用来作 为催化剂。活泼的芳香族化合物,如芳胺、酚、 多烷基苯等则不需要催化剂,实际上这些化合 物的溴化或氯化用溴或氯的稀水溶液在室温即 能迅速进行。芳胺一般不易停留在一取代上, 而且易同时发生邻、对位的多取代反应。要制 取芳胺的一元卤代物,常将氨基酰化降低其活 性,再进行卤化。
其它常用的卤化试剂还有N-氯代酰胺,HOCl,tBuOCl,NBS,BrCl,ICl及IBr。特别强的卤化试剂 为氯化硫S2Cl2及三氯化铝-硫酰氯混合物。过氧化苯 甲酰和卤化锂亦为很好的卤化试剂。
加入Lewis酸作为催化剂时,它和氯或溴作用形成 Cl+或Br+。
FeCl3 + Br2
[FeCl3Br] - + Br+
邻、对位定位基
邻对位定位基主要使反应易于进行(卤素例外),并 使新导入基团进入苯环的邻位或对位。其特点为与苯环 相连的原子外层均有未成对电子或可与苯环大π键发生 σ-π超共轭的基团,根据电子效应可分为以下几类:
(1) 表现-I及+C效应的基团 这类基团根据其-I和 +C效应的相对大小又可分为两类:
H2S2O7 RSO2Cl + AlCl3
R3CX + MXn (X = Br、Cl ) R3COH + H+
R2C=CR’2 + H+ RCH2X + MXn RCOX + MXn
HX R2C=O + H+ R2C=O + MXn
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
19
(5) 杂环及稠杂环体系
20
4. 同芳性
同芳香性是指越过一个或几个饱和碳原子形成 的稳定的环状共轭体系。它也服从 Hü ckel规则, 但在离域的π体系中插入了另外具有饱和中心的原 子,不过其几何构型允许 P 轨道跨过这个隔离的 间隙而仍然能相互重叠。即在某些环状正离子中 无正统的芳香体系的 σ骨架,也无连续的 P电子轨 道排列,但当体系由于不相邻碳上 P 轨道部分重 叠且具有 4n+2 个 π 电子的环状排列时也会呈现出 一定的芳香稳定性。
28
2. 芳环上亲电取代反应实例: 芳环上可以发生的基本的五类亲电取代反应,又称 为“五化”反应: 卤化: 硝化: 磺化: 烷基化:
酰化:
29
芳环上可以发生通常的“五化”反应外,还可发 生下述几种反应: ① 氢交换反应:
这类反应主要用以研究反应历程,但也可以通过
此反应将D或T引入芳环。例如:用D2O处理苯酚,
其他一些具有同芳香性的化合物:
23
二、芳香族化合物的取代反应
(一) 亲电取代 1. 反应机理:加成消除反应
H E E Nu
+ - 慢
E
快
σ-络合物 (芳正离子) 芳正离子生成的一步是决定反应速率的一步。
24
例:硝化反应
用硫酸催化硝基正离子的形成机理:
2H2SO4 HNO3 H3O
+ HSO 2 4
Fe2+
b. 环庚三烯正离子
- H+ H H
O O
+ +
14
c. 环丙烯正离子
15
(3) 稠环体系
休克尔规则只涉及单环体系,有关理论可用于多
环体系[只计算边缘的平面电子]。
联亚苯:
有芳香性
薁:
有芳香性
16
A 和 B 哪个酸性强?
戊塔烯:
17
(4) 富烯体系
富烯:
环丙富烯:
18
判断下面各化合物有无芳香性?
31
③ Gattermann-Koch反应
该反应的历程一般认为,可能并不经过HCOCl, 而是直接通过下式形成:
32
④ Gattermann反应 芳香化合物在三氯化铝或二氯化锌存在下与 HCN和HCl作用,在芳环上发生甲酰化反应。
反应历程:
33
Schmidt 改进法:
用Zn(CN)2/HCl 代替HCN/HCl,以避免直接使用 剧毒的HCN。
7
3. 化合物芳香性的判断
(1) 轮烯
a. [10]-轮烯
A是全顺式,B是反-顺-顺-顺-顺式,C是反-顺-反-顺顺式,经光谱测定三者都没有芳香性。
原因:角张力及环内两个氢的排斥力影响分子的共 平面性;[10]-轮稀的不稳定性表现为:容易热环 化为双环体系。 8
用一个原子代替两个氢原子得1,6-桥-[10]-环共 轭多烯,有芳香性:
有芳香性
[22]-轮烯已被合成,具有芳香性。某些 [26]-轮烯 为平面的,有芳香性,而一些 [26]-轮烯和 [30]-轮烯 是非平面的,没有芳香性。大环难于达到充分有效 的芳香化合物那样的电子离域。
12
(2) 芳香离子 a. 环戊二烯负离子
是否具有芳香性?
13
环戊二烯负离子的应用之一:制备二茂铁
X
F Cl Br I
电 负 性 降 低
-I 效应 依次 减小
硝化时邻位异构体的比例: X o% F 12 Cl 30 Br I 38 41
47
③ 溶剂效应
CS2 O CH3C Cl AlCl3 PhNO2
O CCH3 O CCH3E+被硝基苯溶剂化,体积增大,较大的空间效 应使它进入1位。
48
④ 螯合效应:
43
E: 具有-I,-C效应的基团:-NO2, -CN, -COR
2. 影响邻位和对位定向比的因素 ① 空间效应:空间效应越大,对位产物越多。
C(CH3)3 H2SO4 C(CH3)3
100 %
SO3H
当苯环上已有一个邻对位定位基时,产物中邻 位和对位取代的比例与原有定位基和新引入基的体 积有关。
3
2. Hü ckel 4n+2规则
A: Hü ckel 规则的内容:含有4n+2个π电子的平面共 轭单环化合物应具芳香性。 B: Hü ckel 规则的理论解释: 用分子轨道理论计算证明:凡含有4n+2个π电子 的平面共轭单环体系,π电子数恰好是成键轨道 数的二倍。
4
例:五元环共轭体系,其分子轨道数及其能量如下 图表示:
36
⑥ Reimer-Timann反应 酚的碱溶液与氯仿作用,在芳环上生成醛类的反应。
反应机理:
适用于酚类和某些杂环 衍生物的甲酰化, 甲酰 基一般主要取代在羟基 37 的邻位.
⑦ Vilsmeier 反应 用N-取代的甲酰胺作酰化剂,三氯氧磷催化活 泼芳环、杂环化合物甲酰化的反应。
反应机理:
38
21
在同芳香体系中,外加原子的存在将破坏离域π体 系的物理连续性却不破坏离域体系。同芳香化合物 显示所有的芳香性,如额外的稳定性和维持环流的 本领。如环辛四烯溶于浓硫酸发生质子化,生成同 芳香性正离子:
越过一个饱和碳原子的同芳香性叫单同芳香体系, 越过二个或三个饱和碳原子的则分别叫双同或三同芳 香体系。 22
A. 当π电子数为4,则电子填充如下:
π电子数不是成键轨道数的2倍,因此无芳香性。
5
B. 当π电子数为5,则电子填充如下:
π电子数也不是成键轨道数的2倍,因此无芳香性。 C. 当π电子数为6,则电子填充如下:
π电子数刚好是成键轨道数的2倍,因此有芳香性。
6
能级的确定方法:圆内接N边形法
轨道数由参与共轭的原子数确定;再根据电子数对 轨道填充情况,即可对体系有无芳香性作出判断, 结果与Hü ckel 规则结论一致。
×
23 1
23 1 23 1
×
6 2
6 2 6 1
63% = 43.5 3% = 2.1 34% = 46.9
×
×
×
×
54
如氯苯和苯甲醚进行硝化反应时,分速度因数分别为:
氯苯的三个分速度因数均小于1,卤素是致钝基团, 且 fm << fp, E+进入间位的可能性很小。 苯甲醚: fp ≈ fo >> fm -OCH3 对邻、对位具有+C, -I效应,+C > -I。对间 位,只有-I, 而无+C效应。
在加热下缓慢发生邻位、对位氢交换,用强酸则交 换比较快。
30
② 原位取代
在芳环上已有取代基的位置上,发生的取代反应:
CH3
NO2OAc Ac2O
CH3 NO2 +
CH3
CH3
CH(CH3)2
CH(CH3)2 82%
+ NO2 CH(CH3)2 NO2 8% 10%
取代基消除的难易程度取决于带正电荷基团的稳 定性和产物的稳定性。上述反应中,+CH(CH3)2比 较稳定,异丙基容易作为正离子消除。
CH2 O CH3 CH2 CH2 OCH3 CH2 69% (邻) NO2 28%(对)
NO2 O NO2
-NO3-
CH3 CH2 O CH2 NO2
CH2 O CH3 CH2 H - H+ 产物 NO2
能够发生螯合效应的条件: a. 杂原子能与试剂结合; b. 所形成环为五员环或六员环。
49
另一个螯合效应例子为Kolbe-Schmidt反应: 酚钠与CO2在加压下发生羧基化生成酚酸的反应。
34
⑤ Hoesch反应
用腈和HCl使芳环酰化的反应称为Hoesch反应。
这个反应与Gattermann反应类似,只是以RCN代
替HCN,故反应结果得到芳酮:
机理:
35
Hoesch反应的影响因素: 要求电子云密度高,即苯环上一定要有2个供电 子基(一元酚、胺一般不发生反应,会生成O-或 N-酰化产物); 适用于间苯二酚、间苯三酚及其 相应的醚,某些杂环如吡咯也能发生反应。
42
③ 定位基与反应活性的本质关系:电子效应
A:具有+C ,+I效应的基团:-OB: +C > -I效应的基团: -OR, -OH, -NR2 C: 只有+I效应的基团:-R D: F: +C < -I效应的基团:-X 只有 -I效应的基团:R3N+-, -CCl3,H3N+-, -CH2Cl,-CH2CN
α-氯化亚胺
反应底物主要是比苯更活泼的芳烃,如:蒽,酚, N,N-二取代苯胺,酚醚,吡咯等。 N-取代的甲酰胺最常用的是:N,N-二甲基甲酰 胺,N-甲基-N-苯基甲酰胺。 39
Vilsmeier反应实例:
40
(二) 定位效应与反应活性 1. 定位基和定位效应 ① 定位基
苯环上原有的取代基对后面引入基团的亲电取代 反应有两种影响--定位与速度,因此,通常将原有取 代基分为: 第一类 定位基: 第二类 定位基:
9
b. [14]-轮烯
有两对氢原子会发生相互作用, 共轭能不高。
有3个环内H彼此干扰,共 轭能也不高。
但是,NMR表明有反磁环流,键长也没有交替现象, 说明有芳香性, 但芳香性不明显。
10
[14]-轮烯衍生物有芳香性:
两对氢原子的相互作用,可使其成桥键来消除 掉,有芳香性。
11
c. [18] - 轮烯
k取代 k苯
×
6 y
×
Z该位置产物的百分比
y:该位置的数目
分速度因数实际上是取代苯再进行取代时,其中 某个位置进行取代时与苯中该位置进行取代时的反应 速率之比。
