碘量法-亚硝酸钠法
2021药学专业知识-药物分析-氧化还原滴定

2021药学专业知识-药物分析:氧化还原滴定自己整理的2021药学专业知识-药物分析:氧化还原滴定相关文档,希望能对大家有所帮助,谢谢阅读!氧化还原滴定氧化还原滴定是基于氧化还原反应的滴定方法。
指示剂:自指示剂、特殊指示剂、氧化还原指示剂。
氧化还原滴定广泛应用于药品检验:碘量法、铈滴定法、亚硝酸钠滴定法。
测试点1:碘量法1.直接碘量法:滴定反应:标准I2溶液还原药物2I-滴定溶液:三氧化二砷,碘滴定溶液——校准的标准物质终点判断:淀粉指标;I2本身滴定条件:中性、酸性和弱碱性2.间接碘量法:(1)置换碘量法:氧化性药物I-I2(过量KI)I2 Na2S2O3Na2S4O6 2I-滴定溶液:硫代硫酸钠滴定剂——,用于校准的标准物质,重铬酸钾终点判断:淀粉指示剂(添加在终点附近)(2)残留碘量法:强还原性药物I22I-(过量) I2(残留)Na2S2O3Na2S4O6 2I-滴定溶液:碘滴定溶液硫代硫酸钠滴定溶液终点判断:淀粉指示剂(添加在终点附近) 碘量法分析的药物:维生素c。
测试地点2:铈测量方法滴定反应:Ce4 e Ce3淡黄色无色滴定溶液:硫酸铈滴定溶液——,用于校准的标准物质,三氧化二砷终点判断:自我指标;邻菲罗啉亚铁反应条件:酸度铈定量法分析药物:硝苯地平测试点3:亚硝酸钠滴定滴定反应:ar-NH2 nano 22 HCl [ ar-nn]clnac l2h2o芳香伯胺重氮化反应滴定溶液:亚硝酸钠滴定溶液——校准用标准物质:对氨基苯磺酸终点判断:永久滴定法、外指示剂法(碘化钾-淀粉试纸)反应条件:(1)酸的种类和浓度:HBr HCl H2S04或HN03的酸度不宜过高。
(2)反应温度和滴定速度:温度过高,亚硝酸会挥发分解;温度太低,反应速度太慢。
滴定速度在:前快后慢(3)添加溴化钾的作用:加速重氮化反应亚硝酸盐滴定法分析的药物:盐酸普鲁卡因、磺胺甲恶唑、磺胺嘧啶、用氢氧化钠滴定溶液(0.1000 mol/L)滴定20.00ml盐酸溶液(0.1000 mol/L),滴定突跃范围的pH值为A.1.00~3.00B.3.00~4.30C.4.30~9.70D.8.00~9.70E.9.70~10.00“正确答案”c“答案分析”氢氧化钠滴定盐酸如同强碱滴定强酸,PH值突跃范围应跨越酸碱范围,只有C符合。
碘量法测亚硝酸盐的含量

碘量法测亚硝酸盐的含量1实验原理(1)采用间接碘量滴定法测定腌制蔬菜中亚硝酸盐含量变化,主要是利用了亚硝酸盐在酸淀性(Ph=4)[6]条件下具有氧化性,可以把碘离子还原成为为碘单质。
碘单质与粉溶液形成蓝色物质,同时淀单质与硫代硫酸钠发生反应,使蓝色物质褪色。
根据这个特点,用硫代硫酸钠来滴定还原出来的碘单质,计算出碘单质的质量,再间接计算出样品中亚硝酸盐的质量。
2计算公式X=2(V1-V2)×C×M×103/m式中:X---试样中亚硝酸盐(NaNo2计算)总含量,单位为毫克每千克(mg/g)V1---滴定式样所用硫代硫酸钠标液的体积V2---滴定试剂空白所用硫代硫酸钠标液的体积C---硫代硫酸钠标准溶液的浓度,单位为摩尔每升(mol/L)M---亚硝酸钠的摩尔质量(69g/mol)单位为克每摩尔(g/mol)m---式样质量,单位为克(g)3材料与方法3.1实验材料不同时期腌制的萝卜3.2实验仪器绞肉机、分析天平、滴定管、移液管(20ML)、容量瓶(500ML)、锥形瓶、烧杯、玻璃棒、滤纸、pH试纸3.3实验试剂(1)盐酸溶液(1:1):量取250毫升的浓盐酸,稀释至500毫升。
(2)碘化钾溶液:称取碘化钾10克,置于50毫升烧杯中加水溶解,然后洗入100毫升容量瓶中,定溶,摇匀,备用。
(3)淀粉溶液(0.5%):称取2.5克的淀粉,用水稀释至500毫升,加热溶解。
(4)硫代硫酸钠标准溶液(0.1mol/L):称取25克硫代硫酸钠置于1000ML新煮沸经冷却的蒸馏水中,待完全溶解后加入约0.2克的碳酸钠(Na2Co3),摇匀,置于棕色瓶中,放于暗处7天后标定。
4实验步骤4.1数据计算经过对文献的阅读参考发现,对测定食品和腌制蔬菜中亚硝酸盐的含量的方法很多,其中以分光光度法居多,但也有其他方法。
并且间接碘量滴定法一般都用于对蔬菜、水果、饮料中维生素C的测定。
而运用这种方法测食定食品蔬菜中亚硝酸盐含量的文献只有一篇,既周石洋和陈玲的《滴定法测定食品中亚硝酸盐含量的研究》。
简述碘量法的原理及其应用

简述碘量法的原理及其应用1. 碘量法原理碘量法是一种常用于分析物质中含碘量的方法,它基于碘在溶液中与物质发生化学反应的特性。
碘量法的原理可简述如下:1.碘-亚碘溶液反应原理:碘和亚碘溶液之间存在可逆反应,即: I2 +I- ⇌ I3- 碘(I2)可以与碘离子(I-)反应生成三碘化离子(I3-),反应过程中溶液的颜色由无色或黄色变为深蓝色。
2.碘与被测物质反应:碘与许多有机物和无机物质均可发生反应。
碘量法利用了这种特性,在反应过程中测定溶液中的碘含量。
3.碘滴定法:碘量法中常用的方法是使用亚碘酸钠(NaI3O6)作为滴定剂,将溶液滴加到含有淀粉指示剂的样品中,直到溶液颜色由蓝色变为无色。
滴定过程中所使用的溶液体积即为所用的碘量。
2. 碘量法的应用碘量法在实际应用中具有广泛的用途。
下面列举了一些常见的应用领域及实例:2.1 食品安全检测•碘含量分析:碘在食品中的含量对人体健康至关重要。
碘量法可以用于测定食品中的碘含量,如海产品、食盐、蔬菜等。
通过监测食品中的碘含量,可以评估人们膳食中碘摄入的情况,从而制定相应的健康策略。
•防腐剂检测:碘是一种常用的食品防腐剂,用于防止食品腐败。
使用碘量法可以对食品中的碘含量进行测定,确保食品中防腐剂的合理使用,保证食品的安全性。
2.2 环境监测•水质检测:水中含有的碘物质对人体健康影响重大。
通过碘量法可以测定水中的碘含量,例如测定饮用水中的碘含量,从而评估水质是否符合标准,保障人们的健康。
•气体检测:碘量法可以用于检测大气中的碘含量。
例如,在核电站事故发生后,可以采集空气样品,使用碘量法测定空气中的碘含量,评估事故对环境的影响程度。
2.3 医药领域•药物分析:碘量法可以应用于药物分析中,例如测定药物中的碘含量。
这对于评估药物的质量、确定药物成分以及监测药物稳定性等方面具有重要意义。
•甲状腺功能检测:碘在人体内起着关键的甲状腺代谢作用。
在医学领域中,碘量法可以用于检测甲状腺功能异常,如测定血液中的甲状腺激素含量,评估甲状腺功能的正常与否。
氧化还原滴定法-2

0.5355V
测定对象:还原性物质
θ
θ
I2 /2 I
滴定条件:酸性、中性或弱碱性溶液
若pH>9 3I2 +6OH-
5I- + IO3+3H2O
4
例:Vc含量的测定
CH2OH HC OH
O O
HO
OH
+ I2
CH2OH HC OH
O O
O
O
+ 2HI
滴定剂:I2 测定条件:稀HAc介质
指示剂: 淀粉(无色蓝色)
返滴定 置换滴定
强氧化性物质 非氧化还原性
CrO42-、S2O82-、ClO3-、 BrO3-、 IO3-、MnO4-、MnO2、PbO2等
Ca2+
加入C2O42-
试样 Ca2+
CaC2O4
洗涤,过滤, H2SO4溶解
C2O42-
KMnO184
例6-9:过氧化氢的测定 滴定反应:
2MnO4-+5H2O2+6H+
终点时: NO2-+ I- + H+
I2+ NO↑ + H2O
• 内指示剂 橙黄IV-亚甲蓝、中性红等。
• 永停滴定法(药典)
24
三、亚硝酸钠法的标准溶液
• 配制 • 标定
间接法 加 入 Na2CO3 作 稳 定 剂 (pH≈10) 棕色瓶贮存
对氨基苯磺酸
H2N
SO3H + NaNO2 + HCl
三、标准溶液
(一)碘标准溶液 (二)硫代硫酸钠标准溶液
间接法配制
12
(一)碘标准溶液(碘液)
• 配制 间接法 加入KI,加入HCl
棕色瓶贮存 稳定后标定
亚硝酸钠氧化法测定昆布中碘的含量
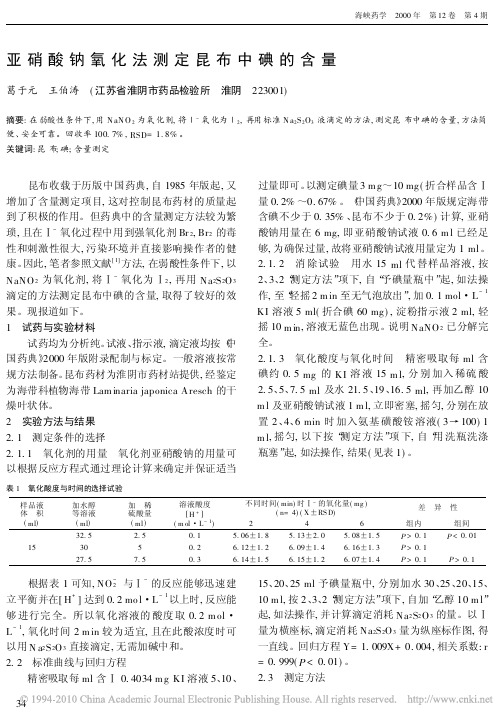
亚硝酸钠氧化法测定昆布中碘的含量葛于元 王伯涛 (江苏省淮阴市药品检验所 淮阴 223001)摘要:在弱酸性条件下,用N aN O2为氧化剂,将Ⅰ-氧化为Ⅰ2,再用标准N a2S2O3液滴定的方法,测定昆布中碘的含量,方法简便、安全可靠。
回收率100.7%,RSD=1.8%。
关键词:昆布;碘;含量测定 昆布收载于历版中国药典,自1985年版起,又增加了含量测定项目,这对控制昆布药材的质量起到了积极的作用。
但药典中的含量测定方法较为繁琐,且在Ⅰ-氧化过程中用到强氧化剂Br2,Br2的毒性和刺激性很大,污染环境并直接影响操作者的健康。
因此,笔者参照文献[1]方法,在弱酸性条件下,以NaNO2为氧化剂,将Ⅰ-氧化为Ⅰ2,再用Na2S2O3滴定的方法测定昆布中碘的含量,取得了较好的效果。
现报道如下。
1 试药与实验材料试药均为分析纯。
试液、指示液,滴定液均按《中国药典》2000年版附录配制与标定。
一般溶液按常规方法制备。
昆布药材为淮阴市药材站提供,经鉴定为海带科植物海带Lam inaria japonica Aresch的干燥叶状体。
2 实验方法与结果2.1 测定条件的选择2.1.1 氧化剂的用量 氧化剂亚硝酸钠的用量可以根据反应方程式通过理论计算来确定并保证适当过量即可。
以测定碘量3m g~10mg(折合样品含Ⅰ量0.2%~0.67%。
《中国药典》2000年版规定海带含碘不少于0.35%、昆布不少于0.2%)计算,亚硝酸钠用量在6mg,即亚硝酸钠试液0.6m l已经足够,为确保过量,故将亚硝酸钠试液用量定为1ml。
2.1.2 消除试验 用水15ml代替样品溶液,按2、3、2“测定方法”项下,自“予碘量瓶中”起,如法操作,至“轻摇2m in至无气泡放出”,加0.1mol・L-1 KI溶液5ml(折合碘60mg),淀粉指示液2ml,轻摇10m in,溶液无蓝色出现。
说明NaNO2已分解完全。
2.1.3 氧化酸度与氧化时间 精密吸取每ml含碘约0.5mg的KI溶液15m l,分别加入稀硫酸2.5、5、7.5ml及水21.5、19、16.5ml,再加乙醇10 m l及亚硝酸钠试液1m l,立即密塞,摇匀,分别在放置2、4、6min时加入氨基磺酸铵溶液(3→100)1 m l,摇匀,以下按“测定方法”项下,自“用洗瓶洗涤瓶塞”起,如法操作,结果(见表1)。
最新1碘量法测定方法 辽宁农业职业技术学院讲学课件

学习目标 复习提问 新课大纲 新课内容 本课小结 课后习题
4.永停滴定法 适用于容量分析中多种分析方法的终点指示。 本法采用2支相同的铂电极插入待滴定的溶 液中。当在电极间加一低电压(10~100mV) 时,若电极在溶液中极化,则在未到达滴定 终点时,仅有很小或无电流通过;但当到达 终点时,滴定液略有过剩,使电极去极化, 溶液中即有电流通过,电流计指针突然偏 转,不再回复。反之,若电极由去极化变为 极化,则电流计指针从有偏转回到零点,也 不再变动。该法仪器简单,操作方便,准确 可靠,所以应用非常广泛。
胸部CT:未见异常;脂肪肝
心脏彩超:左房大;主动脉瓣、二尖瓣轻度关闭不全;左室舒张功能减退, 收缩功能可
颈动脉B超:双侧颈动脉硬化并左侧斑块形成 腹部B超:轻度脂肪肝;前列腺增生
辅助检查
血常规未见异常, 尿常规:隐血:阴性,葡萄糖:3+,酮体:1+; 糖化血红蛋白:10.4%;葡萄糖:14.23mmol/L; 肝功能:谷丙转氨酶:70.0U/L,γ-谷氨酰酶:95.0U/L; 血脂:甘油三酯:4.40mmol/L,总胆固醇:6.38mmol/L; 电解质、凝血功能、心肌酶谱、甲状腺功能未见异常
学习目标 复习提问 新课大纲 新课内容 本课小结 课后习题
终点判断: 滴定条件
药物 直接滴定法
+淀粉变蓝色; 或本身是黄色
中性、酸性、弱碱性
安乃近、维生素C
学习目标 复习提问 新课大纲 新课内容 本课小结 课后习题
剩余滴定法 置换滴定法
强还原性药物与过量的I2 反应,剩余I2用硫代硫酸 钠滴定。
身指示剂法。如高锰酸钾滴
定液,在溶液中高锰酸钾
为紫红色,而其还原产
物MnO2则几乎
亚硝酸钠的标定结果判断

亚硝酸钠的标定结果判断【原创实用版】目录1.亚硝酸钠的概述2.亚硝酸钠的标定方法3.标定结果的判断4.标定结果的误差分析5.结论正文一、亚硝酸钠的概述亚硝酸钠(NaNO2)是一种无色或浅黄色的晶体,具有咸味,易溶于水。
在工业和生活中,亚硝酸钠被广泛应用于肉类食品的防腐、保鲜等领域。
然而,亚硝酸钠对人体具有一定毒性,因此对其含量的检测至关重要。
二、亚硝酸钠的标定方法亚硝酸钠的标定方法通常采用滴定法。
滴定法是一种通过向待测溶液中加入已知浓度的标准溶液,根据加入的标准溶液的体积和浓度计算待测溶液中物质含量的方法。
对于亚硝酸钠的标定,常用的是碘量法,即用碘液作为标准溶液进行滴定。
三、标定结果的判断标定结果的判断主要依据碘液的消耗量。
在滴定过程中,当亚硝酸钠与碘液完全反应时,溶液的颜色由无色变为黄色,且半分钟内不恢复原色,这说明亚硝酸钠已被完全氧化。
此时,通过测量消耗的碘液体积,可以计算出亚硝酸钠的含量。
四、标定结果的误差分析在标定过程中,可能会出现误差。
常见的误差有:1.操作误差:如滴定过程中读数不准确、体积计量误差等。
2.试剂误差:如标准溶液浓度不准确、试剂不稳定等。
3.待测液误差:如待测液的 pH 值、温度等条件对滴定结果产生影响。
为减小误差,可以采取以下措施:1.严格执行操作规程,提高操作技能。
2.选择合适的标准溶液,定期检查和调整浓度。
3.对待测液进行充分的预处理,保证滴定条件稳定。
五、结论亚硝酸钠的标定结果判断对于确保食品安全具有重要意义。
通过采用滴定法,可以较为准确地测定亚硝酸钠的含量。
第六章氧化还原滴定法碘量法

但温度不能高于900C,否则:
H2C2O4
CO2 +CO +H2O
2)酸度 一般在开始滴定时,溶液的酸度约为
0.5~1mol/L,滴定终了,酸度约为0.2 ~0.5
mol/L。 酸度过高,又会促使H2C2O4分解。
3) 滴定速度 开始滴定时速度不宜快,
否则,KMnO4来不及与C2O4 2- 反应, 便在热的酸性溶液中发生分解。
+= C H 3 C O O C H C H 2B r 2C H 3 C O O C H B r C H 2 B r
4 I4H O 2 22 I2H 2O
若在碱性溶液中,则发生:
32 I6 OH5 IIO 3 32 H O 42 IS 2 O 3 2 1 0O H 22 4 S 8 O I52 O H
间接碘量法的误差主要来源于两
方面:一是I2的挥发,二是I-在酸性 溶液中被空气中的O2氧化。
防止I2挥发的方法:1)加入过量的 KI;2)在室温中进行;3)使用碘瓶, 快滴慢摇。
(二)硫代硫酸钠标准溶液
1、配制方法
标定法
由于Na2S2O3 ·5H2O 晶体容易 风化,并含有少量 S、S2-、SO32-、 CO32-、Cl-等杂质,不能直接配制标 准溶液,配好的Na2S2O3溶液也不稳 定,浓度将逐渐发生变化,这是因为:
a、 溶于水中的CO2的作用,水中 CO2的存在,使水呈弱酸性,而Na2S2O3 在酸性溶液中会缓慢分解。
2、标定的方法
常用基准物:As2O3
As2O3+2NaOH
2NaAsO2+H2O
(溶解)
酸化后,加NaHCO3调pH值
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
四、滴定液的配制与标定
(一)I2滴定液的配制与标定
1、I2滴定液的配制 ①加入适量的KI,使生成,这样既可增加I2的溶解度,
还能降低其挥发性; ②加入少许盐酸,以除去碘中微量碘酸盐杂质,并
碱性介质: I-与S2O32-发生副反应,无计量关系
S2O32- + 2H+
SO2 ↑+ S↓+ H2O(分解)
4I2+ S2O32- +10 OH+5H O
8I- + 2SO42-
三、滴定条件的控制
1、酸度控制 直接碘量法、间接碘量法,均适合在PH=3-8的溶液中
2、终点控制——主要是淀粉指示剂的加入时机 直接碘量法:滴定开始时加入,终点时溶液由无色变为
可在滴定时中和配制硫代硫酸钠滴定液时加入的少量稳 定剂碳酸钠;
③为防止少量未溶解的碘影响浓度,需用垂熔玻璃 漏斗滤过后再标定;
④贮于棕色瓶中,密塞阴凉处保存,以避免KI的氧 化。
注意:用升华碘可直接配制滴定液。但因碘具有 挥发性和腐蚀性,不能用电子天平称量, 一般采用间接法配制碘滴定液。即先配制 近似浓度的滴定液,然后再标定。
c.水中微生物作用: S2O32- →Na2SO3 + S↓
四、滴定液的配制与标定
(二)Na2S2O3滴定液的配制与标定
2、 Na2S2O3滴定液的标定 可用于标定的物质很多。以K2Cr2O7基准物为例标定 ①原理
Cr2O72-+ 6I- (过量)+ 14H+
2Cr3++ 3I2 + 7H2O
(酸度高)
使 pH=9~10,放置7~8天,过滤。配制好的溶液应在棕 色瓶中暗处保存;如发现溶液变浑浊,应重新标定或弃 去重配。 不稳定原因:
a.水中溶解的CO2易使Na2S2O3分解; S2O32- + CO2 + H2O → HSO3- + HCO3- + S↓
b.空气氧化: 2S2O32- + O2 →SO42- + S↓
(助溶)
3 I-
I3
I
0.5345V
I2 / I 较小,I2是一种弱氧化剂,而I-是一种中等强
度的还原剂。
所以,碘量法既能测定氧化剂,还能测定
还原剂。I2/I-电对反应的可逆性好,副反应少, 淀粉指示剂指示终点灵敏,应用广泛。
一、直接碘量法
利用I2的弱氧化性质滴定还原性物质的方法。 滴定剂: I3- , 指示剂: 可溶性淀粉。
蓝色,即为终点。 间接碘量法:临近终点时(I2的黄色很浅)再加入淀粉
指示剂,溶液蓝色消失,即为终点。如过早加入淀粉,它 与I2会紧紧吸附在一起,到终点时蓝色不易褪去,终点延迟, 造成正误差。 3、挥发性控制:
①过量加入KI助溶,防止I2挥发。②溶液温度勿高。③ 碘量瓶中进行反应。④滴定中勿过分振摇。 4、返蓝现象:
②淀粉水解成糊精导致终点不敏锐 强碱性介质:I2发生歧化反应
3I2 + 6OH-
5I- + IO3- + 3H2O(歧化反应)
二、间接碘量法
利用I-的中等强度还原性滴定氧化性物质的方法。
滴定剂: Na2S2O3 , 指示剂: 可溶性淀粉。 原 理:①氧化剂与I-作用,使I-氧化而析出I2;
②用Na2S2O3标准溶液滴定析出的I2。
测定物:具有氧化性物质(电位值比它高的氧化性物质,
可在一定条件下,用I-还原,然后用Na2S2O3滴定 液滴定释放出的I2) 可 测:MnO4-,Cr2O7-、CrO4-、AsO43-、BrO3-、NO2-、Fe3+ IO3-、H2O2、CIO-、Cu2+等。 酸度要求:中性或弱酸性
强酸性介质:S2O32-发生分解导致终点提前; I-发生氧化导致终点拖后
四、滴定液的配制与标定
(一)I2滴定液的配制与标定
2、I2滴定液的标定 常用砒霜作为基准物质,溶于碱液中,使之生成亚砷酸
钠后再标定。
As2O3 + 6OH -
2AsO33- + 3H2O
AsO33- + I2 + 2H2O
H3AsO4 + 2 I - + H+
nI2 2nAs2O3
3、I2滴定液的标定条件 ①为使碘氧化亚砷酸钠的反应能定量进行,常加入碳
基本原理:
碘量法:利用I2的氧化性和I-的还原性进行滴定的分析方法。 为增加固体I2的水溶性,通常将I2溶解在KI溶液中,此时
I2以电I3-对的反形应式存在I2(+为了2e简化起见,I32-I一- 般仍I2简I 写 为 I02 .)53。35V
I2 + I I3- + 2e
I3-
酸氢钠,使溶液pH=8~9;②淀粉指示剂在滴定前加入。
4、I2滴定V As2 O3 I2
四、滴定液的配制与标定
(二)Na2S2O3滴定液的配制与标定
1、 Na2S2O3滴定液的配制 市售硫代硫酸钠常含有杂质,不能用直接法配制。 配制方法:加煮沸并冷却的蒸馏水水,加入Na2CO3
(一)维生素C(又称抗坏血酸)的质量分数测定
1、 原理
O
H OH
O
H OH
C-C=C-C-C-CH +I
O O HO H H O H H
2
C-C-C-C-C-CH +2HI
O O O H OH 2
2、步骤 精密称取维生素C试样约0.2g,加放冷的
测定物:具有还原性物质(用I2配制成的滴定液可以直 接滴定电位值比它低的,能被I2迅速氧化的强还 原性物质)
可 测:S2-、Sn2+、S2O32-、SO32-、As(Ⅲ)、维生素C等 酸度要求:弱酸性,中性,或弱碱性(pH<9) 强酸性介质:①I-发生氧化导致终点拖后;
4I-+O2 + 4H+
2I2 + 2H2O(氧化反应)
I2 + 2S2O32-
2I-+ S4O62- (加水稀释→弱酸性)
n
6n
Na 2S2O3
K 2Cr2O7
②指示剂:淀粉,近终点时加
终点:蓝色-亮绿色
③浓度计算
C
Na
2S2O3
6×
m K 2Cr 2O 7× 1000 M V K 2 Cr 2 O 7 Na 2 S 2 O 3
五、应用与实例
碘量法应用很广。直接碘量法可测定很多具有还原性药物 的含量,如维生素C、安乃近等;间接碘量法可测定很多具有 氧化性药物的含量,如高锰酸钾、葡萄糖等。
