杂化轨道理论要点
杂化轨道理论要点
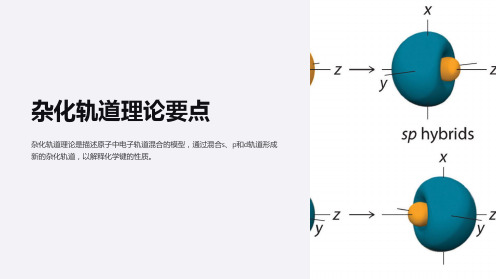
sp杂化轨道是s轨道和一个p轨道的线性组合, 形成两个等价的sp杂化轨道。
除了sp3、sp2和sp杂化轨道外,还存在其他 类型的杂化轨道,如dsp3、sp3d等。
杂化轨道的形成原理
1
轨道杂化形成过程
2
通过改变s和p轨道的比例和重叠程度,
可以形成具有不同方向性和能量的杂化
轨道。
3
电子排斥原理
电子在轨道中相互排斥,若s和p轨道重 叠,会使电子能量增加,因此形成了杂 化轨道。
能量最低原则
形成的杂化轨道应具有最低能量,以保 持系统的稳定性。
sp3杂化轨道
形状
应用
sp3杂化轨道呈四面体形状,分布在空间中四个等角。 sp3杂化轨道解释了甲烷分子中碳原子与四个氢原子 形成的四条等长和等角的化学键。
sp2 杂化轨道
形状
sp2杂化轨道呈平面三角形形 状,与未杂化的p轨道垂直。
应用
杂化轨道用于描述共价键中 电子的空间分布与方向性。
杂化轨道的类型
1 sp3杂化道
2 sp2杂化轨道
sp3杂化轨道是s轨道和三个p轨道的线性组合, 形成四个等价的sp3杂化轨道。
sp2杂化轨道是s轨道、两个p轨道和一个未杂 化的p轨道的线性组合,形成三个等价的sp2 杂化轨道。
3 sp杂化轨道
4 其他类型
sp2杂化轨道解释了烯烃分子 中碳原子之间形成的双键和 单键的几何构型。
π键
未杂化的p轨道形成了烯烃分 子中的π键。
sp杂化轨道
1
形状
sp杂化轨道呈直线形状,与未杂化的p轨道平行。
2
应用
sp杂化轨道解释了炔烃分子中碳原子之间形成的三键和单键的几何构型。
3
π键
高中化学物质结构杂化轨道理论

第2课时 杂化轨道理论[学习目标定位] 知道杂化轨道理论的基本内容,能根据杂化轨道理论确定简单分子的立体构型。
一 杂化轨道理论1.杂化轨道及其理论要点(1)阅读教材内容,并讨论甲烷分子中四个C—H 键的键能、键长,为什么都完全相同? 答案 在形成CH 4分子时,碳原子的一个2s 轨道和三个2p 轨道发生混杂,形成四个能量相等的sp 3杂化轨道。
四个sp 3杂化轨道分别与四个H 原子的1s 轨道重叠成键形成CH 4分子,所以四个C—H 是等同的。
可表示为(2)由以上分析可知①在外界条件影响下,原子内部能量相近的原子轨道重新组合形成一组新轨道的过程叫做原子轨道的杂化,重新组合后的新的原子轨道,叫做杂化原子轨道,简称杂化轨道。
②轨道杂化的过程:激发→杂化→轨道重叠。
(3)杂化轨道理论要点①原子在成键时,同一原子中能量相近的原子轨道可重新组合成杂化轨道。
②参与杂化的原子轨道数等于形成的杂化轨道数。
③杂化改变了原子轨道的形状、方向。
杂化使原子的成键能力增加。
2.杂化轨道类型和立体构型 (1)sp 杂化——BeCl 2分子的形成 ①BeCl 2分子的形成杂化后的2个sp 杂化轨道分别与氯原子的3p 轨道发生重叠,形成2个σ键,构成直线形的BeCl 2分子。
②sp 杂化:sp 杂化轨道是由一个n s 轨道和一个n p 轨道杂化而得,每个sp 杂化轨道含有12s和12p 轨道的成分。
sp 杂化轨道间的夹角为180°,呈直线形(如BeCl 2)。
③sp 杂化后,未参与杂化的两个n p 轨道可以用于形成π键,如乙炔分子中的C ≡C 键的形成。
(2)sp 2杂化——BF 3分子的形成 ①BF 3分子的形成②sp 2杂化:sp 2杂化轨道是由一个n s 轨道和两个n p 轨道杂化而得,每个sp 2杂化轨道含有13s 和23p 的成分。
sp 2杂化轨道间的夹角为120°,呈平面三角形(如BF 3)。
高中化学 杂化轨道理论的基本要点

杂化轨道理论的基本要点1.只有能量相近的原子轨道才能进行杂化,同时只有在形成分子的过程中才会发生,而孤立的原子是不可能发生杂化的。
在形成分子时,通常存在激发、杂化、轨道重叠等过程。
2.杂化轨道的成键能力比原来未杂化的轨道的成键能力强,形成的化学键的键能大。
因为杂化后原子轨道的形状发生变化,电子云分布集中在某一方向上,比未杂化的s、p、d轨道的电子云分布更为集中,重叠程度增大,成键能力增强。
3.杂化轨道的数目等于参加杂化的原子轨道的总数。
4.杂化轨道成键时,要满足化学键间最小排斥原理。
键与键间排斥力的大小决定于键的方向,即决定于杂化轨道间的夹角。
故杂化轨道的类型与分子的空间构型有关。
杂化轨道理论是鲍林为了解释分子的立体结构提出的。
中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。
杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式(1)sp杂化:直线型如:CO2、CS2(2)sp2杂化:平面三角形(等性杂化为平面正三角形)如:BCl3C2H4不等性杂化为V字型如:H2O H2S OF2(3)sp3杂化:空间四面体(等性杂化为正四面体)如:CH4、CCl4不等性杂化为三角锥如:NH3PCl3H3O+sp3d杂化:三角双锥sp3d2杂化:八面体(等性杂化为正八面体)杂化轨道理论认为:原子在形成分子时,由于原子间相互作用的影响,若干不同类型能量相近的原子轨道混合起来,重新组合成一组新轨道,这种重新组合的过程称为杂化hybridation),所形成的新的原子轨道称为杂化轨道(hybrid orbit)。
什么叫杂化?同一原子的能量相近的原有的原子轨道“混杂”起来,重新组合形成新轨道的过程,叫做杂化。
什么叫杂化轨道?新组合的原子轨道叫做杂化轨道。
为什么要杂化?杂化轨道形成的化学键的强度更大,体系的能量更低。
高一化学《杂化轨道理论》知识要点精华

高一化学《杂化轨道理论》知识要点精华1.杂化轨道理论(1)杂化轨道理论要点为了解释分子或离子的立体结构,鲍林以量子力学为基础提出了杂化轨道理论。
我们不妨先以甲烷为例说明杂化轨道理论的出发点;甲烷分子实测的和VSEPR模型预测的立体结构都是正四面体。
若认为CH4里的中心原子碳的4个价电子层原子轨道一一2s和2 px,2py,2pz分别跟4个氛原子的Is原子轨道重叠形成。
键,无法解样甲烷的4个C-H 键是等同的,因为碳原子的3个2p轨道是相互垂直,而2s轨道是球形的.鲍林假没,甲烷的中心原子一一碳原子一一在形成化学键时,4个价电子层原子轨道并不维持原来的形状,而是发生所谓“杂化”,得到4个等同的轨道,总称sp3杂化轨道。
除sp3杂化,还有两种由s轨道和p轨道杂化的类型,一种是1个s轨道和2个p轨道杂化,杂化后得到平面三角形分布的3个轨道,总称sp2杂化轨道;另一种是1个s轨道和 1个P轨道杂化,杂化后得到呈直线分布的2个轨道,总称sp杂化轨道。
图2-6画出了sp3、s P2和sp三种杂化轨道在空间的排布。
在该图最右边画出了未参与sp2杂化和sp杂化的剩余p轨道与杂化轨道的空间关系一一未参与sp2杂化的1个p轨道垂直于杂化轨道形成的平面;未参与sp杂化的2个p轨道与sp杂化轨道形成的直线呈正交关系(即相互垂直)。
注意:杂化轨道总是用于构建分子的。
轨道,未参与杂化的p轨道才能用于构建n键,在学习杂化轨道理论时既要掌握杂化轨道的空间分布,也要掌握未杂化的p轨道与杂化轨道的空间关系,否则难以全面掌握分子的化学键结构。
f...芸厂……二IIIHS诿化Q+00(=>OO=—O—讨论分子中的中心原子的杂化轨道类型的基础是预先知道它的立体结构。
如果没有实验数据,可以借助VSEPR模型对分子的立体结构作出预沉这是我们为什么在讨论杂化轨道理论之前先讨论VSEPR的原因。
特别要注意的是.如果分子的中心原子上有采取。
杂化轨道理论

Ψ孤= 0.8s + 0.2 p
对于NH3 ,形成σ键的每个杂化轨道中,s轨道成分 占0.23, p轨道占0.77。而孤对电子占据的杂化轨道s占 0.77, p轨道占0.23。
3. 孤对电子对对几何构型的影响
孤对电子对占据的杂化轨道含有较多的s成分,而 成键电子对占据的轨道含有较高的p成分
孤对电子对和成键电子对分布示意图
n
∑ cki ckj = c1i c1 j + c2i c2 j + ⋅ ⋅ ⋅ + cni cnj = 0
i≠j
k =1
n
∑ cki ckj = δ ij
k =1
i,j=1,2,···,n
四、常见的杂化轨道和分子的几何构型
1、 s-p等性杂化
以sp2等性杂化为例进行讨论
(1)设参加杂化轨道为s、 px、 py,取杂化轨道ψ1 的
⋅⋅⋅ ⋅⋅⋅
c1n c2n
φ1 φ2
⋅
⋅
⋅
=
⋅
⋅⋅
⋅⋅⋅
⋅⋅⋅ ⋅⋅⋅ ⋅⋅⋅
⋅
⋅⋅
⋅⋅
⋅
ψ k
ψ⋅ ⋅n⋅
ck1 ⋅⋅⋅ cn1
ck 2 ⋅⋅⋅
cn2
⋅⋅⋅ ⋅⋅⋅
⋅⋅⋅
cki ⋅⋅⋅
cni
⋅⋅⋅ ⋅⋅⋅
⋅⋅⋅
ckn ⋅⋅⋅
cnn
φi
⋅⋅⋅
φn
原子轨道的杂化过程实质上是由一组正交归一的原子 轨道集合到另一组正交归一的原子轨函集合的变换。
cosθ kl = −
α kα l (1 − α k )(1 − α l )
在s-p杂化轨道ψk和ψl中,如果αk=αl, 即等性杂化
分子杂化理论要点

杂化轨道理论要点杂化轨道理论(hybrid orbital theory)是1931年由Pauling L等人在价键理论的基础上提出,它实质上仍属于现代价键理论,但它在成键能力、分子的空间构型等方面丰富和发展了现代价键理论。
杂化轨道理论的要点:1.在成键过程中,由于原子间的相互影响,同一原子中几个能量相近的不同类型的原子轨道(即波函数),可以进行线性组合,重新分配能量和确定空间方向,组成数目相等的新的原子轨道,这种轨道重新组合的过程称为杂化(hybridization),杂化后形成的新轨道称为杂化轨道(hybrid orbital)。
2.杂化轨道的角度波函数在某个方向的值比杂化前的大得多,更有利于原子轨道间最大程度地重叠,因而杂化轨道比原来轨道的成键能力强。
3.杂化轨道之间力图在空间取最大夹角分布,使相互间的排斥能最小,故形成的键较稳定。
不同类型的杂化轨道之间的夹角不同,成键后所形成的分子就具有不同的空间构型。
轨道杂化类型及实例按参加杂化的原子轨道种类,轨道的杂化有sp和spd两种主要类型。
按杂化后形成的几个杂化轨道的能量是否相同,轨道的杂化可分为等性杂化和不等性杂化。
sp型和spd型杂化1. sp型杂化能量相近的n s轨道和n p轨道之间的杂化称为sp型杂化。
按参加杂化的s轨道、p轨道数目的不同,sp型杂化又可分为sp、sp2、sp3三种杂化。
(1)sp杂化由1个s轨道和1个p轨道组合成2个sp杂化轨道的过程称为sp杂化,所形成的轨道称为sp杂化轨道。
每个sp杂化轨道均含有1/2的s轨道成分和1/2的p轨道成分。
为使相互间的排斥能最小,轨道间的夹角为180°。
当2个sp杂化轨道与其他原子轨道重叠成键后就形成直线型分子。
图9-1 sp杂化过程及sp杂化轨道的形状(2)sp2杂化由1个s轨道与2个p轨道组合成3个sp2杂化轨道的过程称为sp2杂化。
每个sp2杂化轨道含有1/3的s轨道成分和2/3的p轨道成分,为使轨道间的排斥能最小,3个sp2杂化轨道呈正三角形分布,夹角为120°[图9-2]。
简述杂化轨道理论的基本要点
简述杂化轨道理论的基本要点
杂化轨道理论(Hybrid-Orbital Theory,简称HOT)是一种用来描述键杂化
过程的理论,它是聚变(Fusion)和解聚(Fission)这两种基本原子键形成模型
的基础。
它将原有的单一轨道(S-orbital)和双核轨道(D-orbital)这两种基本理论进行有机结合,构成一种多轨道模型,称为“杂化轨道”。
HOT观点认为,原子内部由某个共价键形成了一个杂化轨道,它由一种原子轨
道(单一轨道)与另一种原子轨道(双核轨道)混合而形成。
由于杂化轨道内的原子依然处于一个轨道,所以杂化轨道不但可以降低共价键能量,而且还能保持原子的稳定性。
HOT观点形成的最重要的实践结论之一就是,原子的杂化轨道有三种重要状态:离解状态、反芳香状态和正芳香状态。
分清这三种状态有助于实验家正确预测合成反应结果。
此外,HOT体系中涉及到的计算过程主要有能量计算与质子计算——这些计算
可以用来准确判断原子的行为。
此外,它还推导出了化合物的芳香性、反芳香性以及前行方向,使合成反应变得容易,科学家们可以使用HOT技术推断出新材料,从而在化学工艺中发挥更大作用。
总之,杂化轨道理论解释了共价键形成的原理,并且可以用于解答键类型、能
量变化以及其他领域的许多类型现象,对化学合成具有重要意义。
中学杂化轨道理论学习要点
中学杂化轨道理论学习要点作者:何传忠来源:《中学化学》2014年第04期1.杂化轨道的基本知识(1)原子中的价电子处于一种相对的平衡状态,不可能发生原子轨道杂化。
但原子在形成分子的过程中,原有价电子的平衡被破坏,在寻找新的平衡时就需要进行轨道杂化,以达到减小成键阻力、增强成键能力的目的。
所以,中心原子的轨道杂化是成键过程中受周围原子的作用而发生的,故多原子分子在形成时几乎都要发生轨道杂化。
(2)没有电子占据的原子轨道是不可能发生杂化的,除非在成键过程中有其他轨道的电子填入该轨道中;参与杂化的原子轨道(价电子轨道)的能量相近。
(3)参与了杂化的轨道在形成分子时未必都能成键。
对参与了杂化而又没有参与成键的轨道上的电子称为孤电子对;有杂化轨道参与的成键为σ键,没有杂化轨道参与的成键往往为π键;π键相对于σ键的键能较小,π键的形成能影响相邻轨道的杂化程度。
(4)中心原子上的孤电子对分布在中心原子未成键的杂化轨道上,成键的电子分布在杂化轨道与配位原子的原子轨道(或杂化轨道)重叠形成的成键轨道上。
(5)分子的构型与中心原子的轨道杂化类型直接相关。
中心原子的杂化类型通常可根据其周围价层电子对数的多少来判断。
成键电子对之间、孤电子对与成键电子对之间、孤电子对之间都存在着斥力,且上述三类斥力依次增强,这些斥力间的平衡就决定了分子的构型。
又由于只有坚固的σ键才能撑得起分子的“骨架”,所以分子的最终形状取决于σ键的多少和孤电子对的影响。
2.价层电子对数的确定方法价层电子对数的求法没有绝对的数学公式,目前流行的一些经验式求法,笔者觉得高中化学教材人教版选修3第二章介绍的方法,其适应性相对较好。
中心原子的价层电子对数=σ键电子对数(m)+孤电子对数(n)σ键电子对数(m)=中心原子周围的配位原子(或原子团)的数目孤电子对数(n)=12(a-mb)其中:a为中心原子的价电子数,b为每个配位原子(或原子团)能接受的电子数例下列物质中中心原子的价层电子对数分别为:SO3:3+12(6-3×2)=3SO2-3:3+12(6+2-3×2)=4NH+4:4+12(5-1-4×1)=4H2SO4: 4+12(6-2×2-2×1)=4(其中有2个-OH)3.中心原子的轨道杂化类型与分子空间构型的确定根据价层电子对互斥理论,价层电子对之间将尽可能远离,以达到相互间斥力最小,构型最稳定的效果。
杂化轨道理论(重点高中)
高中杂化轨道理论(图解)一、原子轨道角度分布图二、共价键理论和分子结构价键法(VB法)价键理论一:1、要点:⑴、共价键的形成条件:①、先决条件:原子具有未成对电子;②、配对电子参与成键的原子轨道要满足对称匹配、能量相近以及最大重叠的原则;③、两原子具有成单的自旋相反的电子配对,服从保里不相容原理。
⑵、共价键的本质:是由于原子相互接近时轨道重叠,原子间通过共用自旋相反的电子使能量降低而成键。
⑶、共价键的特征:①、饱和性,一个原子有几个未成对电子(包括激发后形成的未成对电子),便和几个自旋相反的电子配对成键;而未成对电子数是有限的,故形成化学键的数目是有限的。
②、根据原子轨道最大重叠原理,原子轨道沿其角度分布最大值方向重叠,即共价键具有一定的方向性。
⑷、共价键的类型:单键、双键和叁键。
①、σ键和π键。
ⅰ、σ键:沿键轴方向重叠,呈圆柱形对称,称为σ轨道,生成的键称为σ键σ是希腊字母,相当于英文的s,是对称Symmetry[`simitri]这个字的第一个字母)。
σ键形成的方式:ⅱ、π键:两个p轨道彼此平行地重叠起来,轨道的对称面是通过键轴的平面,这个对称面就叫节面,这样的轨道称为π轨道,生成的键称为π键(π相当于英文的p,是平行parallel[`p?r?lel]的第一个字母)。
π键的形成过程:,σ键和π键的比较 σ键 (共价键中都存在σ键) π键 (只存在不饱和共价键中)重叠方式(成建方向)沿两电子云(原子轨道)的键轴方向以“头碰头”的方式遵循原子轨道最大程度重叠原理进行重叠 两互相平行的电子云(原子轨道)以“肩并肩”的方式遵循原子轨道最大程度重叠原理进行重叠 重叠程度重叠程度较大 重叠程度较小电子云形状 共价键电子云(重叠部分)呈轴对称 共价键电子云(重叠部分)呈镜像对称 牢固程度 强度较大,键能大,较牢固,不易断裂强度较小,键能较小,不很牢固,易断裂 化学活泼性不活泼,比π键稳定 活泼,易发生化学反应 类型 s-s 、s-p 、、p-p 、s-SP 杂化轨道、s-SP 2杂化轨道、s-SP 3杂化轨道、杂化轨道间p -p π键,、p -p 大π键 是否能旋转 可绕键轴旋转 不可旋转,存在的规律 共价单键是σ键,共价双键有一个σ键,有一个π键;共价叁键有一个σ键,有两个π键。
高中化学 选择性必修2 第二章 第二节 第3课时 杂化轨道理论
二、杂化轨道类型与分子空间结构的关系
1.杂化轨道的类型
(1)sp3杂化轨道——正四面体形
sp3杂化轨道是由 1个 ns轨道和
3个 np轨道杂化而成,每个sp3
杂化轨道都含有
1 4s
和
3 4p
的成
分,sp3杂化轨道间的夹角为
109°28′ ,空间结构为正四面
体形。如右图所示。
(2)sp2杂化轨道——平面三角形 sp2杂化轨道是由 1个 ns轨道和 2个 np轨道杂化而成的,每个sp2杂化轨道
4.下列有关甲醛(HCHO)分子的说法正确的是
①C原子采取sp杂化 ②甲醛分子为三角锥形结构
③C原子采取sp2杂化 ④甲醛分子为平面三角形结构
A.①②
√C.③④
B.②③ D.①④
5.在BrCH==CHBr分子中,C—Br采用的成键轨道是
A.sp-p
√C.sp2-p
B.sp2-s D.sp3-p
12 含有 3s 和 3p成分,sp2杂化轨道间的夹角都是120°,呈平面三角形,如 下图所示。
(3)sp杂化——直线形
sp杂化轨道是由 1个 ns轨道和 1个 np轨道杂化而成的,每个sp杂化轨道含
有
1 2s
和12p
的成分,sp杂化轨道间的夹角为180°,呈直线形,如下图所示。
2.杂化轨道类型与分子空间结构的关系 (1)当杂化轨道全部用于形成σ键时,分子或离子的空间结构与杂化轨道 的空间结构相同。
中心原子 中心原子孤 ABn型分子 杂化类型 电子对数 空间结构
实例
AB2
sp2
1
_V_形__
SO2
AB3 sp3
AB2或(B2A)
1
_三__角__锥__形__ NH3、PCl3、NF3、
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
38
N原子:2s22p3
有3个单电子,可形成3个共价键,
孤对电子
2p 2s 杂化
孤电子对占据的杂化轨道,不参与成键,电子云密集在中 心原子周围,s轨道成分相对增大,其余3个杂化轨道p成分相对 增大。
产生不等性杂化的原因:参与杂化的原子轨 道中电子数目多于轨道数目,出现孤电子对。
的空间构型
O 不提供电 在 ClO3 中,Cl 有7个价电子, 子,再加上得到的1个电子,价层电子总数为 8 个,价层电子对为4对。Cl的价层电子对的排布 为四面体,四面体的 3 个顶角被3个O占据,余 下的一个顶角被孤对电子占据,因此 ClO3 为三 角锥形。
52
(三) PCl5 的空间构型
27
BeCl2分子结构
px
Cl
sp
px
Cl
Cl
Be
Cl
规律:第ⅡA族、ⅡB族元素与第ⅦA族元素所形成的MX2 型共价化合物,中心原子采取sp杂化。如BeBr2、HgCl2。
28
(2)
sp2 杂化 —— BF3分子的形成
形成3个sp2 杂化轨道。
每个sp2杂化轨道的形状也为一头大,一头小,
sp2杂化:1个s 轨道与2个p 轨道进行的杂化,
33
CH4分子的形成:
实验测得,四个共价键,正四面体形分子(键角109°28′)
34
C原子:1s22s22p2
只有2个单电子
规律:第ⅣA族元素与第ⅠA族、ⅦA族元素所形成的MX4 型共价化合物,中心原子采取sp3杂化。如CCl4、SiF4、 CHCl3。
35
36
3. 等性杂化与不等性杂化
等性杂化:参与杂化的各原子轨道进行成分的均匀混合。
杂化轨道:杂化后所形成的若干新原子轨道。 sp型杂化 : 同一原子的1个s 轨道与p 轨道进行的杂化。
有:
sp
sp2
sp3
23
2.杂化轨道理论的要点
(1) 发生轨道杂化的原子一定是中心原子; (2) 参加杂化的各原子轨道能量要相近(同一能级组或 相近能级组的轨道); (3) 杂化前后原子轨道数目不变:参加杂化的轨道数目 等于形成的杂化轨道数目;但杂化轨道在成键时更 有利于轨道间的重叠; (4) 杂化轨道在空间构型上都具有一定的对称性 (以减小化学键之间的排斥力)。
含有 1/3 s 轨道和 2/3 p 轨道的成分
每两个轨道间的夹角为120°,呈平面三角形
29
30
BF3分子的形成:
实验测得,三个共价键,平面三角形分子(键角120°)。 B原子:1s22s22p1
F
120°
B
F F
规律:第ⅢA族元素与第 ⅦA族元素所形成的MX3型 共价化合物,中心原子采取 sp2杂化。如BBr3。
rr+
d=r++r-
d=r++r离子的特征影响化合物的性质
7
电负性相差不大的非金属元素之间是如何形成化学键的?
同种元素之间为什么能形成化学键?
四种共价键理论:价键理论、 杂化轨道理论、 分子轨道理论、
价层电子对互斥理论。
8
§ 2 共价键
2.1 价键理论
1. 共价键的形成
(电子配对理论、VB理论)
在 PCl5 中,P 有5个价电子,5 个Cl分别提 供1个电子,中心原子共有5对价层电子对,价 层电子对的空间排布方式为三角双锥,由于中 心原子的价层电子对全部是成键电子对,因此 PCl5 的空间构型为三角双锥形。 利用价层电子对互斥理论,可以预测大 多 数主族元素的原子所形成的共价化合物分子或 离子的空间构型。
Fe3+ : 3d 64s2 3d 5, Mn2+ : 3 d 54s2 子的外层电子构型)
简单的负离子:8电子结构 (如;F-,Cl-,O2-等) 简单正离子: 有多种构型,如下所列:
① 2电子构型:Li+、Be2+
② 8电子构型: Na+、Mg2+、Al3+
31
(3) sp3杂化 —— CH4分子的形成
sp3杂化:1个s 轨道与3个p 轨道进行的杂化,
形成4个sp3 杂化轨道。
每个sp3杂化轨道的形状也为一头大,一头小, 含有 1/4 s 轨道和 3/4 p 轨道的成分 每两个轨道间的夹角为109.5°, 空间构型为正四面体型
32
• sp3杂化轨道
离子键没有饱和性和方向性;
离子型化合物常以晶体形式存在,没有独立的分子 。
1.3 形成离子键的条件
两种原子间电负性相差较大,一般要相差1.7以上。
4
1.4 离子的特征
1. 离子的电荷 主族元素生成的离子:稀有气体结构 ( p 轨道全充满 ) 过渡元素:它们生成的离子的d 轨道一般都处 于半充满状态。
17
b:π 键
两原子轨道沿键轴方向在键轴两侧平行同号重叠所形成的键
z
肩并肩
● ●
p z— p z
x
py— py
●
●
x
轨道重叠
电子云分布
18
σ键和π 键的特征比较
键类型
原子轨道重叠方式
原子轨道重叠部位 原子轨道重叠程度 键的强度 化学活泼性
σ键
沿键轴方向相对重叠
两原子核之间, 在键轴处 大 较大 不活泼
( s区 )
( s、 p 区 )
③ 18电子构型:Zn2+、Hg2+、Ga3+、Cu+(ds区、p区) ④ 18+2电子构型: Pb2+、Sn2+ ⑤ 9~17电子构型:Fe2+、Cr3+、Cu2+ ( p区 ) ( d区 )
6
3. 离子的半径
正、负离子间静电吸引力 和排斥力达平衡时,正、负离 子间保持着一定的平衡距离为 正、负离子半径之和(核间距)
39
40
41
H2O 分子:
实验测得,V字形分子,键角104°29′
O原子:2s22p4 有2个 单电子,可形成2个共价键, 键角应当是90°,Why?
42
H2O 分子
2p 2s
O原子:2s22p4
2 对孤对电子 杂化
O原子成键前先进行了SP3不等性杂化,其中的两条杂化轨 道由成对电子占据,其余两条P成分更多,键角更靠近90°, 实测:104°29′
1 s— 1 s
H2
HCl 1s—3px
14
H2
1s
HF
H
F
2p
F2
2p
F
F
2p
电子云重叠示意图
15
4. 共价键的类型
a: σ键
根据轨道重叠的方向方式及重叠 部分的对称性划分为不同的类型
两原子轨道沿键轴方向进行同号重叠所形成的键。
头对头
16
s—s
●
●
px — s
●
●
px — px
●
●
轨道重叠
电子云分布
配位键形成条件:
一方有空轨道,另一方有孤对电子。
配位键与共价键的区别与联系:两者的形成过程不同,但 配位键一旦形成,其结果与共价键没有区别。是一种特殊的 共价键。 配位键广泛存在于配位化合物及一些无机含氧酸根中:
22
2.2 杂化轨道理论
1. 杂化轨道概念
形成分子时,同一原子中的若干不同类型、能量相近的 原子轨道混合起来,从新分配能量和调整空间方向组成数目 相同、能量相等的新的原子轨道, 这种混合平均化的过程称为原子轨道的“杂化”
π键
沿键轴方向平行重叠
键轴上方和下方, 键轴处为零 小 较小 活泼
★ 两原子间若只形成一个共价键,一定是σ 键; ★ 两原子间若形成多个共价键,其中一个是σ 键,其余为键。 如N2、CH2=CH2、CH≡CH;
19
例:
H2 Cl2 HCl N2 2s22p3 1s1 3s23p5 1s—1s 3px—3px 1s— 3px 2px—2px 1个σ 键 1个σ 键 1个σ 键 1个σ 键
分子结构
1
分子: 保持物质化学性质的最小微粒, 参加化学反应的基本单元
原子为什么能聚集在一起形成分子或晶体?
H2O, NaCl, Fe, C(金刚石)
化学键:分子或晶体中相邻原子之间的强烈 相互作用力。
化学键分类:离子键、共价键 (配位键)、
金属键。
2
§ 1 离子键
6.1.1 离子键的形成
Na (3s ) Na (2 s 2 p )
A: 饱和性
几个未成对电子只能和几个自旋方向相反的 单电子配对成键。
H(1s1)
Cl(3s23p5)
H—Cl N≡N
N(2s22px12py12pz1) H2 NH3
12
B: 方向性
两个电子配对,就是两个原子轨道发生重叠。重叠的
结果是电子云密度在两核之间增大。
13
重叠越大,形成的键越牢固
——共价键具有方向性。
杂化轨道 每个轨道的成分 轨道间夹角( 键角)
sp
sp2 sp3
1/2 s,1/2 p
1/3 s,2/3 p 1/4 s,3/4p
180°
120° 109°28′
(p )
p
90°
随p 轨 道成分 的增大, 夹角向 90°靠 拢。
不等性杂化:参与杂化的各原子轨道进行成分上的 不均匀混合。
37
NH3 分子
49
(3)根据中心原子的价层电子对的排布方式,
把配位原子排布在中心原子周围,每一对电子连
接一个配位原子,未结合配位原子的电子对就是
孤对电子。若中心原子的价电子对全部是成键电
