TAKARA植物DNA提取试剂盒说明书
TaKaRa一步法RT-PCR提取法

*2 用以校正孔与孔之间产生的荧光信号误差。ABI PRISM® 7000/7700 和 Applied
Biosystems® 7300 Real-Time PCR System 使用 ROX Reference Dye,7500
Real-Time PCR System 使用 ROX Reference Dye II,Thermal Cycler Dice Real
的荧光探针,游离荧光物质发出荧光。通过检测
反应体系中的荧光强度,可以达到检测 PCR 产物
扩增量的目的。具体原理见右图。
-2-
● 制品内容(50 μl 反应×100 次)
1. 2×One Step RT-PCR Buffer Ⅲ*1(2×)
840 μl ×3 支
2. TaKaRa Ex Taq HS(5 U/μl)
RNase Free dH2O
7.5 μl
Total
25 μl
*1 通常引物终浓度为 0.2 μM 可以得到较好结果。反应性能较差时,可以在 0.1~1.0 μM 范围 内调整引物浓度。
*2 探针浓度与所使用的 Real Time PCR 扩增仪、探针种类、荧光标记物质种类有关,使用时 请参考仪器说明书,或各荧光探针的具体使用要求进行。使用 Smart Cycler® System 时, 通常探针终浓度在 0.1~0.5 μM 范围内进行调整。
Stage 2:PCR 反应 Repeat:40 times 95℃ 5 sec 60℃ 20 sec
◆特别提示: 本制品中使用的 TaKaRa Ex Taq HS 是利用抗 Taq 抗体的 Hot Start 用 DNA 聚合酶,与其他公司的化 学修饰型 Hot Start 用 DNA 聚合酶相比,不需要 PCR 反应前的 95℃、5~15 分钟的酶的活性化反应。 如果高温处理时间过长,会使酶的活性下降,其 PCR 的扩增效率、定量精度等都会受到影响。PCR 反应前的反转录酶的热变性失活通常设定为 95℃、10 sec。
Takara说明书

● 使用注意
以下为使用本试剂盒时的注意事项,使用前一定认真阅读。 1. 当同时需要进行数次反应时,应先配制各种试剂的混合液(Master Mix;其中包括 RNase Free dH2O、
Buffer、酶等),然后再分装到每个反应管中。这样可使所取的试剂体积更准确,减少试剂损失,避免 重复分取同一试剂。同时也可以减少实验操作或实验之间产生的误差。 2. gDNA Eraser 和 PrimeScript RT Enzyme Mix I 在使用前要小心地离心收集到反应管底部。由于酶保存 液中含有 50%的甘油,粘度高,分取时应慢慢吸取。同时,要使用精确、量程适合的移液枪,并且不 要使 Tip 插入液面过深,否则会因 Tip 壁粘着造成损失,而使酶量不足。 3. 5×gDNA Eraser Buffer 和 5×PrimeScript Buffer 2(for Real Time)在使用前需 Vortex 振荡混匀,轻轻 离心后使用。 4. 分装试剂时务必使用新的枪头(Tip),以防止样品间污染。
*5:反转录体系可以根据需要相应扩大。 *6:使用 Gene Specific Primer 时,建议反转录反应条件设置为 42℃ 15 min。PCR 反应有非特
异性扩增时,将温度升到 50℃会有所改善。 *7:合成的 cDNA 需要长期保存时,请于-20℃或更低温度保存。 注意:1) 在反转录反应中,SYBR® Green qPCR 法的 RT Primer Mix 用量为 1 μl,TaqMan®
页码
1 1 1 1 2 2 2 4 6 7 8
● 制品说明
为了准确地进行基因表达量分析,必须满足只有 cDNA 作为模板检出的先决条件,但 Total RNA 中常常 混有基因组 DNA,并可以直接作为 PCR 反应的模板进行扩增,因此会造成解析结果不准确。为了避免这 种情况发生,通常将检测用引物设计在内含子前后的外显子上,使基因组 DNA 得不到扩增。但是,此方 法不适合具有单个外显子的基因或两个外显子之间所跨的内含子过小的基因,同时当基因组上有伪基因存 在时、或设计引物对基因组有非特异性扩增时、以及基因信息没被完全解析的生物种等也同样不适合于本 方法。在这种情况下,我们常常需要对 Total RNA 样品进行 DNase I 处理,以除去残存的基因组 DNA。 而 DNase I 处理通常要进行复杂的纯化操作,同时会造成 RNA 的降解和损失。 PrimeScript RT reagent Kit with gDNA Eraser 是可以除去基因组 DNA 进行 Real Time RT-PCR 反应的专 用反转录试剂。Kit 中使用了具有较强 DNA 分解活性的 gDNA Eraser,通过 42℃,2 min 即可除去基因 组 DNA。同时由于反转录试剂中含有抑制 DNA 分解酶活性的组分,经过 gDNA Eraser 处理后的样品可 以直接进行 15 min 的反转录反应合成 cDNA,因此,20 min 内即可迅速完成从基因组 DNA 去除到 cDNA 合成的全过程。 使用本制品合成的cDNA适用于SYBR® Green分析法和TaqMan®探针分析法,可以根据实验目的,选择与 SYBR® Premix Ex Taq II(Tli RNaseH Plus)、Premix Ex Taq(Probe qPCR)等定量试剂组合使用。 注意:Takara Bio 使用 SYBR® Green I 作为研究试剂已得到 Molecular Probes Inc.的许可。SYBR®为
植物DNA试剂盒说明书
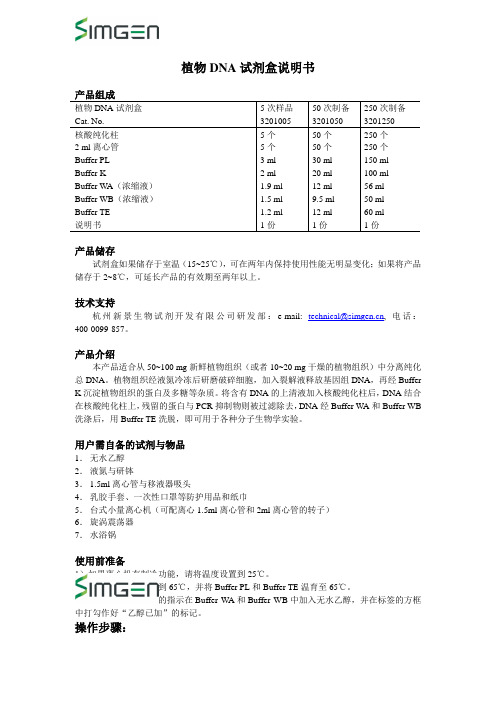
植物DNA试剂盒说明书植物DNA试剂盒Cat. No. 5次样品320100550次制备3201050250次制备3201250核酸纯化柱2 ml离心管Buffer PLBuffer KBuffer WA(浓缩液)Buffer WB(浓缩液)Buffer TE说明书5个5个3 ml2 ml1.9 ml1.5 ml1.2 ml1份50个50个30 ml20 ml12 ml9.5 ml12 ml1份250个250个150 ml100 ml56 ml50 ml60 ml1份产品储存试剂盒如果储存于室温(15~25℃),可在两年内保持使用性能无明显变化;如果将产品储存于2~8℃,可延长产品的有效期至两年以上。
技术支持杭州新景生物试剂开发有限公司研发部:e-mail: technical@, 电话:400-0099-857。
产品介绍本产品适合从50~100 mg新鲜植物组织(或者10~20 mg干燥的植物组织)中分离纯化总DNA。
植物组织经液氮冷冻后研磨破碎细胞,加入裂解液释放基因组DNA,再经Buffer K沉淀植物组织的蛋白及多糖等杂质。
将含有DNA的上清液加入核酸纯化柱后,DNA结合在核酸纯化柱上,残留的蛋白与PCR抑制物则被过滤除去,DNA经Buffer WA和Buffer WB 洗涤后,用Buffer TE洗脱,即可用于各种分子生物学实验。
用户需自备的试剂与物品1.无水乙醇2.液氮与研钵3.1.5ml离心管与移液器吸头4.乳胶手套、一次性口罩等防护用品和纸巾5.台式小量离心机(可配离心1.5ml离心管和2ml离心管的转子)6.旋涡震荡器7.水浴锅使用前准备1)如果离心机有制冷功能,请将温度设置到25℃。
2)将水浴锅温度设置到65℃,并将Buffer PL和Buffer TE温育至65℃。
3)根据试剂瓶标签上的指示在Buffer WA和Buffer WB中加入无水乙醇,并在标签的方框中打勾作好“乙醇已加”的标记。
takara反转录试剂盒说明书

takara反转录试剂盒说明书Takara反转录试剂盒是一种用于研究RNA分子的试剂盒。
该试剂盒可以用于DNA的反转录,将RNA转录成DNA,并进行后续的PCR扩增。
反转录试剂盒在生命科学领域中起着非常重要的作用,因此在使用过程中需仔细阅读说明书并按照说明书进行操作。
一、试剂盒组成Takara反转录试剂盒主要包含以下拉玛:1.反转录酶:外源的M-MLV反转录酶,具有高度的反转录活性和优异的扩增效率等优良特性。
2.反转录缓冲液:针对反转录酶的酶切优化反转录缓冲液。
3.引物:随机9mers引物,适用于多种RNA逆转录的应用。
4.对照RNA:In Vitro转录的任意序列的RNA,用于反转录和后续PCR扩增反应的质控。
二、试剂盒使用方法1. RNA提取:在使用Takara反转录试剂盒之前,需要从样品中提取RNA。
2. 反转录反应:将RNA测序专用随机引物、针对反转录酶的反转录缓冲液、反转录酶和RNA样品混合,进行逆转录反应。
3. PCR扩增:反转录完成后,可以利用PCR扩增技术对转录所得DNA进行扩增,完成DNA序列的检测和分析。
三、试剂盒注意事项1. 避免多次冻融。
为保证试剂的稳定性,反转录试剂盒必须储存于-20℃及以下的冰箱中,避免多次冻融。
2. 操作时需佩戴手套。
操作时需佩戴手套,尽量避免手汗或皮脂的污染,影响试剂盒的效率和准确性。
3. 注意反转录缓冲液的稀释量。
反转录缓冲液的稀释量会影响反转录效果,因此需要按照说明书进行操作,精准稀释。
4. 注意反转录酶的用量。
不同反转录酶的最优用量不同,需要根据实验需要按照说明书或文献进行调整。
5. 确认对照RNA引物的扩增效果。
在进行PCR扩增前,需要先进行对照RNA引物的扩增,以确认反转录反应的正确性,避免因为反应偏差而引起的实验结果的偏差。
4. 根据实验需要进行调整。
反转录试剂盒虽然具有大量的优良特性,但是实验环境和实验条件的不同,会对反转录试剂盒的效果产生较大的影响,因此需要根据实验需要进行调整。
Takara基因组抽提试剂盒说明书

照说明书的要求进行。 ② DNA 中含有乙醇。在 Rinse B 洗净时,离心速度和时间应严格遵循说明书要求进行。
Q5. 能否使用本试剂盒提取酵母菌中的基因组 DNA? A5. 不能。因为酵母菌属于真核微生物,其细胞壁的化学组成和结构与细菌不同,因此 Lysozyme 不
TaKaRa Code:DV810A
MiniBEST Bacterial Genomic DNA Extraction Kit Ver.2.0 (50 次量)
说明书
宝生物工程(大连)有限公司
内容
●制品说明 ●制品内容 ●运输温度 ●保存温度 ●实验前的准备 ●操作方法 ●使用例 ●注意事项 ●Q&A
22 ml
Solution C
35 ml
DB Buffer
25 ml
Rinse A
28 ml
Rinse B*3
24 ml
Elution Buffer
4 ml
*1 RNase A1 为混浊溶液。 *2 若出现沉淀,请于 65℃加热溶解,待恢复至室温后使用。 *3 首次使用前,请添加 56 ml 的 100%乙醇。
11. 弃 Filter Cup,在滤液中加入 450 μl 的 DB Buffer, 混合均匀。
12. 将试剂盒中的 Spin Column 安置于 Collection Tube 上。
-2-
图 1. 操作流程简图
13. 将上述操作 11 的混合液转移至 Spin Column 中,12,000 rpm 离心 1 分钟,弃滤液。 14. 将 500 μl 的 Rinse A 加入至 Spin Column 中,12,000 rpm 离心 1 分钟,弃滤液。
植物DNA提取使用说明书

15. 于12,000 x g 离心1分钟,并弃去Spin column。
1.5ml离心管中液体含有DNA。
16. 提取的DNA可直接用于各种下游应用实验,如不立即使用,请于-20℃保存。
常见问题及对策问:本试剂盒能从那些植物组织中提取DNA?答:可从植物叶、花、茎(如树皮等含细胞部分)、根(如根冠部分)、果实、种子(如黄豆、玉米等)中提取DNA。
问:什么时候需要在过滤之前进行离心?答:有些样本在加入DA Buffer冰浴之后,整个混合物会非常粘稠,如先进行离心,就能很方便得将上清液转移到hredder Spin Column中。
问:DNA得率低,怎么办?答:DNA得率与裂解效率有很大关系,可以通过延长裂解温浴的时间(对于某些样本,甚至可以温浴过夜)来提高裂解的效率,进而提高DNA得率。
问:如何去除提取的DNA中有RNA污染?答:可按说明书中的方法加入RNase A来消化去除RNA。
问:提取的基因组DNA片断长度是多少?答:提取的基因组DNA片段长度一般为30~50KB。
核酸的检测分析及图例见英文说明书 Biospin Plant Genomic DNA ExtractionKitBiospin植物基因组DNA提取试剂盒Cat# BSC13S1sterile 1.5ml microcentrifuge tube.14. Add 100μl to 200μl Elution Buffer, Incubate at room temperature for 1 minute.15. Centrifuge at 12,000 x g for 1 minute. The buffer in the microcentrifuge tube containsthe DNA.16. The purified DNA can be used directly for kinds of downstream molecular biologicalexperiments. Store at -20℃ if not used immediately.FAQQ1: We can extract DNA from which plant tissue using the kit?A: We can extract DNA from leaves, flowers, caudexes (as the parts of bark which contain cells), roots (as the pileorhiza), fruits, seeds (as soybean, corn and so on).Q2: When should be centrifugated before filtration?A: Some samples will be very dense after put into DA Buffer ice bath. We can transfer the above clear liquid into shredder Spin Column if centrifugate before that.Q3: What can we do when DNA extraction yield is low?A: DNA yield relates with lysis efficiency very much. We can improve lysis efficiency by extend incubate time (we can adopt full night lysis incubate to some samples), and then improve DNA yield.Q4: How to wipe off the RNA included in the extracted DNA?A: We can add RNase A to digest the RNA following with the method listed in Specification. Q5: How long about the extracted genomic DNA fragments?A: Length of the extracted genomic DNA fragments is about 30~50KB in general. Analysis DNA⊕Absorbance anlysisGet some DNA,diluted in a advisable factor with elution buffer.Survey the OD260,OD280 and OD320.expressions:concentration(μg/ml)=50×OD260×dilution facttarget: 2.0≥OD260-320/ OD280-320≥1.7Notice: 1.0≥OD260≥0.1, the result of ratio is much reliable.⊕Agarose Gel Analysis0.8~1% Agarose gel Example 1:rice leaves Example 2:rice leaves试剂盒组成 (50T)成分数量LP Buffer 22.5 mlDA Buffer 7.5 mlP Binding Buffer 14mlG Binding Buffer 25mlWash Buffer 25.2mlElution Buffer 10mlSpin column 50Shredder Spin Column 50说明书 1 份储存条件保存于室温 (15-25℃)。
TaKaRa 提取RNA说明书

T a K a R a提取R N A说
明书
-CAL-FENGHAI.-(YICAI)-Company One1
TaKaRa Code TaKaRa MiniBEST Plant RNA Extration Kit 说明书
一、制品说明
本试剂盒是小量提取植物组织Total RNA 的试剂盒。
试剂盒采用了独特的裂解系统,可以对各种简单的植物材料(叶片、茎、幼苗等)富含多糖多酚的植物组织材料(果实、种子)、真菌等进行RNA的提取,适用范围广。
按照标准流程使用本试剂盒可以有效提取分子量大于200nt的RNA,也可以按照可选步骤提取得到包含Small RNA(<200nt)的Total RNA。
试剂盒中包含了RNA提取所需的全部是局,无需额外购买其他试剂。
本试剂盒具有高效、快速、方便的特点,组织或自爆裂解后,提取操作仅需要30min 便可完成操作。
提取过程中无需苯酚氯仿抽提等步骤。
利用该试剂盒提取的RNA纯度高,基本不含蛋白质及及基因组DNA污染。
本试剂盒可以从50mg—100mg植物组织中纯化得到多至数十微克的高纯度RNA。
提取得到的RNA可以直接用于Northern杂交、斑点杂交、mRNA纯化、体外翻译、RNA分解酶的保护分析、RT-PCR、Real Time PCR、构建cDNA文库等各种分子生物学实验。
二、制品内容(50次量)
本试剂盒分两部分|Part 1和Part 2。
(1)Part 1 (-20℃保存)
2。
TaKaRa MutanBEST Kit (20 次量) 说明书

TaKaRa Code:D401TaKaRa MutanBEST Kit(20次量)宝生物工程(大连)有限公司目录内容页码●制品说明 1●制品内容 1●保存 1●试剂盒原理 1●操作方法 2I . PCR反应 2II. Blunting Kination反应 2 III. Ligation反应3 IV. 结果 3 ●注意事项 3●制品说明本制品是利用PCR技术进行定点突变操作的试剂盒。
其原理是利用导入变异点的引物进行PCR反应后,对PCR产物进行末端平滑化及5′磷酸(P)化处理,再用高效连接试剂Ligation Solution I进行自身连接(环化反应),然后转化、提取突变体DNA。
本试剂盒的原理十分简单,但Taq酶在PCR过程中的错配率限制了这一技术的应用。
现在,TaKaRa的Pyrobest DNA Polymerase使这一技术得到了最大程度的发挥。
Pyrobest DNA Polymerase不仅具有超高的保真性(Fidelity),并且和TaKaRa Taq具有同样的扩增效率。
与其他突变试剂盒相比,本试剂盒的最大特点是操作方便、简单,只需一天时间便可完成整个操作,并且不受载体、宿主菌的限制。
●制品内容(20次量)Pyrobest DNA Polymerase(5 U/μl) 15 μl10×Pyrobest Buffer II 200 μldNTP Mixture(2.5 mM each) 180 μl10×Blunting Kination Buffer 50 μlBlunting Kination Enzyme Mix 25 μlLigation Solution I 150 μl●保 存: -20℃●试剂盒原理试剂盒原理见图1,全套操作约需5小时,简单说明如下。
1. 设计一对5′端邻接,3′端方向相反的引物用以导入变异点。
2. 进行PCR扩增(使用高保真DNA聚合酶Pyrobest DNA Polymerase)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
图 1 从植物组织中提取的基因组 DNA 电泳图 -2-
表 1 从植物组织中提取的基因组 DNA 纯度*
样品名称
样品量
Sample No.
A260/A280
A260/A230
20 mg
1
拟南芥幼芽
2
3
50 mg
4
2.2
1.4
2.2
1.4
2.1
1.7
2.1
1.7
20 mg
5
6
西红柿幼芽
7
50 mg
8
TaKaRa Code:D9194
Plant DNA Isolation Reagent (100 次量)
说明书
宝生物工程(大连)有限公司
目录
内容
●制品说明 ●制品内容 ●保 存 ●使用注意事项 ●操作方法 ●实验例 ●Troubleshooting ●参考文献 ●关联制品
页码
1 1 1 1 1 2 6 6 6
10 mg M12
100 mg M1 2
1% Agarose电泳
1:5 μl提取液 2:0.5 μl提取液 M:λ-Hin d III digest 150 ng
图 4 从菠菜叶(10 mg、100 mg)中提取的基因组 DNA 电泳图
表 3 从菠菜(10 mg、100 mg)中提取基因组 DNA 的纯度*
-4-
实验例 4:从菠菜叶(10 mg、100 mg)中提取基因组 DNA 将菠菜叶用剪刀剪至 3 mm 以下角形状,分别称取 10 mg、100 mg 放入 1.5 ml Microtube 中,于-20℃ 冻结后按“操作方法”进行基因组 DNA 的提取,使用 20 μl TE Buffer 溶解后,进行吸光度测定和电泳确 认,电泳结果如下。
需用手指轻弹 Microtube 使其悬浮。 6. 轻微离心,加入 80 μl 的 Extraction Solution 2,剧烈振荡 5 秒钟。添加 Extraction Solution 2
后产生白色沉淀,剧烈振荡后溶液呈白浊状态。如果植物组织仍滞留于 Microtube 底部,需用手指轻 弹 Microtube 使其悬浮。 7. 轻微离心,加入 150 μl 的 Extraction Solution 3,剧烈振荡 5 秒钟。如果植物组织仍滞留于 Microtube 底部,需用手指轻弹 Microtube 使其悬浮。
2. DNA 溶液不立即使用时,请于 4℃保存。
实验操作流程简图
植物组织剪至3 mm以下角形状,称重后于-20℃ 冻结(10~100 mg植物组织/1.5 ml Microtube)
冻结的植物组织室温放置5分钟左右融解
轻微离心后、用 Pipet Tip 尖端将植物组织按压 Microtube 底部 10 次左右
2.0
1.4
2.0
1.6
1.8
1.4
1.7
1.4
20 mg
9
2.2
1.6
10
2.2
1.8
菠菜叶
11
2.1
1.8
50 mg
12
2.0
1.7
*:按照“操作方法”提取的基因组DNA中含有RNA,不能正确反映出基因组DNA的纯度。
实验例 2:从烟草 BY-2 培养细胞中提取基因组 DNA 将湿重 50 mg 的烟草 BY-2 培养细胞放入 1.5 ml Microtube 中,使用 PBS Buffer 洗净,于-20℃冻结后 省略了用 Pipet Tip 尖端将植物组织按压 Microtube 底部这一步骤,其余步骤按“操作方法”操作,沉淀用 20 μl TE Buffer 溶解后,进行吸光度测定和电泳确认,电泳结果如下。每份样品分别平行提取了 2 个。
【目的基因及扩增片段大小】
实验材料:
菠菜
目的基因:
coxl 基因
片段大小:
约 0.5 kbp
PCR 反应条件:
98℃
10 sec
60℃
30 sec
72℃
30 sec
30 Cycles
-5-
10 mg M1 2 345 6
100 mg M1 2 3 4 56
1% Agarose 电泳
1:基因组 DNA 原液 2:基因组 DNA 溶液 2 倍稀释液 3:基因组 DNA 溶液 5 倍稀释液 4:基因组 DNA 溶液 10 倍稀释液 5:基因组 DNA 溶液 20 倍稀释液 6:基因组 DNA 溶液 40 倍稀释液 M:250 bp DNA Ladder Marker
30 Cycles
西红柿,烟草 98℃ 10 sec 55℃ 30 sec 72℃ 1 min/kbp
30 Cycles
实验例 2 提取的
基因组 DNA
实验例 1 提取的基因组 DNA
烟草 BY-2
拟南芥
西红柿
菠菜
培养细胞
20 mg 50 mg 20 mg 50 mg 20 mg 50 mg 50 mg
-1-
8. 轻微离心 2 秒钟以内,于 50℃温浴 15 分钟。 注:长时间离心 Extraction Solution 3 将会分层, 务必控制在 2 秒钟以内。
9. 12,000 rpm 4℃离心 15 分钟。 10. 取上层水相移至新的 1.5 ml Microtube 中,上层水
相约 400 μl。注意尽量不要混入水相以外的物质。 11. 添加等量的异丙醇,轻柔混匀。
●制品内容(100 次量)
组份名称 Extraction Solution 1 Extraction Solution 2 Extraction Solution 3(100% Benzyl Chloride)
包装量 40 ml 8 ml 15 ml
【试剂盒之外所需准备试剂及器具】 ◆ 异丙醇 ◆ 70%乙醇 ◆ TE Buffer ◆ RNase A(必要时使用) ◆ Micropipet ◆ Micropipet 用 Tip ◆ 1.5 ml Microtube ◆ 离心机(转速可达 12,000 rpm) ◆ 桌面离心机 ◆ 桌面振荡仪
淀。 注:沉淀过度干燥将导致难以溶解,请注意。
注 1. 回收的基因组 DNA 溶液可直接作为 PCR 反应的 模板或直接进行限制酶切断等反应。 使用 20 μl TE Buffer 溶解基因组 DNA 时,PCR 反应液(25 μl 反应体系)或限制酶酶切反应液(20 μl 反应体系)中添加的 DNA 溶液在 0.5~2 μl 之 间为好。
●制品说明
Plant DNA Isolation Reagent 是 根 据 氯 化 苄 法 构 建 的 , 可 以 从 植 物 材 料 中 提 取 基 因 组 DNA 的 Ready-to-use 试剂盒。氯化苄具有能将含有纤维素等的细胞壁中的羟基苄基化,从而破坏细胞壁的特性。 本制品利用了氯化苄的这一特性,将植物样品冻结融解后,再使用 Pipet Tip 的尖端将植物样品在 Microtube 壁上数次按压即可破坏细胞壁。本法与传统方法相比,省去了液氮研磨等烦琐步骤,有利于一次性处理大量 样品。而且,本制品经过了改良,热处理时间只需 15 分钟,使用本制品从实验开始至水相回收只需 30 分 钟时间。得到的基因组 DNA 可以进行 PCR 扩增及限制酶处理等。
2. 取出冻结的植物组织于室温放置 5 分钟左右,使其融解。 3. 轻微离心,将植物组织收集在 Microtube 底部。 4. 使用 Pipet Tip 尖端将植物组织按压 Microtube 底部 10 次左右,进行物理破碎。 5. 加入 400 μl 的 Extraction Solution 1,剧烈振荡 5 秒钟。如果植物组织仍滞留于 Microtube 底部,
除去上清,加入 1 ml 70%乙醇清洗沉淀 12,000 rpm 4℃离心 3 分钟
●实验例
除去上清,沉淀干燥后用 TE Buffer 溶解
实验例 1:从植物组织中提取基因组 DNA
将拟南芥的幼芽、西红柿的幼芽和菠菜叶用剪刀剪至 3 mm 以下角形状,分别称取 20 mg 和 50 mg 放入
1.5 ml Microtube 中,于-20℃冻结后按“操作方法”进行基因组 DNA 的提取,基因组 DNA 使用 20 μl TE
50 mg
2
2.2
2.1
2.2
2.2
*:按照“操作方法”提取的基因组DNA中含有RNA,不能正确反映出基因组DNA的纯度。
-3-
实验例 3:以提取的基因组 DNA 为模板进行 PCR 扩增 以实验例 1、2 中提取的基因组 DNA 溶液为模板进行 PCR 扩增。 Template: 实验例 1、2 提取的基因组 DNA 溶液各 0.5 μl PCR Enzyme: TaKaRa Taq Hot Start Version(TaKaRa Code:DRR006A) Total Volume: 25 μl
M 1 2 3 4 5 6 7 8 9 10 11 12 1 2 M
1.0 kbp 0.5 kbp
2.0 kbp
PCR 反应液 4 μl,1% Agarose 电泳,M:Wide-Range DNA Ladder(50~10,000 bp) 图 3 以提取的基因组 DNA 为模板进行 PCR 扩增的电泳图
12M
5 μl 提取液,1% Agarose 电泳
M:λ-Hind Ⅲ digest 150 ng
图 2 烟草 BY-2 培养细胞中提取的基因组 DNA 电泳图
表 2 从烟草 BY-2 培养细胞中提取基因组 DNA 的纯度*
样品名称
样品量
Sample No.
A260/A280
A260/A230
1
烟草BY-2培养细胞
Buffer 溶解后,进行吸光度测定和电泳确认,电泳结果如下。每份样品分别平行提取了 2 个。
