重组逆转录病毒载体的包装及病毒滴度影响因素
人HGF基因重组逆转录病毒表达载体及包装细胞株的构建和鉴定[1]
![人HGF基因重组逆转录病毒表达载体及包装细胞株的构建和鉴定[1]](https://img.taocdn.com/s3/m/0aabf78e71fe910ef12df8d5.png)
WANG Yun2Fang , NAN Xue , YUE Wen , LI Yan2Hua , YAN Fang , PEI Xue2Tao 3
图 1 重组逆转录病毒载体质粒构建流程示意图
换完全培养液 。细胞转染 48 h 后按 1∶15 传代 ,加入含 600 μg/ ml G418 筛选 14 d ,直至抗性细胞集落形成 。挑选大的健 康的细胞集落 ,用完全培养液扩大培养 ,以制备含病毒的包 装细胞上清 ,测定病毒滴度并冻存细胞 。 1. 5 重组逆转录病毒滴度的测定
PT67 细胞用含 10 %胎牛血清的 DMEM/ F12 培养液 (完 全培养液) 培养至 95 %汇合 。将 pMSCV2HGF 5μg 加入 250μl 无血清培养液 ,取 LF2000 10μl 加入 250μl 上述培养液 ,两者 混匀后于室温放置 20 min。将 PT67 细胞用培养液洗 2 次 ,缓 慢滴入用 1 ml 培养液稀释的 DNA2LF2000 混合液 。培养 6 h 后 ,加入 1 ml 含 20 %胎牛血清的培养液 ,继续培养 24 h 后更
军事医学科学院院刊 2004 年 6 月 第 28 卷 第 3 期
Bull Acad Mil Med Sci , Jun 2004 ; Vol 28 No 3
205
人 HGF 基因重组逆转录病毒表达载体及 包装细胞株的构建和鉴定
论 著
王韫芳 , 南 雪 , 岳 文 , 李艳华 , 闫 舫 , 裴雪涛 3
根据 hHGF2cDNA 编码区的序列并分别引入 Hpa Ⅰ和 BamH Ⅰ酶 切 位 点 合 成 引 物 1 , P1 : 5′2CCG GTTAAC AT2
逆转录病毒试用装操作手册

汉恒逆转录病毒操作手册一、逆转录病毒的试用装分装与储存1.收到汉恒生物逆转录病毒产品后,请先对逆转录病毒产品进行分装处理,建议20-50μl/管。
如1-2天内使用,则留足够量病毒4℃保存,余下逆转录病毒置于-80℃长期保存。
2.病毒可以存放于-80℃ 6个月以上;但如果病毒储存时间超过6个月,建议在使用前重新测定病毒滴度。
3.反复冻融会降低逆转录病毒滴度:逆转录病毒滴度越低,冻融对滴度的影响越大,108IU/ml的逆转录病毒冻融2次滴度没有显著性差异,第3次冻融开始,每冻融一次滴度降低约10%;滴度107IU/ml滴度逆转录病毒,从第2次冻融开始,每次冻融病毒滴度下降10%-15%。
二、逆转录病毒试用装实验策略与关键知识点1.逆转录病毒感染策略:逆转录病毒本身的病毒滴度不高,感染细胞时病毒消耗量较大,试用装体积较小,建议使用96孔板进行MOI梯度感染测试。
逆转录病毒感染细胞后会反转录并插入基因组形成稳转,因此逆转录病毒感染一般采用感染少量细胞,然后将细胞放大化培养。
而不是直接大量感染。
注意:对于一些传代能力较差的原代细胞,比如BMSC等,建议采用腺病毒感染。
2.逆转录病毒感染关键知识点1)细胞准备:由于试用装体积有限,请使用96孔板准备细胞,逆转录病毒感染细胞前,请确保目的细胞状态良好、无支原体污染。
逆转录病毒感染的时候细胞汇合率为40%~60%间为宜。
2)感染细胞最佳MOI的测定:MOI(感染复数)是指每个细胞感染的病毒数。
逆转录病毒对于不同种类不同来源的细胞,其最适MOI各有差别,原则上最适MOI是感染效率较好的最低MOI。
MOI一般以3:10:30:100的比例递增进行梯度摸索,一般的细胞基础逆转录病毒感染MOI 可从3为开始,即设立4个常规的MOI摸索,即3,10,30,100。
3)助转剂polybrene的选择:实验证明,polybrene可提高逆转录病毒对大部分细胞的感染效率,但polybrene 有一定的细胞毒性,不同细胞对polybrene的敏感度不同,polybrene最常用的工作浓度为5~8μg/ml。
磷酸钙转染方法的优化

磷酸钙转染方法的优化程腾;李佳佳;贺小英;刘希宇;陈珊;李文达;马利兵【摘要】通过比较293T细胞的接种密度、质粒DNA的量以及 CO2浓度对磷酸钙转染方法的影响,确定最佳的转染条件。
以各单因素试验的最适条件为依据,设计三因素三水平的正交试验。
结果表明,磷酸钙介导质粒DNA转染,当293T细胞的接种密度为5×105/mL、质粒 DNA 的量为30μg、细胞培养环境 CO2浓度为3%时,转染效果最佳。
%In this study,the effects of seeding density of 293T cells,as well as the amount of plasmid DNA and the concentration of CO2 in culture environment,on the efficiency of calcium phosphate transfec—tion were compared,optimum transfection condition was confirmed.On the basis of optimum condition obtained from single factor experiments,orthogonal tests in three levels of three factors were designed and performed.The results showed that the highest transfection efficiency was obtained when the seeding den—sity of 293T cells was 5×105/mL,the amount of plasmid DNA was 30μg and the concentration of CO2 in culture environment was 3%.【期刊名称】《内蒙古师范大学学报(自然科学汉文版)》【年(卷),期】2014(000)006【总页数】5页(P776-780)【关键词】磷酸钙;质粒DNA转染;293T细胞;接种密度【作者】程腾;李佳佳;贺小英;刘希宇;陈珊;李文达;马利兵【作者单位】内蒙古科技大学数理与生物工程学院,内蒙古包头 014010;内蒙古科技大学数理与生物工程学院,内蒙古包头 014010;内蒙古科技大学数理与生物工程学院,内蒙古包头 014010;内蒙古科技大学数理与生物工程学院,内蒙古包头 014010;内蒙古科技大学数理与生物工程学院,内蒙古包头 014010;内蒙古科技大学数理与生物工程学院,内蒙古包头 014010;内蒙古科技大学数理与生物工程学院,内蒙古包头 014010【正文语种】中文【中图分类】Q987.2近年来关于诱导性多潜能干细胞(induced pluripotent stem cells,iPSCs)的研究[1-4]是生物技术研究领域的热点之一,在iPSCs的研究中,应用最多的载体是逆转录病毒载体和慢病毒载体,二者都能获得很高的诱导效率.将逆转录病毒载体和包装质粒一起转染到293T细胞后培养一段时间即可制备逆转录病毒颗粒.采用质粒DNA 转染293T细胞的方法有多种,应用较为广泛的有脂质体法、磷酸钙法、电穿孔法等.用以转染的脂质体多为商业化的脂质体,性质稳定,转染效率高,但价格昂贵.电穿孔法操作简单,但是需要对相应实验条件进行摸索,同时细胞在转染时的致死率大.磷酸钙应用成本低,对具体的体系加以优化后也能获得比较高的转染效率和病毒滴度.本实验采用磷酸钙转染的方法,从293T细胞的接种密度、质粒DNA的量及CO2浓度三方面进行研究,确定最佳的转染条件,以便为后续诱导人的iPS细胞进行准备.1.1 试剂和溶液试剂:胰蛋白酶、台盼蓝购于Amresco公司,EDTA,胎牛血清(fetal bovine serum,FBS)购于杭州四季青公司,DMEM(高糖)培养基购于Gibco公司,青霉素、链霉素购于华北制药,其余试剂均购于国药集团化学试剂有限公司,重组逆转录病毒载体p EYK-E4由内蒙古科技大学王建英教授惠赠,其病毒包装载体p LP1、p LP2、p LP/VSVG购于Invitrogen公司.溶液:D-Hanks液、胰蛋白酶消化液(0.25%胰蛋白酶、0.05%EDTA)、0.4%台盼蓝染液、含10%FBS的DMEM(高糖)培养液(青霉素100IU/m L、链霉素100μg/m L)、含不同浓度FBS的各种培养液、细胞冷冻液.除非特别说明,文中所用相应溶液的配制方法均参见文献[5].1.2 磷酸钙介导质粒DNA转染和包装病毒的生产、收集转染前24 h,通过胰酶消化收集对数期生长的293T细胞,以适宜的密度接种于100 mm培养皿.加入10 m L完全培养液,于5%CO2、饱和湿度、37℃的培养箱过夜培养细胞.取适量超螺旋质粒DNA溶于0.5 m L 0.25 mol/L CaCl2,混匀,然后将其加至0.5 m L 2×BES缓冲液中,室温下孵育10~20 min.重组逆转录病毒载体质粒和包装质粒的比为p EYK-E4∶p LP1∶p LP2∶p LP/VSVG=1∶0.45∶0.45∶0.8.滴加CaCl2-DNA-BBS溶液于细胞中,轻轻旋转以混匀.放入适宜CO2浓度、饱和湿度、37℃的培养箱中培养细胞12~16 h.吸去培养液,用培养液洗涤细胞2次.加10 m L新鲜的完全培养液.于5%CO2、饱和湿度、37℃培养箱培养32~36 h.转染48 h后细胞培养液中已含有病毒,可以收集含病毒的培养液.1.3 转染条件的优化1.3.1 磷酸钙介导质粒DNA转染中293T细胞的接种密度对病毒包装效率的影响以5×104,1×105, 5×105,10×105,50×105个/m L将293T细胞接种于100 mm 培养皿中,每皿加10 m L细胞悬液,转染时质粒DNA量为30 g、CO2浓度为5%.转染后测定滴度,以确定转染时293T细胞的最优接种密度.1.3.2 磷酸钙介导质粒DNA转染中质粒DNA的量对病毒包装效率的影响采用1.3.1中所得的最佳接种密度,设置细胞培养环境CO2浓度为5%,质粒DNA的量为10,20,30,40,50μg,转染后测定滴度,以确定转染时质粒DNA的最佳用量.1.3.3 磷酸钙介导质粒DNA转染中细胞培养环境CO2浓度对病毒包装效率的影响采用上两步骤中所得的最佳接种密度和最佳质粒DNA的量.转染时细胞培养环境CO2浓度设置1%、2%、3%、4%、5%5个梯度.转染后测定滴度,确定转染时最优的细胞培养环境CO2浓度.1.3.4 磷酸钙介导的质粒DNA转染条件中影响病毒包装效率因素的正交实验根据最优条件设计三因素三水平的正交实验,以确定三因素中的主次关系及病毒包装的最优化转染条件.1.4 逆转录病毒颗粒滴度的测定将收集的含病毒的培养基,转入15 m L离心管中,4℃4 500 r/min离心5 min沉淀细胞碎片,吸取上清液,以0.45μm滤膜的滤器过滤上清液.取相应体积的液体进行病毒滴度的测定.其他的则以2 m L的量分装在冷冻管里,置于-80℃下保存备用.提前24 h在6孔板中接种293T细胞,每孔接种2×105个,培养过夜汇合度达到20%~50%.取病毒上清液分别加入新鲜的培养液稀释102、103、104、105、106倍,同时加入Polybrene浓缩液,使Polybrene浓度达到6μg/m L.移去孔中的培养基,以D-Hanks溶液冲洗两次后,每孔加入1 m L稀释液,并设置不加病毒上清液的空白对照孔.置于5%CO2、饱和湿度、37℃培养箱中吸附5 h,移去培养液,加入10%FBS的DMEM (高糖)完全培养液,同时向全部的孔中加入博莱霉素浓缩液,终浓度为200μg/m L.每2~3 d换液一次,同时观察处理孔和对照孔的细胞状态,包括细胞死亡的状况和抗性集落的出现.第13 d对各孔中的集落数目进行计数.取数量适中且细胞集落比较清晰的孔的数据进行计算:病毒滴度(CFU/m L)=细胞集落个数×稀释倍数/加入的病毒液体积.2.1 293T细胞接种密度对病毒包装效率的影响以5×104,1×105,5×105,10×105, 50×105个/m L接种293T细胞,转染时质粒DNA量为30μg、细胞培养环境CO2浓度为5%,所获得的病毒的滴度如图1所示.由图1可知,293T细胞的接种密度对病毒包装效率具有一定影响.在接种密度达到5×105个/m L时,所获得的病毒的滴度是最大的,能达到6 500 CFU/m L;接种密度在1×105个/m L、10×105个/m L时,所获得的病毒的滴度分别为6 100 CFU/m L和5 900 CFU/m L,相比之下差异显著(P>0.05);接种密度为5×104个/m L和50×105个/m L时,病毒的滴度不理想,只能达到4 700 CFU/m L和4 200 CFU/m L.因此在进行磷酸钙介导的质粒DNA转染时,293T细胞的接种密度以5×105个/m L为宜.2.2 质粒DNA的量对病毒包装效率的影响采用5×105个/m L的293T细胞接种密度,设置CO2浓度为5%,转染时质粒DNA的量设置为10, 20,30,40,50μg,转染后测定滴度,所获得的病毒的滴度如图2所示.由图2可知,质粒DNA用量从10μg到20μg,病毒滴度有上升的趋势,在20μg时病毒的滴度最大,为7 300 CFU/m L,而10μg时仅能达到5 900 CFU/m L,虽然质粒DNA量为30μg时病毒的滴度有所下降,但是也能达到6 900 CFU/m L,与前一个梯度差异不显著(P>0.05).继续加大质粒DNA的量时,病毒的滴度呈现比较大幅度的下降.当质粒DNA量为40μg和50μg时,病毒的滴度分别为5 300 CFU/m L和5200 CFU/m L,二者差异不显著(P>0.05),说明此时质粒DNA量并不再足以影响病毒的包装效率.因此质粒DNA的量在20μg时比较适宜.2.3 细胞培养环境CO2浓度对病毒包装效率的影响293T细胞的接种密度以5×105个/m L、质粒DNA的量为20μg,转染时细胞培养环境CO2浓度设置1%、2%、3%、4%及5%,转染后测定的病毒滴度,结果如图3所示.由图3可知,细胞培养环境CO2浓度对对病毒包装效率的影响是比较明显的,从1%到3%呈现快速上升的态势,在细胞培养环境CO2浓度为3%时,病毒的滴度达到了最大值,为1.46×104CFU/m L,随后细胞培养环境CO2浓度逐渐增高,所获得的病毒的滴度也在下降.细胞培养环境CO2浓度为1%时病毒滴度只能达到5 600 CFU/m L,为最低值;细胞培养环境CO2浓度为2%可达到9600 CFU/m L,低于细胞培养环境CO2浓度为4%时的1.20×104CFU/m L,但要比细胞培养环境CO2浓度为5%时的7000 CFU/m L要高.因此比较适宜的范围为2%~4%,本文选择3%为适宜条件.2.4 正交实验根据各单因素试验(293T细胞的接种密度、细胞培养环境CO2浓度、质粒DNA 的量)的最适条件为依据,设计三因素三水平的正交试验,见表1,所得结果如表2所示.由表2中的极差分析可知,影响病毒包装效率的磷酸钙介导质粒DNA转染三个因素的主次关系为B>C>A,即细胞培养环境CO2浓度>质粒DNA的量>293T细胞接种密度,最优水平的组合为A2B2C3,即转染的最佳条件为293T细胞的接种密度5×105个/m L、细胞培养环境CO2浓度3%、质粒DNA的量30μg.使用磷酸钙介导的质粒DNA转染293T细胞制备逆转录病毒颗粒时,最佳的条件为293T细胞的接种密度为5×105个/m L、细胞培养环境CO2浓度为3%、质粒DNA的量为30μg,此条件下可获得1.9×104CFU/ml的病毒滴度.本实验参照的是文献[6]中改进型的磷酸钙介导质粒DNA转染真核细胞的方法,这种方法相对于传统方法的效率要高出很多.本实验以转染中最为关键的影响因素对转染体系做了相应的优化.293T细胞是本次实验中所使用的包装细胞系.这种细胞是最适合磷酸钙法转染的细胞之一,在优化后的转染条件中能达到很高的病毒滴度.而293T细胞接种密度对本实验的影响不仅仅限于转染的进行,还包括病毒生产的过程.Kotani等[7]认为逆转录病毒的滴度和使用的包装细胞数量是相关的,而杨生玺等[8]的研究称逆转录病毒的滴度随包装细胞(PA317)密度上升而上升.但本实验使用的100 mm培养皿的最适的接种密度为5×105个/m L,细胞的接种密度过小或过大都会影响实验结果.低的接种密度在进行转染时,细胞的绝对数量达不到,相应的被转染的细胞数量也就少;由于293T细胞生长很迅速,当接种密度过大时,在进行转染时,细胞的汇合度就会很大,细胞的生长活动会受到抑制,同时293T细胞的贴壁性不强,汇合度大的细胞在转染和病毒制备的过程中会成片的浮起,极大影响病毒的制备.而且293T细胞的生长状态也很重要,进行转染和病毒生产的细胞一般都要是生长旺盛的细胞,而293T细胞汇合度很高时,其细胞的生长状态会受到抑制,长满后的细胞明显衰退,抑制了病毒的生产.有研究[9]使用无CO2和低温的环境来减缓已经长满后的细胞的衰退,从而提高病毒分泌效率.而本实验中,生长状态好的293T细胞接种24 h汇合度能达到50%左右,进行转染、病毒生产后,细胞则基本长满培养皿底部,细胞状态和数量均能达到最佳状态.质粒DNA的量会影响磷酸钙-DNA沉淀的性质.实验中只有质粒DNA量在20μg 和30μg时转染效率和病毒的包装效率比较高.DNA的量在实验中是以质粒DNA 的浓度来体现的,DNA最佳浓度的范围较窄,合适的DNA浓度形成的磷酸钙-DNA 沉淀会更易形成细致的沉淀,利于转染.同时质粒DNA的纯度、形式也会对转染效率有影响.由于细菌污染的抑制作用,不纯的质粒DNA转染的效率极低;线性质粒DNA转化效率的也是很低的,因为其与磷酸钙形成沉淀的速度慢,DNA与胞内核酸酶接触时间比较长[10-11].所以本实验中使用的质粒DNA都是使用高纯度质粒DNA提取试剂盒提取的,其的值都在1.8~1.9,经过电泳检测抽提到的质粒基本上都是超螺旋状态的.CO2浓度对病毒包装效率的影响是通过影响培养液p H环境而实现的.也有研究[9]使用了无CO2培养条件和32℃的低温,称获得的病毒滴度能提高10倍,而这种条件影响的不仅包括p H,还有细胞的生长状态,与普通的磷酸钙转染体系差别很大.一般细胞培养使用的培养液中都会有Na HCO3,通过HCO-3/CO2缓冲系统维持p H于7.2~7.4之间的稳定,而与之相配的CO2气体环境一般在5%才能补偿外溢的CO2,以防止其碱化.但磷酸钙-DNA沉淀形成的缓慢过程中,则需要微酸的p H,最佳的p H为6.96[6].所以2×BES的在配制的时候,p H值严格要求在6.96,然后就要采用适宜的CO2浓度来维持p H的稳定.从实验结果来看,1%CO2浓度则显然过低,其获得的病毒滴度也是最低的.最为常用的5%CO2浓度并不适合于磷酸钙介导的质粒DNA转染,其维持的培养液的p H相对来说还是偏碱性的.最适条件3%CO2浓度中所能获得病毒的滴度是5%CO2浓度环境中的2倍以上,低CO2浓度的培养,能显著的提高病毒的包装效率.本实验确定的最优化的转染条件所获得的病毒滴度是较高的,达到了1.9×104CFU/m L,并不低于其他报道[8,9,12-13]中逆转录病毒载体包装时所得到的病毒滴度.有研究称单个质粒转染的效率要高于多质粒共转染,采取单个质粒分批次转染的方式有时可以获取更高的病毒滴度.本实验采用的多质粒共转染的方式,这主要是因为单质粒分批转染时间长、操作环节多,加之293T细胞生长速度快、细胞贴壁性不好,转染操作也会对其造成损伤,使得后续质粒转染效果会受到影响,也易对细胞培养体系造成污染.【相关文献】[1] Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663-676.[2] Takahashi K,Tanabe K,Ohnuki M,et al.Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J].Cell,2007,131(5):861-872.[3] Yamanaka S.Elite and stochastic models for induced pluripotent stem cell generation[J].Nature,2009,460(7251):49-52.[4] Trokovic R,Weltner J,Manninen T,et al.Small molecule inhibitors promote efficient generation of induced pluripotent stem cells from human skeletal myoblasts[J].Stem Cells Dev,2013,22(1):114-123.[5] 马利兵,赵秀娟.动物细胞工程[M].长春:吉林大学出版社,2011.[6] [美]萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].黄培堂,译.北京:科学出版社,2002:1286-1287.[7] Kotani H,Newton P B,Zhang S,et al.Improved methods of retroviral vector transduction and production for gene therapy[J].Hum Gene Ther,1994,5(1):19-28.[8] 杨生玺,蒋虹.重组逆转录病毒载体的包装及病毒滴度影响因素[J].第四军医大学学报,2005,26(14):261.[9] 单路娟,刘越坚,吴泰华.逆转录病毒滴度测定新方法的实验研究[J].大连医科大学学报,2010,32(4):483-485.[10] 邓虎平,庄然,贾卫,等.人CD22分子胞膜外区D1和鉴定和D2真核表达载体的构建、表达[J].免疫学杂志,2007, 23(5):499-501.[11] Zheng L H,Bao Y L,Wu Y,et al.Cantharidin reverses multidrug resistance of human hepatoma Hep G2/ADM cells via down-regulation of P-glycoprotein expression[J].Cancer Lett,2008,272(1):102-109.[12] 许建.基于逆转录病毒载体的高效表达系统的建立和应用[D].北京:中国人民解放军军事医学科学院,2008.[13] 满朝来,张庆,陈岩,等.逆转录病毒的高效包装及转基因技术平台的建立[J].生物医学工程学杂志,2007,24(5): 1111-1117.。
关于靶基因说明

关于靶基因的说明"靶基因" :target gene"靶基因" 在学术文献中的解释1、在维甲酸诱导APL细胞分化的研究中,一般将受维甲酸及受体直接作用的基因称为靶基因,而将受靶基因蛋白质产物调控的基因称为受维甲酸调控基因 .2、靶基因是指编码特定蛋白质的结构基因,它能使转基因生物体产生新的表型.转基因鱼研究中所使用的靶基因大多是生长激素基因、抗冻蛋白基因、珠蛋白基因、金属硫蛋白基因和生长激素释放因子基因等.3、而欲进行杂交的实验样本(DNA或是RNA)称为靶基因,这指的是从试验样品中提取的丰度一定的未知序列的核苷酸链.基因靶技术(gene targeting)一、基因靶技术的原理基因靶技术的原理是设计一个靶载体,其内含有与靶位点相同的核苷酸序列,用基因转移的方法将载体导入靶细胞,通过载体与靶位点相同的核苷酸顺序间的同源重组,使外源DNA序列定点整合入靶位点,从而达到对靶位点进行定点修复或定点突变的目的。
载体分两种:一是序列插入型载体,通过与靶点序列的单交换导入外源序列;二是序列取代型载体,通过与靶点序列间的双交换,用外源序列取代靶序列。
二、基因靶技术的作用(一)确定基因表达水平目前应用最多的基因转移途径—逆转录病毒载体介导的基因转移存在二个问题,一是导入的外源基因难以生理方式进行表达;二是即使表达也不够完善。
采用基因同源重组的基因靶技术,可使病变的基因在原位得到改正,与正常基因的结构与调控环境一致,即以生理方式来进行表达。
1989年Thomphon采用小鼠胚干细胞HPRT基因的同源重组置换,使HPRT缺陷功能得到恢复。
(二)增强基因表达的稳定性与安全性通过逆转录病毒载体,将目的基因导入靶细胞后,随时间的推移,目的基因表达的稳定性会有所下降,表达的活性会慢慢的降低,有的甚至完全停止表达。
同样,外源基因与靶细胞染色体基因组的整合位点是随机的,常可导致基因的丢失和重排而失去表达活性。
慢病毒包装步骤及经验总结

慢病毒包装步骤及经验总结慢病毒(Lentivirus)是逆转录病毒的⼀种,它能够将靶基因导⼊到⼀些较难转染的细胞,如原代细胞等,并且将靶基因随机整合到宿主的基因组中,从⽽⼤⼤增加了转染效率,并且能够在细胞系中稳定表达若⼲代,可以进⾏稳转细胞株的筛选。
因为是随机整合,也有不确定因素,有些公司还能提供定点整合技术,将靶基因定点整合到基因组特定的部位,从⽽保证其⾼效表达并且对细胞不产⽣随机整合可能产⽣的伤害。
慢病毒表达载体包含了包装、转染、稳定整合所需要的遗传信息。
慢病毒包装质粒可提供所有的转录并包装RNA到重组的假病毒载体所需要的所有辅助蛋⽩。
为产⽣⾼滴度的病毒颗粒,需要利⽤表达载体和包装质粒同时共转染细胞,在细胞中进⾏病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离⼼取得上清液后,可以直接⽤于宿主细胞的感染。
慢病毒载体基因组是正链RNA,其基因组进⼊细胞后,在细胞浆中被其⾃⾝携带的逆转录酶逆转录为DNA,形成DNA整合前复合体,进⼊细胞核后,DNA整合到细胞基因组中。
整合后的DNA转录mRNA,回到细胞浆中,表达⽬的蛋⽩或产⽣RNAi⼲扰。
慢病毒包装系统由⼀个包装质粒混合物(Mix)和⼀个慢病毒载体质粒(LentiviralVector)组成,如下图(图⽚来⾃MIT):载体中含有HIV的基本元件5’LTR和3’LTR以及其他辅助元件等。
不同系统包装质粒混合物也不⼀样,以本实验室的三质粒系统为例,包装质粒混合物中含pMDL,VSVG,pRSV-Rev,⽐例为5:3:2;其中pMDL含有编码HIV病毒主要结构蛋⽩的gag基因和编码病毒特异性酶的pol基因,pRSV-Rev含编码调节gag和pol基因表达的调节因⼦rev基因,VSVG含有提供病毒包装所需要的单纯疱疹病毒来源的VSVG基因。
以下介绍⽤293T细胞在六孔板(35mm)中包装病毒,其他孔板相应增加或减少体积。
准备试剂篇? 核⼼质粒;? 指数⽣长的293T细胞;? 病毒包装质粒Mix:1 µg/µl(Mix=pMDL: VSV-G : REV=5:3:2),不同载体系统所⽤的包装病毒质粒也不⼀样,此系统可⽤于包装PBOBi,PLKO, Plv等载体质粒。
病毒包装载体构建常见问题汇总

病毒包装载体构建常见问题汇总病毒包装、载体构建我们整理了以下几个常见问题。
1、什么是MOI?在微生物学中,MOI是病原体(如噬菌体或病毒、细菌等)与感染目标(如细胞)的比率。
对于病毒,MOI是病毒颗粒数量与特定空间中存在的目标细胞数量的比率。
通常可将某株细胞有80%被感染时所用的病毒颗粒数和细胞数目的比值作为该株细胞的MOI。
2、如何稀释病毒?您可使用完全培养基、PBS液等将病毒稀释到需要的滴度。
如将滴度为5 x109 2TU/ml的病毒稀释到1 x109 TU/ml,则需取20 µl 病毒液加入到80 µl的完全培养基中。
3、用于病毒感染的细胞接种量是多少?根据细胞增殖的速度调整细胞接种量,以保证在感染后3天左右细胞刚好快长满培养皿底部为宜。
针对大部分细胞系:传代周期在2-3天,感染时细胞铺板的密度保持在20-30%左右,则72h后细胞增殖后铺板密度约在90%左右;针对某些原代细胞:由于细胞增长缓慢,可以在接种时提高汇合度到50%~ 60%,但要确保在感染后3天时细胞汇合度达到90%~100%;针对非分裂细胞:如神经元细胞,接种后不再增殖,此时可以按照80%的汇合度进行接种。
4、如何提高病毒对细胞的感染效率?病毒对细胞的感染效率受细胞自身生长的状态,细胞数量,细胞被病毒感染的难易程度等多个因素影响。
因此保证细胞生长状态良好,轮廓清晰,合适的细胞密度,选择最优的感染条件(如合适的MOI值)可以更好的保证感染效率。
对于悬浮细胞,可采用离心感染方法,减少病毒感染时的体积,从而提高感染效率。
如可以在加入病毒后将细胞培养板密封,用离心机在1000g条件下离心1h,再放回培养箱中正常培养。
5、加入病毒病毒后,细胞死亡很厉害,该如何处理?病毒有一定的细胞毒性,如果培养过程中细胞出现了明显的病变或细胞状态变差,建议将转导时间缩短至5~8小时之间。
或者调整并降低感染的MOI值,并且在感染后4小时、 8 小时、 12小时对细胞进行观察,若发现细胞状态变差时,则需要立刻对细胞进行换液操作,使用新鲜的完全培养液替换病毒感染培养液6、细胞能被病毒感染,但为何GFP荧光很弱?GFP病毒感染细胞后,细胞中荧光强度取决于病毒进入到细胞的颗粒数、细胞本身的增殖状态、细胞类等因素。
病毒包装经验总结(病毒包装注意点)

病毒包装经验总结(病毒包装注意点)病毒包装需要注意什么--病毒包装经验总结在做病毒包装实验中,有科研工作者常遇到:用同样一个病毒载体系统进行病毒包装实验,为什么有人做的很好,次次成功,有人却是时常做不出来,稳定性很差,不是滴度低就是根本不出毒? 当然你也可以找公司例如汉恒生物,进行病毒包装。
从我们对不同载体系统病毒包装的多年经验总结,主要以下几个方面心得:第一,病毒包装的几个关键节点就是细胞因素、载体系统(尽量使用成熟的商业化载体系统)、构建重组的质粒正确与否、质粒抽提纯化情况、包装转染控制(24、48 小时的细胞及荧光状态判断)、目的基因对病毒包装影响(基因大小、序列情况、蛋白功能毒性等都会影响到是否能包装成功)。
第二,如果有细胞培养和细胞转染实验的常规经验,细胞因素应该没有什么问题(细胞培养人员一定要关注,包装或转染感染前一定要重视细胞干净细微污染与否、饱满立体感是否好、铺板均匀细胞密度适中否),细胞产毒出毒期间过程中的活力是包装正常和出来的病毒滴度高低的一个重要环节(正常包装出病毒情况,慢病毒、逆转录病毒包装一个细胞出一个病毒颗粒,腺病毒是1000 个,腺相关病毒是10000 个),所以实践操作表明,病毒包装转染时细胞的密度要控制,使得收毒(72 小时)时细胞密度在90%-95%左右。
第三,建议使用商品化的成熟毒载体系统(不要用来路不清或基本被淘汰很少人在使用的系统),从文献和我们多年的实践可以结论,这类系统是稳定的,因而分析原因时尽量少花精力在对载体系统的验证上,这样会白花力气。
第四,至于包装转染时的操作控制细节及其转染试剂因素,只要在操作时按相关使用说明和操作步骤,应该没有大问题,所以也不要白花太多精力在这上面。
第五,另一个需要重点关注和排查的因素就是目的基因的表达载体构建和抽提纯化环节,是否构建时导致质粒载体重组或某个部件缺失,或污染别的质粒或杂物?中抽纯化是否污染?是否抽提的是别的质粒?要养成同时做阴性对照的习惯(是否目的基因载体和阴性对照GFP 载体是同一批,建议同一批,建议每次包装都如此操作),如果这个环节没有啥问题,在构建中出现重组和缺失、或抽提纯化失败的可能性也不大。
AAV病毒包装实验常见问题的解答
AAV病毒包装实验常见问题的解答腺相关病毒载体介导的感染效率⽐真核表达质粒的要⾼,且⽬的基因表达稳定,⽬前已经被⼴泛应⽤于体外细胞和体内动物实验中⽬的基因的功能研究、模型建⽴和临床试验等。
越来越多实验室的课题都要⽤到AAV病毒包装,不过在实验的过程中会出现很多问题,⽐如载体构建、质粒抽提纯化异常、病毒滴度过低甚⾄出不了毒等等情况。
今天来聊聊这⽅⾯的问题,看看病毒包装⾼质量的交付受到哪些因素影响,怎样能做得更好。
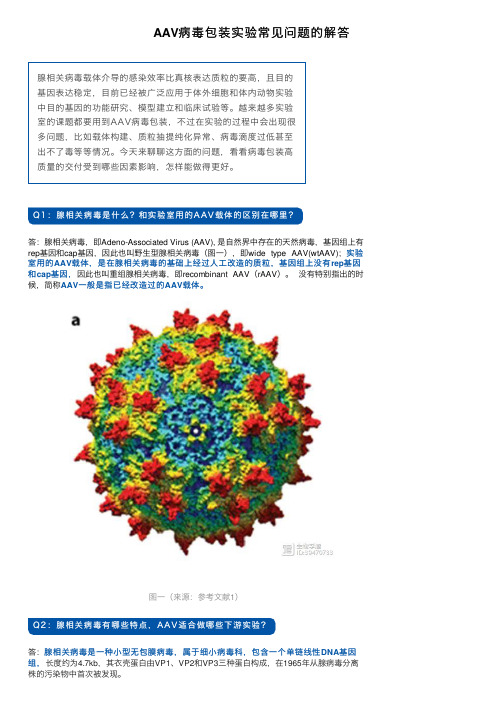
Q1:腺相关病毒是什么?和实验室⽤的A A V载体的区别在哪⾥?答:腺相关病毒,即Adeno-Associated Virus (AAV), 是⾃然界中存在的天然病毒,基因组上有rep基因和cap基因,因此也叫野⽣型腺相关病毒(图⼀),即wide type AAV(wtAAV);实验室⽤的AAV载体,是在腺相关病毒的基础上经过⼈⼯改造的质粒,基因组上没有rep基因,因此也叫重组腺相关病毒,即recombinant AAV(rAAV)。
没有特别指出的时基因,和cap基因候,简称AAV⼀般是指已经改造过的AAV载体。
图⼀(来源:参考⽂献1)Q2:腺相关病毒有哪些特点,A A V适合做哪些下游实验?答:腺相关病毒是⼀种⼩型⽆包膜病毒,属于细⼩病毒科,包含⼀个单链线性DNA基因组,长度约为4.7kb,其⾐壳蛋⽩由VP1、VP2和VP3三种蛋⽩构成,在1965年从腺病毒分离株的污染物中⾸次被发现。
Q3.腺相关病毒进⼊宿主细胞之后,其基因组会整合到宿主细胞基因组中吗?答:野⽣型腺相关病毒wtAAV感染⼈体细胞后,由于其rep基因、ITR序列结构和宿主基因组的相互作⽤,可能倾向整合到19号染⾊体短臂上的AAVS1位点,在⼩⿏中是倾向整合到ROSA26基因位点;⽽改造过的重组型腺相关病毒rAAV,由于基因组上已经去除了rep和cap基因,因此失去了整合到宿主基因组的特性。
rAAV在体内组织,特别是在肌⾁组织中,在宿主基因组染⾊体以外以附加⼦(episome)的双链DNA形式存在,持续稳定表达⽬的基因。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
筮四至医太堂堂亟(!里!竺些丛!!塑鲤旦里i!!兰塑!;堑(!兰2丛P;』41坚里生:鱼竺旦:!塑:塑
·研究简报·文章编号:1000_2790(2005)14一封2旬1
重组逆转录病毒载体的包装及病毒滴度影响因素
杨生玺1,蒋虹2(青海大学:1医学院生物教研室,2附属医院高压氧科,青海西宁810001)
【摘要】目的:探讨产生重组逆转录病毒包装及其病毒滴度(以cfu表示)的影响因素.方法:用逆转录病毒载体pMNs—TK—M,以脂质体法转染包装细胞PA317细胞,挑选抗性集落(PA317/pMNS—TK—M)扩大培养后,进行PA317/pMNS—TK.M细胞接种密度、培养温度(37℃,32℃)、纯化方法等对其培养上清中重组病毒cfu影响的比较性研究.结果:包装细胞的密度是影响cfu的关键因素;降低培养温度需延长培养时间方可提高cfu滴度.结论:该实验结果为应用逆转录病毒载体进行的基因治疗实验研究提供重要的参考依据.
【关键词】逆转录病毒载体;包装细胞;病毒滴度
【中图号】R394【文献标识码】BG418的DMEM培养液继续培养3d,然后更换含800m∥L的G418的培养液,培养约14d,细胞克隆基本形成.分别以0.5,0.7,0.9,1.2及1.5×106不同细胞密度接种产病毒包装细胞,于相同温度及相同培养时间条件下制备含重组逆转录的包装细胞上清,并于相同的条件下测定它们的cfu滴度.取最高cfu的包装细胞系集落,以相同的密度接种细胞,分别在37℃及32℃的条件下培养细胞,并于24h及48h分别收集细胞上清测定病毒cfu滴度.
2结果采用脂质体法,将逆转录病毒载体GINaTK导入PA317细胞,命名为PA317/TK.根据HsV.TK基因设计的引物PcR扩增产物大小为404bp.经PcR扩增,载体GINaTK和抗性细胞PA317/TK细胞均出现阳性条带,而PA317细胞未出现相应条带(图1).分别以0.5,O.7,O.9,1.2及1.5×106不同细胞密度接种产病毒包装细胞,24h收集上清测定cfu,结果随细胞密度上升而上升.在PA317/TK包装细胞密度相同条件下降低温度需延长培养时间,我们在32cc条件下培养48h获得了4.0×10cf∥L的病毒滴度.
0引言在目前众多的基因治疗临床试验方案中,逆转录病
毒载体仍是被广泛应用的载体之一.作为目的基因转运过程
中的逆转录病毒载体和包装细胞,其本身的分子生物学特性404bp已被广泛研究,但对于包装后这些含目的基因的重组逆转录
病毒的生物、物理学特性的研究却较少.为此,我们对产生重
组逆转录病毒的包装细胞系的建立过程及其上清中重组逆转
录病毒集落形成单位(colonyfomingunit,cfu)影响因素进行
了比较性研究.
1材料和方法
1.1材料含有单纯疱疹病毒胸苷激酶基因的小鼠白血病源性逆转录病毒表达载体pMNS—TK,PA317包装细胞及小鼠成纤维细胞NIH3r13培养于含胎牛血清的DMEM培养液中.DMEM,RPMll640培养基等均为Gibco公司产品,胎牛血清为四季青公司产品.逆转录病毒载体、细胞株PA317,NIH31r3由东南大学医学院遗传中心惠赠.
1.2方法按常规方法扩增、抽提、纯化质粒DNA片段、回收HsV—TK片段.在T4DNALigase的作用下,定向克隆入逆转录病毒载体pMNsM中sv40启动子下游的多克隆位点.重组质粒转化JMl09菌后经克隆筛选、鉴定获重组质粒pMNS—TK.M.以脂质体法将上述重组质粒DNA转染至逆病毒包装细胞PA317.以含400m∥LG418的DMEM选择培养基选择培养14d,获G418抗性克隆PA317/TK细胞NIH3r13细胞为靶细胞在Polybrene存在条件下测定、计算病毒滴度.病毒滴度(cfh/L)=细胞克隆平均数×病毒液稀释倍数×103.将收集到的病毒上清液分别作10~,10~,10,10。
倍稀释.分别吸取1.5mL稀释的病毒液(8mg/L聚凝胺)加入NIH3耶细胞培养瓶内,使病毒吸附2.5h后,补加等量含300mg/L
收稿日期:2005旬2旬7;修回日期:2005_03一ll
基金项目:国家自然科学基金(30070229)
通讯作者:杨生玺(1963一),男(汉族),青海省西宁市人.学士,副教授,青海大学医学院生物教研室副主任.Tel.(0971)6143631Email.yan百ian963@126.com
l:GIN仅TK;2:PA317/TK;3:Marker.
图1载体GINaTK和抗性细胞PA317/TK细胞出现的阳性条带
3讨论将外源基因转入靶细胞是基因治疗的基础和关键步骤,其效率的高低将直接影响整个基因治疗的效果甚至成败,而包装后逆转录病毒滴度的高低是重要参数之一.结果提示在建立稳定产生重组腻转录病毒的包装细胞时,抗性集落数量的挑选应尽可能多一些并需传代培养观察病毒滴度的变化.制备含重组逆转录病毒的包装细胞上清时,细胞密度及培养温度是影响病毒滴度的重要因素,细胞密度与细胞生长状态有关,过低或过高的细胞密度对细胞生长均不利,均不能使病毒滴度达到最佳化.用聚凝胺处理细胞,可提高对逆转录病毒的敏感性’1J.张惠中等心。
报道在细胞培养皿中接种1.2×106个包装细胞可获最佳的效果.采用降低培养温度的方法,在工业化培养罐中可以提高细胞病毒滴度.把病毒上清液进行超速离心,透析纯化,浓缩处理,有可能将病毒滴度提高到较高水平,从而满足今后以逆转录病毒载体进行的临床基因治疗的需要.
【参考文献】
[1]陈道桢,张丽珊,鲁晓萱,等.胸苷激酶基因对乳腺癌细胞的杀伤性研究[J].实用癌症杂志,2003;18(2):122—125.
[2]张惠中,范清宇,杨安钢.产生重组逆转录病毒包装细胞系建立及病毒滴度影响因素[J].第四军医大学学报,200l皿(4):313—315.
编辑潘伯荣
万方数据
重组逆转录病毒载体的包装及病毒滴度影响因素
作者:杨生玺, 蒋虹, Yang SX, Jiang H
作者单位:杨生玺,Yang SX(青海大学医学院生物教研室,青海,西宁,810001), 蒋虹,Jiang H(青海大学附属医院高压氧科,青海,西宁,810001)
刊名:
第四军医大学学报
英文刊名:JOURNAL OF THE FOURTH MILITARY MEDICAL UNIVERSITY
年,卷(期):2005,26(14)
被引用次数:3次
1.张惠中;范清宇;杨安钢产生重组逆转录病毒包装细胞系建立及病毒滴度影响因素[期刊论文]-第四军医大学学报 2001(04)
2.陈道桢;张丽珊;鲁晓萱胸苷激酶基因对乳腺癌细胞的杀伤性研究[期刊论文]-实用癌症杂志 2003(02)
1.张惠中.范清宇.杨安钢.ZHANG Hui-Zhong.FAN Qing-Yu.YANG An-Gang产生重组逆转录病毒包装细胞系建立及病毒滴度影响因素[期刊论文]-第四军医大学学报2001,22(4)
2.赵英会.王继英.张念华.张春山.侯盼飞.ZHAO Ying-hui.WANG Ji-ying.ZHANG Nian-hua.ZHANG Chun-shan.HOU Pan-fei逆转录病毒载体包装细胞的培养及包装过程[期刊论文]-泰山医学院学报2007,28(9)
3.刘相萍.罗文娟.杨堃.隋爱华.吕振华.王传富.LIU Xiang-Ping.LUO Wen-Juan.YANG Kun.SUI Ai-Hua.LV Zhen-Hua.WANG Chuan-Fu重组人神经生长因子腺相关病毒载体的构建及病毒滴度的测定[期刊论文]-眼科新进展2007,27(10)
4.蒋伟.杨栋强.潘蕾.于海涛.李彧.王伟.王平忠.白雪帆运用流式细胞术快速检测汉滩病毒滴度[期刊论文]-细胞与分子免疫学杂志2011,27(5)
5.曾嵘.李进.周生.刘原林.沈继铭三种反义c-myc逆转录病毒表达载体的纯化、病毒包装、滴度测定及整合检测[期刊论文]-解剖科学进展2000,6(3)
6.赵焕英.包金风.赵春礼.杨慧.徐群渊.Zhao Huanying.Bao Jinfeng.Zhao Chunli.Yang Hui.Xu Qunyuan应用载体介导的RNA干扰技术抑制Nurr1基因在PT67细胞中的表达[期刊论文]-神经解剖学杂志2007,23(2)
7.李洋.钱明.井宏宇.钱东华HSV-TK逆转录病毒包装细胞系建立及病毒滴度测定[期刊论文]-中国老年学杂志2011,31(16)
8.江千里.王健民.温丽敏.江汕.周虹批量快速测定法测定标志基因为GFP的重组病毒滴度[期刊论文]-第二军医大学学报2002,23(9)
9.茅幼霞.陈迟.刘景丰.MAO You-xia.Chen Chi.LIU Jing-feng携带反义甲胎蛋白增强子/单纯疱疹病毒胸苷激酶基因的产病毒细胞系的建立及对肝癌细胞的靶向杀伤效应[期刊论文]-中华实验外科杂志2005,22(8)
10.刘相萍.罗文娟.隋爱华.杨堃.吕振华.王传富.Liu XP.Luo W J.Sui AH.Yang K.Lü ZH.Wang CF克隆人血小板源性生长因子B基因构建腺相关病毒载体及其病毒滴度测定[期刊论文]-中国组织工程研究与临床康复2007,11(24)
1.单路娟.刘越坚.吴泰华逆转录病毒滴度测定新方法的实验研究[期刊论文]-大连医科大学学报 2010(4)
2.许建.李世崇.陈昭烈逆转录病毒表达系统及其在外源蛋白高效表达中的应用[期刊论文]-中国生物工程杂志2008(5)
3.胡志敏猪带绦虫六钩蚴TSOL18基因重组犬腺病毒2型活载体疫苗的基础研究[学位论文]硕士 2006
本文链接:/Periodical_dsjydxxb_4200514029.aspx。
