自身互补型腺相关病毒载体发展趋势
新型冠状病毒基因组、蛋白质及疫苗的研究进展

慢病毒载体研究进展

谓的前病毒 D A N 。前病毒 D A连接成环状结构后 N
进 入 细胞 核 , 后 随机 整合 到宿 主细 胞基 因组 中。 然 整 合 进 去 的前 病 毒 D A会 转 录 出病 毒 蛋 白的 m N N R A 和 病毒 基 因组 R A, N 二者 在 宿 主细胞 的细 胞质 中包 装 成 完 整 的 病 毒 颗 粒 ,并 以 出芽 方 式 释 放 到 细 胞 外。 被感 染 后 的细胞 持续 的产 生病 毒 , 不发 生细胞 并 裂解 。 在整 合过 程 中 ,T s L R 起着 重 要 的作用 , 因为 只 有 两端 的 L R 通 过 共 价键 连 接 成环 状 分 子才 可 以 Ts
一
1慢病毒基 因组结构及特点[ l
1 1慢病 毒 的基 因组 .
条 与之 互 补 的 D A链 , N 形成 D A双链 , 就是所 N 这
慢病毒为二倍体 R A病毒 ,即有两个相 同的 N R A分子 , 5 端 附近经 氢键 连接成 7 SR A, N 在 ’ 0 N 它
们 的相 互作 用可 能在 反转 录过 程 中起调 节作 用 。慢 病 毒 R A分子 具 有典 型 的 真核 m N N R A的结 构 :一 个 甲基 化 的 5 端 帽子 结构 和 3 端 的聚 ( 尾 , ’ ’ A) 每个 R A均 可 以和宿 主 的 tN N R A配对 ,从 而为 逆转 录做 准备 。 慢病 毒 的基 因组 中一般 有 3个 基本 基 因 :编 码 病 毒 核衣 壳 蛋 白的结 构基 因 gg a ,编 码 逆转 录 酶 的 基 因 pl 编码 包膜 蛋 白的基 因 ev o和 n ,方 向为 5 ’端
感染分裂细胞及非分裂细胞 、 转移基 因片段容量较大、 目的基 因表达 时间长 、 不易诱发宿主免疫反应等优点, 已成为 当前 基 因治疗和 转基 因动物 中载体 研 究 的热点 。近 年来 对其 基 础 生物学 特 性、载 体 改造及 其应 用等
维真生物-如何阅读基因载体图谱

如何阅读基因载体图谱1、按属性分类:病毒载体和非病毒载体病毒载体是一种常见的分子生物学工具,可将遗传物质带入细胞,原理是利用病毒具有传送其基因组进入目的细胞,进行感染的分子机制。
可发生于完整活体或是细胞培养中。
可应用于基础研究、基因疗法或疫苗。
用于基因治疗和疫苗的病毒载体应具备以下基本条件:(1)携带外源基因并能包装成病毒颗粒;(2)介导外源基因的转移和表达;(3)对人体不致病;(4)在环境中不会引起增殖和传播。
非病毒载体一般是指质粒DNA。
2、按进入受体细胞的类型分类:原核载体、真核载体、穿梭载体(含原核和真核2个复制子,能在原核和真核细胞中复制,并可以在真核细胞中有效表达)。
3、按功能分类:克隆载体、表达载体克隆载体:具有克隆载体的基本元件(Ori,Ampr,MCS等),可以携带DNA片段或外源基因进入受体细胞并克隆和大量扩增DNA片段(外源基因)的载体。
表达载体:克隆载体中加入一些与表达调控(具有转录/翻译所必需的DNA顺序)有关的元件即成为表达载体。
1、复制起始位点Ori:即控制复制起始的位点。
Ori的箭头指复制方向,其他元件标注的箭头多指转录方向(正向)。
2、抗生素抗性基因:可以便于加以检测,如Amp+ ,Kan+(1)Ampr:水解β-内酰胺环,解除氨苄的毒性。
(2)tetr :可以阻止四环素进入细胞。
(3)camr:生成氯霉素羟乙酰基衍生物,使之失去毒性。
(4)neor(kanr):氨基糖苷磷酸转移酶,使G418(卡那霉素衍生物)失活。
(5)hygr:使潮霉素β失活。
3、多克隆位点:MCS克隆携带外源基因片段,它具有多个限制酶的单一切点,便于外源基因的插入。
如果在这些位点外有外源基因的插入,会导致某种标志基因的失活,便于筛选。
决定能不能放目的基因以及如何放置目的基因。
还要再看外源DNA插入片段大小。
质粒一般只能容纳小于10kb的外源DNA片段。
一般来说,外源DNA片段越长,越难插入,越不稳定,转化效率越低。
克隆载体与表达载体
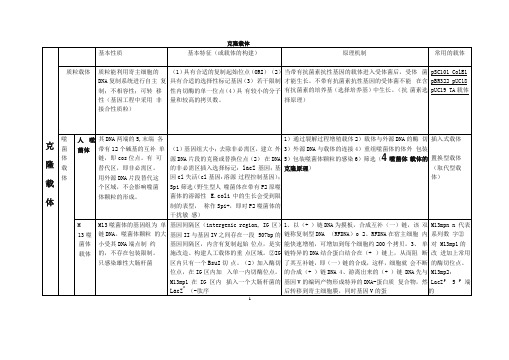
分类
结构组成及表达兀件
特点或优点
备注
质 粒 表 达 载 体
原核表达载 体
1启动子、
2转录终止子(防止克隆的外源基因表达干
扰载体的稳定性)
(1)基因组大小;去除非必需区,建立 外源DNA片段的克隆或替换位点(2) 在DNA的非必需区插入选择标记:lacZ基因;基因cl失活(cl基因:溶源 过程控制基因);Spi筛选(野生型人 噬菌体在带有P2原噬菌体的溶源性E.coli中的生长会受到限制的表型, 称作Spi+,即对P2噬菌体的干扰敏 感)
YAC的构建有比在细菌中克隆的一些优点,因为某些真核 细胞的序列,特别是重复序列是难以甚至不可能在细菌中 繁殖的,酵母细胞却具有这样的能力
5
色
体
细菌人工染色体 载体
BAC
是基于大肠杆菌 的F质粒构建 的,高通量低拷 贝的质粒载体
每个环状DNA分子中携带一个抗生素抗性标 记,一个来源于大肠杆菌F因子(致育因子) 的严谨型控制的复制子oriS(Shizuya et al.
主要使用EcoR I
ColEl
天然质粒,属松弛型多拷贝型
6.3 kb
大肠杆菌素(colicin) E1和对E1免疫的 基因(immE1)
EcoR I位于E1内部,插入外源DNA会导致E1失活,使受体菌不能合成E1 (ColE1-),但仍然 表现出对E1免疫型(皿1^1+)
pBR322
兀件来源①复制起点orip
酵母人工染 色体载体YAC细菌人工染 色体载体BAC
P1噬菌体人 工染色体载 体PAC
质粒载体总结
质 粒 载 体
类型
长度
选择标记
克隆位点
pSC101
慢病毒包装原理介绍

慢病毒包装系统简介及应用一、慢病毒包装简介及其用途慢病毒 Lentivirus 载体是以 HIV-1 人类免疫缺陷 I 型病毒为基础发展起来的基因治疗载体;区别一般的逆转录病毒载体,它对分裂细胞和非分裂细胞均具有感染能力;慢病毒载体的研究发展得很快,研究的也非常深入;该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达;在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果,在美国已经开展了临床研究,效果非常理想,因此具有广阔的应用前景;目前慢病毒也被广泛地应用于表达 RNAi 的研究中;由于有些类型细胞脂质体转染效果差,转移到细胞内的 siRNA 半衰期短,体外合成 siRNA 对基因表达的抑制作用通常是短暂的,因而使其应用受到较大的限制;采用事先在体外构建能够表达 siRNA 的载体,然后转移到细胞内转录 siRNA 的策略,不但使脂质体有效转染的细胞种类增加,而且对基因表达抑制效果也不逊色于体外合成 siRNA ,在长期稳定表达载体的细胞中,甚至可以发挥长期阻断基因表达的作用;在所构建的 siRNA 表达载体中,是由 RNA 聚合酶Ⅲ启动子来指导 RNA 合成的,这是因为 RNA 聚合酶Ⅲ有明确的起始和终止序列,而且合成的 RNA 不会带 poly A 尾;当 RNA 聚合酶Ⅲ遇到连续 4 个或 5 个 T 时,它指导的转录就会停止,在转录产物 3' 端形成 1~4 个U ; U6 和 H1 RNA 启动子是两种 RNA 聚合酶Ⅲ依赖的启动子,其特点是启动子自身元素均位于转录区的上游,适合于表达~ 21ntRNA 和~ 50ntRNA 茎环结构 stem loop ;在 siRNA 表达载体中,构成 siRNA 的正义与反义链,可由各自的启动子分别转录,然后两条链互补结合形成 siRNA ;也可由载体直接表达小发卡状 RNAsmall hairpin RNA, shRNA,载体包含位于RNA 聚合酶Ⅲ启动子和 4 ~ 5 T转录终止位点之间的茎环结构序列,转录后即可折叠成具有 1~4 个U 3 ' 突出端的茎环结构,在细胞内进一步加工成 siRNA ;构建载体前通常要通过合成 siRNA 的方法,寻找高效的 siRNA ,然后从中挑选符合载体要求的序列,将其引入 siRNA 表达载体;慢病毒载体 Lentiviral vector 较逆转录病毒载体有更广的宿主范围,慢病毒能够有效感染非周期性和有丝分裂后的细胞;慢病毒载体能够产生表达 shRNA 的高滴度的慢病毒,在周期性和非周期性细胞、干细胞、受精卵以及分化的后代细胞中表达 shRNA ,实现在多种类型的细胞和转基因小鼠中特异而稳定的基因表达的功能性沉默,为在原代的人和动物细胞组织中快速而高效地研究基因功能,以及产生特定基因表达降低的动物提供了可能性;慢病毒表达载体包含了包装、转染、稳定整合所需要的遗传信息;慢病毒包装质粒可提供所有的转录并包装 RNA 到重组的假病毒载体所需要的所有辅助蛋白;为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子;二、这一系统的目的,主要是为了解决以下问题:1. 对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,能大大提高目的基因转导效率,而且目的基因整合到宿主细胞基因组的几率大大增加,这就为 RNAi,cDNA 克隆以及报告基因的研究提供了一个有利的途径;2. 进行稳转细胞株的筛选;3. 为活体动物模型实验提供高质量的包含目的基因的病毒液;在细胞相关的实验操作中,对于一些按常规方法难以转染甚至无法转染的细胞,通过病毒介导的实验能够大大提高基因的转导效率,以达到目的基因的高效瞬时表达;三、慢病毒载体介绍慢病毒载体 Lentiviral vector, LVs 是在 HIV-1 病毒基础上改造而成的病毒载体系统,它能高效的将目的基因或 RNAi 导入动物和人的原代细胞或细胞系;慢病毒载体基因组是正链 RNA ,其基因组进入细胞后,在细胞浆中被其自身携带的反转录酶反转为 DNA ,形成 DNA 整合前复合体,进入细胞核后, DNA 整合到细胞基因组中;整合后的 DNA 转录 mRNA ,回到细胞浆中,表达目的蛋白;或产生 RNAi 干扰;慢病毒载体介导的基因表达或 RNAi 干扰作用持续且稳定,原因是目的基因整合到宿主细胞基因组中,并随细胞基因组的分裂而分裂;另外,慢病毒载体能有效感染并整合到非分裂细胞中;以上特性使慢病毒载体与其它病毒载体相比,比如不整合的腺病毒载体、整合率低的腺相关病毒载体、只整合分裂细胞的传统逆转录病毒载体,有鲜明的特色;大量文献研究表明,慢病毒载体介导的目的基因长期表达的组织或细胞包括脑、肝脏、肌肉、视网膜、造血干细胞、骨髓间充质干细胞、巨噬细胞等;慢病毒载体不表达任何 HIV-1 蛋白,免疫原性低,在注射部位无细胞免疫反应,体液免疫反应也较低,不影响病毒载体的第 2 次注射;四、慢病毒载体的构建1. 构建原理慢病毒属于逆转录病毒科,但其基因组结构复杂,除 gag、pol 和 env 这 3 个和单纯逆转录病毒相似的结构基因外,还包括 4 个辅助基因,vif、vpr、nef、vpu 和 2 个调节基因 tat 和 rev ; HIV 21 是慢病毒中最具特征性的病毒,第一个慢病毒载体系统即以此病毒为基础进行构建的;慢病毒载体的构建原理就是将 HIV 21 基因组中的顺式作用元件如包装信号、长末端重复序列和编码反式作用蛋白的序列进行分离;载体系统包括包装成分和载体成分:包装成分由 HIV 21 基因组去除了包装、逆转录和整合所需的顺式作用序列而构建,能反式提供产生病毒颗粒所需的蛋白;载体成分与包装成分互补,含有包装、逆转录和整合所需的 HIV 21顺式作用序列;同时具有异源启动子控制下的多克隆位点及在此位点插入的目的基因;为降低两种成分同源重组产生有复制能力的病毒 RCV 的可能性,将包装成分的 5 ′ LTR 换成巨细胞病毒 CMV 立即早期启动子,3 ′ LTR 换成 SV 40 polyA 位点等;将包装成分分别构建在两个质粒上,即一个表达 gag 和 pol、另一个表达 env ;根据这个原理,Naldini 和 Kafri 等构建了三质粒表达系统;2. 三质粒表达系统三质粒表达系统包括包装质粒、包膜蛋白质粒和转移质粒;其中包装质粒在 CMV 启动子的控制下,表达 HIV 21 复制所需的全部反式激活蛋白,但不产生病毒包膜蛋白及辅助蛋白 vpu;包膜蛋白质粒编码水泡性口炎病毒 G 蛋白 V SV 2G,应用 VSV 2G 包膜的假构型慢病毒载体扩大了载体的靶细胞嗜性范围,而且增加了载体的稳定性,允许通过高速离心对载体进行浓缩,提高了滴度;转移质粒中除含有包装、逆转录及整合所需的顺式序列,还保留 350 bp 的 gag 和 RRE,并在其中插入目的基因或标志基因绿色荧光蛋白 GFP ;将载体系统分成三个质粒最大的益处是使序列重叠的机会大大减少,减少载体重组过程中产生 RCV 的可能性;通过三质粒共转染 293T 细胞,超速离心后病毒滴度可达 109IU /m l ;3. 四质粒表达系统为了减少 HIV 21 包装结构的序列同源性,进一步减少重组成 RCV 的可能性,Dull 等人将辅助基因去除;但由于 gag2pol 的转运需要 rev,因此,在上述的三质粒系统的基础上,构建成四质粒表达系统,该系统加上含 rev 的质粒减少了产生 RCV 的可能性,而且对非分裂期细胞转导效率无影响;五、慢病毒载体应用1. 将目的基因 /RNAi 基因转入难以转染的细胞,比如神经元细胞、干细胞或其它原代细胞;2. 将目的基因 /RNAi 基因转入动物组织,以期获得长期表达;3. 构建稳定表达目的蛋白 /RNAi 的细胞系,再用exvivo的方法导入动物体内;4. 基因治疗;5. 转基因动物;6. 基因敲除;7. 药物研究:构建表达受体蛋白的细胞系,研究药物的作用;8. 快速建立生产目的蛋白的细胞系,非常有前途的真核细胞表达方法;。
抗HIV-1基因治疗新进展

抗HIV-1基因治疗新进展田雅茹;焦艳梅;张彤;吴昊【摘要】虽然高效抗反转录病毒治疗(highly active anti-retroviral therapy,HAART)取得了显著的成果,但是抗人类免疫缺陷病毒(human immunodeficiency virus,HIV)药物治疗仍有其局限性(如引起毒素蓄积和病毒突变).基因治疗在理论上具有较好的抗HIV能力,可以通过持续干扰病毒复制,提供了阻止HIV进行性感染的希望.本篇综述主要探讨当前多种基因治疗策略及其最新进展.【期刊名称】《首都医科大学学报》【年(卷),期】2014(035)001【总页数】7页(P101-107)【关键词】获得性免疫缺陷综合征;人类免疫缺陷病毒1型;基因疗法;慢病毒载体【作者】田雅茹;焦艳梅;张彤;吴昊【作者单位】首都医科大学附属北京佑安医院感染中心,北京,100069;首都医科大学附属北京佑安医院感染中心,北京,100069;首都医科大学附属北京佑安医院感染中心,北京,100069;首都医科大学附属北京佑安医院感染中心,北京,100069【正文语种】中文【中图分类】R512.91获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS)是人类感染人类免疫缺陷病毒(human immunodeficiency virus,HIV)后导致免疫缺陷,并发一系列机会性感染及肿瘤,严重者可导致死亡的综合征。
该病传播速度快、病死率高,是危害极大的传染性疾病之一。
HIV主要有2种类型:HIV-1和HIV-2,其中HIV-1是引起艾滋病的主要病原。
因此,目前艾滋病的防治研究主要是针对HIV-1进行的。
自从20世纪90年代后高效抗反转录病毒治疗(highly active antiretroviral therapy,HAART)应用于艾滋病的临床,使HIV-1患者的病毒载量下降及CD4+T细胞水平升高[1],降低了HIV的发病率和病死率,显著地改变了HIV-1感染者发展到AIDS的进程,但是HAART需要坚持终身用药,这会引发药物不良反应、病毒耐药突变和经济负担等问题[2]。
备战2025年高考-生物考点教案讲义:中心法则及其发展

中心法则及其发展(含答案解析)高考频度:★★☆☆☆难易程度:★★☆☆☆根据中心法则图解填写序号的名称①DNA的复制;②转录;③翻译;④RNA的复制;⑤逆转录。
考向一通过中心法则分析遗传信息的传递过程1.结合下图分析,下列叙述错误的是A.生物的遗传信息储存在DNA或RNA的核苷酸序列中B.核苷酸序列不同的基因可表达出相同的蛋白质C.遗传信息传递到蛋白质是表现型实现的基础D.编码蛋白质的基因含遗传信息相同的两条单链【参考答案】D【试题解析】生物的遗传物质是DNA或RNA,则遗传信息储存在DNA或RNA的核苷酸序列中,A正确;由于密码子的简并性,核苷酸序列不同的基因可表达出相同的蛋白质,B正确;表现型通过蛋白质表现,故遗传信息传递到蛋白质是表现型实现的基础,C正确;编码蛋白质的基因含两条单链,碱基序列互补,遗传信息不同,D错误。
解题技巧利用图示分类剖析中心法则图示中1、8为转录过程;2、5、9为翻译过程;3、10为DNA复制过程;4、6为RNA复制过程;7为逆转录过程。
2.流感病毒是一种单股负链RNA(—RNA)病毒,其在宿主细胞内增殖的过程如下图所示。
以下相关叙述正确的是A.人类免疫缺陷病毒与流感病毒的核酸类型和增殖过程相同B.正常情况下,过程①③和过程②中发生的碱基配对方式相同C.图中过程①③所需的酶是由宿主细胞的遗传物质控制合成的D.含32P标记的一RNA通过图示过程组装出来的子代病毒也含有32P【答案】B【解析】分析题图可知:①为以负链RNA为模板复制形成正链RNA;②为在正链RNA的作用下翻译出病毒蛋白质;③为以正链RNA为模板复制出病毒的负链RNA。
人类免疫缺陷病毒与流感病毒都是RNA 病毒,但人类免疫缺陷病毒是逆转录病毒,与流感病毒的增殖方式不同,A错误;过程①③表示RNA 的复制,过程②表示翻译,正常情况下RNA复制过程和翻译过程中发生的都是A—U,C—G之间的配对,碱基配对方式相同,B正确;过程①③中流感病毒的遗传物质复制时所需要酶应是以自身的遗传物质为模板合成的,C错误;含32P标记的一RNA通过图示过程合成蛋白质和一RNA所消耗的原料都是由宿主细胞提供的,故组装出来的子代病毒不含有32P标记,D错误。
2022年高考生物二轮复习核心素养串讲课5 科学探究之PCR

【解析】(1)PCR技术是在体外模拟体内DNA复制过程,利用DNA的热变性原理, 替代原有的解旋酶的作用,通过控制温度来控制DNA的解聚(解旋)与结合。 (2)利用PCR技术扩增DNA的过程中还需增加耐高温的DNA聚合酶,DNA聚合 酶发挥作用需要提供现成的引物,引物序列和目的基因的两端的碱基互补配对。 所用引物Ⅰ为:5'—GTTA—OH,与一段DNA序列中3'—CAATTGGAATC—5' 的3'端互补,故引物Ⅱ要与一段DNA序列中5'—GTTAACCTTAG—3'的3'端互补, 故引物Ⅱ为:5'—CTAA—OH。
2.(不定项选择)(2021·潍坊三模)聚合酶链式反应(PCR)是一种用于扩增特定DNA 片段的分子生物学技术。下列关于PCR引物的叙述正确的是 ( ) A.为保证模板链与引物结合的效率,两种引物之间尽量避免存在互补序列 B.为了便于将扩增的DNA片段与载体连接,可在引物的3'端加上限制酶识别序 列 C.在两种引物上设计加入不同的限制酶识别序列,主要目的是使目的基因定向 插入载体并可避免目的基因自身环化 D.复性所需的温度、时长和延伸所需的温度、时长均与引物有关
【解析】选B。新型冠状病毒为RNA病毒,由RNA与蛋白质构成,RT-PCR技术 利用病毒RNA进行逆转录获得cDNA,该过程以RNA为模板,脱氧核苷酸为原 料,需要逆转录酶进行催化。新型冠状病毒为RNA病毒,遗传物质为RNA,其 中含有尿嘧啶核糖核苷酸,A正确;检测过程含有RNA的逆转录与DNA的复制, 原料均为脱氧核苷酸,不需要核糖核苷酸,B错误;RT-PCR反应过程中包括 RNA的逆转录与DNA的复制,需要逆转录酶与DNA聚合酶,C正确;相同反应 时间内,病毒含量越高,逆转录复制后获得的DNA含量越多,D正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生物工程学报 Chin J Biotech 2009, May 25; 25(5): 658-664
journals.im.ac.cn Chinese Journal of Biotechnology ISSN 1000-3061 cjb@im.ac.cn © 2009 Institute of Microbiology, CAS & CSM, All rights reserved
Received: December 4, 2008; Accepted: March 20, 2009 Supported by: National High Technology Research and Development Program of China (863 Program) (Nos. 2005AA216050, 2008AA02Z135). Corresponding author: Rui’an Xu. Tel: +86-595-22690952; Fax: +86-595-22690952; E-mail: ruianxu@hqu.edu.cn 国家高技术研究发展计划(863计划)(Nos. 2005AA216050, 2008AA02Z135)资助。
综 述 自身互补型腺相关病毒载体发展趋势 吕颖慧1,2, 王启钊1,2, 肖卫东1,3, 刁勇1,2, 许瑞安1,2 1 华侨大学分子药物学研究所, 福建 362021 2 分子药物教育部工程研究中心, 福建 362021 3 宾州大学医学院, 宾夕法尼亚 19104, 美国
摘 要: 重组腺相关病毒(Recombinant adeno-associated virus, rAAV)可以作为基因运载工具将目的基因运送入靶器官并对多种疾病发挥治疗作用。以rAAV为载体进行基因治疗的关键是病毒基因组由单链变为双链, 否则不能适时、有效表达目的基因。自身互补型rAAV(scrAAV)载体基因组本身以双链形式存在, 与常规的单链rAAV(ssrAAV)载体相比, 无论在表达时间还是表达强度上都有十分明显改善, 可显著降低在疾病治疗过程中由于载体本身所诱发的免疫反应。目前, scrAAV已经在肝脏疾病、中枢神经系统疾病、眼部疾病、干细胞修饰以及RNA干扰、核酶技术等领域得到应用。以下在介绍scrAAV载体构建、表达、定位的基础上, 以血友病B为主要对象, 阐述scrAAV的应用潜力及发展趋势。
关键词: 基因治疗, 自身互补, 重组腺相关病毒, 血友病B, RNA干扰
Trends in development of self-complementary adeno-associated virus vector
Yinghui Lü1,2, Qizhao Wang1,2, Weidong Xiao1,3, Yong Diao1,2, and Rui’an Xu1,2 1 Institute of Molecular Medicine, Huaqiao University, Fujian 362021, China 2 Engineering Research Center of Molecular Medicine, Ministry of Education, Fujian 362021, China 3 Department of Pediatrics, University of Pennsylvania, Philadelphia 19104, USA
Abstract: Numerous studies and clinical trials have demonstrated the efficacy of recombinant adeno-associated virus gene delivery
vectors. However, prior to expression, it is necessary to convert the single-stranded DNA genome into double-stranded DNA, which hinders the efficiency of these vectors. We can entirely circumvent this step through the use of self-complementary recombinant adeno-associated virus vector (scrAAV). ScrAAV packages an inverted repeat genome that can fold into double-stranded DNA without the requirement for DNA synthesis or base-pairing between multiple vector genomes. By using scrAAV, we could increase expression efficiency and reduce immune response caused by vectors themselves. Therefore, it is a promising vector for gene therapy. So far, it has been used in the treatment of hepatic diseases, central nervous system diseases, and eye diseases. It has also been used in the modifications of stem cells and as vectors for siRNA/miRNA and ribozymes. In this review, we focused on the preparation, expression and location of scrAAV both in vitro and in vivo. We mainly introduced the recent progress of scrAAV based therapy of Hemophilia B, in order to elucidate the potential and prospects of scrAAV in gene therapy.
Keywords: gene therapy, self-complementary, recombinant adeno-associated virus, hemophilia B, RNAi 吕颖慧等: 自身互补型腺相关病毒载体发展趋势 659 Journals.im.ac.cn 重组腺相关病毒(Recombinant adeno-associated virus, rAAV)载体被认为是最有希望的临床基因治疗载体[1], 已有60余项以rAAV为载体的基因治疗
进入临床试验。本实验室近20年的研究业已显示其在众多疑难杂症中具有良好的应用前景[2−4]。rAAV载体进一步在临床上应用的关键是在不影响目的基因表达的同时如何最大限度地克服免疫反应。因此, 提高rAAV载体在靶细胞的转染效率, 降低载体的使用剂量是目前研究的目标。本实验室前期研究发现, 由单链(ssDNA)变成双链(dsDNA)之后, rAAV dsDNA不稳定是影响转染效率和持久性的最主要因素[5]。因此, 开发带有双链基因组的自身互补型
rAAV病毒载体(Self-complementary rAAV, scrAAV)是解决目前困扰AAV临床研究的有效方法之一。
1 scrAAV载体的构建原理 无论是野生型AAV(wt-AAV)病毒, 还是rAAV载体, 其病毒颗粒中都可包裹二倍体, 甚至四倍体的AAV基因组[6,7], 这是构建scrAAV载体的理论基
础。而wt-AAV ITR序列的特殊性是构建scrAAV载体的结构基础。目前的载体大多以AAV2为骨架, 其DNA两端ITR由145个核苷酸组成(图1)。其中, RBE由一连串重复5′-GNGC-3′序列组成, 是Rep(Rep78和Rep68)结合位点。AAV复制时, 以自身3′端序列
作为引物, 产生2个等长的具有一个共价连接末端的分子(子/母链)。之后, Rep78和Rep68发挥核酸内切酶的作用, 在母链末端断裂位点处(TRS)产生一个缺口。在T型结构顶端, 存在另外一个RBE(RBE′), 能维持这一结构的稳定性。新产生的-3′OH 作为DNA聚合酶底物, 合成新的ITR。最后, ITR退火形成发夹结构, 并将-3′OH重新置于单链取代合成的起始位点。经过新一轮复制, 可形成一个新的AAV病毒及一个子/母链共存二聚体。如果其中一个ITR中的缺口产生失败, 那么产生的AAV病毒将可以二聚体形式稳定存在。因此, 将TRS缺失或者突变, 甚至将D序列也同时缺失, 即可得到scrAAV载体[9−11]。
2 scrAAV载体的包装容量和包装效率 scrAAV病毒颗粒中包装的是二聚体基因组, 那么其包装容量能否满足基因治疗需要呢? 本实验室前期已报道单链rAAV(Single-stranded rAAV, ssrAAV)载体最大包装容量为5.7 kb[12], 虽也有报道
包装容量可达6.0 kb, 但其包装效率却明显下降[13]。
McCarty 等最初制备的scrAAV 基因组总大小为
4474 bp, 而当单链基因组达3.4 kb时即不能有效包装成病毒颗粒[9]。Wu等证实, 能有效形成scrAAV
病毒颗粒的最大单链基因组为3.3 kb, 且在2.3~3.3 kb之间包装效率基本相同, 超过3.4 kb虽也能形成
图1 AAV病毒复制过程以及scAAV的产生机理(该图由Gonçalves MA发表于2005年Virol J的文章修改而成[8])
Fig. 1 Schematic representation of the AAV DNA replication model and mechanism of scAAV generation. The AAV2 ITR is composed of two arm palindromes (B-B' and C-C') embedded in a larger stem palindrome (A-A'). The D sequence is present only once at each end of the genome thus remaining single-stranded. RBE: Rep-binding element; TRS: terminal resolution site; DM: duplex monomers; DD: duplex dimmers (Modified from the article of Gonçalves MA [8]).
