2019医疗器械不良反应报告表
医疗器械不良反应报告表格和例子

国家食品药品监督管理可疑医疗器械不良事件报告表报告日期: 年 月□ □口 口报告来源:口生产企业 联系地址: 日编码:□□口□□口 口□经营企业口使用单位单位名称: 邮编:联系电话:A 。
患者资料1。
姓名:2。
年龄: 3、性别口男□女 4 .预期治疗疾病或作用:B 。
不良事件情况5。
事件主要表现: 6. 事件发生日期: 年 月曰 7. 发现或者知悉时间: 年 月 日8;医疗器械实际使用场所:口医疗机构 口家庭口其它(请注明): 9、事件后果□死亡 ____________________________________ (时间); □危及生命;□机体功能结构永久性损伤:□可能导致机体功能机构永久性损伤; □需要内、外科治疗避免上述永久损伤; □ 苴它(在事件陈述中说明)。
附件1: 局制依据、使用情况、出现得不良事件情况、对受害者影响、采取得治疗措施、器械联合使用情况)报告人:医师口技师口护士口其她口报告人签名:例子:附件1:国家食品药品监督管理局制可疑医疗器械不良事件报告表报告日期:2010 年 10 月 2 5日编码:□□□□□□□□□ □口报告来源:口生产企业□经营企业口 J使用单位单位名称:按实际填写联系地址:按实际填写邮编:联系电话:A.患者资料1.姓名:|2.年龄:| 3、性别□男□女丁4。
预期治疗疾病或作用:输液B.不良事件情况5.事件主要表现:穿刺部位红肿6.事件发生日期:2010年 1 0月22日7。
发现或者知悉时间:2010年 1 0月22日8、医疗器械实际使用场所:□ V医疗机构口家庭□其它(请注明):5。
事件主要表现:监护仪黑屏6。
事件发生日期:20 1 0年1 0月6日7.发现或者知悉时间:2010年10月6日8^医疗器械实际使用场所:□ J医疗机构□家庭口其它(请注明):9、事件后果□死亡_____________________________________ (时间);□危及生命;□机体功能结构永久性损伤:□可能导致机体功能机构永久性损伤;□需要内、外科治疗避免上述永久损伤:口 J其它(在事件陈述中说明).10、事件陈述:(至少包括器械使用时间、使用目得、使用依据、使用情况、出现得不良事件情况、对受害者影响、采取得治疗描施、器械联合使用情况)患者因心脏病发作到我科治疗,于2 010年10月6 日10时20分使用多参数监护仪监护病人,至30分钟,多参数监护仪显示屏突然黑屏,因而无法监测到病人生命体征,立即更换多参数监护仪,对患者没有造成不良影响.报告人:医师口技师口护士其她□报告人签名:。
医疗器械不良事件报告表(2019)

初步处理情况:(可上传附件)
医疗器械不良事件报告表(2019)
报告日期:
年月日
单位:
联系电话:
上报人:
1.医疗器械情况
3.使用情况
产品名称:
预期治疗疾病和作用:①疾病:
②作用:
注册证号:
型号规格:
器械使用日期:年月日
使用场所:□医疗机构□家庭□其它(请注明:)
产品批号:
产品编号:
使用过程(请详细描述):
生产日期:
有效期至:
上市许可持有人名称:
2.不良事件情况
事件发生日期:年月日
合并用药/械情况:
事件发现或获知日期:年月日
伤害类型:□死亡□严重伤害□其他
伤害表现:
4.事件初步原因分析与处置
事件原因分析:
患者信息:
□产品原因(包括说明书等)
姓名:年龄:
□与产品有关的操作原因
性别:男□女□
□患分析描述:(可上传附件)
器械不良反应报告表

器械不良反应报告表
器械不良反应报告表通常包含以下内容:
1. 产品信息:包括器械名称、型号、规格、批号等。
2. 不良反应信息:记录不良反应的详细描述,如患者症状、体征、疾病诊断等。
3. 不良反应发生时间:记录不良反应发生的具体日期和时间。
4. 不良反应等级:根据不良反应的严重程度进行评估,常分为轻度、中度、重度等等。
5. 不良反应处理措施:描述针对不良反应所采取的处理措施,如停用器械、调整使用方法等。
6. 结论和评价:对不良反应进行综合评价,包括对患者的危害和器械的安全性进行分析。
7. 填报者信息:填报人的姓名、联系方式、填报日期等。
8. 医疗机构信息:记录报告的医疗机构的名称、地址、联系方式等。
9. 患者信息:包括患者的姓名、性别、年龄、病史等。
10. 相关附件:如患者的医疗记录、影像学报告等相关文件的副本。
以上仅为一般器械不良反应报告表的内容,具体表格的设计和要求可能因国家、地区以及器械类型等因素而有所差异。
在填报表格时,应按照相关要求提供准确的信息,并及时向监管部门报告。
医疗器械不良反应报告表doc

附件1:《可疑医疗器械不良事件报告表》及填写要求可疑医疗器械不良事件报告表报告日期: 年 月 日 编 码: 报告来源: 生产企业 经营企业 使用单位 单位名称:联系地址: 邮 编: 联系电话:报告人签名:国家食品药品监督管理局制A .患者资料1.姓名: 2.年龄: 3.性别 男 女4.预期治疗疾病或作用:B .不良事件情况5.事件主要表现:6.事件发生日期: 年 月 日7.发现或者知悉时间: 年 月 日8. 医疗器械实际使用场所:医疗机构 家庭 其他(请注明):9.事件后果死亡 (时间);危及生命;机体功能结构永久性损伤;可能导致机体功能结构永久性损伤;需要内、外科治疗避免上述永久损伤; 其他(在事件陈述中说明)。
10.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)C .医疗器械情况 11.产品名称: 12.商品名称: 13.注册证号: 14.生产企业名称: 生产企业地址: 企业联系电话: 15.型号规格: 产品编号: 产品批号: 16. 操作人:专业人员 非专业人员 患者 其他(请注明): 17. 有效期至: 年 月 日 18.生产日期: 年 月 日 19. 停用日期: 年 月 日 20. 植入日期(若植入): 年 月 日 21. 事件发生初步原因分析: 22. 事件初步处理情况: 23.事件报告状态: 已通知使用单位 已通知生产企业 已通知经营企业 已通知药监部门 D.关联性评价 (1)使用医疗器械与已发生/可能发生的伤害事件之间是否具有合理的先后时间顺序? 是□ 否□ (2)已发生/可能发生的伤害事件是否属于所使用医疗器械可能导致的伤害类型?是□ 否□ 不清楚□ (3)已发生/可能发生的伤害事件是否可用合并用药和/或械的作用、患者病情或其他非医疗器械因素来解释? 是□ 否□ 不清楚□ 评价结论:很可能□可能有关□可能无关□无法确定□ E. 不良事件评价 24.省级监测技术机构评价意见(可另附附页): 25.国家监测技术机构评价意见(可另附附页):填写要求《可疑医疗器械不良事件报告表》由题眉、患者资料、不良事件情况、医疗器械情况、关联性评价、不良事件评价及题末7部分组成。
洗胃机不良反应报告表范例

洗胃机不良反应报告背景洗胃机是一种用于清洁胃部的医疗设备,广泛应用于急诊科、消化内科等医疗领域。
洗胃是通过将液体引入胃内,然后再吸出来,以清除胃内的毒素、残渣和其他有害物质的过程。
然而,在使用洗胃机的过程中,我们注意到了一些不良反应的发生。
这些不良反应可能对患者的健康产生负面影响,并且可能降低洗胃机的安全性和有效性。
因此,我们进行了一项研究来分析这些不良反应,并提出相应的建议来改善洗胃机的设计和使用。
分析数据收集为了收集相关数据,我们在两个医院进行了为期三个月的调查。
我们记录了每位接受洗胃治疗的患者在治疗过程中出现的不良反应,并对其进行详细描述。
同时,我们还收集了患者的年龄、性别、基础健康状况等信息。
不良反应类型在收集到的数据中,我们发现了以下几种常见的不良反应类型:1.呕吐:部分患者在洗胃过程中出现呕吐的症状,其中包括轻度呕吐和剧烈呕吐两种情况。
2.腹部不适:一些患者在洗胃后出现腹部不适的感觉,包括腹痛、腹胀等。
3.恶心:部分患者在洗胃治疗后出现恶心的感觉,但并没有呕吐。
4.反酸:少数患者在治疗后出现胃酸倒流的症状,引起不适感。
5.其他:还有一些较为罕见的不良反应,如低血压、头晕等。
结果通过对收集到的数据进行统计和分析,我们得到以下结果:1.不良反应发生率:在参与调查的患者中,大约有20%出现了不良反应。
2.不良反应严重程度:绝大多数不良反应属于轻度或中度程度,只有少数属于严重程度。
3.不良反应相关因素:我们发现年龄、性别和基础健康状况与不良反应的发生有一定的相关性。
年龄较小和较大的患者更容易出现不良反应,女性患者比男性患者更容易出现不良反应,基础健康状况较差的患者更容易出现不良反应。
建议根据我们的分析结果,我们提出以下几点建议来改善洗胃机的设计和使用:1.设计改进:洗胃机应该采用更加舒适和安全的设计,以减少不良反应的发生。
例如,在吸入液体时可以采用更加柔软和适合人体工程学原理的吸管,以减少对胃黏膜的刺激。
可疑医疗器械不良反应报告表范文

可疑医疗器械不良反应报告表范文英文回答:Adverse Event Reporting Form for Suspected Medical Device Adverse Reactions.Name: [Your Name]Date: [Date]Patient Information:Name: [Patient's Name]Age: [Patient's Age]Sex: [Patient's Gender]Medical History: [Brief summary of patient's medical history]Device Information:Device Name: [Name of the medical device]Manufacturer: [Name of the manufacturer]Model/Serial Number: [Model/Serial Number of the device]Date of Implantation/Use: [Date of deviceimplantation/use]Description of the Adverse Event:Please provide a detailed description of the adverse event experienced by the patient, including any signs or symptoms observed.Example: I recently used a blood pressure monitoring device on a patient. The patient experienced severe painand discomfort during the procedure. The device seemed tobe malfunctioning as it was displaying inconsistentreadings. The patient's blood pressure was also abnormally high, which was concerning.Actions Taken:Please describe any actions taken in response to the adverse event, such as discontinuation of device use, medical intervention, or device replacement.Example: As soon as I noticed the patient's discomfort and the device malfunction, I immediately stopped using the device. I informed the patient about the situation and provided them with alternative methods for monitoring their blood pressure. I also reported the incident to thehospital's medical device department for further investigation.Outcome:Please describe the outcome of the adverse event, including any medical interventions or treatments provided to the patient.Example: After discontinuing the use of the blood pressure monitoring device, the patient's pain and discomfort subsided. The patient was closely monitored for any further complications and was eventually switched to a different device for blood pressure monitoring. No further adverse events were reported.Preventive Measures:Please suggest any preventive measures that can be taken to avoid similar adverse events in the future.Example: To prevent similar adverse events in the future, it is important to conduct regular maintenance and calibration checks on medical devices. Additionally, healthcare professionals should receive proper training on device usage and troubleshooting. It is also crucial to establish a robust reporting system for adverse events to ensure prompt investigation and appropriate action.中文回答:可疑医疗器械不良反应报告表。
医疗器械不良反应报告
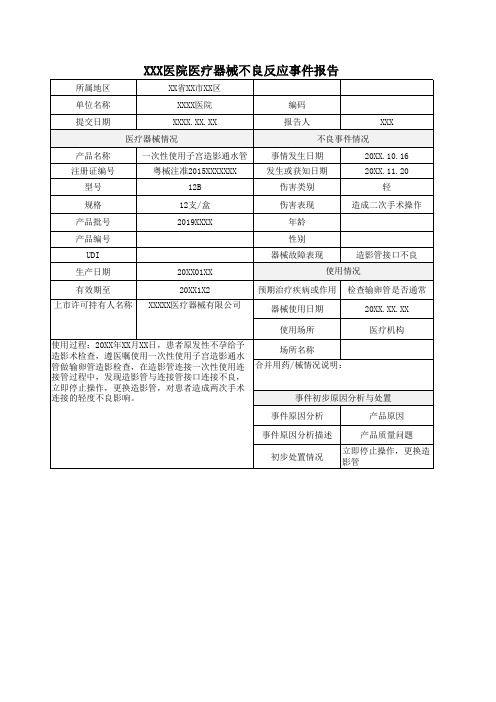
医疗机构
使用过程:20XX年XX月XX日,患者原发性不孕给予 造影术检查,遵医嘱使用一次性使用子宫造影通水 管做输卵管造影检查,在造影管连接一次性使用连 接管过程中,发现造影管与连接管接口连接不良, 立即停止操作,更换造影管,对患者造成两次手术 连接的轻度不良影响。
场所名称 合并用药/械情况说明:
事件初步原因分析与处置
伤害类别
轻
规格
12支/盒
伤害表现
造成二次手术操作
产品批号
2019XXXX
年龄
产品编号
性别
UDI
器械故障表现
造影管接口不良
生产日期
20XX01XX
使用情况
有效期至 上市许可持有人名称
20XX1X2 XXXXX医疗器械有限公司
预期治疗疾病或作用 检查输卵管是否通常
器械使用日期
20XX.XX.XX
使用场所
XXX医院医疗器械不良反应事件报告
所属地区
XX省XX市XX区
单位名称
XXXX医院编码提来自日期XXXX.XX.XX
报告人
XXX
医疗器械情况
不良事件情况
产品名称 注册证编号
一次性使用子宫造影通水管 粤械注准2015XXXXXXX
事情发生日期 发生或获知日期
20XX.10.16 20XX.11.20
型号
12B
事件原因分析
产品原因
事件原因分析描述
产品质量问题
初步处置情况
立即停止操作,更换造 影管
国家医疗器械不良事件监测年度报告(2019年)

国家医疗器械不良事件监测年度报告(2019年)2020年04月29日发布为全面反映2019年我国医疗器械不良事件监测情况,国家药品不良反应监测中心编撰了《国家医疗器械不良事件监测年度报告(2019年)》。
一、医疗器械不良事件监测工作进展2019年,我国医疗器械不良事件监测工作继续坚持“四个最严”的要求,贯彻落实《医疗器械不良事件监测和再评价管理办法》(以下简称《办法》),以评价医疗器械风险为主线,以落实医疗器械注册人和备案人(以下简称注册人)不良事件监测主体责任为重点,继续加强制度体系建设、不断拓展宣传培训方式、深入探索监测评价方法、全面提升风险预警和处置能力,医疗器械不良事件监测工作取得了新的进展:(一)医疗器械不良事件报告收集2019年,国家医疗器械不良事件监测信息系统接收可疑医疗器械不良事件报告39万余份,每百万人口平均报告数为297份,全国96.70%的区县报告了医疗器械不良事件,系统基层注册用户达到31万余家,其中医疗器械注册人达19662家。
与2018年相比,全国医疗器械不良事件报告数量保持平稳,系统基层注册用户数量持续增加,新旧医疗器械不良事件监测信息系统实现平稳过渡。
(二)医疗器械不良事件风险处置2019年,医疗器械不良事件风险信号评价处置工作深入开展。
强化对全国医疗器械不良事件报告的日常监测、预警分析及季度汇总,根据发现的风险情况,全年共发布《医疗器械不良事件信息通报》3期、《医疗器械警戒快讯》12期。
“十三五”医疗器械不良事件重点监测工作持续推进,各承担单位积极回顾前期工作,梳理产品风险,确保重点监测工作有序开展。
(三)医疗器械监测能力提升2019年,国家药品不良反应监测中心共培训注册人、医疗机构、监测机构人员1300余人次,同时为各级药品监管部门组织开展的《办法》及相关指导原则培训班提供师资,强化注册人主体责任,提升监测人员能力水平,取得了较好的培训效果。
此外,积极跟进国际医疗器械监管机构论坛不良事件术语和编码、患者登记数据评价两个项目的工作进展,正式加入国家监管机构报告交换机制,国际化水平进一步提升。
